基于PERK/TXNIP/NLRP3 通路探讨左归降糖通脉方对糖尿病合并脑梗死大鼠神经元细胞焦亡的影响
刘迅,刘华,彭岚玉,罗政,邓奕辉(. 湖南中医药大学中西医结合心脑疾病防治湖南省重点实验室,湖南 长沙 4008;. 中国人民解放军南部战区总医院,广东 广州 5000)
脑梗死(cerebral infarction,CI)是致残的主要疾病,也是全球第二大致死性疾病[1]。糖尿病(diabetes mellitus,DM)可直接诱发或加重脑梗死,是脑梗死的主要高危因素。据统计[2],与没有糖尿病的人比较,糖尿病患者罹患脑梗死的概率明显上升,约为没有糖尿病的患者的2倍以上;且糖尿病合并脑梗死(diabetes mellitus complicated with cerebral infarction,DM-CI)患者的神经功能缺损更严重、恢复速度更慢、病死率更高[3]。DM-CI的发病机制非常复杂,包括但不限于糖脂代谢紊乱、内皮功能障碍、应激损伤以及炎症反应等,其中炎症反应在DM-CI 的发生发展过程中发挥着越来越重要的作用[4-5]。
细胞焦亡是以消皮素D(GSDMD)为执行蛋白的程序性细胞死亡方式,表现为细胞不断肿胀,细胞器变形,最终细胞膜破裂,释放IL-1β、IL-18 等炎症因子,进而引起强烈的炎症反应,又称细胞炎性坏死[6]。有证据[7]支持PERK可以通过诱导TXNIP激活NLRP3 炎症小体,使胰岛β 细胞发生焦亡。事实上,PERK[8]和TXNIP/NLRP3炎症小体[9]蛋白的表达上升也能在缺血性脑损伤的神经元细胞上被观察到,通过抑制神经元上述蛋白的表达,脑缺血损伤可以得到明显缓解。
DM-CI属中医“消渴病中风”范畴[10],以气阴两虚,瘀血阻滞为其主要病机[11]。基于该病机特征,课题组前期研究[12-13]认为该病的中医治法为滋阴益气活血,并探索出了具有治疗前景的左归降糖通脉方(原名降糖通脉方)。该方对DM-CI疗效确切,具有改善糖脂代谢、减轻炎症因子等作用[12-16]。但其能否通过调控PERK/TXNIP/NLRP3 炎症小体途径介导神经元细胞焦亡,从而对DM-CI 起到神经保护作用,目前尚不明确。
鉴于以上基础,本研究拟以神经元细胞焦亡为研究重点,以PERK/TXNIP/NLRP3 炎症小体途径为切入点,探讨左归降糖通脉方对DM-CI 大鼠PERK/TXNIP/NLRP3 炎症小体通路及神经元细胞焦亡的影响。
1 材料
1.1 动物SPF雄性SD大鼠,6~8周龄,体质量160~180 g,均来自湖南斯莱克景达实验动物有限公司,动物生产许可证号:SCXK(湘)2019-0004,动物质量合格证号:430727221100325916,饲养于湖南中医药大学实验动物中心,温度为(24±0.5)℃,相对湿度为50%。本实验由湖南中医药大学动物伦理委员会批准,批号:LL2022022306。
1.2 药物①左归降糖通脉方:组方源自课题组前期的降糖通脉方,以黄芪30 g、熟地20 g、山茱萸12 g、枸杞子12 g、丹参20 g、川芎12 g、地龙12 g、水蛭8 g、黄连10 g 和石菖蒲8 g 等10 味药组成,中药均购自湖南中医药大学门诊部中药房,分别以10 倍水和8倍水进行煎药,两次水煎后取出药液进行合并,将合并的药液继续浓缩至每毫升含2 g 生药,在-80 ℃的温度下储存备用。②阳性对照药:吡格列酮二甲双胍片, 杭州华东制药集团生产, 货号:H20 100180;阿司匹林肠溶片,拜耳集团生产,货号:HJ20160685。使用前将吡格列酮二甲双胍片和阿司匹林肠溶片按比例研磨成粉末状,用超纯水溶解制成悬液,以备后续灌胃使用。
1.3 主要试剂链脲佐菌素、曲拉通Triton X-100、封闭山羊血清、柠檬酸钠缓冲液、DAPI 溶液、抗荧光衰减封片剂,北京Solarbio 公司,货号分别为:8050、T8200、SL038、C1013、C0065、S2100;PERK、eIF2α、p-eIF2α、TXNIP、GSDMD、IL-1β、IL-18一抗,美国Abcam 公司,货号分别为:b229912、ab169528、ab32157、ab188865、ab219800、ab254360、ab 191860;p-PERK 一抗,美国赛默飞公司,货号:PA5- 102853;NLRP3 一抗,美国ABclonal 公司,货号:A12694 ;Caspase-1、β-actin、NSE一抗,美国Proteintech 公司,货号分别为:2915-1-AP、66009-1-Ig、66150-1-Ig;山羊抗小鼠二抗、山羊抗兔二抗,长沙Abiowell 公司,货号分别为:WS0001、AWS0002。
1.4 主要仪器GA-3 型血糖测试仪、血糖试纸,长沙Sinocare 公司;DYY-6C 型蛋白电泳仪、DYCZ-24DN 型电泳槽、DYCZ-40D 型转膜仪,北京六一生物科技有限公司;Milli-Q BiocelA10超滤除热源纯水器,德国Merck公司;HM325石蜡切片机,美国赛默飞公司;ChemiDoC XRS+化学发光凝胶成像仪,美国Bio-Rad 公司;Tissue FAXS Plus 全景组织细胞定量分析系统,奥地利Tissue Gnostics公司。
2 方法
2.1 模型复制及评价大鼠用高糖高脂饲料(67%基础饲料+10%猪油+20%蔗糖+2.5%胆固醇+0.5%胆酸钠)喂养4 周后禁食12 h,在冰盒上用预冷柠檬酸钠缓冲液现配1%的STZ,测量体质量后即以35 mg·kg-1STZ的剂量进行腹腔注射(现用),恢复饮食。在注射STZ 后的第3 天采尾尖血检测,测得随机血糖≥16.7 mmol·L-1且稳定7 d 判定为糖尿病模型复制成功[17]。随后的7 d 按照组别给予相应药物灌胃,至第7 天灌胃结束,禁食8 h 后复制MCAO 术[18]造成局灶性脑缺血损伤,以下为具体步骤:①大鼠麻醉:测量大鼠体质量后以50 mg·kg-11%戊巴比妥钠的剂量进行腹腔麻醉(现配现用);②三叉口分离:将大鼠麻醉后仰卧固定在操作板上,进行剃毛消毒处理后,以手术刀在颈部正中纵向切开长1 cm 左右的切口,用镊子将组织进行钝性分离,找到并剥离干净右侧颈总、颈外和颈内动脉,三者相交处即为三叉口;③结扎、插栓:以缝合线将右侧的颈总、颈外动脉的近心端进行结扎,动脉夹夹闭颈内动脉,在距三叉口5 mm左右的颈总动脉壁上破口,从破口处将栓线插入颈内动脉(中途松开动脉夹),直至栓线上黑色标记点对齐三叉口为基准,再以缝合线结扎颈内动脉及颈总动脉;④消毒、缝合及保温:术后消毒后加适量阿莫西林外用抗感染,逐层组织缝合,保温至清醒。
以NIHSS 评分的分数达到1~3 分为准[18],判定DM-CI 模型复制成功。使用普通饲料喂养假手术组大鼠,在相同时间内按体质量计算给予柠檬酸钠缓冲液腹腔注射,且只将血管进行分离,不插入栓线,之后的操作与模型组的干预步骤相同。
2.2 NIHSS 评分采用Zea Longa 5 分制法[18]在大鼠麻醉清醒后评分:无神经损伤,活动正常的计0 分;尾端倒提,左前爪伸不开的计1分;走平地向左边转圈的计2分;走平地向左边倾倒的计3分;不能走平地,意识下降的计4分。
2.3 分组及给药将95 只大鼠随机分为5 组,每组19只。依据人与大鼠体表面积折算法[19]估算各组给药剂量:①左归降糖通脉方低剂量组,给予12 g·kg-1(临床等效剂量)左归降糖通脉方药液;②左归降糖通脉方高剂量组,给予24 g·kg-1(临床等效剂量的2 倍)左归降糖通脉方药液;③阳性对照组,即吡格列酮二甲双胍片和阿司匹林肠溶片组,给予140 mg·kg-1吡格列酮二甲双胍片和27 mg·kg-1阿司匹林肠溶片(临床等效剂量);④假手术组、模型组,给予等量蒸馏水。
以上各组均在MCAO 术前的7 d 按照组别的对应药液进行灌胃处理,每日2 次,连续7 d。除去模型复制不成功的大鼠(11 只)和过程中死亡的大鼠(14 只),假手术组剩下15只,模型组剩下12只,左归降糖通脉方分别剩下低剂量13 只和高剂量15 只,阳性对照组剩下15只。
2.4 随机血糖浓度检测按“2.1”项下方法,大鼠麻醉后,尾静脉采血,以血糖仪分别检测各组大鼠注射STZ 前1 d、注射STZ 后3 d 和MCAO 术前1 d 的随机血糖水平。
2.5 果糖胺含量检测腹主动脉采血,静置2 h 以后以3 000 r·min-1离心10 min(离心半径8 cm),取上清液后立即送湖南中医药大学第一附属医院检验科检测验果糖胺的含量。
2.6 脑梗死体积检测大鼠麻醉后取出完整大脑,-20 ℃下速冻20 min 后除去嗅球、小脑、脑干等部分,切成冠状片,每片厚1~2 mm 左右,每个大脑切5 片。将脑片分别用2% TTC 溶液染色和4%多聚甲醛固定后,测量每组大鼠脑梗死体积。
2.7 脑组织形态学观察取出完整脑,经固定、脱水、透明、石蜡包埋、切片、脱蜡、染色、封片后,显微镜下观察脑组织形态学变化。
2.8 相关蛋白检测各组随机选取3只大鼠麻醉后分离缺血侧脑皮质和海马区组织,加入裂解液匀浆后,测定蛋白质浓度,再经制胶、电泳、转膜和封闭后,分别加入PERK(1∶1 000)、p-PERK(1∶2 000)、eIF2α(1∶3 000)、p-eIF2α(1∶5 000)、TXNIP(1∶1 000)、NLRP3(1∶1 000)、Caspase-1(1∶1 000)、GSDMD(1∶1 000)、IL-1β(1∶1 000)、IL-18(0.5 μg·mL-1)、β-actin(1∶5 000)一抗,4度孵育过夜。TBST 洗涤3 次,每次10 min,加入二抗(1∶5 000)室温孵育60 min,洗涤后显色成像,采用ImageJ分析条带灰度值。
2.9 NSE 与NLRP3 共定位表达检测各组大鼠随机抽取5 只,麻醉、取脑、固定、脱蜡步骤同“2.7”项,通透、封闭后,滴加一抗NSE(1∶200)和NLRP3(1∶1 000)。孵育结束后经冲洗,再滴加荧光二抗孵育1 h,洗片后滴加DAPI孵育,洗片后滴加抗荧光衰减封片剂。镜下计数双阳性表达细胞个数。
2.10 统计学处理方法采用Excel 表和SPSS 25.0 软件处理数据,数据用均数± 标准差(±s)表示,符合正态性、方差齐性的数据采用单因素方差分析,组间比较用LSD 检验;不满足正态性、方差齐性的数据用非参数的秩和检验。以P<0.05为差异有统计学意义。
3 结果
3.1 左归降糖通脉方对DM-CI 大鼠NIHSS 评分的影响由表1 可知,与假手术组比较,模型组大鼠NIHSS 评分上升,差异有统计学意义(P<0.01)。与模型组比较,左归降糖通脉方低剂量组有下降趋势,但差异无统计学意义(P>0.05);左归降糖通脉方高剂量组及阳性对照组大鼠NIHSS 评分下降明显,差异均有统计学意义(P<0.05)。
表1 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠NIHSS 评分的影响( ±s)Table 1 Effects of Zuogui Jiangtang Tongmai Prescription on NIHSS scores of rats with diabetes mellitus complicated with cerebral infarction(DM-CI)( ±s)

表1 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠NIHSS 评分的影响( ±s)Table 1 Effects of Zuogui Jiangtang Tongmai Prescription on NIHSS scores of rats with diabetes mellitus complicated with cerebral infarction(DM-CI)( ±s)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05
NIHSS评分/分0.00 ± 0.00 2.67 ± 0.49**2.23 ± 0.44 1.53 ± 0.52#1.60 ± 0.51#组别假手术组模型组左归降糖通脉方低剂量组左归降糖通脉方高剂量组阳性对照组鼠数/只15 12 13 15 15
3.2 左归降糖通脉方对DM-CI 大鼠脑梗死体积的影响TTC 染色结果如图1、表2 所示,TTC 将正常脑组织染成红色,将脑梗死区染成白色。假手术组全部呈现红色,其余各组均呈现大小不一的白色(梗死灶)。与假手术组比较,模型组大鼠脑梗死体积增大,差异具有统计学意义(P<0.01);与模型组比较,左归降糖通脉方低、高剂量组和阳性对照组脑梗死体积明显减少(P<0.05、P<0.01);与左归降糖通脉方低剂量组和阳性对照组比较,左归降糖通脉方高剂量组大鼠脑梗死体积减少更为明显(P<0.01,P<0.05)。
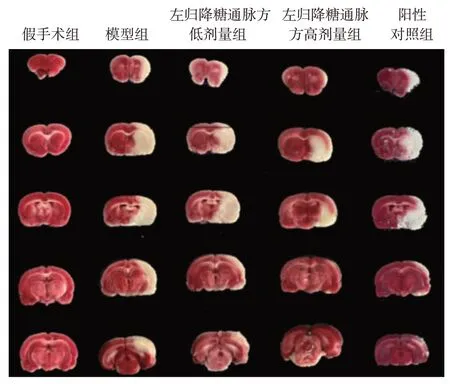
图1 各组大鼠脑梗死体积示意图(TTC 染色)Figure 1 Schematic diagram of cerebral infarction volume of rats in each group(TTC staining)
表2 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠脑梗死体积的影响( ±s,n=4)Table 2 Effects of Zuogui Jiangtang Tongmai Prescription on cerebral infarction volume of rats with DM-CI( ±s,n=4)

表2 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠脑梗死体积的影响( ±s,n=4)Table 2 Effects of Zuogui Jiangtang Tongmai Prescription on cerebral infarction volume of rats with DM-CI( ±s,n=4)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与左归降糖通脉方低剂量组比较,△△P<0.01;与阳性对照组比较,▲P<0.05
脑梗死体积/%0 24.47 ± 2.01**18.78 ± 1.95#10.68 ± 0.63##△△▲17.40 ± 2.31#组别假手术组模型组左归降糖通脉方低剂量组左归降糖通脉方高剂量组阳性对照组
3.3 左归降糖通脉方对DM-CI 大鼠随机血糖的影响见表3。每组大鼠在未进行STZ干预的情况下,随机血糖相差不大,差异无统计学意义(P>0.05)。注射STZ 3 d 后,其余各组大鼠随机血糖较假手术组均有明显上升(P<0.01),且组间比较的差异没有统计学意义(P>0.05)。给药干预后,与模型组比较,左归降糖通脉方低、高剂量组和阳性对照组大鼠随机血糖均明显下降(P<0.05,P<0.01),且左归降糖通脉方高剂量组和阳性对照组较左归降糖通脉方低剂量组下降更为明显(P<0.01,P<0.05)。用药前后差值比较,左归降糖通脉方低、高剂量组和阳性对照组与模型组比较,差值均明显增加(P<0.01);左归降糖通脉方高剂量组和阳性对照组与左归降糖通脉方低剂量组比较,差值增加更为明显(P<0.01)。
表3 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠随机血糖的影响( ±s,mmol·L-1)Table 3 Effects of Zuogui Jiangtang Tongmai Prescription on random blood glucose of rats with DM-CI( ±s,mmol·L-1)
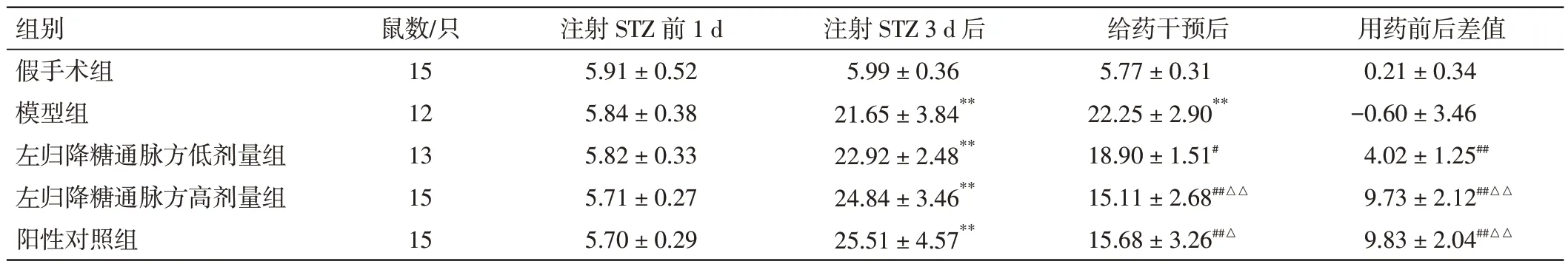
表3 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠随机血糖的影响( ±s,mmol·L-1)Table 3 Effects of Zuogui Jiangtang Tongmai Prescription on random blood glucose of rats with DM-CI( ±s,mmol·L-1)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01;与左归降糖通脉方低剂量组比较,△P<0.05,△△P<0.01
用药前后差值0.21±0.34-0.60±3.46 4.02±1.25##9.73±2.12##△△9.83±2.04##△△组别假手术组模型组左归降糖通脉方低剂量组左归降糖通脉方高剂量组阳性对照组鼠数/只15 12 13 15 15注射STZ 前1 d 5.91±0.52 5.84±0.38 5.82±0.33 5.71±0.27 5.70±0.29注射STZ 3 d 后5.99±0.36 21.65±3.84**22.92±2.48**24.84±3.46**25.51±4.57**给药干预后5.77±0.31 22.25±2.90**18.90±1.51#15.11±2.68##△△15.68±3.26##△
3.4 左归降糖通脉方对DM-CI 大鼠血清果糖胺的影响由表4可知,与假手术组比较,模型组血清中的果糖胺含量升高,差异具有统计学意义(P<0.01)。与模型组比较,左归降糖通脉方低剂量组有下降趋势,但差异无统计学意义(P>0.05);左归降糖通脉方高剂量组和阳性对照组血清中的果糖胺含量均有所下降(P<0.05)。
表4 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠血清果糖胺的影响( ±s,n=3)Table 4 Effects of Zuogui Jiangtang Tongmai Prescription on serum fructosamine of rats with DM-CI( ±s,n=3)
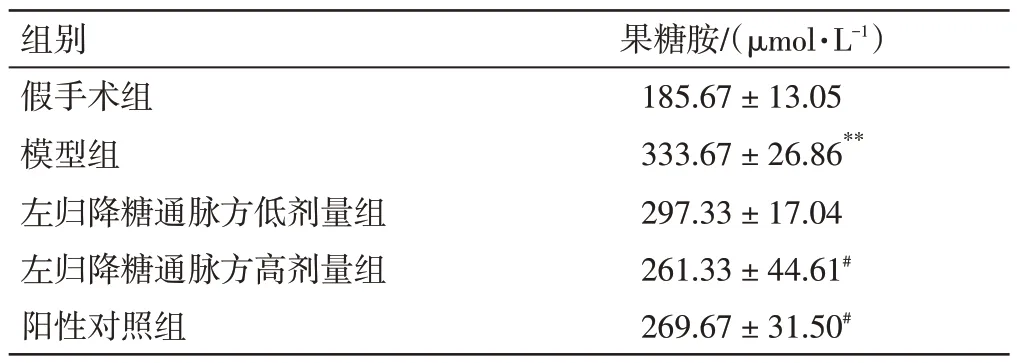
表4 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠血清果糖胺的影响( ±s,n=3)Table 4 Effects of Zuogui Jiangtang Tongmai Prescription on serum fructosamine of rats with DM-CI( ±s,n=3)
注:与假手术组比较,**P<0.01;与模型组比较,#P<0.05
果糖胺/(μmol·L-1)185.67±13.05 333.67±26.86**297.33±17.04 261.33±44.61#269.67±31.50#组别假手术组模型组左归降糖通脉方低剂量组左归降糖通脉方高剂量组阳性对照组
3.5 左归降糖通脉方对DM-CI 大鼠脑组织形态学的影响见图2。经显微镜观察,假手术组脑皮质、海马区组织结构完整,细胞排列整齐有序,细胞周围间隙致密无水肿,神经元细胞形态正常;模型组脑皮质和海马区组织结构疏松,神经元细胞消失或排列紊乱,部分细胞发生核固缩,有明显的水肿和空泡,甚至坏死;与模型组比较,左归降糖通脉方低、高剂量组和阳性对照组大鼠脑皮质和海马区组织损伤均有不同程度的减轻。
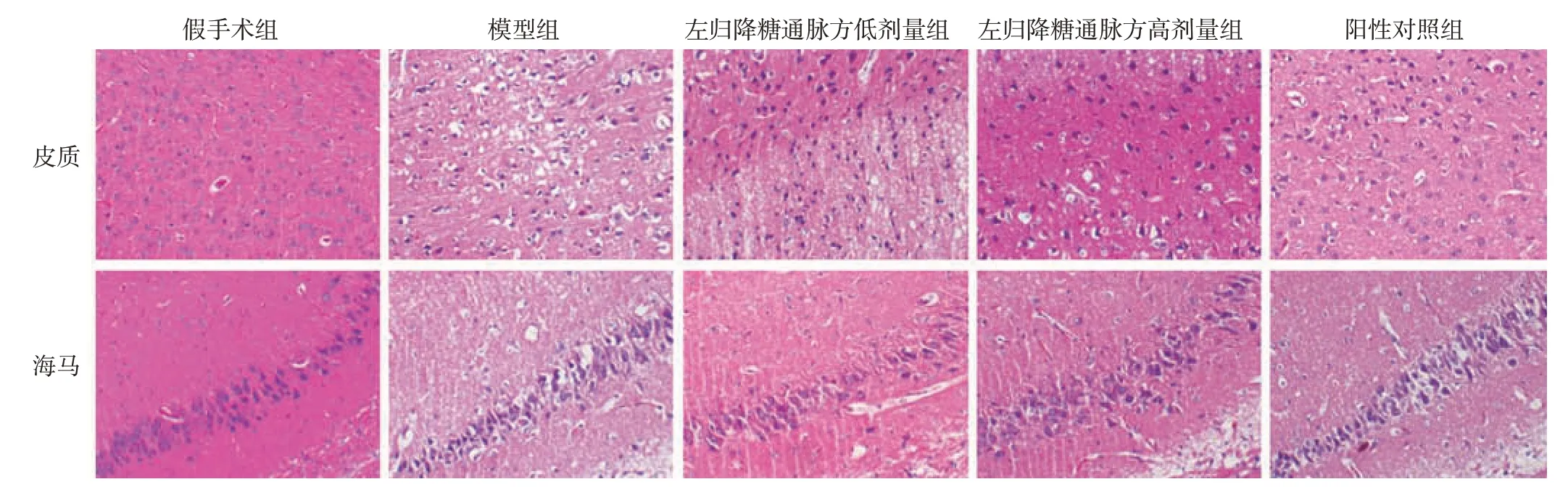
图2 各组大鼠脑组织形态示意图(HE 染色,×200)Figure 2 Schematic diagram of brain tissue morphology of rats in each group(HE staining,× 200)
3.6 左归降糖通脉方对DM-CI 大鼠脑组织中p-PERK、PERK、p-eIF2α、eIF2α 蛋白表达的影响如图3~图5所示,与假手术组比较,模型组大鼠缺血侧脑皮质、海马区组织中p-PERK/PERK、p-eIF2α/eIF2α 蛋白比值明显升高(P<0.01)。与模型组比较,左归降糖通脉方低剂量组大鼠缺血侧脑皮质、海马区组织中p-PERK/PERK、p-eIF2α/eIF2α蛋白比值有下降趋势,但差异无统计学意义(P>0.05);左归降糖通脉方高剂量组和阳性对照组大鼠缺血侧脑皮质、海马区组织中p-PERK/PERK、p-eIF2α/eIF2α蛋白比值明显下降(P<0.05,P<0.01)。

图3 各组大鼠脑皮质组织p-PERK、PERK、p-eIF2α、eIF2α 蛋白电泳图Figure 3 Protein electrophoresis of p-PERK,PERK,p-eIF2α and eIF2α in cortical tissue of rats in each group

图4 各组大鼠海马区组织p-PERK、PERK、p-eIF2α、eIF2α 蛋白电泳图Figure 4 Protein electrophoresis of p-PERK,PERK,p-eIF2α and eIF2α in hippocampus of rats in each group

图5 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠脑组织中p-PERK/PERK、p-eIF2α/eIF2α 蛋白比值的影响( ±s,n=3)Figure 5 Effects of Zuogui Jiangtang Tongmai Prescription on the protein ratio of p-PERK/PERK and p-eIF2α/eIF2α in brain tissue of rats with DM-CI( ±s,n=3)
3.7 左归降糖通脉方对DM-CI 大鼠脑组织中TXNIP、NLRP3 蛋白表达的影响由图6~图8 可知,与假手术组比较,模型组大鼠缺血侧脑皮质、海马区组织中TXNIP、NLRP3 蛋白表达增加,差异具有统计学意义(P<0.01)。与模型组比较,左归降糖通脉方低剂量组仅大鼠缺血侧脑皮质组织中NLRP3 蛋白表达降低(P<0.05),其余蛋白表达的差异均无统计学意义(P>0.05);左归降糖通脉方高剂量组大鼠缺血侧脑皮质、海马区组织中TXNIP、NLRP3蛋白表达均降低(P<0.05,P<0.01);阳性对照组大鼠缺血侧脑皮质、海马区组织中TXNIP、NLRP3蛋白表达均明显降低(P<0.01)。

图6 各组大鼠脑皮质组织TXNIP、NLRP3 蛋白电泳图Figure 6 Protein electrophoresis of TXNIP and NLRP3 in cortical tissue of rats in each group
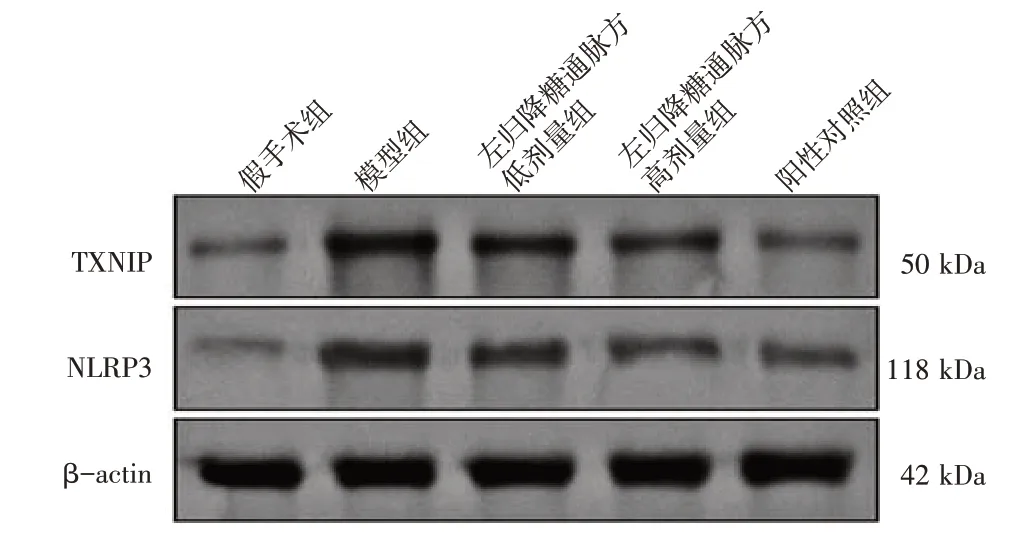
图7 各组大鼠海马区组织TXNIP、NLRP3 蛋白电泳图Figure 7 Protein electrophoresis of TXNIP and NLRP3 in hippocampus of rats in each group

图8 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠脑组织中TXNIP、NLRP3 蛋白表达的影响( ±s,n=3)Figure 8 Effects of Zuogui Jiangtang Tongmai Prescription on the protein expression of TXNIP and NLRP3 in brain tissue of rats with DM-CI( ±s,n=3)
3.8 左归降糖通脉方对DM-CI 大鼠脑组织中Caspase-1、GSDMD、IL-1β、IL-18 蛋白表达的影响如图9~图11 所示,与假手术组比较,模型组大鼠缺血侧脑皮质、海马区组织中Caspase-1、GSDMD、IL-1β、IL-18 蛋白表达明显增加(P<0.01)。与模型组比较,左归降糖通脉方低剂量组大鼠缺血侧脑皮质组织中IL-18蛋白表达下降明显(P<0.01),海马区组织中Caspase-1 蛋白表达下降(P<0.05),其余差异均无统计学意义(P>0.05);左归降糖通脉方高剂量组和阳性对照组大鼠缺血侧脑皮质、海马区组织中Caspase-1、GSDMD、IL-1β、IL-18 蛋白表达均明显减少(P<0.05,P<0.01);与左归降糖通脉方低剂量组比较,左归降糖通脉方高剂量组和阳性对照组大鼠缺血侧脑皮质组织中IL-18蛋白表达明显下降(P<0.01),海马区组织中Caspase-1蛋白表达降低(P<0.05,P<0.01)。

图9 各组大鼠脑皮质组织Caspase-1、GSDMD、IL-1β、IL-18 蛋白电泳图Figure 9 Protein electrophoresis of Caspase-1, GSDMD,IL-1β and IL-18 in cortical tissue of rats in each group

图10 各组大鼠海马区组织Caspase-1、GSDMD、IL-1β、IL-18 蛋白电泳图Figure 10 Protein electrophoresis of Caspase-1, GSDMD,IL-1β and IL-18 in hippocampus of rats in each group

图11 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠脑组织中Caspase-1、GSDMD、IL-1β、IL-18 蛋白表达的影响( ±s,n=3)Figure 11 Effects of Zuogui Jiangtang Tongmai Prescription on the protein expression of Caspase-1,GSDMD,IL-1β and IL-18 in brain tissue of rats with DM-CI( ±s,n=3)
3.9 左归降糖通脉方对DM-CI 大鼠脑组织中NSE与NLRP3 共定位表达的影响如表5、图12和图13所示,与假手术组比较,模型组大鼠缺血侧脑皮质和海马区组织中NSE 与NLRP3 双阳性信号细胞数量明显增多(P<0.01);与模型组比较,左归降糖通脉方低、高剂量组和阳性对照组大鼠缺血侧脑皮质和海马区组织中NSE 与NLRP3 双阳性信号细胞数均明显减少(P<0.01);与左归降糖通脉方低剂量组比较,左归降糖通脉方高剂量组及阳性对照组大鼠缺血侧脑皮质和海马区组织中NSE 与NLRP3 双阳性信号细胞数量均明显减少(P<0.05,P<0.01)。
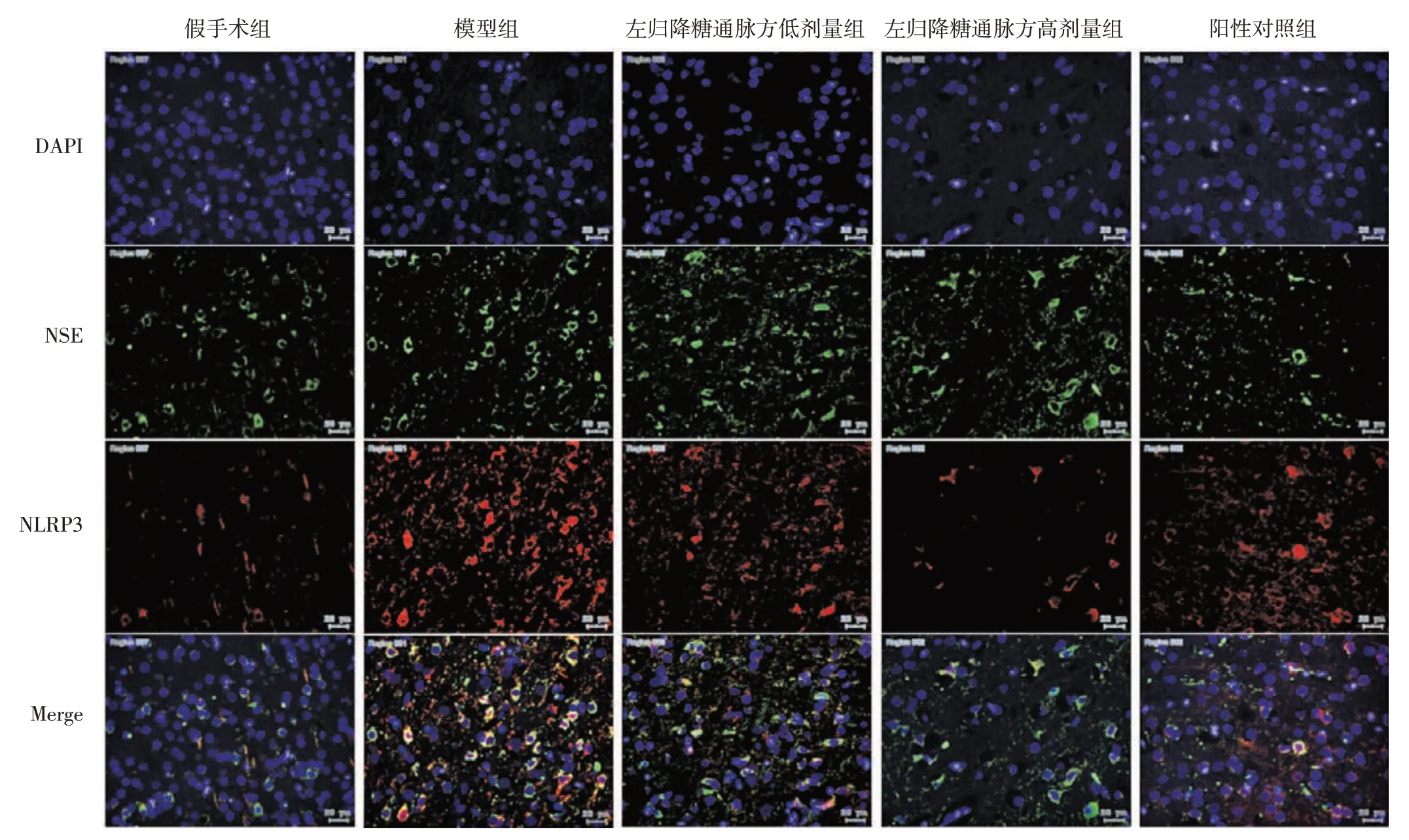
图12 各组大鼠脑皮质NSE 与NLRP3 荧光共定位示意图(×200)Figure 12 Schematic diagram of fluorescence co-localization of NSE and NLRP3 in the cerebral cortex of rats in each group(× 200)
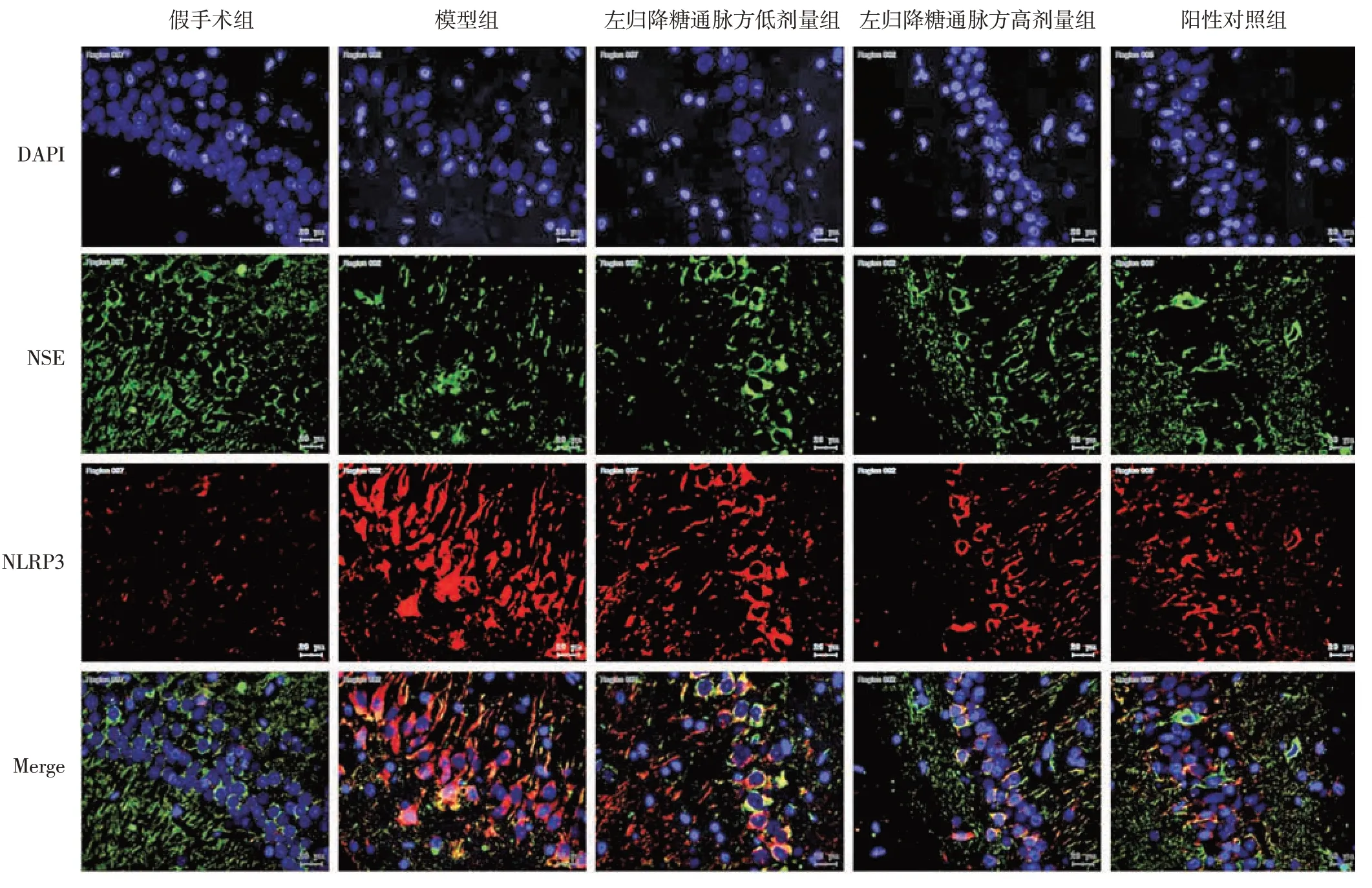
图13 各组大鼠海马区NSE 与NLRP3 荧光共定位示意图(×200)Figure 13 Schematic diagram of fluorescence co-localization of NSE and NLRP3 in hippocampus of rats in each group(× 200)
表5 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠脑组织NSE 与NLRP3 共定位表达细胞数的影响( ±s,n=5)Table 5 Effects of Zuogui Jiangtang Tongmai Prescription on number of co-located expression cells of NSE and NLRP3 in brain tissue of rats with DM-CI( ±s,n=5)

表5 左归降糖通脉方对糖尿病合并脑梗死(DM-CI)大鼠脑组织NSE 与NLRP3 共定位表达细胞数的影响( ±s,n=5)Table 5 Effects of Zuogui Jiangtang Tongmai Prescription on number of co-located expression cells of NSE and NLRP3 in brain tissue of rats with DM-CI( ±s,n=5)
注:与假手术组比较,**P<0.01;与模型组比较,##P<0.01;与左归降糖通脉方低剂量组比较,△△P<0.01
海马区组织3.40±2.30 45.00±5.87**28.40±2.70##16.40±2.07##△△17.00±1.58##△△组别假手术组模型组左归降糖通脉方低剂量组左归降糖通脉方高剂量组阳性对照组脑皮质组织2.80±1.48 30.20±5.36**14.60±2.07##8.40±2.07##△△9.20±2.39##△
4 讨论
糖尿病合并脑梗死(DM-CI)在中医学中没有直接的病名,因糖尿病属中医“消渴”范畴,脑梗死属中医“缺血性中风”范畴,加上长期处于消渴易发作缺血性中风,所以本实验把DM-CI 合称为“消渴病中风”。中医认为,消渴发病,皆是由于本脏(肺、胃、肾)阴津亏损,燥热过盛所致。阴虚则气无所附,气虚则阴无所生,周而复始,奠定了消渴气阴两虚的基础。由于长期处于消渴之下,体内津液亏耗无以充血、气虚乏力无以运血、血受燥热则煎熬成块,故消渴后期容易造成血液瘀积,而瘀血正是缺血性中风的致病根源之一。基于此,消渴病中风是以气阴两虚,瘀血阻滞为主要病机。在左归降糖通脉方的组方中,重用黄芪入肺脾以急固无形之气,走经络以补益有形之阴,熟地、山茱萸、枸杞子三者合用功专生血益精固髓,大壮乙癸精血,配以川芎、丹参行血海,破症结宿血以生新血,地龙入肝治血热,通经络,水蛭走血逐瘀结,利水道,佐以黄连济君火以养神,石菖蒲帅气以通窍,诸药合用,共奏滋阴益气活血之效。
正常情况下,错误折叠蛋白的积累会导致PERK自磷酸化,eIF2α也发生磷酸化,从而减轻内质网的压力;一旦错误折叠蛋白超出细胞的承受范围,磷酸化的PERK、eIF2α 就会不断地被激活,该信号通路就会从促使细胞存活向促使细胞死亡的方向逆转[20]。研究[7]表明,PERK/eIF2α在慢性高糖环境中的异常激活可以提高胰岛β细胞中TXNIP的表达,后者激活下游NLRP3 炎症小体,促使分泌IL-1β 和IL-18,使炎症反应加剧,进而导致胰岛β 细胞死亡。作为机体内参与炎症过程的关键靶点,TXNIP广泛表达于全身器官和细胞中[21]。此外,当外界不利因素刺激NLRP3 炎性小体时,该炎症小体就会催生出具有活性的Caspase-1,该炎性Caspase-1又可以通过剪切作用催生出具有活性的IL-1β 和IL-18。同时,Caspase-1作为焦亡事件发生的“刽子手”,能从抑制性结构域C-末端中解离出具有成孔活性的N-末端结构域(GSDMD-N)。游离的GSDMD-N 表现出与细胞膜上的磷酸肌醇和心磷脂强大的结合特性,在细胞膜上形成一个内径为12~14 nm 的跨膜孔道,最终导致严重的细胞膜裂解、细胞器及IL-1β、IL-18 等炎症因子外泄[6]。数据[22]表明,NLRP3/Caspase-1/GSDMD 介导的焦亡可以造成胰岛β 细胞大量丢失甚至胰岛功能衰竭。此外,脑梗死中亦常见NLRP3/Caspase-1 通路激活,从而触发细胞焦亡的现象[23]。结合本实验结果,DM-CI 大鼠脑组织中PERK/TXNIP/NLRP3 通路蛋白和细胞焦亡关键蛋白的表达明显上升,且特异性表达在神经元细胞上的蛋白(NSE)与NLRP3 的双阳性信号的细胞数量亦明显增加,提示PERK/TXNIP/NLRP3 途径介导的神经元细胞焦亡可能参与该模型的神经损伤过程。与模型组比较,经左归降糖通脉方干预的大鼠缺血侧脑组织中PERK/TXNIP/NLRP3 通路蛋白和细胞焦亡关键蛋白的表达均明显下降,NSE 与NLRP3 共定位表达细胞数量均明显减少,这表明左归降糖通脉方可以降低PERK/TXNIP/NLRP3 炎症小体的表达,抑制神经元细胞焦亡,从而对DM-CI 大鼠起到神经保护作用。综合实验结果可以发现,左归降糖通脉方对DM-CI 大鼠神经损伤有明显改善作用,且高剂量的左归降糖通脉方改善作用更加明显,这种改善作用可能是通过抑制PERK/TXNIP/NLRP3 炎症小体途径,减轻神经元细胞焦亡实现的。
综上,本研究初步证明左归降糖通脉方可以通过抑制PERK/TXNIP/NLRP3 通路,减轻神经元细胞焦亡,从而改善DM-CI损伤。

