雷帕霉素诱导β-珠蛋白家族基因座位重塑调控该基因的转换表达
许 兰, 肖亦舒, 刘春亚, 贾炳豪, 杜 乐, 李冬娜, 任立成
(海南医学院生物学教研室, 海口 571199)
哺乳动物血红蛋白是由与血红素相关的2条α和2条β-多肽链组成的四聚体,多肽链组成不同形式的血红蛋白由相关但不同的基因表达提供。在人类基因组中,编码α和β-多肽链的基因位于不同染色体上的2个多基因簇中。每个簇包含在个体发育不同阶段表达的几个基因:前者由位于16号染色体上的胚胎基因ε和2个成人基因α所编码;后者由位于11号染色体上的5个(1个胚胎基因ε、2个胎儿基因Gγ、Aγ和2个成人基因δ和β)功能基本相同的基因所组成。珠蛋白基因的这种阶段特异性表达现象称为珠蛋白基因转换[1,2]。
人血红蛋白转换描述了人β-珠蛋白基因复合物的5个珠蛋白基因(HBE(hemoglobin subunit epsilon)、HBG2(hemoglobin subunit gamma 2)、HBG1(hemoglobin subunit gamma 1)、HBD(hemoglobin subunit delta)和HBB(hemoglobin subunit beta)分别编码ε、γ、δ、β珠蛋白链)的高度协同调控表达的分子机制。在人类从胚胎早期到晚期的发育过程中,这些珠蛋白基因的激活顺序对应于它们在11号染色体上5′到3′的排列位置(HBE-HBG2-HBG1-HBD-HBB)。研究发现,β-珠蛋白各基因转录活性主要受位点控制区(locus control regions, LCR)的调控,这是一个位于ε基因上游6~25 kb区域内的远端顺式增强子调控元件,调控β-珠蛋白基因簇的转录状态和转录活性。LCR通过染色质的折叠作用,在人体不同发育阶段、与不同珠蛋白基因的启动子结合,从而在时间和空间上特异性的调控基因的转换表达[3-6]。人类β-珠蛋白基因阶段特异性表达的遗传改变和表观遗传机制引起了广泛关注。β-珠蛋白基因的阶段特异性表达是由不同机制组成的一个复杂调控网络。当细胞在不同状态之间转换时,其基因组空间组织的整体变化与局部转录的染色质状态密切相关。染色质构象通过抑制或促进转录因子与其靶标结合的活性,从而调控基因的转录。
近年来,三维基因组的研究成为理解细胞命运决定的一个不可或缺的方面,与高通量测序和染色质构象捕获(chromosome conformation capture, 3C)相关的新技术的发展,使人们能够直接对染色质的空间构象进行分析,揭示了染色质状态、基因组构象和基因表达动态之间存在的显著联系。这为解决细胞分化、细胞重编程和肿瘤发生过程中关键的生物过程铺平道路[7,8]。
本研究以急性白血病CD4+T细胞为研究对象,用不同浓度雷帕霉素处理细胞,研究其核内β-珠蛋白家族基因染色质重塑过程中,染色质三维相互作用网络变化过程、染色质开放区的重构,以及染色质重塑在功能上调控相关基因的表达。雷帕霉素作为mTOR的变构抑制剂,在临床上是用于治疗血红蛋白病的良好候选药物,对红细胞生成有显著的促进作用。雷帕霉素及其类似物不仅可以诱导肿瘤细胞凋亡、细胞周期停滞和信号转导抑制,还可以影响基因转录和表观遗传调控[9]。因此,开展对雷帕霉素诱导染色质重塑分子机制的研究具有十分重要的基础理论与临床实践意义。
1 材料与方法
1.1 实验材料
人CD4+T淋巴白血病细胞(Jurkat细胞株)购自中国典型培养物保藏中心(武汉);雷帕霉素(rapamycin, RAPA)购自Sigma公司;反转录试剂盒Fasting RT Kit、DNA纯化试剂盒购自天根生化科技有限公司;兔抗-HBD、兔抗-HBE、兔抗-HBG和兔抗-GAPDH抗体均购自博士德生物技术有限公司;辣根过氧化物酶标记山羊抗兔购自碧云天生物技术有限公司;抗-CTCF抗体购自美国upstate公司;TB Green® Premix Dimer EraserTM(RR091A)购自宝日医生物技术有限公司;PowerUpTMSYBRTMGreen Master Mix(A25742)荧光定量试剂盒购自Thermo Fisher Scientific有限公司;超敏ECL化学发光试剂盒购自biosharp生物科技有限公司;限制性内切酶Hind Ⅲ、T4 DNA连接酶购自纽英伦生物技术有限公司。
1.2 细胞培养
将CD4+T细胞接种于含10 %胎牛血清和1 %青霉素/链霉素的RPMI-1640培养基中,置于37 ℃和5% CO2的恒温培养箱中进行培养,当处在指数期的细胞密度达到80 %时,用终浓度为10, 20, 50 nmol/L的RAPA处理细胞48 h,即刻收集细胞,用于后续实验。
1.3 RT-qPCR及Western 印迹分析
使用Trizol法提取细胞总RNA,并反转录合成cDNA。取1 μL稀释10×的cDNA为模板进行定量分析,以GAPDH基因作为内参,基因相对表达量用2-ΔΔCT公式计算。在Applied Biosystems QuantStudio 3荧光定量PCR仪上进行扩增检测,反应程序按照定量试剂盒的说明进行(RR091A):95 ℃ 30 s,95 ℃ 5 s,60 ℃ 25 s,72 ℃ 20 s,40个循环。设计引物序列正如Table 1所示。收集不同浓度RAPA处理的细胞悬液加入RIPA裂解液,充分裂解细胞以提取总蛋白质。制备15 % SDS-PAGE凝胶分离样品,5 %脱脂奶粉封闭2 h,一抗4 ℃孵育过夜,二抗孵育2 h,ECL发光试剂盒检测目的蛋白质的表达。
1.4 甲醛交联细胞核样品的制备
当培养细胞处在指数生长期时,在培养基中添加甲醛,使其终浓度为1 %,室温下交联固定10 min,加入终浓度为0.125 mol/L的甘氨酸,振荡混匀5 min,淬灭甲醛。用PBS洗涤3次,加入5 mL NP-40细胞裂解液,在冰上裂解1.5 h,离心去上清;再重新加入1 mL预冷的细胞裂解液重悬细胞沉淀,收集交联的细胞核,每管约含107个细胞。将样品储存于-80 ℃。
1.5 甲醛辅助分离调控元件(FAIRE)分析
FAIRE样品制备方法参考Simon 等[10-12]报道的方法。取一支交联的细胞核进行超声波处理,将染色质DNA剪切至200~300 bp的平均大小。取超声后样品的10 %作为上样量分析。剩余样品4 ℃离心,去除不溶物,通过酚氯仿抽提纯化DNA,即可获得FAIRE样品。在Applied Biosystems QuantStudio 3荧光定量PCR仪上进行扩增检测,按照定量试剂盒(RR091A)说明设置反应程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 25 s,72 ℃ 20 s,40个循环。引物序列见Table 2。
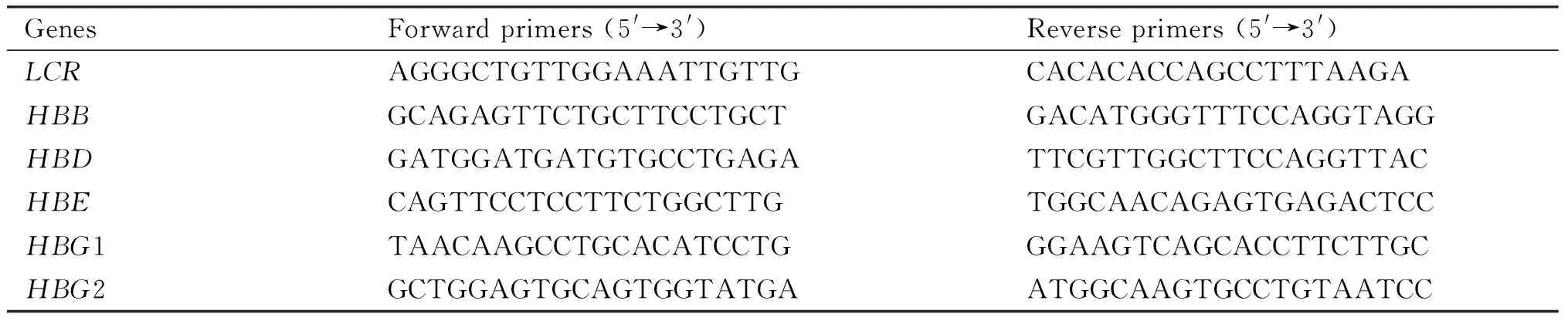
Table 2 Primer sequences for FAIRE/ChIP
1.6 染色体构象捕获(3C)技术分析
3C样品制备方法参考Dekker[12,13]等报道的方法进行。交联的细胞核用限制酶缓冲液洗涤并重悬于含有1% SDS的限制酶缓冲液中,37 ℃恒温振荡10 min,加入20 % Trion 100猝灭SDS,之后加入Hind Ⅲ 酶切消化过夜(14~16 h),酶切结束,加入10 % SDS于65 ℃水浴孵育20 min灭活酶。在10 mL的连接体系中,加入T4 DNA连接酶,16 ℃条件下连接4~5 h。之后加入蛋白酶K消化蛋白质并通过乙醇沉淀DNA,即可获得3C样品。在Applied Biosystems QuantStudio 3荧光定量PCR仪上,对3C样品进行扩增检测。qPCR采用PowerUpTMSYBRTMGreen Master Mix荧光定量试剂盒(ABI),按照试剂盒要求设置反应程序:50 ℃ 2 min,95 ℃ 2 min,95 ℃ 15 s,60 ℃ 20 s,72 ℃ 20 s,40个循环。3C定量PCR引物通过Primer3在线设计,其序列见Table 3。
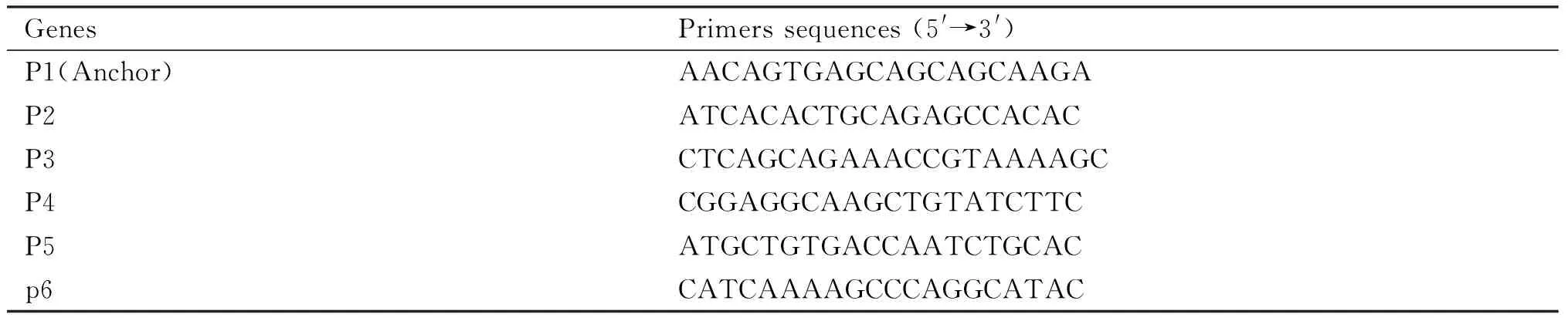
Table 3 Primer sequences for 3C
1.7 染色质免疫共沉淀(ChIP)分析
ChIP样品的制备方法参考文献报道[12]以及试剂盒说明的方法进行。甲醛交联过的细胞核加入1 mL RIPA缓冲液,重悬并超声,将其剪切到200~300 bp的平均大小。超声样品4 ℃离心,取上清的10 %作为上样量分析。余下样品加入10 mL RIPA进行稀释,加入蛋白酶抑制剂和3 μL的CTCF抗体,4 ℃低速旋转反应过夜。加入20 μL的蛋白 A/G琼脂糖(protein A/G plus-agarose)亲和过夜,收集DNA-蛋白质免疫复合物。所富集的DNA样品,用100 μL EB 缓冲液洗脱。洗脱样品加蛋白酶K,在65 ℃下消化解交联过夜。ChIP富集的DNA样品进一步用超薄DNA纯化试剂盒纯化回收。按照定量试剂盒(RR091A)说明设置反应程序:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 25 s,72 ℃ 20 s,40个循环。引物设计同FAIRE引物一致(见Table 1)。
1.8 统计学分析
采用GraphPad Prism 8.0软件进行统计学分析并作图,以(mean ±SD)表示分析结果,采用t检验进行两组间数据比较,P<0.05具有统计学意义。
2 结果
2.1 雷帕霉素影响β-珠蛋白家族基因的表达水平
本课题组前期研究工作发现,RAPA作用于CD4+T细胞48 h的半抑制浓度约为98.82 nmol/L[14]。高浓度的RAPA作用下,会抑制细胞增殖并导致细胞自噬,低浓度处理情况下对细胞增殖无影响。因此,本文选取终浓度为10 、20 和50 nmol/L浓度的RAPA处理细胞48 h时,收集细胞样本,提取RNA并反转录合成cDNA。分别对β-珠蛋白家族基因的5个成员HBE、HBG1、HBG2、HBD和HBB的转录水平进行定量分析。qPCR结果表明,β-珠蛋白家族基因在未处理的CD4+T细胞中转录水平具有明显的差异性(Fig.1A);其中,HBE与HBD基因转录水平较高,HBB基因转录水平最低。经10 nmol/L RAPA处理后,珠蛋白基因HBG1/HBG2、HBD、HBB的转录水平均降低;RAPA处理浓度增加到20 nmol/L和50 nmol/L时,HBE、HBG1/HBG2、HBD和HBB基因的转录水平显著上升,上调约2~3倍;尤其是HBB基因经50 nmol/L的RAPA处理时,上调近10倍;而HBE基因的转录水平随着RAPA处理浓度的增加一直呈现上升趋势。
通过Western 印迹分析,进一步验证了β-珠蛋白家族基因在蛋白质表达水平的变化趋势(Fig.1 B)。RAPA诱导后,β-珠蛋白家族基因的蛋白质表达水平明显上调。其中,HBG、HBD、HBB基因在10 nmol/L浓度下,蛋白质表达水平下调,20 nmol/L和50 nmol时蛋白质表达水平上升;HBE基因经RAPA诱导后蛋白质的表达水平上调,与定量PCR结果趋势基本一致。研究结果表明,β-珠蛋白家族基因在RAPA诱导的CD4+T细胞中的表达呈现显著的差异。这为进一步深入研究β-珠蛋白家族基因转换表达调控的分子机制提供了良好的模型。据此研究结果,本文认为,RAPA诱导CD4+T细胞可能改变了细胞内的表观遗传学微环境,例如染色质开放性和基因座位的空间组织等,从而影响基因的表达水平。为了进一步探究β-珠蛋白家族基因表达调控的机制,本文通过FAIRE、3C及ChIP技术来进一步验证分析。
2.2 雷帕霉素诱导β-珠蛋白基因座位染色质可及性改变
基因表达水平的改变与染色质可及性格局的动态变化密切相关。开放的染色质结构是招募转录因子到DNA序列以启动转录所必需的[15-17]。为了进一步研究β-珠蛋白家族基因表达调控的分子机制,本文应用甲醛辅助分离调控元件(formaldchyde assisted isolation of regulatory elements, FAIRE)技术分析细胞核内染色质的开放程度。FAIRE是直接检测基因组核小体缺失区域的一种简单方法。它可以直接富集活性染色质区域,对该区域的DNA片段进行高通量测序,就可以在全基因组范围内对开放染色质区域进行分析和作图。
本文通过qPCR实验对β-珠蛋白家族基因启动子区域染色质的开放程度进行验证分析。结果正如Fig.2所示,当10 nmol/L浓度的RAPA诱导时,珠蛋白HBG1/2、HBD、HBB基因启动子区染色质可及性降低,当RAPA处理浓度增加到20 nmol/L和50 nmol/L时,染色质可及性明显增加。调控元件LCR在10 nmol/L、20 nmol/L浓度的RAPA诱导下,染色质可及性降低;50 nmol/L时,可及性增加。经10、20 和50 nmol/L浓度的RAPA诱导,β-珠蛋白家族基因启动子区域染色质可及性变化趋势与基因表达变化趋势基本一致。但是,在50 nmol/L RAPA处理细胞时,各基因的染色质可及性变化趋势与基因表达趋势略微不符,这是由于RAPA处理浓度偏高,引起细胞自噬,使其染色质结构松散,从而导致50 nmol/L RAPA诱导时,染色质可及性整体结果虚高。这些结果表明,10 nmol/L RAPA能够抑制珠蛋白基因染色质的开放程度,从而抑制基因的表达;20 nmol/L和50 nmol/L的RAPA能够活跃珠蛋白基因染色质开放区,从而激活基因的表达。染色质可及性分析结果,进一步证明了RAPA通过影响染色质可及性重构,从而在功能上调控该基因家族成员的表达。
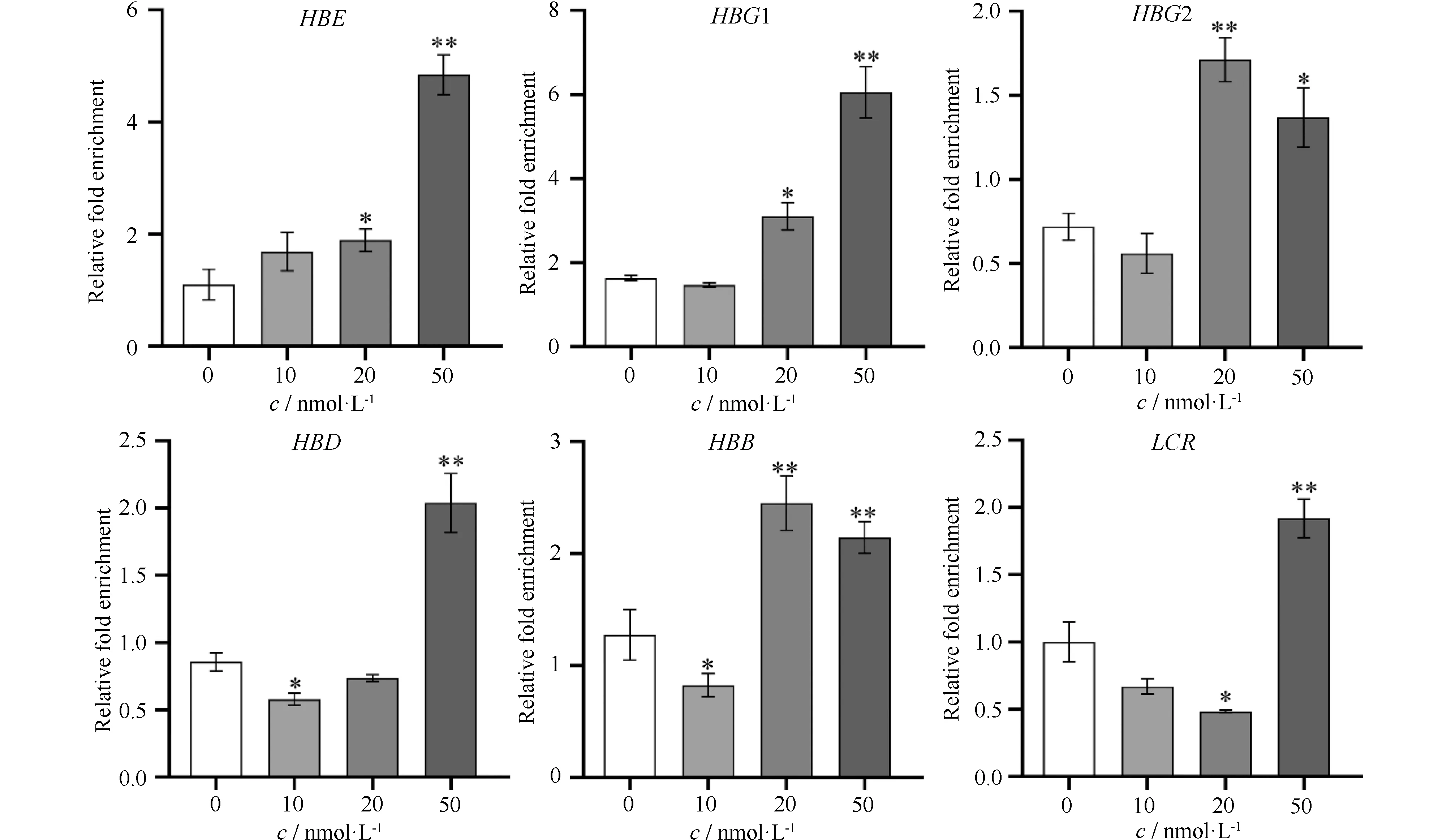
Fig.2 Chromatin accessibility analysis of β-globin family gene loci after RAPA induction After 48 hours of RAPA treatment, qPCR was used to analyze the degree of chromatin opening in the promoter regions of LCR and β-globin family genes. Results are reported as the mean ± SD (n=3).*P<0.05,**P<0.01
2.3 雷帕霉素诱导LCR与β-珠蛋白家族基因座位间相互作用频率的改变
为进一步了解RAPA诱导染色质可及性重构过程中,染色质开放程度对染色质之间相互作用的影响。本文通过3C技术,分析了RAPA诱导细胞前后,β-珠蛋白家族基因座位的空间组织变化过程。在珠蛋白基因启动子区域寻找合适的Hind III酶切位点,在该点位设计下游引物,LCR区域设计上游引物,并作为3C分析的锚定位点(Anchor)(Fig.3A)。通过控制模板对不同引物间的扩增效率进行校正,3C模板的设计参照Ren L报道的方法[12],qPCR实验分析调控元件LCR与珠蛋白家族基因启动子区之间的相互作用频率。由于3C样品成分复杂,使用模板量大,易受背景噪音的影响产生非特异性扩增,故需要对3C引物的特异性进行验证。qPCR产物凝胶电泳结果显示(Fig.3A),HBE、HBG1/HBG2、HBD和HBB基因启动子区分别与调控元件LCR之间发生相互作用,形成连接产物,且连接产物未见非特异性扩增。
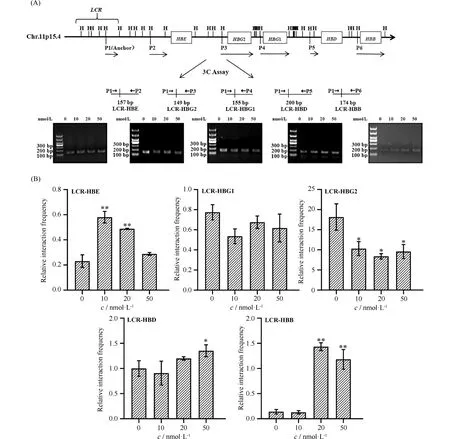
Fig.3 3C-qPCR analysis of the interaction frequency between β-globin family genes and LCR A schematic of the β-globin family gene region depicts the locations of the Hind III sites (top tick marks) and the primers used (bottom tick marks) in the 3C assays. The direction and length of the arrows indicate the primer direction and the size of the amplified fragment; (B) After cells were treated with different concentrations of RAPA for 48 hours, the frequency of interaction between the regulatory element LCR and the globin gene promoter region was analyzed by qPCR. Results are reported as the mean ± SD (n=3).*P<0.05,**P<0.01
qPCR分析结果进一步显示(Fig.3B),经不同浓度RAPA诱导,调控元件LCR与珠蛋白家族基因启动子区之间的相互作用频率存在明显差异。LCR-HBE之间的相互作用频率呈现上升趋势;而LCR- HBG1/HBG2相互作用频率均呈现降低趋势;LCR-HBD/HBB在10 nmol/L浓度的RAPA诱导下相互作用频率降低,随着RAPA浓度增加,相互作用频率也随之增加。LCR与HBE、HBD及HBB启动子区相互作用频率变化趋势与染色质可及性变化趋势基本一致。进一步说明了RAPA通过改变β-珠蛋白家族基因座位的空间结构,进而调控该基因的表达。在研究结果中发现,LCR-HBG2相互作用频率均降低与染色质可及性变化趋势相反,这是由于在设计HBG2基因的3C引物时,Hind III酶切位点分布较少,所选取的研究片段过长(7.4 kb),在样品制备过程中,染色质片段随机连接时不易与LCR形成有效连接片段,进而导致LCR与HBG2之间的相互作用频率偏低。
2.4 雷帕霉素处理CD4+T细胞,改变了CTCF与β-珠蛋白家族基因座位的结合频率
CTCF(CCCTC-binding factor)是一种重要的染色质架构蛋白质。它通过介导染色质环的形成,改变染色质的空间组织结构。染色质三维结构的改变与基因的表达调控密切相关。ChIP作为研究体内蛋白质与DNA相互作用的有力工具,将该技术与高通量测序结合,能够高效地在全基因组范围内检测与目的蛋白质相互作用的DNA片段[18-19]。本文通过qPCR实验来验证β-珠蛋白家族基因与CTCF之间相互作用频率的变化情况,以期说明RAPA诱导过程中,CTCF蛋白参与调控β-珠蛋白家族基因的空间组织构象,导致珠蛋白启动子区域染色质可及性发生改变,进而在功能上调控基因的表达。研究结果正如Fig.4显示,不同浓度RAPA诱导后,CTCF与β-珠蛋白家族各基因的结合频率发生显著改变。10 nmol/L浓度的RAPA处理时,除HBE基因外,珠蛋白HBG1/2、HBD和HBB基因启动子区与CTCF的结合频率降低;RAPA处理浓度增加到20 nmol/L和50 nmol/L时,珠蛋白基因启动子区与CTCF的结合频率增加;调控元件LCR在10 nmol/L和20 nmol/L浓度的RAPA诱导下,与CTCF的结合频率降低;50 nmol/L时,与CTCF的结合频率显著增加。CTCF结合频率的变化趋势与染色质可及性以及染色质相互作用频率的变化趋势基本一致。该结果进一步证明了CTCF参与了RAPA所诱导的β-珠蛋白家族基因座位的重塑过程,从而在功能上调控了该基因家族成员的表达。
3 讨论
血红蛋白病是一种遗传性疾病。在这种疾病中,点突变会产生结构异常的珠蛋白链。例如,β珠蛋白链合成异常会导致β-地中海贫血,这是许多亚洲国家最常见的血红蛋白病。地中海贫血是一个重要的健康问题,约1 %~5 %的世界人口是地中海贫血的突变携带者。根据合成受抑制的链,又将地中海贫血命名为α-,β-,γ-,δ-等地中海贫血。所有地中海贫血症的共同点是血红蛋白链的合成不足,导致不稳定的血红蛋白链在红系细胞内积累使得红细胞过早溶解。地中海贫血是一种复杂的疾病,由许多不同的分子缺陷引起。来自正常供体的造血干细胞移植、基因治疗或者患者自体造血干细胞的基因编辑可以明确改善有缺陷的红细胞生成,是治疗重型地中海贫血的有效方法。尽管如此,移植排斥反应和移植相关死亡的风险很高,而基因治疗和基因编辑试验仍需要相当大的优化和进一步的安全性评估。定期输血和铁螯合疗法仍然是地中海贫血治疗的基石[20,21]。
随着对珠蛋白基因表达的分子基础和表观遗传机制的深入研究。表观遗传药物逐渐成为治疗地中海贫血的新方案。许多研究旨在寻找能够提高人类HbF水平的药物,例如激素、细胞毒剂和造血细胞因子等。特别是寻找与病理无关但表现出诱导γ-珠蛋白基因表达特性的分子。在红细胞生成过程中,mTOR是红细胞在体外和体内生长和增殖的关键调节因子,用RAPA抑制mTOR通路,对红细胞生成有显著影响[22]。Pecoraro等实验室[23]对25例镰状细胞病和25例β-地中海患者的红系祖细胞进行了分析,发现RAPA能够增加60 %的镰状细胞病患者和56 %的β-地中海患者中γ-珠蛋白的mRNA表达,并将其疗效与羟基脲进行比较。结果表明,RAPA可在体内用于治疗血红蛋白疾病,特别是对羟基脲治疗无效或长期治疗后反应降低的患者。这一研究结果证明,RAPA可能是体内用于治疗血红蛋白病的良好候选药物。Zuccato等[24]报告了一项基于西罗莫司的临床试验结果。低剂量的西罗莫司可改变造血功能,并使部分β-地中海贫血患者的γ-珠蛋白基因的表达增加。
本文研究结果为上述研究团队的临床研究结果提供了重要的分子机制与理论基础。RAPA是一种在临床上较为广泛应用的抗免疫排斥药物,可以抑制T淋巴细胞的活化和增殖。本文使用RAPA处理CD4+T细胞后,显著提高了β-珠蛋白家族基因启动子区染色质的开放程度,更加开放的染色质促进了CTCF介导的调控元件LCR与珠蛋白基因启动子区的结合,以激活基因的转录。而本文对不同RAPA处理条件下染色质开放区的变化情况,以及调控元件与基因之间相互作用频率进行研究,结果发现,RAPA处理浓度从低到高的变化过程中,染色质的开放程度发生不同的改变,这种变化导致了基因表达模式也呈现相同的变化趋势。染色质可及性增加时,基因表达上调;染色质可及性降低时,基因表达下调(Fig.5)。本文通过这种动态的变化过程阐述了β-珠蛋白家族基因表达转换调控的分子机制,为临床精准治疗提供了理论与临床实践基础。
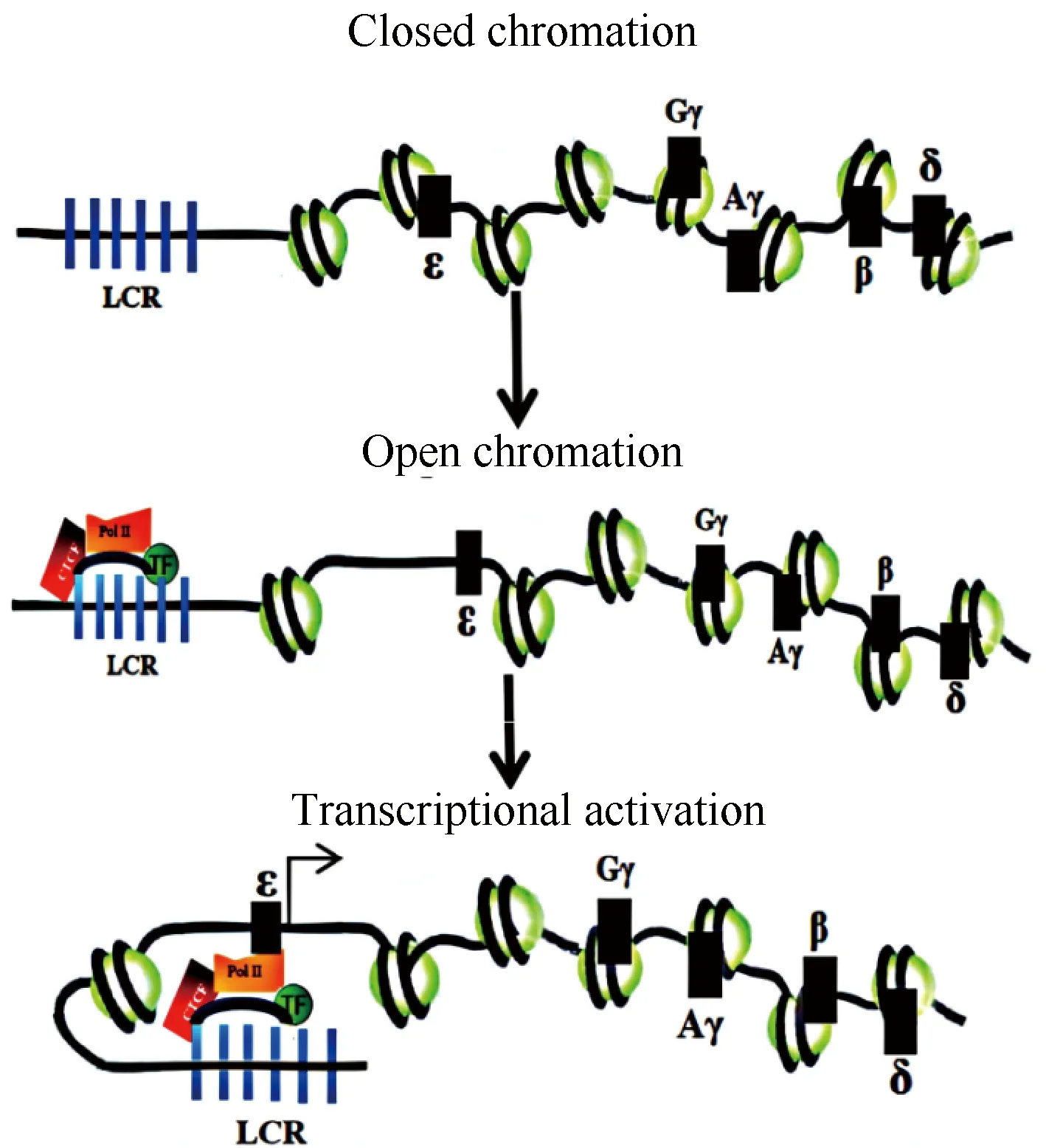
Fig.5 The pattern of chromatin structure changes induced by transcription of β-globin family genes This model describes the process of chromatin structure changes induced by β-globin gene transcription. In the context of open chromatin centers, the local remodeling of chromatin structure exposed the binding sites of the ε gene, and the transcription complex is recruited to the accessible LCR holocomplex. Transcription complexes are then transferred from the LCR to high affinity binding sites at the globin gene promoters, thereby activating the expression of the ε gene
此外,大量的临床研究表明,RAPA在延长寿命方面显示出巨大的前景。RAPA可以用于预防和治疗几乎所有与年龄相关的疾病,包括癌症、肥胖、动脉粥样硬化和神经退行性变。据报道,RAPA作为一种抗衰老药物在高剂量和低剂量的生物系统中具有截然不同的效应,中/高剂量时具有细胞毒性,低剂量时可抑制衰老、延长寿命[25-26]。本文使用RAPA处理CD4+T细胞后,发现10 nmol/L RAPA显著抑制HBG/HGD/HBE基因的表达,激活HBE基因的表达。在人血红蛋白转换表达机制中,HBE编码胚胎基因ε、HBG1/2编码胎儿基因γ、HBD和HBB分别编码成人基因δ和β,经低浓度的RAPA诱导后,胚胎基因ε的表达水平显著上升,而胎儿基因γ和成人基因δ/β的表达水平显著降低。研究发现,在低浓度的RAPA作用下,显示出一种逆分化的特性,抑制细胞的分化。根据这一实验数据可以反映出低浓度的RAPA具有抗衰老的作用。
目前,许多新的治疗方法正在开发中。Sirolimus、benserazide和IMR-687可以诱导HbF的产生;apotransferrin、VIT-2763、PTG-300通过靶向地中海贫血的铁代谢异常改善贫血。这可能结束单纯依赖转铁蛋白作为地中海贫血治疗主要手段的时代[27]。总之,继续开发控制表观基因组景观的药物在研究更精确、有针对性的疗法方面具有广阔的前景。
我们研究结果显示,RAPA处理CD4+T细胞,增强了β-珠蛋白基因座位的染色质可及性,开放的染色质有利于转录因子CTCF与基因序列的结合;并促进顺式增强子元件LCR与珠蛋白家族基因启动子区之间的相互作用,进而激发基因转录的活跃性,从而精确调控珠蛋白基因家族的转换表达。