小麦TaMYB1A负调控苯丙烷代谢途径及植株的株高
夏 舟, 苏美华, 孙 晨, 贾 娜, 兰 迪, 郭光艳, 秘彩莉
(河北师范大学生命科学学院遗传学教研室, 石家庄 050024)
苯丙烷途径是植物次生代谢产物合成的重要途径之一,可合成木质素、类黄酮和芥子酰基苹果酸类等化合物。该途径所产生的化合物不仅影响植物的生长发育及胁迫反应,也与人类的生活息息相关,可用于生产香料、农药、染料和医药等,且在造纸业、饲料业以及生物质能源等领域中有广泛应用[1, 2]。在植物中,MYB(v-myb avian myeloblastosis viral oncogene homolog)类转录因子是最大的转录因子家族之一,其中,R2R3-MYB在植物次生代谢调节、器官发育和应对生物/非生物胁迫反应等方面均发挥重要的生物学功能[3]。小麦是重要的粮食作物,除了籽粒产量外还产生大量秸秆。因此,研究小麦R2R3-MYB类转录因子在植物苯丙烷途径中的功能以及调控机制,对小麦秸秆的有效利用具有重要意义。
次生代谢产物是植物在进化过程中适应环境的产物[4]。苯丙烷代谢途径在模式植物拟南芥(ArabidopsisthalianaL.)中已阐述的比较清楚[5-6]。在苯丙烷途径的共有途径中,苯丙氨酸在苯丙氨酸解氨酶(phenylalanine ammonia-lyase, PAL)、肉桂酸4-羟化酶(cinnamate 4-hydroxylase, C4H)和4-香豆素CoA连接酶(4-hydroxycinnamate CoA ligase, 4CL)的依次作用下产生对香豆酰CoA。在木质素分支途径中,对香豆酰CoA在肉桂酸CoA还原酶(cinnamoyl-CoA reductase, CCR)和肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase, CAD)先后催化下产生香豆醇,最后经聚合作用形成H型木质素单体;香豆酰CoA经莽草酸/喹啉对羟基肉桂酰转移酶(shikimate/ quinarehydroxycinnam-oyltransferase, HCT)和对香豆酸3-羟化酶(ρ-coumarate 3-hydroxylase, C3H)催化能生成咖啡酰CoA;咖啡酰CoA分别通过CCR、CAD和咖啡酸O-甲基转移酶(caffeoyl acid-O-methytranferase, COMT)的依次催化,以及COMT、咖啡酰CoA-O-甲基转移酶(caffeoyl-CoA-O-methytranferase, CCoAOMT)、CCR和CAD的催化生成G型木质素单体[7];松柏醛经过阿魏酸5-羟化酶(ferulicacid 5-hydroxylase, F5H)、COMT和CAD的催化产生S型木质素单体[8-9]。3种木质素单体在过氧化物酶(peroxidase, POD)和漆酶(laccase, LAC)的作用下在次生细胞壁中聚合,分别形成紫丁香基木质素(syringyl lignin,S型木质素)、对-羟基苯基木质素(p-hydroxyphenyl lignin,H 型木质素)和愈创木基木质素(guaiacyl lignin,G 型木质素)[9]。但由于木质素结构复杂,难以自然降解或生物降解,给生物质在能源、造纸、纺织及畜牧业中的应用造成诸多负面影响[8, 9]。类黄酮是一大类化合物的总称,主要包括花青素、原花青素、黄酮和黄酮醇等化合物,在食品、保健品和药物中有广泛应用[10-11]。对香豆酰CoA也是合成类黄酮化合物的前体。对香豆酰CoA和丙二酰CoA经过查尔酮合酶(chalcone synthase, CHS)、查尔酮异构酶(chalcone-flavanone isomerase, CHI)、黄烷酮3-羟化酶(flavanone 3-hydroxylase, F3H)、类黄酮3′-羟化酶(flavonoid 3′-hydroxylase, F3′H)等的作用生成二氢黄酮醇,后者经黄酮醇合成酶(flavonol synthase, FLS)的催化产生黄酮醇;经4-二氢黄烷醇还原酶(dihydroflavonol 4-reductase, DFR)和无色花青素合成酶(leucoanthocyanidin reductase, LAR)作用生成原花青素;经DFR、花青素合酶(anthocyanidin synthase, ANS)等的依次催化形成花青素[11-12]。
MYB类转录因子是植物中最大的转录因子家族之一,广泛参与植物的各种生物学过程[13]。MYB蛋白质均具有保守的DNA结合域—MYB结构域[14]。MYB结构域由N端的1~4个不完全重复序列和C端的转录激活或抑制域组成;根据N端含有不完全重复序列的数量可将MYB类转录因子分为4大类(R1-MYB、R2R3-MYB、R1R2R3-MYB和4R-MYB),其中R2R3-MYB构成了MYB类转录因子中最大的亚家族[13,15]。研究表明,R2R3-MYB在植物次生代谢调节、器官发育和应对生物/非生物胁迫反应在内的许多生物过程中均发挥重要作用,其中,多个R2R3- MYB蛋白质参与了对植物苯丙烷途径的调控[16]。分析表明,编码苯丙烷共有途径酶的许多基因(例如PAL、C4H和4CL等),以及编码合成木质素单体的酶的基因(例如COMT、CCR和CAD等)的启动子中均含有一类保守的基序—AC元件(ACⅠ:ACCTACC;ACⅡ:ACCAACC;ACⅢ:ACCTAAC);某些MYB转录因子能识别并结合AC元件从而调控相关基因的表达[17]。
除MYB结构域外,R2R3-MYB蛋白质的其他区域的保守性较低;根据DNA结合域和C末端结构域中氨基酸序列的保守性,可将R2R3-MYB蛋白质分为22个亚组,同一亚组的成员通常具有相似的功能[10,18]。研究表明,R2R3-MYB蛋白质第4亚组的成员是苯丙烷途径的转录抑制因子,它们通过抑制关键基因的转录进而减少苯丙烷代谢产物的合成。第4亚组的典型特征在于其C端具有4个保守基序,即C1基序(LlsrGIDPxT/SHRxI/L)、C2基序(pdLNLD/ELxiG/S)、ZF基序(CX1-2CX7-12CX2C)和C4基序(FLGLX4-7V/LLD/GF/YR/ SX1LEMK),其中C2中的EAR(LxLxL)基序是在植物中发现的最主要的转录抑制基序[16]。拟南芥中的AtMYB3、AtMYB4、AtMYB7和AtMYB32均属于第4亚组的成员,但其功能和调控机制各异。AtMYB3的转录抑制活性受生物钟相关蛋白质LNK1(NIGHT LIGHT-INDUCIBLE AND CLOCK-REGULATED1)和LNK2的直接调控,它们促进AtMYB3与AtC4H启动子的结合,进而抑制AtC4H的表达,导致转基因植株中花青素含量降低[19]。AtMYB4通过抑制C4H的表达减少芥子酸酯的生成[20]。AtMYB7通过抑制AtC4H和At4CL1以及合成类黄酮化合物的特异基因AtF3’H、AtDFR和AtUGT的表达,进而抑制黄酮醇的合成,但不影响花青素水平[21]。在atmyb32中,多数木质素合成基因的转录水平未见明显变化,而类黄酮化合物合成途径中AtDFR和AtANS的表达水平降低[22]。玉米(Zeamays)中的ZmMYB31和ZmMYB42同属于第4亚组的成员,过量表达ZmMYB31的拟南芥株系中木质素含量大幅降低,而花青素含量大幅增加[23];过量表达ZmMYB42显著降低了转基因拟南芥中的木质素含量和黄酮醇含量[24]。杨树中的PtrMYB57和MYB182均负调控花青素和原花青素的合成[25- 26];丹参(Salviamiltiorrhiza)SmMYB4则负调控酚酸和丹参酮的合成[27]。
迄今为止,在小麦中已报道的第4亚组的R2R3-MYB蛋白质只有TaMYB4和TaMYB1D。TaMYB4在茎和根中表达较高;过量表达TaMYB4降低了转基因烟草中CAD和CCR的酶活性和木质素含量,但类黄酮含量升高[28]。过量表达TaMYB1D降低了转基因烟草中木质素及类黄酮含量[29]。小麦基因组庞大,而有关第4亚组的R2R3-MYB蛋白质的研究甚少。因此,深入解析小麦第4亚组R2R3-MYB在苯丙烷途径中的功能和调控机制,对小麦秸秆的有效利用具有重要理论和实践意义。
本室前期从小麦中克隆了1个MYB类转录因子基因,在小麦基因组网站(http:// wheatomics.sdau.edu.cn/blast/blast.html)的分析表明,该基因为TraesCS5A03G0798500.1,与NCBI网站上的TaMyb1(TraesCS5B03G0831200.1)在氨基酸水平的序列一致性为96%,因此,将其命名为TaMYB1A。初步研究表明,其在小麦木质化程度高的组织中表达较高,系统发育分析表明,其与其他物种中在苯丙烷途径中发挥负调控作用的第4亚组R2R3 MYB转录因子聚在一类,推测其负调控植物苯丙烷代谢途径。本文以过表达TaMYB1A的拟南芥株系为材料,系统分析了TaMYB1A在调控植物苯丙烷途径中的功能及其调控机制。
1 材料与方法
1.1 植物材料
中国春小麦(TriticumaestivumL.cv. Chinese Spring) (CS) 用于克隆TaMYB1A全长cDNA和TaC4H1的启动子序列及TaMYB1A在不同组织中的表达分析;拟南芥(ArabidopsisthalianaL.)哥伦比亚亚型(Col-0)用于TaMYB1A过表达载体的转化;本氏烟草(NicotianabenthamianaL.)用于分析TaMYB1A的亚细胞定位。
1.2 TaMYB1A 在小麦不同组织中的表达特性分析
将中国春小麦正常培养至孕穗期,取其主茎的3个节间,自上向下分别命名为第1节间(1 st)、第2节间(2 st)和第3节间(3 st),相应位置的叶片分别命名为1 b、2 b 和3 b,叶鞘命名为1 sh、2 sh 和 3 sh。由于第1节间较长,将其分为上下两部分,即1 st up(上)和1st low(下)。提取上述11份材料的总RNA并合成 cDNA(Reverse Transcriptase M-MLV,Takara)。以小麦TaEFla(No.M90077)做内对照,利用RT-PCR分析TaMYB1A的组织表达特性。本部分及后续研究所用引物均见Table 1。
1.3 GFP-TaMYB1A的亚细胞定位观察
扩增TaMYB1A的编码区序列,将其连接至pEGAD载体的EcoRⅠ/Hind III酶切点之间,重组载体命名为pEGAD-TaMYB1A;将pEGAD-TaMYB1A及 pEGAD空载体分别转化农杆菌GV3101后注射1月龄本氏烟草叶片,在激光共聚焦显微镜(CarlZeiss LSM710,Germany)下观察GFP及GFP-TaMYB1A融合蛋白的亚细胞定位情况。
1.4 TaMYB1A的转录活性分析
将TaMYB1A的编码区序列分别连接至pGBKT7 和 pGBKT7-VP16(含4×VP16)的EcoR I/BamH I 酶切点之间,所得载体分别命名为 pGBKT7-TaMYB1A和pGBKT7-VP16-TaMYB1A。将pGBKT7、pGBKT7-VP16、pGBKT7-VP16-TaMYB1A和pGBKT7-TabZIP6 (阳性对照) 质粒分别转化酵母菌株 AH109;挑取在SD/-Trp上生长的各菌落,测定其β-半乳糖苷酶活性,以明确TaMYB1A的转录激活/抑制活性,每个载体至少测定3个菌落。
1.5 TaMYB1A 过表达拟南芥株系的获得与鉴定
将TaMYB1A的开放阅读框连接至pCAMBIA1300的KpnI /BamH I 酶切点之间, 所得载体命名为 35S:TaMYB1A。将35S:TaMYB1A质粒转化农杆菌菌株GV3101后用浸花法转化拟南芥Col-0。利用RT-PCR检测异源表达TaMYB1A的拟南芥纯合株系(T3代)中TaMYB1A的表达水平,以拟南芥肌动蛋白基因(actin )(At3g18780) 做内对照。
1.6 总木质素和类黄酮含量分析及总木质素的间苯三酚染色
取正常生长8周的TaMYB1A过表达拟南芥株系及野生型的主茎,在65 ℃ 烘干过夜;将所有材料在液氮中研磨成粉末。采用TGA法测定各材料的总木质素含量[30],每个样品的木质素含量以其每mg干重在335 nm处的吸光值表示(A335/mg DW)。取4周大的TaMYB1A过表达拟南芥株系及野生型的莲座叶各0.1 g,按文献[31]方法对样品进行处理,各样品中类黄酮含量以其在420 nm 的吸光值(A420/mg FW)表示。在木质素和类黄酮含量的测定中,各材料均取5棵植株混合磨样,随机取3份样品测定其吸光值,取其平均值并进行统计学分析。
取正常生长6周的野生型拟南芥及TaMYB1A过表达拟南芥株系L4的主茎(距茎基部1~1.5 cm的茎段)进行切片(30 μm厚,横切),再将切片转移到载玻片上,用 2% (w/v,溶于70%乙醇)间苯三酚溶液染色2 min,再滴18% (V/V) HCl,静置5 min,最后吸去HCl,滴入蒸馏水,立即观察并拍照。
“这一切,是你一开始学酒就自己查,规划好,还是你看到别人的路径是这样的。”说真的,很少人能一开始就那么清晰自己未来的路径。他告诉我:“比赛是一定要比的,这个是我一早就认清楚了,但翻译是另外一回事。翻译是时我大学学葡萄酒第二年的时候,我们的老师罢工,正好那段时间没事干,觉得我当时学葡萄酒那本书挺好,就翻译着玩。然后翻译完,觉得这本书很好,挺有用的。”到后来翻译《葡萄酒世界地图》时,已经来香港了。这本书他翻译了法国和中国的部分,因为学习必须要看,他翻烂过两本。谈起这本书,他觉得这对行业是有贡献的,眼里闪烁的光,充满了感情。
1.7 利用酵母单杂交和双荧光素酶报告系统分析TaMYB1A与相关基因启动子间结合
酵母单杂交分析:首先将TaMYB1A的编码区序列连接至pGADT7载体得到pGADT7- TaMYB1A,再将拟南芥At4CL1、AtC4H、AtC3H和AtCHS,以及小麦Ta4CL1和TaC4H1的启动子序列分别连接至pLacZi载体,得到的重组载体分别命名为pLacZi-At4CL1p、pLacZi-AtC4Hp、pLacZi-AtC3Hp、pLacZi-AtCHSp、pLacZi-Ta4CL1p和 pLacZi-TaC4H1p;将pLacZi-Xp(X代表上述各待测基因,下同)质粒用NcoⅠ进行单酶切,再分别转化酵母菌株 YM4271,转化成功后制备各载体的酵母感受态细胞,用pGADT7和pGADT7- TaMYB1A分别转化上述各载体的感受态细胞,并涂布在SD/-Ura-Leu培养基上,以转化pGADT7 +pLacZi-Xp的酵母菌落做对照,测定转化pGADT7- TaMYB1A与pLacZi-Xp菌落的β-半乳糖苷酶活性(n=3)。
双荧光素酶报告系统分析:将TaMYB1A的ORF连接至pGreenII62 SK载体得到pGreenII62 SK-TaMYB1A。将At4CL1、AtC4H、AtC3H和AtCHS的启动子序列分别连接至pGreenII 0800载体,所得载体分别命名为pGreenII 0800-At4CL1p、pGreenII 0800-AtC4Hp、pGreenII 0800-AtC3Hp和pGreenII 0800-AtCHSp。将上述载体分别转化至农杆菌GV3101,将转化成功的各农杆菌组合(pGreenII6zsk/pGreenII6zsk-TaMYB1A+ pGreenII 0800Xp)注射1月龄本氏烟草叶片,正常培养36~48 h后取注射部位的叶片,按照双荧光素酶试剂盒(Dual luciferase Reporter Assay kit,Cat#DL101-01,Vazyme)说明书测定LUC/REN的比值,每个实验组合注射3个叶片取其平均值。
1.8 利用遗传学策略分析过量表达TaMYB1A对Ta4CL1 和 TaC4H1基因表达的影响
本室前期已获得Ta4CL1p:Gus转基因拟南芥纯合株系[32];本研究首先获得了TaC4H1p:Gus拟南芥纯合株系;将Ta4CL1p:Gus拟南芥株系(♀)和TaC4H1p:Gus拟南芥株系(♀)分别与TaMYB1A过表达拟南芥株系L14()进行杂交。将Ta4CL1p:Gus(♀)×TaMYB1AL4()拟南芥F1植株及Ta4CL1:Gus拟南芥株系正常培养20 d,分别取2个株系第2片莲座叶进行Gus染色和观察;将TaC4H1p:Gus(♀)×TaMYB1AL4()拟南芥F1植株及TaC4H1p:Gus拟南芥株系正常培养5周,分别取2个株系第2片莲座叶进行Gus染色和观察。
1.9 基因芯片分析
将TaMYB1A过表达株系L14及野生型拟南芥正常培养(22℃, 16 h 光照/8 h 黑暗)4周,分别取10株幼苗的1~2片莲座叶混合磨样,再随机取100 mg 粉末提取其总RNA,设计2个生物学重复。cDNA的合成、cRNA的标记及纯化、芯片的杂交及洗涤等流程均按GeneChip®3′ IVT PLUS Reagent Kit (Affymetrix 902415/902416)说明书进行,洗涤完的芯片在Affymetrix Gene-Chip Scanner 3000上扫描,用Partek Genomics Suite6.6 软件分析芯片数据。根据芯片结果筛选出在TaMYB1A过表达株系及野生型拟南芥中差异表达的基因 (≥2 倍,P<0.01,上调或下调) 。以拟南芥肌动蛋白基因actin(At3g18780)作内参,利用qRT-PCR进一步验证TaMYB1A过表达拟南芥株系中苯丙烷途径中关键基因的表达水平。
1.10 4-香豆素CoA连接酶活性测定
取正常培养1个月大的各拟南芥株系莲座叶100 mg(每个株系取3份,即3个生物学重复),按照文献[32]方法对样品进行处理,以不加4-香豆酸的样品为对照,用紫外分光光度计测定各样品在A333处的吸光值。
1.11 统计学分析
如无特殊说明,本论文中的数据均采用t检测,*:P<0.05,**:P<0.01,***:P<0.001。
2 结果
2.1 TaMYB1A 在木质化水平高的组织中表达较高
本室前期从小麦中克隆了1个R2R3型MYB转录因子基因,因其与小麦TaMyb1序列高度相似,且位于5A染色体,遂将其命名为TaMYB1A。RT-PCR分析表明,在小麦孕穗期,TaMYB1A在茎中的表达水平最高,而在叶鞘和叶片中的表达水平较低(Fig. 1),说明TaMYB1A在木质化程度较高的组织中表达水平也较高。

Fig.1 Tissue-specific expression analysis of TaMYB1A in wheat 1 st up and 1 st low, the upper and lower part of the first internode; 2 st and 3 st, the second and third internode of the main stem, respectively. 1 b, 2 b, and 3 b, the leaf blades of the relevant internode; 1 sh, 2 sh, and 3 sh, the leaf sheaths of the corresponding internode. TaEF la (No.M90077) was set as the internal control
2.2 TaMYB1A 的系统进化分析
在NCBI 网站(https://www.ncbi.nlm.nih.gov/)下载了拟南芥(ArabidopsisthalianaL.)、玉米(ZeamaysL.)、小麦(TriticumaestivumL.)、杨树(Populustremula×tremuloides)和丹参(SalviamiltiorrhizaL.)等物种中12个第4亚组MYB蛋白的氨基酸序列,利用 MEGA6.0 软件对其进行系统进化分析。结果表明,TaMYB1A 与小麦中已报道的TaMYB1D及NCBI上登录的TaMyb1相似性最高,三者与ZmMYB31聚成一个小类;TaMYB4则与ZmMYB42聚在一类;拟南芥基因组的4个成员中,AtMYB7与AtMYB32聚在一组,AtMYB4与丹参的SmMYB4在同一组,AtMYB3则位于整个进化树的根部;杨树PtrMYB57和PtrMYB182 与其它成员的关系均较远(Fig.2),推测TaMYB1A与小麦的TaMYB1D和玉米ZmMYB31有相似的功能。

Fig.2 Phylogenetic analysis of TaMYB1A and its homologues in wheat and other plant species An unrooted phylogenetic tree of R2R3-MYBs across plant species was constructed (bootstrap value: 1 000 replicates). The scale bar equals 0.5 amino acid substitutions per position in the sequence. TaMYB1A in this study was marked by an asterisk in the upper right
2.3 TaMYB1A 主要定位于细胞核且具有转录抑制活性
VP16是单纯疱疹病毒的转录激活结构域。为了在酵母中探究TaMYB1A 的转录激活/抑制活性,本研究构建了pGBKT7-TaMYB1A、pGBKT7-VP16、pGBKT7-VP16-TaMYB1A等载体。将上述载体连同pGBKT7(空载体,阴性对照)和 pGBKT7-TabZIP6(阳性对照)一起转化酵母菌株AH109。在SD/-Trp培养基上,所有菌株均能正常生长,说明各质粒均转化成功;挑取在SD/-Trp上正常生长的各酵母菌落测定其β-半乳糖苷酶活性。结果表明,转化pGBKT7- TaMYB1A菌落的β-半乳糖苷酶活性与pGBKT7 相近,无显著差异;转化pGBKT7- TabZIP6的酵母菌落与pGBKT7-VP16相似,其β-半乳糖苷酶活性分别是转化pGBKT7酵母菌落的1.64倍和1.51倍,均显著高于pGBKT7-TaMYB1A 和pGBKT7;而转化pGBKT7 -VP16- TaMYB1A的酵母菌落的β-半乳糖苷酶活性比pGBKT7-TaMYB1A高23.6%,但比转化pGBKT7-VP16的菌落低20.4%(Fig.3A), 以上结果说明TaMYB1A降低了pGBKT7- VP16的转录激活活性,即TaMYB1A具有转录抑制活性。
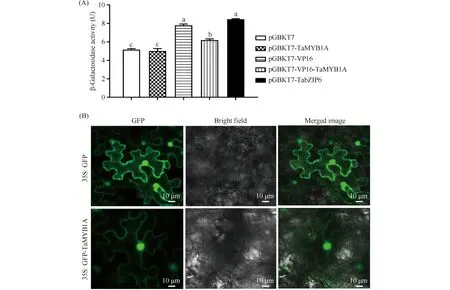
Fig.3 TaMYB1A has transcriptional repression activity and is mainly localized to the nucleus of the epidermal cells of Nicotiana benthamiana L. leaves (A) Transcription activity assays of TaMYB1A. The β-galactosidase activity of yeast cells containing pGBKT7(negative control), pGBKT7-TabZIP6 (positive control), pGBKT7-VP16, pGBKT7-TaMYB1A, and pGBKT7-VP16-TaMYB1A vectors on SD/-Trp medium(n=3) was measured followed by one-way ANOVA analysis (Tukey test) (n=3). Three replicates were performed and similar results were obtained; (B) The GFP-TaMYB1A fusion protein was mainly localized to the nucleus in the epidermal cells of Nicotiana benthamiana L. leaves. The scale bars in figure B were equal to 10 μm
为了明确TaMYB1A蛋白的亚细胞定位,本研究构建了pEGAD-TaMYB1A(即35S: GFP- TaMYB1A)融合表达载体;将转化pEGAD -TaMYB1A和pEGAD空载体(即35S: GFP)的农杆菌菌液分别注射烟草叶片。在注射pEGAD 空载体菌液的烟草表皮细胞中,在细胞核、细胞膜和细胞质中均可观察到强烈的GFP荧光信号;在注射pEGAD- TaMYB1A菌液的表皮细胞中,可在细胞核中观察到强烈的荧光信号,而细胞膜上的荧光信号非常微弱,未在细胞质中检测到荧光信号(Fig.3B),以上结果说明在烟草表皮细胞中GFP-TaMYB1A 融合蛋白主要定位于细胞核中。
2.4 过表达TaMYB1A 负调控转基因拟南芥植株的株高
为了解析TaMYB1A 的生物学功能,本研究构建了35S:TaMYB1A载体并将其转化拟南芥Col-0。对T3代转基因拟南芥纯合株系进行的RT-PCR分析表明,TaMYB1A在3个转基因株系中均正常表达(Fig.4A)。对6周大拟南芥株系的表型观察和统计发现,3个TaMYB1A过表达拟南芥株系较野生型分别矮12.2%、5.9%和6.1%,且均达到显著差异水平(Fig.4B,C),说明过表达TaMYB1A抑制转基因拟南芥株系的株高。
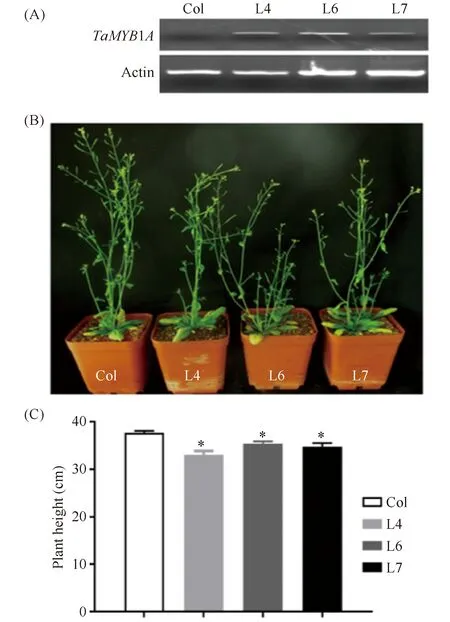
Fig.4 Overexpression of TaMYB1A negatively affected the plant height of transgenic Arabidopsis plants (A) Confirmation of the expression of TaMYB1A in transgenic Arabidopsis lines overexpressing TaMYB1A by RT-PCR; Col: Arabidopsis ecotype Col-0; L4, L6, and L7: Transgenic Arabidopsis lines overexpressing TaMYB1A, the same as below; (B) Phenotype of the transgenic Arabidopsis lines overexpressing TaMYB1A after normally grown for 6 weeks; (C) Statistical analysis of the plant height of transgenic Arabidopsis lines overexpressing TaMYB1A(n=3, N=15). Three biological replicates were performed with similar results,*P<0.05
2.5 过表达TaMYB1A 抑制转基因拟南芥株系中木质素和类黄酮的合成
木质素可被间苯三酚染成红/紫色。间苯三酚染色结果说明,与野生型相比(Fig.5A),TaMYB1A过表达株系的木质部染色较浅(Fig.5B);3个TaMYB1A过表达拟南芥株系的木质素含量较野生型分别降低了33.6%、38.1%和37.0%(Fig.5C),类黄酮含量较野生型分别降低了17.6%、19.0%和13.4%(Fig.5D),且均达到显著差异水平,以上结果说明过表达TaMYB1A抑制了转基因拟南芥株系中木质素和类黄酮的合成。

Fig.5 Overexpression of TaMYB1A decreased the lignin and flavonoid contents in transgenic Arabidopsis plants Phloroglucinol staining results of the inflorescence stem(cross section)of the Arabidopsis wild type (A) and the Arabidopsis plants (L4) expressing TaMYB1A (B); (C) Total lignin contents in the inflorescence stems of the wild type and plants overexpressing TaMYB1A; (D) Flavonoid contents in the leaves of the wild type and Arabidopsis plants overexpressing TaMYB1A. Data shown in C and D were the mean ± SD (N=15) from three biological replicates and were statistically analyzed by Student’s t-test (*P <0.05). if: Interfascicular fiber; e: Epidermis; x: Xylem
2.6 TaMYB1A 可与拟南芥和小麦苯丙烷途径关键基因的启动子结合
AC元件是苯丙烷途径基因启动子中常见的顺式作用元件,参与对苯丙烷途径调控的MYB类转录因子通常可与这些基因启动子区的AC元件结合。本研究首先在Plant CARE 网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)分析了拟南芥中苯丙烷途径关键基因启动子(自ATG至上游约2 kb区域)中AC元件的数量及分布情况(Table 2)。从中选取含有AC元件较多的基因的启动子进行后续实验,包括苯丙烷途径上游(共有途径)的At4CL1和AtC4H、木质素分支途径中的AtC3H以及类黄酮途径的AtCHS的启动子。本研究将At4CL1、AtC4H、AtC3H和AtCHS的启动子序列分别连接至pLac Zi载体,命名为pLac Zi:Xp(X:At4CL1、AtC4H、AtC3H或AtCHS);将TaMYB1A连接至pGADT7,得到pGADT7-TaMYB1A。

Table 2 Prediction of the number and type of AC elements in the promoters of key genes involved in the phenylpropanoid pathway in Arabidopsis
随后,本研究利用酵母单杂交技术分析了TaMYB1A与拟南芥苯丙烷途径基因启动子间的结合情况。以转化pGADT7+pLac Zi:Xp载体的酵母菌株作对照,分别分析转化pGADT7-TaMYB1A + pLac Zi:Xp酵母菌株的β-半乳糖苷酶活性。结果表明,共转化pGADT7- TaMYB1A + pLac Zi:Xp的酵母菌株的β-半乳糖苷酶活性分别是其pGADT7+pLac Zi:Xp对照的1.98倍、2.29倍、2.92倍和2.35倍,均达到显著差异水平,说明TaMYB1A可分别结合于At4CL1、AtC4H、AtC3H和AtCHS的启动子区(Fig.6A、B);此后,本研究利用双荧光素酶报告系统分析了TaMYB1A对At4CL1、AtC4H、AtC3H和AtCHS表达的影响。结果表明,TaMYB1A对AtC4H、At4CL1、AtCHS和AtC3H的表达均呈显著抑制效应,分别为其空载体对照的49.0%、43.0%、36.1%和57.2%(Fig.6C,D)。

Fig.6 TaMYB1A could bind to the promoters of the key genes involved in the phenylpropanoid pathway in Arabidopsis and thereby repress their expression (A) Schematic diagram of the effector and reporter constructs used in Y1H; (B) Measurement of the β-galactosidase activity of the yeast cells containing different effector and reporter (promoters of At4CL1, AtC4H, AtC3H, or AtCHS) construct combinations(n=3); (C) Schematic diagram of the effector and reporter constructs used in dual-luciferase reporter system assays; (D) The ratio of LUC/REN in the Nicotiana benthamiana L. leaves co-injected with different vector combinations(n=3). Three replicates were performed with similar results.*P <0.05,**P <0.01,***P <0.001
Ta4CL1和TaC4H1分别是At4CL1和AtC4H1在小麦中的同源基因,在此前的研究中本实验室克隆了它们的启动子序列。启动子元件分析表明Ta4CL1和TaC4H1的启动子区均含有AC元件(Ta4CL1启动子区含有1个AC I 和2个AC II元件;TaC4H1启动子区含有2个AC II 元件)。酵母单杂交分析表明,共转化pGADT7- TaMYB1A + pLac Zi:Ta4CL1p酵母菌株的β-半乳糖苷酶活性是其pGADT7+pLac Zi:Ta4CL1p对照的4.47倍;共转化pGADT7- TaMYB1A + pLac Zi:TaC4H1p酵母菌株的活性是其pGADT7+pLac Zi:TaC4H1p对照的3.01倍,说明TaMYB1A也可以结合于Ta4CL1和TaC4H1的启动子区(Fig.7A)。遗传学分析表明,转化Ta4CL1p:Gus拟南芥叶片的Gus染色主要分布在叶柄和叶脉,且染色较深(Fig.7B),而Ta4CL1p:Gus(♀)×TaMYB1AL4 () F1叶片只在叶柄处有微弱的染色,在叶脉区基本未染色(Fig.7 C);与转化TaC4H1p:Gus拟南芥叶片的Gus染色相比(Fig.7D),TaC4H1p:Gus(♀)×TaMYB1AL4 () F1叶片的Gus染色也明显减弱(Fig.7E),以上结果说明,TaMYB1A抑制小麦Ta4CL1及TaC4H1的表达。
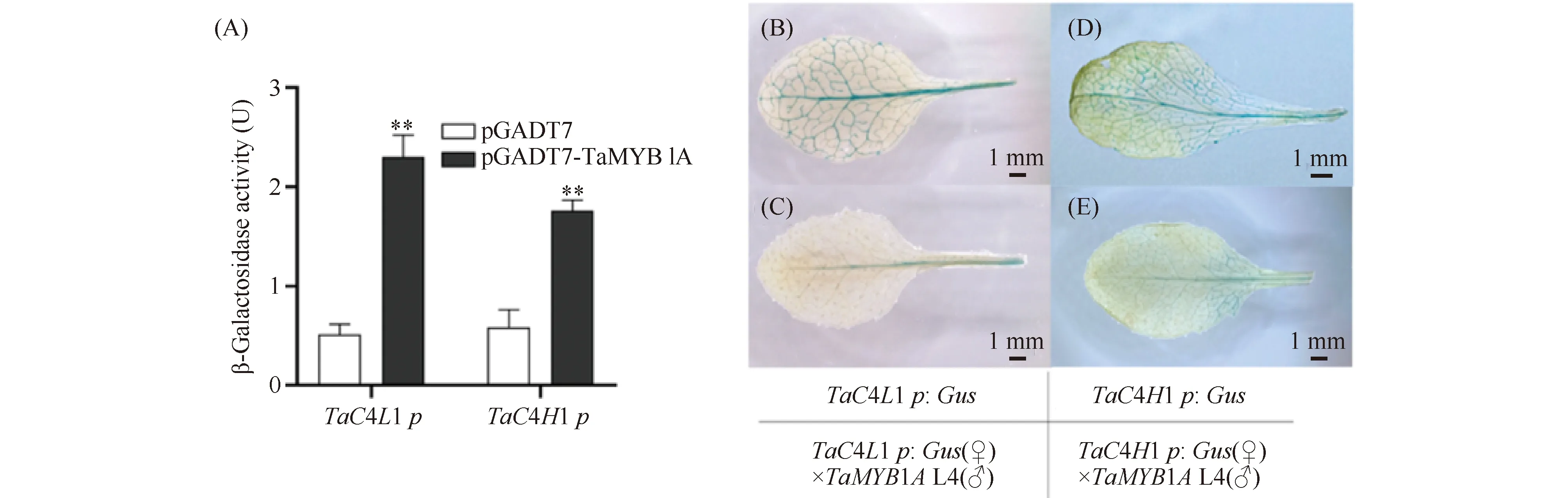
Fig.7 TaMYB1A could bind to the promoters of the wheat Ta4CL1 and TaC4H1 and negatively regulate their expression (A) Y1H assays of the binding activity of TaMYB1A to the promoters of Ta4CL1 and TaC4H1 (n=3). **P<0.01. Three replicates were performed with similar results; (B) and (D) The Gus staining results of the transgenic Arabidopsis leaves harbouring Ta4CL1p:Gus (B) and TaC4H1p:Gus constructs (D); The Gus staining results of leaves of Ta4CL1p:Gus (♀)×TaMYB1A L4 () F1 (C) and TaC4H1p:Gus (♀)×TaMYB1A L4 () F1 (E)
2.7 过表达TaMYB1A抑制转基因拟南芥株系中苯丙烷途径相关基因的表达
为了深入探讨 TaMYB1A对苯丙烷途径的调控机制,本研究利用基因芯片和qRT-PCR技术研究了过量表达TaMYB1A对转基因拟南芥苯丙烷途径中相关基因表达的影响。
以野生型拟南芥(Col-0)为对照,对过表达TaMYB1A拟南芥株系L4中基因的表达情况进行了基因芯片分析。散点图(Fig.8A)及热图(Fig.8B)分析表明,不同材料的两个生物学重复中基因表达水平较为一致;芯片分析表明,与野生型相比,TaMYB1A过表达拟南芥株系L4中大部分苯丙烷途径基因的表达水平显著下降,包括苯丙烷途径上游的PAL1、C4H和4CL1,木质素分支途径的HCT、CAD5、CCoAOMT1、C3H和COMT以及类黄酮途径的CHS、F3H、F3’H、DFR和CHI,FLS的表达略有升高(Table 3)。对这些基因的qRT-PCR分析结果与其在基因芯片中的结果趋势一致,即TaMYB1A过表达拟南芥株系中上述基因的表达水平均显著低于其野生型对照(FLS除外)(Fig.8C)。综上所述,过表达TaMYB1A下调了转基因拟南芥株系中绝大多数苯丙烷途径木质素和类黄酮合成相关基因的表达水平。
Table 3 Most of the genes involving in the phenylpropanoid pathway were down-regulated in TaMYB1A-overexpressed Arabidopsis plants
Fig.8 Overexpression of TaMYB1A negatively regulated the expression of the key genes involved in the phenylpropanoid pathway in Arabidopsis (A) Scatter plot; (B) Heat map; (C) Quantitative real-time PCR of the key genes involved in the phenylpropanoid pathway in the wild type and the TaMYB1A-overexpressed transgenic Arabidopsis plants.**P<0.01,***P<0.001
2.8 过表达TaMYB1A降低了转基因拟南芥株系中4CL酶活性
4CL是苯丙烷途径的关键酶之一,4-香豆酸是 4CL 酶最常见、转化效率最高的底物。因此,本实验以4-香豆酸为底物测定了正常生长1个月的拟南芥野生型及TaMYB1A过表达拟南芥株系叶片中4CL的酶活性。结果表明,3个TaMYB1A过表达拟南芥株系的4CL酶活性较野生型分别降低了28.7%、24.1%和21.7%,且均达显著差异水平(Fig.9),说明过量表达TaMYB1A降低了转基因拟南芥株系中4CL的酶活性。
Fig.9 The 4CL activity in the TaMYB1A-overexpressed Arabidopsis plants was significantly decreased Data shown were the mean ± SD (n=3) from three biological replicates and similar results were generated.*P<0.05,**P<0.01
3 讨论
据报道,多数第4亚组的R2R3 MYB转录因子负调控苯丙烷代谢途径。拟南芥基因组中有4个第4亚组的R2R3 MYB转录因子成员,它们均是苯丙烷途径的负调控因子,但其功能和机制各异[19-22]。玉米中的ZmMYB31和ZmMYB42同属于第4亚组的成员,过量表达ZmMYB31或ZmMYB42的转基因拟南芥株系总木质素含量均显著下降[23, 33],但两者的功能不尽相同:ZmMYB31过表达拟南芥株系中花青素含量大幅增加,而黄酮醇水平几乎保持不变[23];而过量表达ZmMYB42的拟南芥中的黄酮醇含量显著下降,花青素含量略有降低[33]。因此,同一物种中第4亚组的R2R3 MYB转录因子的功能和机制也不尽相同。
系统分析表明,本研究中的TaMYB1A与TaMYB1D和TaMyb1有较近的亲缘关系(Fig.2)。在小麦数据库查询得知TaMyb1对应的基因为TraesCS5B03G0831200.1,TaMYB1D对应的基因为TraesCS5D03G0755200.1;本文中的TaMYB1A为TraesCS5A03G0798500.1,因三者均位于5号染色体上,推测三者分别为位于小麦5A、5B和5D染色体上的同源基因,因此命名为TaMYB1A。
本研究表明,与野生型拟南芥相比,过量表达TaMYB1A导致转基因拟南芥株系中木质素沉积减少(Fig.5A,B)、木质素和类黄酮含量均显著降低(Fig.5C,D),说明TaMYB1A也是苯丙烷途径的负调控因子。小麦TaMyb1响应缺氧、盐及PEG处理,未有报道显示其与苯丙烷途径有关[34];组织化学染色显示,过量表达TaMYB1D的转基因烟草中木质素沉积略有减少;类黄酮含量也略有降低。因此,TaMYB1A与TaMYB1D功能相似,均是苯丙烷途径的负调控因子。TaMYB4是小麦中另一个第4亚组的R2R3 MYB转录因子,但与TaMYB1A的序列相似性较低(Fig.2)。过量表达TaMYB4的转基因烟草木质素含量降低,而类黄酮含量显著升高[28];这与本研究结果不完全一致。
对苯丙烷途径起负调控作用的转录因子一般可结合于相关基因的启动子区,并负调控这些基因的表达。如ZmCOMT和ZmF5H是ZmMYB31的直接靶基因;过表达ZmMYB31的转基因拟南芥株系中C3H、4CL1、4CL2、F5H和COMT表达水平下降以及CHI、F3H、F3’H和DFR表达水平升高[23];RT-PCR分析表明,在ZmMYB42过表达拟南芥株系中,PAL1、C4H、4CL1、F5H、COMT、CAD6、F3H和F3’H表达水平下降,CHS水平升高,而C3H、CCoAOMT1和CCR1表达水平基本不变[33]。在烟草瞬时表达系统中,TaMYB1D可抑制OsCAD或TaCAD的表达[29]。TaMYB4可结合于OsCAD2的启动子区;RT-PCR结果显示,过表达TaMYB4的转基因烟草中CAD的表达显著下降,CCR略有下降[28]。由上可知,TaMYB1D和TaMYB4的直接靶基因均是CAD基因。
与上述研究相比,本研究更深入/全面地探讨了TaMYB1A调控苯丙烷途径的分子机制。在分析了苯丙烷途径基因启动子的基础上(Table 2),本研究选择了拟南芥苯丙烷途径的4个关键基因进行后续分析。在酵母中的分析表明,本研究中的TaMYB1A具有转录抑制活性(Fig.3A);酵母单杂交实验和双分子荧光报告实验表明,TaMYB1A可结合于拟南芥苯丙烷途径上游基因At4CL1和AtC4H以及类黄酮途径上游基因AtCHS和木质素途径上游基因AtC3H的启动子区并抑制其表达(Fig.6)。本研究还特别关注了TaMYB1A对小麦苯丙烷途径上游基因表达的影响。酵母单杂交实验和遗传学分析表明,TaMYB1A可结合于小麦Ta4CL1和TaC4H1的启动子区并抑制其表达(Fig.7)。随后,本研究利用基因芯片技术研究了过量表达TaMYB1A对拟南芥苯丙烷途径所有关键基因表达的影响,并用qRT-PCR验证了这些基因的表达变化。结果显示,过量表达TaMYB1A抑制了苯丙烷途径的多数关键基因(FLS除外)的表达(Fig.8)。此外,过表达TaMYB1A还降低了转基因拟南芥中4CL酶活性(Fig.9)。因此,TaMYB1A的靶基因是苯丙烷途径上游的C4H和4CL(包括小麦中的Ta4CL1和TaC4H1以及拟南芥中At4CL1和AtC4H)、拟南芥木质素途径的AtCHS及类黄酮途径的AtCHS,这与其对整个苯丙烷途径起抑制效应的功能是一致的。综上所述,尽管TaMYB1A与其他第4亚组的R2R3 MYB转录因子相似,均在苯丙烷途径中起负调控作用,但调控机制不同。
据报道,某些MYB类转录因子不仅会影响苯丙烷代谢途径中相关产物的合成,也会影响植物的生长和发育。如过表达玉米ZmMYB31导致转基因拟南芥植株的株高显著降低,只有对照的1/3,且叶片、茎和花均变小[23];过表达ZmMYB42的拟南芥株系也显著低于野生型[33];过量表达TaMYB1D的转基因烟草成熟叶片中叶绿素含量更高,但对其株高无显著影响[29];本研究表明,过表达TaMYB1A的拟南芥株系的株高显著低于野生型对照(Fig.4),表明过表达TaMYB1A可降低植株的株高,这与ZmMYB31和ZmMYB42中的结果一致。因改变苯丙烷途径导致转基因株系矮化的原因是多方面的,如维管系统的缺陷、可溶性苯丙烷代谢物水平的变化以及细胞壁完整性的改变等[8]。因此,在通过基因工程手段调控苯丙烷代谢途径时应密切关注该过程对植物正常生长发育可能产生的负面影响。综上,本研究系统阐述了小麦R2R3 MYB转录因子TaMYB1A负调控苯丙烷代谢途径的分子机理,为将其用于提高植物秸秆利用效率奠定了理论基础。