银耳酵素发酵及体外消化对活性物质影响
孙嘉蔚,张恩泽,代瀚哲,李强,张平平
1.天津农学院食品科学与生物工程学院(天津 300392);2.天津齐心食品集团有限公司(天津 301599)
银耳(Tremella fuciformis),又称白木耳,常生长在株树及其他阔叶树木上[1]。银耳的药用价值主要来自于银耳多糖,还含有多酚类活性物质,具有免疫作用、抗氧化作用、抗肿瘤等功效[2]。食用酵素是以动物、植物、食用菌等为原料,经微生物发酵制得的含有特定生物活性成分可供人类食用的酵素产品,强调微生态整体[3-4],具有清除自由基[5-7]、解酒护肝[8-9]、提高机体免疫力[10-12]、抗糖尿病[5,13-14]及抗肿瘤[15-16]等功效。体外模拟人体消化技术以仿生为原理,测定食物营养成分的消化率[17-18],食用酵素的活性物质种类丰富,利用体外模拟消化研究食用酵素很有必要。
目前银耳酵素的发酵工艺及体外消化方面的研究较少,此次研究以银耳为主要原料,研制出酵母菌发酵银耳酵素(STF)、乳酸菌发酵银耳酵素(LTF)和混合菌种发酵银耳酵素(MTF),优化发酵工艺,并通过体外模拟胃肠消化试验,研究消化对STF、LTF和MTF活性物质含量的影响,以期为研究STF、LTF和MTF抗氧化活性及开发新品提供一定的借鉴。
1 材料与方法
1.1 材料与试剂
干银耳(天津市齐心食品集团有限公司);酵母菌、乳酸菌(安琪酵母股份有限公司);干枸杞(银川市永宁县玄福堂电子商务有限公司);蔗糖(天津市什福来食品科技有限公司);脱脂乳粉[萨普托乳液(中国)有限公司];Tris、EDTA·2Na、盐酸、邻苯三酚、无水乙醇、酚酞、氢氧化钠、碳酸氢钠、浓硫酸、苯酚、福林酚、碳酸钠、亚硝酸钠等均为分析纯(天津市风船化学试剂科技有限公司);马铃薯葡萄糖琼脂培养基、琼脂粉、MRS培养基、MC培养基、胃蛋白酶WDB-G-1、胰酶细胞消化液、胆汁提取液等均为生物制剂(北京奥博星生物技术有限责任公司)。
1.2 仪器与设备
JA2003电子天平(上海舜宇恒平科学仪器有限公司);K-803型粉碎机(广州美的电器制造有限公司);LDZX-50KBS立式高压蒸汽灭菌器(上海申安医疗器械厂);SW-CJ-2FD洁净工作台(苏州安泰空气技术有限公司);ZWYR-D2401恒温培养振荡器(上海智城分析仪器制造有限公司);BSC-250恒温恒湿箱(上海博迅实业有限公司医疗设备厂);HWS28型电热恒温水浴锅(上海恒科学仪器有限公司);KQ3200B型超声波清洗器(昆山市超声仪器有限公司);L366OD型低速离心机(上海知信实验仪器技术有限公司);UV-1200型紫外分光光度计(上海沪粤明科学仪器有限公司)。
1.3 方法
将干银耳复水、打浆、复配后灭菌,接种酵母菌或(和)乳酸菌,对银耳酵素发酵工艺进行优化,并测定在模拟胃肠消化过程中活性物质含量的变化。
1.3.1 银耳酵素的研制
干银耳与枸杞(质量比为4∶1)浸泡在蒸馏水中复水3 h后打浆,并添加一定比例的蔗糖或脱脂乳粉制备银耳发酵基质,高压灭菌后冷却至室温备用。活性干酵母或乳酸菌粉,溶解混匀后于37 ℃活化30 min。
1.3.1.1 酵母菌发酵
酵母菌发酵单因素试验:将酵母菌液按需要量接种到银耳发酵基质中,恒温培养发酵一定时间。固定其他因素,分别改变酵母菌接种量(0,0.5%,0.75%,1%,1.25%和1.5%)、蔗糖添加量(0,6%,12%,18%和24%)、发酵温度(29,32,35,38和41 ℃)、发酵时间(8,16,24,32和40 h)进行单因素试验,以SOD酶活性和酵母菌数为指标,初步确定酵母发酵的工艺条件。
酵母菌发酵正交试验:根据单因素试验结果,进行酵母菌发酵银耳酵素的正交试验,具体因素水平见表1。

表1 酵母菌发酵银耳酵素正交试验因素水平表
1.3.1.2 乳酸菌发酵
乳酸菌发酵单因素试验:将乳酸菌液按需要量接种到银耳发酵基质中,恒温培养发酵一定时间。固定其他因素,分别改变乳酸菌接种量(0,1%,1.5%,2%,2.5%和3%)、脱脂乳粉添加量(0,3%,4.5%,6%,7.5%和9%)、蔗糖添加量(0,2%,4%,6%和8%)、发酵温度(32,36,40,44和48℃)、发酵时间(8,16,24,32和40 h)进行单因素试验,以总酸含量和乳酸菌数为指标,初步确定乳酸菌发酵银耳酵素的工艺条件。
乳酸菌发酵正交试验:根据单因素试验结果,进行乳酸菌发酵银耳酵素的正交试验,具体因素水平见表2。

表2 乳酸菌发酵银耳酵素正交试验因素水平表
1.3.1.3 混合菌种发酵
乳酸菌接种时间对混合菌种发酵的影响:将乳酸菌液按需要量接种到经酵母菌发酵过的银耳酵素中,恒温发酵一定时间,通过控制乳酸菌的接种时间(10,15和20 h)确定混合菌种的最优发酵条件。
1.3.2 体外消化对银耳酵素活性物质含量的影响
1.3.2.1 体外消化
将完成发酵的银耳酵素进行灭菌后冷却,取10 g灭菌液,加入100 mL蒸馏水搅拌均匀,用1 mol/L HCl调节pH至2,再加入0.5 mL模拟胃液(0.5 g蛋白酶溶入5 mL 0.01 mol/L HCl溶液)混合均匀,在恒温振荡器中37 ℃消化4 h。随后取胃液消化后的消化液,用0.1 mol/L NaHCO3溶液调pH至7,加入1 mL模拟肠液(4 g胰酶和25 g胆汁提取物溶于1 L 0.1 mol/L NaHCO3溶液),混合均匀,于37 ℃消化4 h。
1.3.2.2 活性物质含量测定
每隔0.5 h取样,测定多糖、多酚和黄酮含量的变化。
1.3.3 测定方法
酵母菌计数采用GB 4789.15—2016《食品微生物学检验 霉菌和酵母计数》中平板计数法;乳酸菌计数采用GB 4789.35—2016《食品微生物学检验 乳酸菌检验》;SOD酶活性按照GB/T 5009.171—2003《保健食品中超氧化物歧化酶(SOD)活性的测定》中修改的Marklund方法;总酸含量按照GB 12456—2021《食品中总酸的测定》中酸碱指示滴定法;多糖含量测定参照SN/T 4260—2015《出口植物源食品中粗多糖的测定 苯酚-硫酸法》和T/SFABA 3—2018《银耳多糖产品中多糖含量的测定》,葡萄糖的标准曲线为y=10.373x+0.099 7,R2=0.997,甘露糖的标准曲线y=10.206x-0.013 5,R2=0.999 5;总酚含量测定采用GB/T 31740.2—2015《茶制品 第2部分:茶多酚》中改良的福林酚法,没食子酸的标准曲线y=0.012 6x+0.064,R2=0.996 4;黄酮含量采用分光光度比色法测定[19],标准曲线为y=9.994 1x+0.002 7,R2=0.996 7。
2 结果与分析
2.1 酵母菌发酵试验结果
2.1.1 单因素试验结果
酵母菌接种量、蔗糖添加量、发酵温度、发酵时间对酵母发酵银耳酵素SOD酶活性和酵母菌数的影响结果见图1。SOD酶可以清除对机体有害的·O2-,其酶活性代表抗氧化能力;酵母菌数能够直观反映发酵环境是否利于酵母菌的生长繁殖。
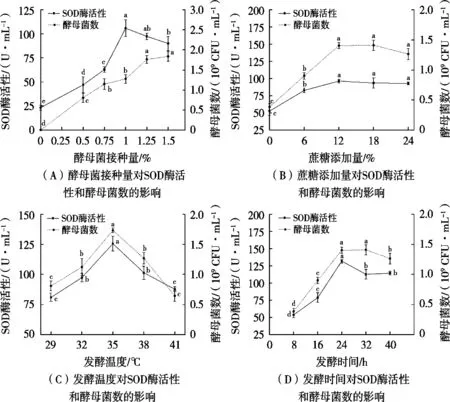
图1 酵母菌发酵单因素试验
如图1(A)所示,随着酵母菌接种量的增加,酵素的SOD酶活性呈先增长后下降的趋势,当接种量为1%时,SOD酶活性达到最大。酵母菌数呈上升趋势,当接种量为1.25%后,趋于稳定。因为接种量过少导致发酵基质中的营养物质未被利用充分,SOD酶活性和活菌数偏低。接种量超过1.25%,活菌数大量增加,基质中的营养活性成分不足以满足菌种生长需要,SOD酶活性下降,因此初步确定适宜接种量为1%。
由图1(B)可知,在蔗糖添加量为12%前,SOD酶活性和酵母菌数随添加量的增加而上升,随后趋于平稳。这是由于随着蔗糖含量的增加,发酵环境中的碳源充足,酵母菌大量繁殖,SOD酶活性升高,而多余的蔗糖未被酵母菌利用,所以选择蔗糖添加量12%为最佳。
图1(C)表明,随着发酵温度的上升,酵素的SOD酶活性和酵母菌数先升高后下降,在35 ℃条件下酵素的发酵效果最好。发酵温度低于32 ℃会导致菌种生长缓慢,温度超过38 ℃会破坏一些结构不稳定的活性物质,导致有机酸被分解出来,酸性环境不利于酵母菌发酵,SOD酶活性和活菌数下降[20]。初步选定最佳发酵温度为35 ℃。
由图1(D)得出,随着发酵时间的延长,SOD酶活性于发酵24 h时达到最大,活菌数于发酵36 h时达到最大,随后缓慢下降。这可能是因为发酵基质中的营养物质消耗量随着发酵时间的延长而增加,后期营养物质不充分,酵母菌繁殖速度下降,导致SOD酶活性和酵母菌数降低。因此发酵时间24 h为最佳。
2.1.2 正交试验结果
酵母菌发酵正交试验结果见表3。

表3 酵母发酵正交试验表
由表3可知,四因素对SOD酶活性和酵母菌数影响的主次顺序都为C>A>D>B。对SOD酶活性影响,试验最优组合为A2B1C2D1;对酵母菌数影响,最优组合为A3B1C1D2。在这两种条件下进行验证试验,A2B1C2D1制得的银耳酵素SOD酶活性为173.14 U/mL,酵母菌数为1.59×109CFU/mL;A3B1C1D2制得的银耳酵素SOD酶活性为165.20 U/mL,酵母菌数为1.48×109CFU/mL。对比得出STF的最佳发酵条件:酵母菌接种量1%、蔗糖添加量10%、发酵温度35 ℃、发酵时间20 h。
2.2 乳酸菌发酵试验结果
2.2.1 单因素试验结果
乳酸菌接种量、脱脂乳粉添加量、蔗糖添加量、发酵温度、发酵时间对乳酸发酵银耳酵素总酸含量和乳酸菌数的影响结果见图2。在乳酸菌发酵过程中,总酸含量反映了乳酸菌的产酸能力,乳酸菌数代表其生长繁殖能力。

图2 乳酸菌发酵单因素试验
由图2(A)可知,随着乳酸菌接种量的升高,酵素的总酸含量先上升后趋于平稳,总酸含量在接种量为2%时达到最高。乳酸菌数呈先增长后降低的趋势,在接种量为2%时达到最多。因为当接种量低于1.5%时,营养物质未被充分利用,导致乳酸菌的生长速度缓慢和产酸能力较低,所以总酸含量和乳酸菌数较小。随着接种量的升高,乳酸菌的发酵环境逐渐达到饱和状态。所以确定2%为最优乳酸菌接种量。
如图2(B)所示,随着脱脂乳粉添加量的增加,酵素的总酸含量和乳酸菌数均呈先快速增长后缓慢下降的趋势,当添加量为6%时发酵效果最佳。这可能是因为脱脂乳粉添加量超过7.5%会抑制发酵过程中乳酸菌的生长,产酸能力下降,乳酸菌数减少。初步选择最佳脱脂乳粉添加量为6%。
如图2(C)所示,在乳酸发酵银耳酵素的过程中,蔗糖添加量与其他因素相比,其总酸含量的最小值和最大值相差较小。乳酸菌数随蔗糖添加量的增大而升高,当添加量为6%~8%时达到平稳。因此蔗糖添加量选择6%。
由图2(D)得出,随着发酵温度的升高,酵素的总酸含量和乳酸菌数均增长后减小,于36 ℃发酵效果最佳。这是由于发酵温度高于40 ℃,对乳酸菌的生长繁殖起抑制作用,导致活菌数减少,总酸含量降低。初步确定发酵温度为36 ℃。
图2(E)表明,发酵时间在8~24 h内,酵素的总酸含量和乳酸菌数逐渐增长,随着发酵时间的延长,发酵基质中的营养物质逐渐被乳酸菌充分利用,乳酸菌生长速率上升,产酸能力增强。而过久的发酵时间导致营养物质被消耗,乳酸菌无法正常生长繁殖,也无法产酸。所以初步选择24 h为最优发酵时间。
2.2.2 正交试验结果
乳酸菌发酵的L18(35)正交试验结果见表4。

表4 乳酸发酵正交试验表
由表4看出:对总酸含量来说,五个因素的主次顺序为D>A>E>C>B,试验最优组合为A1B1C2D1E1;对乳酸菌数来说,五因素的主次顺序为D>B>A>C>E,试验最优组合为A1B1C2D3E1。对二者进行验证试验:A1B1C2D1E1制得的银耳酵素总酸含量为4.21 g/L,乳酸菌数为3.73×108CFU/mL;A1B1C2D3E1制得的银耳酵素总酸含量为4.08 g/L,乳酸菌数为3.68×108CFU/mL。通过对比得出LTF发酵的最优条件:乳酸菌接种量1.75%、脱脂乳粉添加量5.00%、蔗糖添加量6.00%、发酵温度33 ℃、发酵时间20 h。
2.3 混合发酵试验结果
2.3.1 乳酸菌接种时间对混合菌种发酵的影响
乳酸菌接种时间对混合菌种发酵的影响如表5所示。在酵母发酵15 h时接种乳酸菌的银耳酵素的SOD酶活性、酵母菌数和乳酸菌数最高。MTF的最优发酵条件是:发酵基质中添加5%脱脂乳粉和16%蔗糖,接种1%酵母菌,于33 ℃发酵,于15 h接种1.75%乳酸菌,于33 ℃发酵20 h。

表5 乳酸菌接种时间对混合菌种发酵的影响
此次试验利用酵母菌和乳酸菌分别进行了单菌种和混合菌种发酵制备三种银耳酵素,在最佳工艺条件下,STF的SOD酶活性为173.14 U/mL,酵母菌数为1.59×109CFU/mL,LTF的SOD酶活性为166.37 U/mL,总酸含量为4.21 g/L,乳酸菌数为3.73×108CFU/mL,MTF的SOD酶活性223.19 U/mL,酵母菌数1.78×109CFU/mL,乳酸菌数3.43×108CFU/mL,与单菌种发酵相比,混合菌种发酵更有益于提升其抗氧化能力和活菌数量。
2.4 银耳酵素体外消化对活性物质的影响
食用酵素富含多种营养物质和活性成分,此次试验通过体外消化技术,对三种银耳酵素在消化过程中主要活性物质含量的变化规律进行研究。
2.4.1 消化过程中多糖含量的变化规律
在体外胃肠消化过程中,三种银耳酵素多糖含量的变化规律见图3。
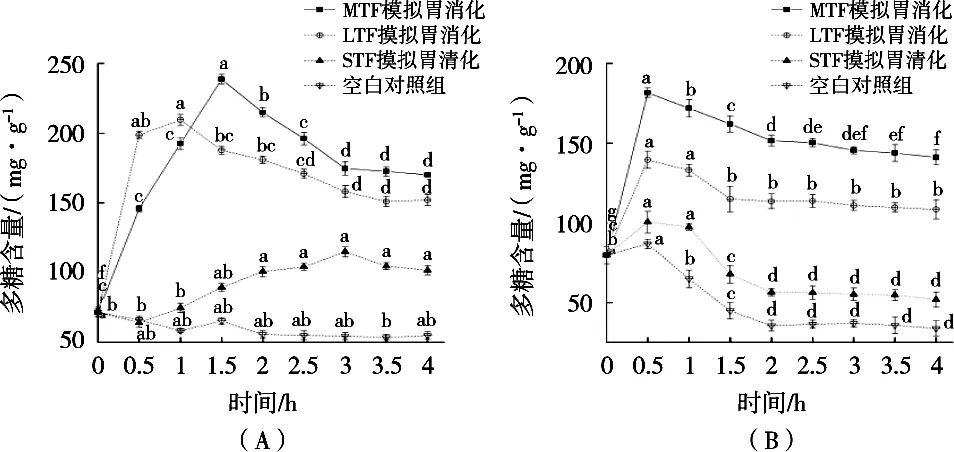
图3 胃、肠消化过程中多糖含量的变化规律
由图3(A)可知:在模拟胃消化过程中,STF的多糖在0.5 h内减少,且低于空白对照组,0.5 h开始显著上升,2 h后趋于稳定;LTF的多糖含量在胃消化前1 h快速上升,随后缓慢降低至无显著性变化;MTF的多糖含量在胃消化初期显著性升高,于1.5 h时达到最大值后缓慢降低,于3 h趋于稳定。模拟胃消化4 h后STF、LTF和MTF的多糖含量分别是消化0 h的1.42,2.12和2.38倍。说明胃蛋白酶可以促进多糖的释放。LTF和MTF多糖含量在胃消化1.5~2 h时发生下降,可能是多糖的糖苷键在胃的酸性环境和胃蛋白酶共同作用下被破坏,其稳定性降低,分子量减小[21]。
如图3(B)所示:在模拟肠消化过程中,STF的多糖含量先上升后下降,2 h达到平稳;LTF的多糖含量快速上升后缓慢降低,1.5 h后无显著性变化;MTF的多糖量在胃消化0.5 h内快速上升,随后下降。模拟肠消化4 h后STF、LTF和MTF的多糖含量分别为消化0 h的0.65,1.36和1.77倍。通过试验结果对比可知,模拟胃消化过程中多糖含量的提升速率高于肠消化,说明模拟胃环境更利于多糖的释放。
2.4.2 消化过程中多酚含量的变化规律
在体外胃肠消化过程中,三种银耳酵素多酚含量的变化规律见图4。
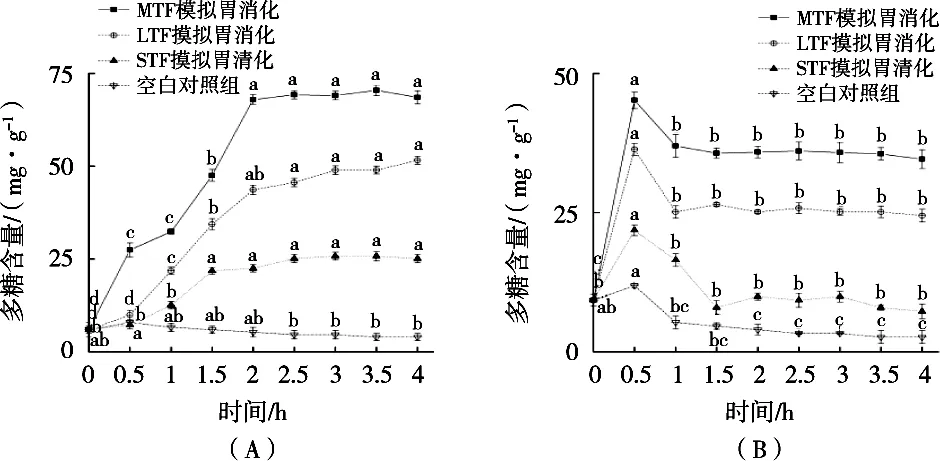
图4 胃、肠消化过程中多酚含量的变化规律
由图4(A)可知:在模拟胃消化过程中,STF在前1.5 h的多酚含量呈增长趋势,随后无显著性变化;LTF与MTF多酚含量在胃消化前期持续上升,分别于2.5 h和2 h后保持稳定。模拟胃消化4 h后STF、LTF和MTF的多酚含量分别为消化0 h的3.73,7.47和9.94倍。在模拟胃消化的强酸条件中,蛋白质被胃蛋白酶分解,导致氢键破坏,促进多酚的释放。
由图4(B)可知:在模拟肠消化过程中,STF、LTF和MTF的多酚含量都是在消化0.5 h内快速上升,随后下降,STF在消化1.5 h后多酚含量保持平稳,LTF和MTF是在消化1 h后无显著性变化。模拟肠消化4 h后STF、LTF和MTF的多酚含量分别为消化0 h的0.79,2.64和3.74倍,说明胰酶和胆汁能够促进多酚的释放。多酚在肠消化1 h出现含量下降,在酸性胃环境转移到碱性肠环境的过程中,多酚的稳定性受到影响,发生降解[22]。
2.4.3 消化过程中黄酮含量的变化规律
在体外胃肠消化过程中,三种银耳酵素黄酮含量的变化规律见图5。

图5 胃、肠消化过程中黄酮含量的变化规律
如图5(A)所示:模拟胃消化过程中,STF和LTF的黄酮含量在3 h前持续上升,随后趋于稳定,LTF在3.5 h后稍有下降;MTF的黄酮含量在消化0~2.5 h内持续增长,2.5 h后显著性变化。模拟胃消化4 h后STF、LTF和MTF的黄酮含量分别是0 h的2.79,5.57和7.41倍。
由图5(B)可知:模拟肠消化过程中,STF和LTF在前0.5 h内的黄酮含量无显著性变化,在0.5~1.5 h内短暂上升又迅速下降,随后无明显起伏,STF在消化2.5 h后有下降趋势;MTF在消化0~1 h的黄酮含量呈上升状态,在1~2.5 h内下降。模拟肠消化4 h后STF、LTF和MTF的黄酮含量分别是0 h的0.89,1.08和1.22倍。胃液和肠液都能够促进黄酮含量的增多,并且黄酮含量变化与多酚相似,较低pH的环境易于黄酮的释放。
模拟胃肠环境有效地提升了三种银耳酵素的活性物质含量,通过胃、肠消化前后对比:MTF的活性物质含量增长速率最快;三种活性物质中,多酚保留效果最好。
3 结论
此次试验以银耳为原料,利用酵母菌和乳酸菌分别进行了单菌种和混合菌种发酵制备三种银耳酵素,STF最佳工艺:发酵基质中添加10.00%蔗糖,接种1.00%酵母菌,在35 ℃条件下振摇发酵20 h;LTF最优工艺:发酵基质中添加6.00%蔗糖、5.00%脱脂乳粉,接种1.75%乳酸菌,在33 ℃条件下发酵20 h;MTF最优工艺:以单菌种酵素发酵工艺为基础,酵母菌发酵15 h时接种乳酸菌,再发酵20 h。虽然MTF的发酵工艺繁琐、发酵时间久,但是发酵效果最佳。在体外胃液消化过程中,STF、LTF和MTF的活性物质含量与胃消化0 h相比,多糖含量是其1.42,2.12和2.38倍,多酚含量是其3.73,7.47和9.94倍,黄酮含量是其2.79,5.57和7.41倍;在肠液消化过程中,STF、LTF和MTF的活性物质含量与肠消化0 h相比,多糖含量是其0.65,1.36和1.77倍,多酚含量是其0.79,2.64和3.74倍,黄酮含量是其0.89,1.08和1.22倍,银耳酵素的活性物质经胃肠消化后仍存在,其中MTF活性物质的释放量最高,尤其是多酚。该结果为研究银耳酵素在体外消化过程中抗氧化性变化规律提供科学支持。

