北京地区猫泛白细胞减少症病毒VP2基因的遗传进化分析
董悦欣,张启龙,程敏姮,王林,栗云鹏,傅彩霞,张永红,崔德凤*,张玮*
(1. 北京农学院动物科学技术学院,北京 102206;2. 中国农业大学动物医学院,北京 100080;3. 北京市动物疫病预防控制中心,北京 102629)
猫泛白细胞减少症又称猫传染性肠炎、猫瘟热,是由猫泛白细胞减少症病毒(feline panleukopenia virus,FPV)引起的[1]。FPV是细小病毒科(Parvoviridae)细小病毒属(Parvovirus)成员,为单股无囊膜线状DNA病毒。细小病毒适于在增殖能力强并处于有丝分裂过程中的细胞内增殖,故其主要侵害动物快速分化或分裂迅速的组织,如肠上皮细胞及骨髓等,会导致出现肠炎等相关疾病[2]。目前,猫泛白细胞减少症在全球范围广泛流行,大多以双相热、呕吐、脱水、白细胞显著减少和出血性肠炎为主要临床特征,给我国猫科动物的健康带来巨大的影响[3-4]。妊娠早期的母猫在感染FPV后,有可能造成流产、死胎等症状[5]。该病毒还可以通过母体直接感染胎儿,并对胎儿的神经发育造成影响,出现小脑发育不全、脑积水等症状。
猫泛白细胞减少症主要根据白细胞减少进行初步诊断,由于FPV具有血凝性,故可使用血清中和试验、血凝和血凝抑制试验进行鉴定,还可以通过采用ELISA、PCR等方法进行确诊[6-7]。免疫接种是该病主要防控措施,目前用于预防FPV感染的疫苗有弱毒疫苗和灭活疫苗2种。FPV基因组全长为5 kb,在电子显微镜下观察,能够看到FPV粒子呈现为一个等轴对称的二十面体,直径大小为 20~24 nm。FPV二十面对称结构的核衣壳蛋白的每一面,都是由VP1、VP2和VP3这3个结构蛋白按一定的方式进行装配蛋白分子构成的,其中VP2蛋白理化性质稳定,抗原性较强,可以诱导产生高水平的抗体,为主要的结构蛋白,在决定病毒的宿主范围和病毒抗原性方面起到了重要作用,是病毒主要的免疫保护性抗原蛋白[8]。FPV共拥有2种非结构蛋白,分别为NS1和NS2,主要作用是调控以及保护FPV基因的表达,这2种蛋白是在病毒早期的增殖过程中最优先被合成的。NS1影响猫细小病毒的基因组以及核衣壳蛋白的组装,也能剪切或者结合DNA片段,以此来调节FPV基因组的复制,不仅在FPV感染宿主体内的时候发挥着重要的作用,同时也在FPV的体外感染中发挥不可或缺的功能;NS2蛋白在病毒复制增殖的过程中,影响病毒衣壳蛋白在靶细胞核内的运输和组装[9-10]。
如今,随着病毒不断地进化和宿主范围的扩大,FPV出现了抗原变异,临床上也出现了猫免疫失败的现象。因此了解FPV的遗传变异和流行情况对新型疫苗的研发和该疾病的防治具有重要作用[11-12]。本研究从北京宠物医院患猫采集肛拭子,扩增VP2基因并对其序列进行分析,以期了解北京地区FPV的流行趋势,丰富我国FPV的流行病学资料,为控制该病的传播提供一定的理论依据。
1 材料与方法
1.1 样品来源
从北京地区宠物医院收集了不同品种、不同月龄、不同免疫状况的疑似感染FPV的猫肛拭子16份(详见表1),已对猫冠状病毒、猫杯状病毒及沙门菌等其他疑似致病原进行检测,结果均为阴性。样品于-20 ℃保存,备用。

表1 样本信息
1.2 主要试剂与仪器
PCR MasterMix购自普洛麦格(北京)生物技术有限公司;磁珠法核酸提取试剂购自天根生化科技(北京)有限公司;DNA的小量纯化试剂盒、大肠杆菌感受态DH5α、质粒连接试剂盒,均购自宝日医生物技术(北京)有限公司。
生物安全柜购自美国Nuaire公司,TGuide S32全自动核酸提取纯化仪购自天根生化科技有限公司,PCR仪购自赛默飞世尔科技(中国)有限公司,电泳仪购自北京六一仪器厂,移液器购自德国Eppendorf公司。
1.3 样品的处理与核酸提取
在样品中分别加入500 μL生理盐水,4 000 r/min离心10 min,取200 μL上清液至一新离心管中,按核酸提取试剂盒说明进行核酸的提取,得到DNA溶液于-80 ℃保存备用。
1.4 VP2基因的PCR鉴定
根据FPV VP2基因保守序列设计引物[13],上游引物序列为:ATGAGTGATGGAGCAGTT;下游引物序列为:TTAATATAATTTTCTAGG,扩增片段的大小为1 755 bp。引物由生工生物工程(上海)股份有限公司合成。PCR反应体系:DNA模板3 μL[14],上、下游引物各1 μL,2×Buffer 25 μL,超纯水20 μL,总反应体积50 μL。循环条件:94 ℃预变性5 min;94 ℃变性30 s,61 ℃退火30 s,72 ℃延伸2 min,共 35个循环;72 ℃再延伸10 min。取出PCR产物20 μL在1%琼脂糖凝胶电泳上电泳检查结果。将扩增产物交由生物工程(上海)股份有限公司进行测序。
1.5 12株FPV VP2基因的克隆与测序
1.5.1 PCR产物的回收
对1.4中PCR产物进行胶回收:在紫外分析仪下,切下带有目的条带的琼脂块。将其放入离心管中,计算净重,用于确定DNA回收过程中溶胶试剂的用量[15]。参考DNA凝胶回收试剂盒对PCR产物进行回收,将回收样品置于-20 ℃中保存备用。
1.5.2 PCR产物的克隆
按照PLB Vector连接体系:目的基因5 μL,载体1 μL,Buffer 1 μL,酶1 μL,超纯水2 μL,总反应体积10 μL。在恒温水浴锅中进行目的片段和载体PUC57质粒的连接[16]。参考文献[6]的方法,将连接产物转化DH5α感受态细胞,参考文献[17]进行提取质粒,将所提取的质粒DNA送生工生物工程(上海)股份有限公司测序。
1.6 12株FPV VP2基因遗传进化分析
将测序获得的序列通过NCBI、MEGA 7.0等软件进行分析。本研究中所使用的51个参考序列(表2)均从GenBank获得。

表2 VP2基因的参考序列
2 结果
2.1 VP2基因鉴定
对动物医院采集的疑似感染FPV的16份猫肛拭子进行VP2基因的PCR鉴定与扩增,经琼脂糖凝胶电泳后结果显示,从12份样品中获得与预期一致的目的基因片段(图1)。
2.2 目的片段测序
将目的片段经胶回收、纯化、连接载体后测序,测序结果显示12个基因片段大小均为1 755 bp,经Blast与标准株(NCBI登录号:M38246.1)序列比对,一致度为99.20%~99.54%,分析均为FPV VP2基因。对12条序列进行编号,分别命名为:FPV-2021-BJ01、FPV-2021-BJ02、FPV-2021-BJ03、FPV-2021-BJ04、FPV-2021-BJ05、FPV-2021-BJ06、FPV-2021-BJ07、FPV-2021-BJ08、FPV-2021-BJ09、FPV-2021-BJ10、FPV-2021-BJ11、FPV-2021-BJ12。
2.3 VP2基因遗传进化分析
对GenBank发布的所有FPV、犬细小病毒(CPV)VP2序列进行分析,由于有些来自同一国家或省市的流行毒株序列完全一致,最终筛选到51条VP2基因序列(包括6株CPV毒株、2株疫苗株和44株FPV毒株)[13],与试验所得12份阳性样品使用MEGA 7.0等软件构建系统进化树(图2)。其中亚洲40株(中国32株,日本5株,韩国3株);欧洲17株(意大利10株,英国 3株、疫苗株2株,葡萄牙1株,法国1株);北美洲5株(美国5株);大洋洲1株(澳大利亚1株)。图2的系统进化树显示,形成了FPV和CPV两大分支,其中CPV单独形成一个基因群(CPV-Group),FPV在不断进化过程中形成3个基因群,即G1、G2和 G3[18]。G1型34株,包括亚洲32株和欧洲2株;G2型16株,包括亚洲5株、欧洲8株、大洋洲1株和北美洲2株;G3型7株,全部来自欧洲(意大利)。本次试验所得的12份阳性样品属于G1型,与标准株M38246.1、疫苗株EU498680、EU498681之间亲缘性较远;与韩国2007年分离株KF002(EU252146.1)在同一基因群内,亲缘性高;与意大利2003年分离株150 03(EU498685.1)分群不同,亲缘性低。

注:○代表本研究中测得的FPV的VP2序列。
2.4 VP2基因同源性比对
使用DNAStar等软件将试验获得的12条VP2基因序列与全球代表性的11个来自不同国家和地区的毒株参考序列进行对比分析(图3)。12条序列核苷酸同源性比对显示,它们之间的同源性为 99.0%~100%;与FPV参考株M38246.1同源性为99.2%~99.5%;与2株疫苗株EU498680、EU498681进行比较,同源性为99.0%~99.4%;与意大利2003年分离株150 03 (EU498685.1)的同源性为98.9%~99.3%;与法国2009年分离株PLI-IV 166 (D88287.1)和英国2006年分离株97 06-10 (EU498713.1)同源性为99.0%~99.4%;与韩国2007年分离株KF002 (EU252146.1)同源性为99.7%~99.9%;与中国北京2018年分离株Beijing-L4(MK266796.1)和日本2000年分离株V208(AB054226.1)同源性为99.1%~99.4%。
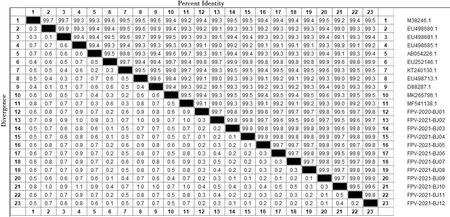
图3 FPV VP2基因同源性分析
2.5 VP2关键氨基酸位点的突变情况
通过查阅文献资料,FPV VP2蛋白的第80、87、93、101、103、297、300、305、323、426、555、564和568位氨基酸位点是决定分离株抗原性和宿主范围的关键位点,这些关键位点的变化会影响其抗原特性和宿主范围[19-20]。将本研究获得的序列与国内外部分FPV和CPV毒株的 VP2基因上关键氨基酸位点进行分析对比,结果见表3。试验所得的12条序列的关键氨基酸位点均相同,未出现突变现象;与参考株CU-4相比,第101位出现了突变I-T,但对比其他毒株,除意大利的Purevax merial vaccine疫苗株外,其余毒株的101位氨基酸均为T;针对第323位氨基酸位点,仅有意大利2008年分离株V142(AB054226)出现突变D-N;与CPV VP2蛋白关键氨基酸位点比对,多个位点出现明显差异:第80位(K-R)、第93位(K-N)、第103位(V-A)、第323位(D-N)、第564位(N-S)、第568位(A-G);与CPV2a、CPV2b、New CPV2a、New CPV2b毒株在个别关键位点显示出差异性,如第87位(M-L)、第93位(K-N)、第300位(A-G)、第305位(Y-D)和第101位(T-I)等。

表3 FPV、CPV的VP2基因上关键位点氨基酸突变情况
3 讨论
FPV对猫科动物的危害较大,其核衣壳蛋白由60个VP1及VP2蛋白按照特定的排列方式相互交替结合而成,其中VP1蛋白约占FPV核衣壳蛋白的10%,而VP2蛋白约占90%[12],所以VP2蛋白对于FPV感染有重要影响,VP2基因在决定其抗原性和宿主范围中起到了重要作用[16]。本研究通过收集疑似感染FPV的猫肛拭子扩增VP2基因,共获得12条基因序列,对其进行遗传进化分析、同源性比对和关键氨基酸位点突变情况分析。
根据VP2基因遗传进化分析,G1群多数由亚洲毒株组成;G2群由世界各地毒株聚集组成,但主要为欧洲、亚洲毒株,与G1群比较,起源较早且包括2株疫苗株;G3群多数由欧洲毒株组成。从世界范围分布上分析,亚洲、欧洲流行株在G1、G2、G3群均有分布,北美洲、大洋洲流行株主要位于G2群内。就我国而言,FPV毒株主要为G1群,且不同地区之间未发现有明显的地理分离现象。到目前为止,世界范围内FPV的流行株是以G1和G2群为主,G3群也在部分国家流行。本次试验所得的12条 VP2基因序列均属于G1群,与中国、日本和韩国毒株之间亲缘性更近,这说明,在不同国家之间FPV的演化存在地理分离的现象,与翟志安[14]报道一致。
本试验12条VP2基因序列与国内外最近流行株的序列对比,关键的氨基酸位点鲜有突变,表明FPV VP2蛋白的抗原性和宿主范围等在进化过程中较少发生改变,与洪马林等[21]报道一致;与意大利的Purevax merial vaccine疫苗株相比,第101位氨基酸发生突变,可能是导致免疫失败的原因之一[11]。FPV和CPV 毒株的VP2蛋白关键氨基酸位点存在一定的突变,表明VP2蛋白在不同宿主上可能表现出功能差异性。与CPV相比,FPV在VP2基因的遗传进化上更为保守[19-20]。
由于FPV不断进化,对FPV抗原变异株的分子监测尤为重要,不仅为FPV感染的防控提供一定的理论基础和参考依据,而且对研究细小病毒的生物学特性、新型疫苗的研发等具有重要意义。

