基于小胶质细胞活化探讨不同部位电针对小鼠脑缺血急性期炎性反应的影响
庄丽华,柯 晖,陈 涛,张彦红,徐 俊,韩永明
(湖北中医药大学,湖北 武汉 430065)
缺血性脑卒中是指各种原因所致的脑部血液循环障碍导致的脑组织缺血、缺氧性坏死,进而出现相应神经功能受损的疾病。脑缺血后小胶质细胞大量活化,介导炎性反应,从而引发一系列级联反应,导致卒中后二次损伤,目前研究认为小胶质细胞活化介导的炎性反应是影响脑卒中进展及预后的主要因素之一[1-3]。电针是起源于中国古代的一种治疗方法,可用于包括脑卒中等疾患在内的多种神经系统疾病的治疗[4-6],可通过多种机制改善脑缺血损伤及其炎性反应[7-10]。百会穴、太阳穴是临床治疗缺血性脑卒中的重要头部穴位,足三里穴、曲池穴是治疗缺血性脑卒中的重要体部穴位。课题组前期实验研究表明,联合电针上述穴位能抑制小鼠脑缺血后小胶质细胞的活化,降低血清炎性因子水平[11]。本实验观察比较了电针不同穴位对小鼠脑缺血后小胶质细胞活化及炎性因子的影响,旨在为电针选穴治疗缺血性脑卒中提供更多依据。
1 实验材料与方法
1.1实验动物 SPF级野生型健康成年雄性C57BL/6小鼠50只,体重20~25 g,购自维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0006。饲养于湖北中医药大学动物实验中心SPF级实验室,饲养室温度保持20~26 ℃,相对湿度40%~70%。所有实验和程序均提前申请通过湖北中医药大学动物伦理委员会批准。
1.2主要仪器及试剂 小鼠MCAO线栓(1620-20-A4),北京西浓科技有限公司(beijing cinontech co.ltd);G6805-2型低频电子脉冲治疗仪,上海医用电子仪器厂;规格为0.25 mm×25 mm的华佗牌针灸针,中国苏州医疗用品厂有限公司;Magnetom skyra3.0T磁共振仪,德国西门子公司;3.0T8通道横向放置老鼠线圈,上海辰光医疗科技股份有限公司;小鼠C反应蛋白(CRP)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)酶联免疫检测试剂盒,赛默飞世尔科技公司;伊红和苏木素,美国Sigma公司;抗IBA1抗体,美国abcam公司。
1.3实验方法 将小鼠按照体重分层随机法分为假手术组、模型组、头电针组、体电针组、头体电针组,每组10只。术前所有小鼠严格禁食12 h,自由饮水,采用1%戊巴比妥钠35~40 mg/kg腹腔注射麻醉小鼠,仰卧位固定,采用眼科剪剪开颈部正中皮肤1.0~1.5 cm,用眼科镊顿性分离皮下组织及腺体,暴露颈动脉鞘,假手术组分离出颈总动脉、颈外动脉和颈内动脉,不插线栓。模型组和各电针组小鼠采用改良的Longa线栓法[12]建立右侧大脑中动脉闭塞模型:分离右侧颈总动脉及颈外动脉,结扎颈总动脉近心端及颈外动脉;将直径(0.14±0.02)mm线栓放入27G注射器针头(外径0.4 mm、针长13 mm),将针头从颈总动脉插入,从针头尾部推入线栓,镊子夹住颈总动脉及其内线栓,退出针头后继续将线栓插入颈内动脉,遇到阻力时停止,这时线栓头端距离颈总动脉分叉约1 cm,大脑中动脉起始处刚好被堵住。减掉线栓多余部分并进行固定,消毒切口并缝合。术后单笼饲养,维持小鼠直肠温度在(37.0±0.5)℃,记录每只小鼠神经功能得分(Longa’s 5分法,0分:无明显神经功能缺损症状;1分:垂直提尾时不能伸展对侧前爪;2分:行走时向偏瘫侧转圈;3分:行走时身体向偏瘫侧倾倒;4分:不能自发行走,意识丧失;5分:死亡)。实验纳入评分为1~3分小鼠,剔除0分、4分、5分小鼠。若有小鼠在观察时间点前死亡或样本(血清)未取出,则随机补充同厂家相似体重的小鼠,以保证各组动物的样本数量。小鼠完全苏醒生命体征平稳后开始按组别行电针治疗,参照《实验动物常用穴位名称与定位第3部分:小鼠》[13],头电针组取百会穴(小鼠头顶右侧两耳根连线与前后中线交点处)+患侧太阳穴(小鼠外眼角与耳之间的凹陷即颞窝中),体电针组取患侧足三里穴(后三里穴,小鼠膝关节外侧腓骨小头下3 mm处)+患侧曲池穴(小鼠桡骨近端肘关节外侧前方的凹陷处),头体电针组取百会穴+患侧太阳穴+患侧曲池穴+患侧足三里穴。操作方法:将小鼠俯卧位固定于特制固定器上,常规消毒,以毫针直刺各穴位,下针深度约3 mm,进针后连接低频脉冲治疗仪,选择低频疏密波,电针治疗频率为2/20 Hz,每3 s交替1次,每次刺激30 min,每12 h针刺1次,至造模后72 h,针刺强度以小鼠耳郭或针柄轻微颤动为度。模型组和假手术组每日在各电针组干预的同时行抓取刺激。
1.4观察指标及方法
1.4.1神经功能评分 记录各组小鼠完全苏醒后及术后72 h的Longa’s 5分法神经功能评分。
1.4.2脑水肿总体积百分比 采用1%戊巴比妥钠(35~40 mg/kg)腹腔注射麻醉小鼠后,俯卧位行磁共振扫描,在T2WI每个层面图像上画出高信号区域及整个层面的范围,读出水肿区域像素点数(S1-Sn)以及每个层面总像素点(S1总-Sn总),小鼠脑水肿总体积百分比=水肿体积/总体积=(S1+S2…+Sn)×T/[(S1总+S2总…+Sn总)×T],T为层厚(1 mm)。
1.4.3血清CRP、TNF-α及IL-1β水平 各组小鼠在术后72 h即刻摘眼球取血,静置30 min后,以3 000 r/min(离心半径10 cm)离心15~20 min,取上层血清,采用ELISA法测定血清CRP、IL-1β及TNF-α水平。
1.4.4脑组织病理形态 取血后立刻脱颈处死小鼠,取出完整脑组织,采用4%多聚甲醛固定24 h后进行HE染色和IBA1免疫组化染色。扫描全部玻片信息,在HE染色图片上观察神经元坏死及炎性细胞浸润情况;在免疫组化染色图上观察小胶质细胞活化情况,并计算活化小胶质细胞百分比,计算方法:在病变侧梗死中心取4个不重复的视野(400倍),统计活化的小胶质细胞数目和总小胶质细胞数目,将两者比值作为该图活化小胶质细胞数目百分比,每只小鼠4个视野百分比均值为该小鼠活化小胶质细胞数目百分比。
1.5统计学方法 采用SPSS 25.0软件进行统计学分析。神经功能评分采用众数进行描述,组间比较采用非参数检验(Kruskal-Wallis 检验)。水肿总体积百分比、活化小胶质细胞百分比、血清炎性因子水平数据若不符合正态分布,则采用非参数检验;若符合正态分布、方差齐性,则采用单因素方差分析,组间两两比较采用最小显著性差异法(LSD法);若数据符合正态分布、方差不齐,则采用Dunnett’sT2检验。P<0.05为差异有统计学意义。
2 结 果
2.1各组小鼠神经功能评分比较 假手术组小鼠均无明显神经功能缺损症状,评分均为0分;各造模组小鼠在造模后和术后72 h均有不同程度的神经功能缺损,模型组、头电针组、体电针组、头体电针组小鼠术后神经功能评分众数分别为3,3,3,2分,术后72 h神经功能评分分别为3,2,3,2分。
2.2各组小鼠脑水肿总体积百分比比较 假手术组小鼠T2WI图像无明显水肿信号改变,脑水肿总体积百分比为0;各造模组小鼠T2WI图像右侧脑组织出现不同范围高信号区域,模型组、头电针组、体电针组、头体电针组的脑水肿总体积百分比分别为(29.441±3.907)%、(28.025±3.006)%、(29.149±3.228)%、(26.624±2.918)%。头电针组、体电针组、头体电针组脑水肿总体积百分比较模型组略降低,但各组间比较差异均无统计学意义(P均>0.05)。见图1。
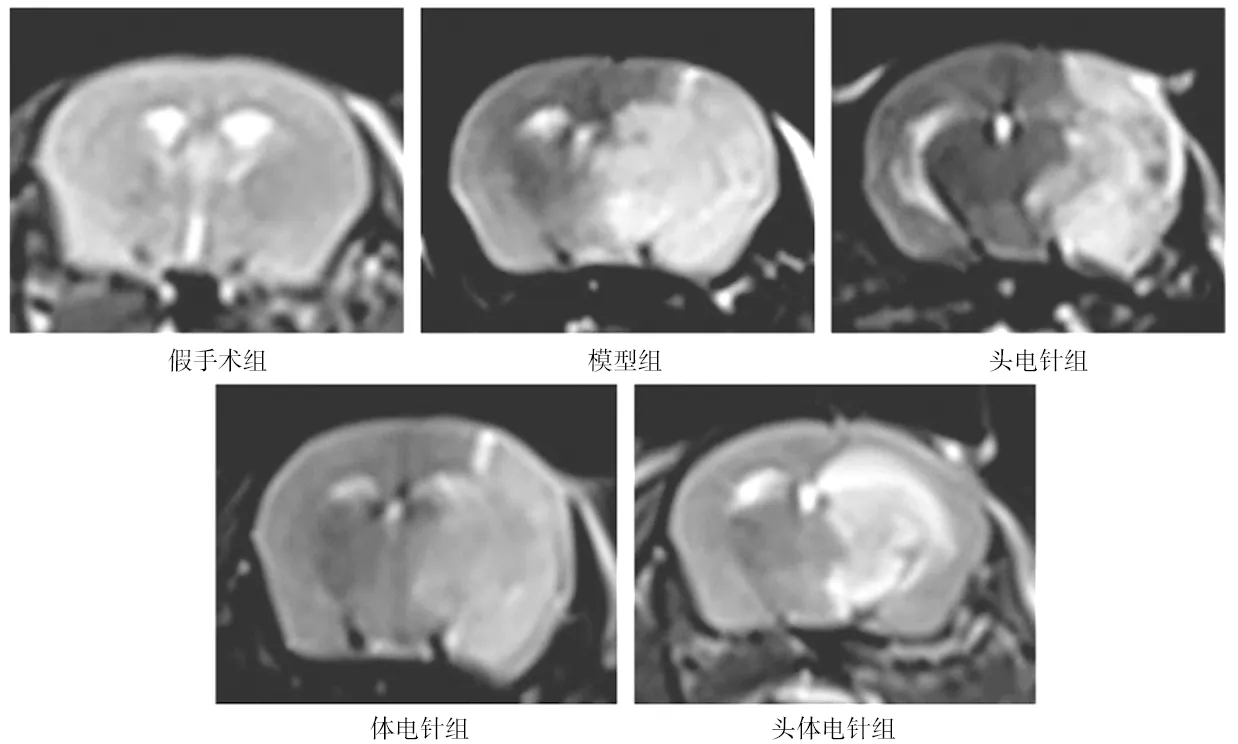
图1 假手术组和脑缺血各组小鼠右侧脑组织T2WI图像
2.3各组小鼠血清hs-CRP、TNF-α和IL-1β水平比较 模型组血清hs-CRP、TNF-α、IL-1β水平均明显高于假手术组(P均<0.05);头体电针组血清hs-CRP、TNF-α、IL-1β水平均明显低于模型组(P<0.05),且头体电针组血清TNF-α水平均明显低于头电针组和体电针组(P均<0.05)。见表1。
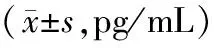
表1 假手术组和脑缺血各组小鼠血清hs-CRP、TNF-α和IL-1β水平比较
2.4各组小鼠脑组织HE染色形态 假手术组小鼠两侧脑组织结构清晰,细胞排列整齐,细胞间隙致密,未见明显坏死,仅见少量炎性细胞浸润。模型组小鼠右侧脑组织可见片状细胞坏死,细胞排列紊乱,皮质及海马区神经元细胞数目减少,细胞间质水肿明显,可见较多炎性细胞浸润,部分小鼠左侧脑组织可见轻度水肿。与模型组相比,头电针组及体电针组神经元细胞坏死及间质水肿程度略有减轻,仍存在较大面积细胞排列紊乱及炎性细胞浸润区域;头体电针组小鼠脑组织神经元细胞坏死程度及间质水肿程度明显减轻,少数区域可见细胞排列紊乱,呈局灶性炎性细胞浸润。见图2。

图2 假手术组和脑缺血各组小鼠脑组织HE染色表现
2.5各组小鼠脑组织 IBA1免疫组化染色表现假手术组可见极少量活化的小胶质细胞和大量未活化的呈分支状的小胶质细胞;模型组和各电针组可见大量活化的阿米巴样且形态不一的小胶质细胞。假手术组、模型组、头电针组、体电针组、头体电针组小鼠活化小胶质细胞数目百分比分别为(13.05±3.94)%,(50.90±5.43)%,(46.35±6.57)%,(46.85±6.17)%,(43.60±3.98)%。头体电针组活化小胶质细胞数目百分比明显少于模型组(P<0.05),头电针组和体电针组活化小胶质细胞数目百分比与模型组比较差异均无统计学意义(P均>0.05)。见图3。
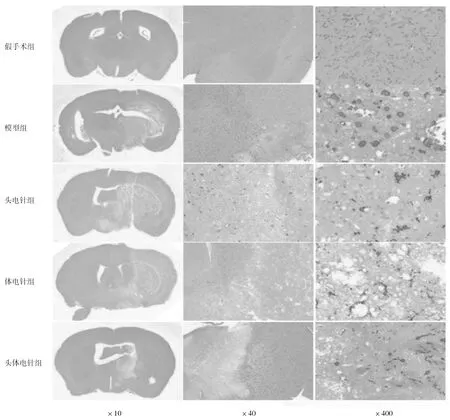
图3 假手术组和脑缺血各组小鼠脑组织 IBA1免疫组化染色小胶质细胞分布情况
3 讨 论
缺血性脑卒中是有许多因素共同参与的极为复杂的病理过程。在缺血性脑卒中患者神经损害过程中,缺血后炎性反应起着关键作用,其中脑组织缺血后的炎性反应是由级联反应中的氧自由基和其他介质所致的致炎物质产生的结果,CRP、TNF-α、IL-1β等炎性因子大量释放,参与中枢神经系统炎症反应[14]。脑内小胶质细胞及血液来源的单核巨噬细胞在卒中后炎性反应中扮演着重要角色[15]。卒中发生后,脑内小胶质细胞迅速大量活化,活化的小胶质细胞通常被作为神经炎症的标志[16]。
电针是治疗脑卒中的常用方法,治疗选穴中百会穴、太阳穴、足三里、曲池穴应用频率较高。百会穴属督脉,是阳气汇集之所,可提神醒脑、回阳固脱、平肝熄风、凝神安心、调理中气等,太阳穴可止痛醒脑、振奋精神、解除疲劳、明目;足三里是足阳明胃经的主要穴位之一,具有调节机体免疫力、调理脾胃、补中益气、通经活络、疏风化湿、扶正祛邪的作用;曲池穴属于手阳明大肠经之合穴,有清热解表、疏经通络的作用。刺激以上穴位能达到止痛、提神醒脑、通经活络的目的。
本实验研究结果显示,头电针组、体电针组、头体电针组小鼠神经功能缺损评分和脑水肿总体积百分比与模型组比较均无明显差异,分析与本实验中小鼠造模后脑梗死面积均较大、电针刺激观察时间较短(本实验仅做了术后72 h各指标检测)、样本量有限有关。病理学检查发现,头电针组及头体电针组神经元细胞坏死、间质水肿、细胞排列紊乱、炎性细胞浸润等病变程度较体电针组轻,且头体电针组梗死周围活化小胶质细胞数目百分比较模型组少,提示头体电针能通过调节小胶质细胞活化,从而减轻脑缺血后脑组织水肿。头体电针组血清hs-CRP、TNF-α、IL-1β水平均明显低于模型组,且血清TNF-α水平明显低于头电针组和体电针组,说明头体电针能明显降低脑缺血后血清hs-CRP、TNF-α、IL-1β水平,尤其是降低TNF-α作用更明显。
综上所述,头部与体部电针结合能通过抑制缺血性脑损伤后小胶质细胞的活化,减少血清炎性因子CRP、TNF-α、IL-1β的释放,尤其是TNF-α的释放,从而减轻炎症反应损伤,保护脑组织及神经元,为临床联合应用头体电针治疗脑卒中及其并发症提供了一定的理论依据。
利益冲突:所有作者均声明不存在利益冲突。

