主动脉夹层法医学伤病关系35例案例回顾分析
高 晴,王 峰,何 军,汪 浩,陈 玲,何方刚
主动脉夹层(aortic dissection, AD)是由于各种原因引起主动脉内膜和(或)中层弹力膜发生撕裂、主动脉滋养血管破裂,血液进入主动脉壁中层,导致血管壁内外膜分离并沿长轴扩张,在主动脉壁间形成假腔,并通过破口与主动脉真腔相交通的病理改变[1]。AD是一类发病率低但致死率极高的心血管疾病,AD近年来的发病率逐年上升,且呈年轻化趋势[2]。AD患者急性发作时典型临床表现为胸背部疼痛,但部分患者症状不典型,易造成漏、误诊而引起医疗纠纷,此时需要通过法医学鉴定来明确责任[3-4]。本文收集了35例AD鉴定资料,通过分析AD的发病特点、危险因素、病理特点,期望为复杂病因的AD案件提供鉴定思路。
1 材料与方法
1.1 材料收集2007~2023年武汉大学基础医学院鉴定案件中法医病理诊断涉及AD的案例合计35例,其中3例为法医临床鉴定案例,收集患者的临床资料;另32例为法医病理尸检案例,已进行系统解剖及病理检验。
1.2 方法复习并分析35例AD案例的病历、影像学资料、尸检材料及病理切片,对被鉴定人的年龄、性别、外伤史、发病经过、医疗过程、尸体解剖、病理检验等进行分类总结,计数资料以百分比进行统计描述,计量资料以进行统计描述。
2 结果
2.1 基本信息外伤史合计13例:交通事故8例(61%);徒手斗殴3例(23%);棍棒砖块等工具斗殴1例(8%);高坠1例(8%)。年龄分布:少年(13~17岁)1例(3%),青年(18~39岁)10例(28.5%),中年(40~59岁)14例(40%),老年(>60岁)10例(28.5%),平均年龄(47±15)岁。性别:男性32例(91%),女性3例(9%)。
2.2 临床特征首发症状:胸痛或呼吸困难18例(51%);腹痛或呕吐8例(23%);头痛或头晕3例(9%);意识丧失4例(11%);腰痛或下肢不适2例(6%)。行手术干预8例(23%,图1、2)。AD死亡患者32例:外伤或出现首发症状至死亡时间间隔为:急性期(1周内)31例(97%),亚急性期(8天~1个月)1例(3%),慢性期(>1个月)0例(0),平均时间间隔为(1.8±1.8)天。
2.3 尸检特征病理分型:Stanford分型A型23例(66%),B型12例(34%)。DeBakey分型:Ⅰ型16例(46%),Ⅱ型7例(20%),Ⅲ型12例(34%)。组织病理学:35例被鉴定人中,主动脉膜存在内膜病变26例(74%)(硬化或溃疡或炎症细胞浸润);主动脉膜存在中膜病变24例(69%)(平滑肌细胞减少,或弹力纤维减少变性,或肉芽组织增生,或胶原纤维增生,或胆固醇结晶沉积,或炎症细胞浸润,图3);主动脉膜存在外膜病变14例(40%)(含铁血黄素沉积,或炎症细胞浸润,图4)。合并疾病或特殊状态:35例被鉴定人中,合并高血压或心脏肥大27例(77%),合并动脉粥样硬化症24(69%),合并妊娠状态1例(8%)(全部被鉴定人仅3例女性,不具备参考性)。伴随损伤集中在有外伤史的案例中(13例):胸骨、肋骨或椎骨骨折(胸外按压所致骨折不计入)5例(38%),肺挫伤2例(15%),全身软组织挫伤11例(85%),心包或纵膈积血5例(38%),胸腔积血或腹腔积血8例(62%)(表1,图5)。直接死亡原因:心包填塞18例(56%),失血性休克10例(31%),急性心肌梗死4例(13%)(表2)。
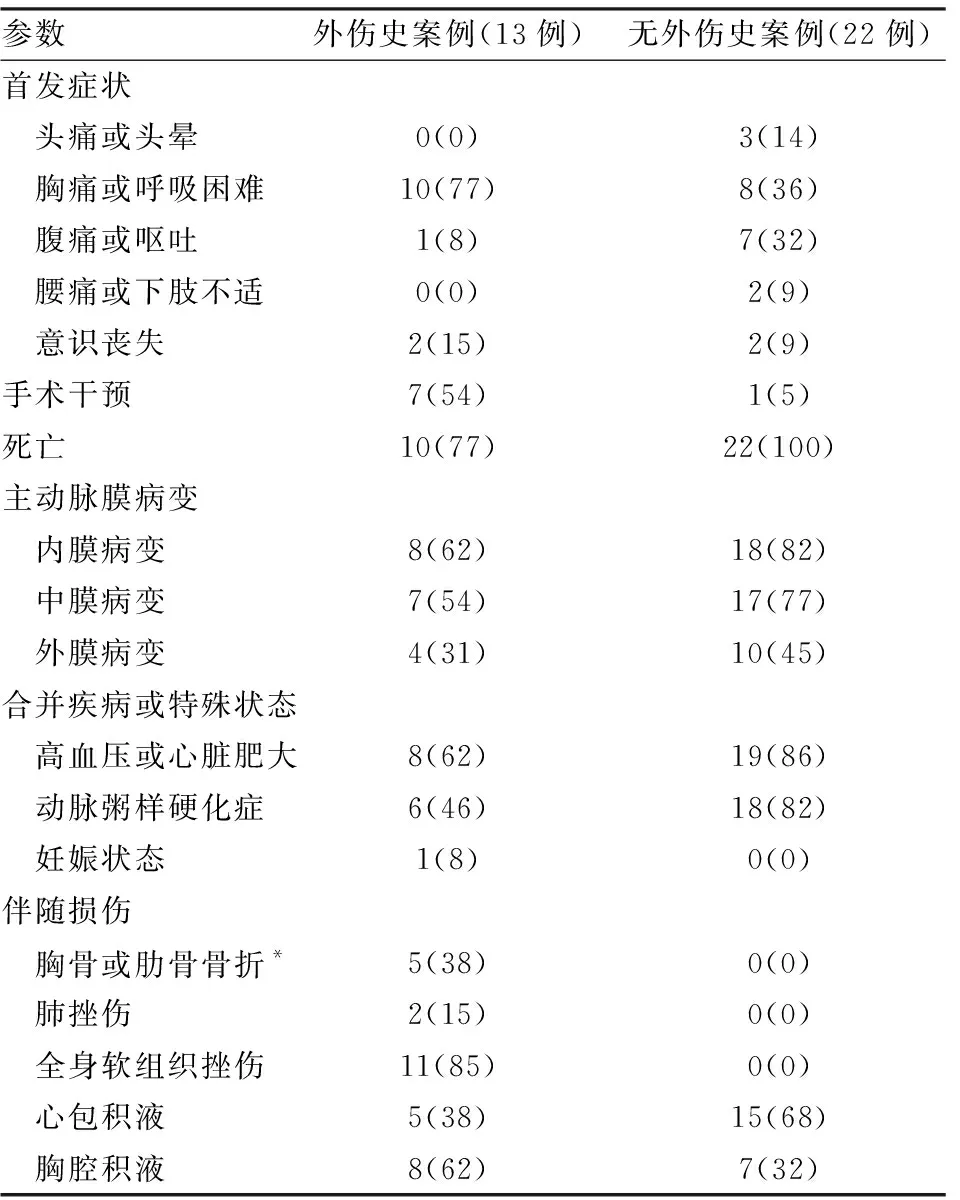
表1 外伤史案例与无外伤史AD案例的信息分布[n(%)]

表2 外伤史案例与无外伤史AD案例的直接死亡原因[n(%)]
3 讨论
目前AD的发病机制尚不明确,与多种危险因素相关,但大多数学者均支持主动脉壁结构薄弱是动脉夹层形成的主要原因[1,5]。临床上,DeBakey分型与Stanford分型均是依据夹层累及的解剖位置对AD进行分类[6]。从法医学鉴定角度可将造成主动脉壁破裂的原因分为两大类:创伤性主动脉夹层(traumatic aortic dissection, TAD)与病理性非创伤性主动脉夹层(non-traumatic aortic dissection, Non-TAD),它们常同时存在于同一个体上。因此,需要法医学者通过伤病关系分析来解决医疗纠纷、交通责任、保险理赔等社会问题。
3.1 病理性Non-TAD和TAD病理性Non-TAD:被鉴定人无外伤暴露史时,由于高血压、动脉粥样硬化、遗传性疾病、先天性心血管畸形、炎症性血管疾病、妊娠等所导致的AD[7]。
高血压被认为是AD最重要的危险因素,50%的AD患者均可归因于高血压[1],本文中35例患者有77%合并高血压。动脉粥样硬化也是AD的危险因素之一,部分学者认为动脉粥样硬化会导致血管变应力降低引发AD[5],且对Stanford B型的影响更大[8]。本文中有69%的患者合并动脉粥样硬化,但在Stanford分型中差异无统计学意义(P>0.05)。马凡综合征和其他遗传性结缔组织病,如血管型Ehlers-Danlos综合征或Loeys-Dietz综合征与AD有关,且多出现在AD年轻患者中[9]。目前认为马凡综合征的致病机制是FBN1基因突变引起原纤维蛋白1减少,导致血管弹力纤维不足和基质降解酶的释放,最终进展为AD[10]。血管型Ehlers-Danlos综合征致病机制与Ⅲ型前胶原合成缺陷有关[11],Ⅲ型前胶原是Ⅰ型胶原纤维生成的重要调节元件。Ⅰ型原纤维生成异常导致血管内皮变薄,动脉夹层风险增加。先天性心血管畸形中,先天性二叶主动脉瓣患者发生AD和破裂等急性主动脉并发症的风险是一般人群的40倍[12]。炎症性血管疾病(如主动脉炎)是由巨细胞动脉炎、大动脉炎或系统性红斑狼疮引起的并发症,有1%~5%的主动脉炎患者会发生AD[13]。女性妊娠及产后发生AD或夹层动脉瘤破裂的风险增加,其作用机制可能与妊娠和产后状态引起血流动力学变化进而导致主动脉壁上的变应力增加[14]。
TAD:患者有外伤暴露史,立即或延迟出现的AD。发生位置上,TAD常局限在主动脉峡部,很少广泛损伤[15];少量TAD也见于其他部位,依次为升主动脉、主动脉弓、胸主动脉、腹主动脉[16]。发生时间上,自发生外伤到诊断出TAD的时间间隔并不确定,虽然大多数TAD患者在急性期内死于心包填塞[7,17],但有文献报道迟发性TAD最长的时间间隔可达3个月[18]。迟发性TAD破裂导致的死亡往往会引起社会纠纷,伤者如有主动脉疾病会使案情更加复杂。
3.2 解剖检查要点大部分AD相关的法医学鉴定案件最先需确定死亡原因。本组32例死亡案件患者直接死亡原因通过尸体解剖及组织病理检查即可明确诊断。尸体检查时需注意保留完整的主动脉,作者建议解剖时系统性完整取出胸腹腔脏器,将主动脉自髂动脉及颈总动脉开始向近心端剪开,注意寻找夹层内膜及外膜破口的位置及大小。值得注意的是,内膜破口有时会因血液滋养存在反复机化、修复的情况[2],导致主动脉上内膜破口消失。本组32例死亡案件中10例未找到主动脉内膜裂口。
3.3 伤病关系分析AD患者活体鉴定的法医学鉴定要求往往是鉴定AD与外伤的因果关系,此时被鉴定人的术前影像资料十分关键。本组有3例法医临床鉴定,被鉴定人确诊AD前均发生交通事故,交通事故前3例被鉴定人均无胸痛、呼吸困难、晕厥等不适;术前影像资料提示:主动脉弓夹层位于降部3例,Stanford B型3例;伴随损伤:胸骨或肋骨骨折3例,伴有肺挫伤3例,伴有胸腔积液、肺不张3例;合并疾病:主动脉硬化1例。从AD的发生过程看,3例被鉴定人所受的外界暴力较大,导致了肋骨骨折、肺挫伤等伴随损伤,这提示外伤与AD发生存在因果关系;病理基础上,有1例存在主动脉硬化,1例存在主动脉中膜纤维变性及肥厚性心肌病突变基因,不能排除疾病因素在AD发生中的作用。此类案例需根据案情经过、外力大小和病理基础等综合分析外伤对AD的原因大小,以明确交通事故中车方对受害者的赔偿责任。
值得注意的是,医疗等中介因素常常会改变尸体解剖所见,例如手术后发生破裂出血,由于心包一般是敞开的,多不会发生心包填塞,出血常流入右侧胸腔。本组有1例男性青年患者在徒手斗殴2天后因胸痛入院,在医院行人工血管置换术手术后第2天死亡。临床手术前CT显示:升主动脉至左侧髂总动脉可见动脉夹层双腔结构;术中见升主动脉、主动脉弓夹层形成,未见内膜、外膜破口。尸体解剖:右侧胸腔大量积血,人工血管及象鼻区各吻合口无松脱,纵膈及主动脉弓、升主动脉根部人工血管周围大量出血,右心耳上侧与升主动脉区外膜撕裂、见直径约0.5 cm破口。组织病理学:内膜尚完整,未见明显粥样硬化斑块;中膜部分弹性纤维溶解坏死状,灶性炎性细胞浸润;外膜可见含铁血黄素,灶性炎性细胞浸润。此案例我们的分析逻辑为:被鉴定人术前CT示广泛性动脉夹层形成,主动脉中膜见弹力纤维坏死、炎性细胞浸润,存在主动脉壁肌纤维变性的病理基础;被鉴定人被打后当时无明显胸痛,1天后出现胸痛,影像学检查发现AD,事件发生上具备TAD的时序性规律;手术后第2天发生AD破裂、失血性休克死亡,右侧胸腔大量积血,提示夹层破裂发生于手术后,死亡原因应将医疗因素考虑在内。
综上所述,对涉及AD的案例鉴定,首先需要诊断被鉴定人的自身基础疾病,上述病理性AD的疾病都应被考虑在内,必要时进行基因检测;其次,尽可能收集详细的案情调查资料,结合尸体解剖所见,找到暴力作用的部位,结合伴随损伤评价作用力的大小;最后,部分伴随医疗因素参与的案例往往会使案情变得更复杂,此时除了系统地解剖尸体查验夹层的位置、形态、破口外,还需要与AD患者的活体鉴定一样将被鉴定人的临床资料(尤其是术前影像学资料)与解剖所见仔细比对,综合考虑医疗等中介因素对患者死亡或损伤的影响。

