人冠状动脉粥样硬化斑块内YKL-40、CXCL2、IFN-γ的表达及其与冠心病猝死的关系
乐翠云,万昌武,彭 进,王 杰,张桥军,苟 吉,夏 冰
冠状动脉粥样硬化性心脏病(coronary heart disease, CHD)是心源性猝死中最常见的心血管系统疾病[1-2]。越来越多的研究显示,CHD的发作与冠状动脉斑块的稳定性密切相关,而炎症反应在斑块稳定性中扮演重要角色[3]。YKL-40通常由组织中激活的中性粒细胞、巨噬细胞和血管平滑肌细胞等分泌[4]。研究报道,YKL-40参与多种肿瘤组织损伤后细胞外基质的炎症和重塑,通过与多种炎性介质发生联系参与炎症反应[5-6]。血清YKL-40可以作为CHD早期预警的标志物之一,与动脉粥样硬化板块不稳定性事件相关[7-8]。多数研究是基于动物实验、CHD患者血管影像学观察及血清检验后进行相关性分析得出结论。本文检测人冠状动脉粥样硬化斑块内YKL-40及其下游信号分子γ干扰素(interferon-γ, IFN-γ)、趋化因子配体2(chemokine ligand 2, CXCL2)的表达变化,分析三者表达水平与冠状动脉粥样硬化斑块稳定性的关系,为CHD不良预后提供临床理论基础,也为法医病理学鉴定中的心源性猝死提供参考依据。
1 材料与方法
1.1 人体标本收集依据中华人民共和国卫生部颁布的解剖尸体规则,收集2017年12月~2021年6月贵州医科大学法医司法鉴定中心尸体解剖提取的人体心脏冠状动脉组织,本实验经贵州医科大学伦理审查委员批准,患者直系亲属均知情同意。
纳入标准:(1)冷冻保存96 h内或常温保存48 h内解剖的尸体;(2)CHD组为组织病理检查明确有冠状动脉粥样硬化的病例,且死亡原因明确为机械性暴力且急速死亡者;(3)CHD猝死组为已明确死亡原因是CHD者;(4)对照组为同期尸检经证实无冠状动脉病变,且死亡原因明确为交通事故、高坠、钝锐器致死等急速死亡者。排除标准:(1)具有败血症、毒血症等感染性疾病病例;(2)具有多器官功能衰竭及障碍的病例;(3)结构破坏的腐败、自溶组织病例。
1.2 案例基线资料根据是否为冠状动脉粥样硬化猝死分为:CHD猝死组24例,其中男性13例,女性11例,平均年龄(55.92±6.00)岁;CHD组24例,其中男性10例,女性14例,平均年龄(39.29±4.39)岁;对照组18例,其中男性11例,女性7例,平均年龄(36.17±14.89)岁。
1.3 血管组织形态学观察及分析标本经10%中性福尔马林固定,石蜡包埋,切片,行HE染色后于镜下观察冠状动脉血管管腔横断面的形态。参照课题组前期的方法[9-10],采用IPP 6.0检测冠状动脉内膜厚度:血管内膜(含病灶)、纤维帽厚度、坏死灶厚度及血管腔狭窄程度,综合评价血管的结构改变,其中血管内膜越厚、血管腔狭窄程度越大,提示动脉粥样硬化的程度越重;纤维帽越薄、坏死灶越大,提示动脉粥样硬化斑块越不稳定。
1.4 Western blot法检测血管组织中YKL-40、CXCL2、IFN-γ蛋白表达量提取-80 ℃冻存的冠状动脉血管组织蛋白,紫外分光光度计(美国Thermo公司)对蛋白进行鉴定,10%SDS-PAGE电泳,聚偏二氟乙烯(PVDF)膜转膜,封闭。按照YKL-40兔多克隆(稀释比1 ∶800,美国Affinit公司)、IFN-γ兔多克隆(稀释比1 ∶1 000,美国Affinit公司)、CXCL2兔多克隆(稀释比1 ∶500,美国OmnimAbs公司)及β-actin兔单克隆(稀释比1 ∶2 000,英国Abcam公司)一抗孵育过夜,辣根过氧化物酶(HRP)标记的羊抗兔IgG(稀释比1 ∶8 000,美国Thermo公司)常温孵育2 h,BIO-RAD曝光液显影。以β-actin为内参,采用Image J软件进行条带灰度值分析,结果为重复测量3次取平均值。
1.5 免疫组化法检测血管病灶中YKL-40、CXCL2、IFN-γ蛋白表达及分布标本经10%中性福尔马林固定,常规石蜡包埋,4 μm厚切片,脱蜡,水化。加入3%H2O2,湿盒内室温封闭10 min,高压热修复抗原4 min。免疫组化采用PV 6000法,YKL-40兔多克隆(稀释比1 ∶100)、IFN-γ兔多克隆(稀释比1 ∶200)、CXCL2兔多克隆(稀释比1 ∶150)为一抗,PBS缓冲液为阴性对照,4 ℃孵育过夜。PBS缓冲液冲洗后加入HRP标记的羊抗小鼠/兔IgG二抗(北京中杉金桥公司),室温孵育45 min,DAB显色,镜下控制染色时间,苏木精复染,逆浓度梯度乙醇脱水、封固。镜下(40×)选取3个视野拍照,计算其平均光密度值(MOD值),即MOD=阳性光密度值/测量总面积。结果为重复测量3次取平均值。

2 结果
2.1 冠状动脉血管的病理组织学变化镜下见对照组血管管壁均匀一致,管腔无狭窄;CHD组血管壁内膜不均匀增厚,管腔轻、中度狭窄,可见纤维帽形成;CHD猝死组血管壁偏心性增厚,血管腔严重狭窄,纤维帽厚薄不一,部分案例病灶内可见钙化、斑块内出血、破裂及血栓形成等继发性改变,在病灶内及周边可见泡沫细胞等炎性细胞散在分布,中膜受压萎缩变薄(图1)。
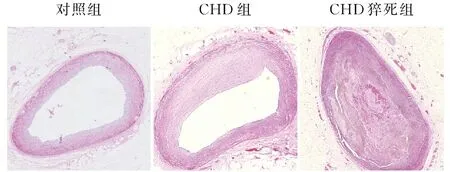
图1 各组冠状动脉结构改变:对照组.冠脉正常;CHD组.冠脉内膜不均匀增厚;CHD猝死组.冠脉内膜显著增厚,或伴有斑块内出血等继发病变形成
2.2 冠状动脉病灶血管形态学指标分析图像分析软件测得冠状动脉病灶血管各形态学指标并计算,结果显示与对照组相比,CHD组和CHD猝死组内膜厚度、纤维帽厚度、坏死灶厚度及管腔狭窄程度均升高,差异有统计学意义(P<0.01);与CHD组相比,CHD猝死组内膜增厚、坏死灶扩大、纤维帽厚度变薄、管腔狭窄程度增加(P<0.01,表1)。

表1 冠状动脉病灶血管形态学相关指标分析
2.3 冠状动脉血管组织中YKL-40、CXCL2、IFN-γ蛋白表达Western blot结果显示,对照组、CHD组和CHD猝死组冠状动脉血管中YKL-40、CXCL2和IFN-γ蛋白表达量呈逐渐升高趋势,且各组间蛋白表达量两两相比,差异有统计学意义(P<0.01,图2)。
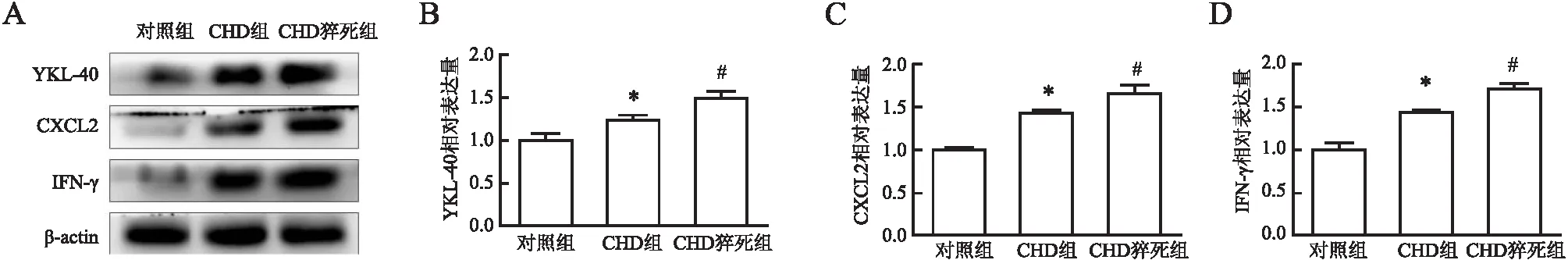
图2 A.Western blot法检测各组冠状动脉血管中YKL-40、CXCL2、IFN-γ蛋白表达;B.YKL-40相对表达量统计图;C.CXCL2相对表达量统计图;D.IFN-γ相对表达量统计图:与对照组相比,*P<0.01;与CHD组或对照组相比,#P<0.01
2.4 冠状动脉病灶内YKL-40、CXCL2、IFN-γ表达水平及分布对照组血管管壁未见YKL-40、CXCL2、IFN-γ蛋白表达,CHD组和CHD猝死组血管内膜病灶内可见YKL-40、CXCL2、IFN-γ表达(图3),主要分布在病灶的肩部及基底部的泡沫细胞胞质、胞核。对照组、CHD组、CHD猝死组中YKL-40、CXCL2、IFN-γ表达水平逐渐增高,以CHD猝死组增高更为显著(P<0.01)。
2.5 YKL-40蛋白表达水平与冠状动脉形态学指标的相关性将CHD组和CHD猝死组冠状动脉内膜病灶内YKL-40表达的MOD值与冠状动脉形态学指标内膜厚度、坏死灶厚度、纤维帽厚度及管腔狭窄程度进行相关性分析,结果显示YKL-40表达的MOD值与病灶厚度、纤维帽厚度及管腔狭窄程度呈正相关,与纤维帽厚度呈负相关(图4)。
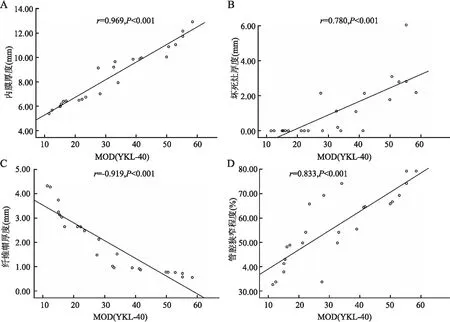
图4 CHD组和CHD猝死组冠状动脉内膜病灶内YKL-40蛋白表达MOD值与冠状动脉形态学指标的相关性:A.YKL-40蛋白表达MOD值与冠状动脉内膜厚度呈正相关;B.YKL-40蛋白表达MOD值与坏死灶厚度呈正相关;C.YKL-40蛋白表达MOD值与纤维帽厚度呈负相关;D.YKL-40蛋白表达MOD值与管腔狭窄程度呈正相关
2.6 冠状动脉血管中YKL-40、CXCL2、IFN-γ蛋白表达水平的相关性分析相关性分析显示,CHD组和CHD猝死组冠状动脉内膜病灶内YKL-40蛋白表达MOD值与CXCL2、IFN-γ蛋白表达MOD值呈正相关(图5)。
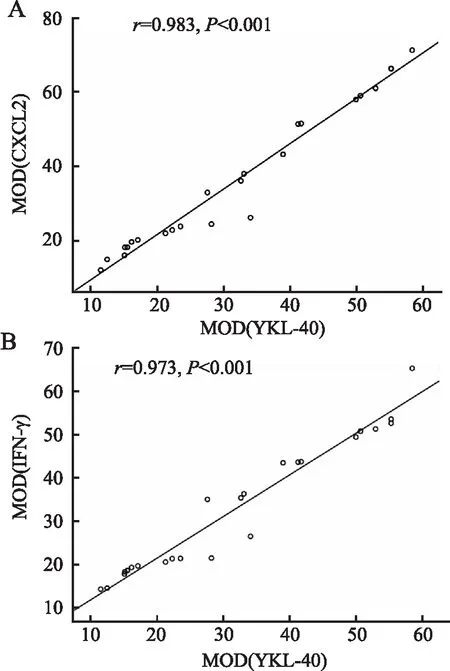
图5 CHD组和CHD猝死组冠状动脉内膜病灶内YKL-40、CXCL2、IFN-γ蛋白表达的相关性分析:A.YKL-40蛋白表达MOD值与CXCL2蛋白表达MOD值呈正相关;B.YKL-40蛋白表达MOD值与IFN-γ蛋白表达MOD值呈正相关
3 讨论
研究显示动脉粥样硬化晚期,斑块内出现多量炎症细胞,同时坏死灶扩大,胶原蛋白含量降低,纤维帽变薄,导致斑块不稳定,最终可引起斑块破裂和CHD不良事件发生[3]。本实验通过检测冠状动脉血管结构的相关指标,发现CHD患者冠状动脉内膜厚度普遍增厚、血管腔不同程度狭窄;对比分析CHD猝死组和CHD组的血管结构对应指标显示,前者除管腔狭窄程度均更严重外,其病灶内坏死灶厚度明显大于后者,纤维帽厚度也较后者明显变薄,与课题组前期的研究结果[9-10]较为一致,表明人冠状动脉粥样硬化斑块结构与其病灶稳定性之间存在密切联系,即斑块内坏死灶小、纤维帽厚,则斑块稳定性较好,此类患者不易发生CHD急性事件,反之斑块内坏死灶越大、纤维帽越薄,斑块稳定性较低,则可能因斑块破裂、斑块处血栓形成等极易引发CHD急性事件。
临床检测显示CHD组患者血清YKL-40水平较对照组显著增高,且YKL-40水平与冠状动脉粥样硬化程度具有相关性[11-12];Gong等[13]通过靶向敲低ApoE-/-小鼠YKL-40基因水平,发现动脉斑块内脂质和巨噬细胞含量减少,斑块中胶原蛋白和平滑肌细胞含量增加。这些研究均提示YKL-40表达变化与动脉粥样硬化的不良预后相关。本实验通过直接检测不同死亡原因CHD患者冠状动脉粥样硬化病灶内YKL-40水平,了解YKL-40水平与病灶结构变化的关系及其与死亡原因的可能关系。结果显示,冠状动脉粥样硬化斑块内YKL-40水平比对照组显著增高,而CHD猝死组病灶内YKL-40水平亦明显高于CHD组;相关性分析显示,病灶内YKL-40水平和病灶结构指标的YKL-40水平与病灶内坏死灶厚度呈正相关,与纤维帽厚度呈负相关,即YKL-40水平越高,病灶坏死灶越大、纤维帽则越薄。这一结果与前述临床研究及动物实验结果相一致,且本实验以人体冠状动脉为研究对象,直接检测病灶内YKL-40表达水平及其与病灶结构指标之间的关系,能更进一步证明YKL-40表达水平对人冠状动脉病灶结构产生的影响,与动脉粥样硬化斑块不稳定性存在相关性,并可能是CHD猝死等急性CHD事件发生的相关因素。
有研究在体外用siRNA抑制YKL-40表达,发现能抑制巨噬细胞表达CXCL2和MMP-9等,CXCL2是趋化因子,能够从血液中募集单核细胞、中性粒细胞进入血管内皮下激活炎症体[14],激活的炎性体能诱导IL-1β、IL-18等炎症介质表达和释放,促进动脉粥样硬化的发展[15],而抑制CXCL2表达,可减少血管炎症和氧化应激,抑制动脉粥样硬化的发展[16]。另有研究显示,YKL-40可以调节IFN-γ的表达,Li等[17]敲除YKL-40后可降低INF-γ的表达水平,过表达YKL-40可引起血清肿瘤坏死因子-α、IL-1β和IL-6等炎症因子表达水平的降低[18]。IFN-γ主要由巨噬细胞和T细胞分泌的促炎细胞因子,在高脂饮食的ApoE-/-小鼠主动脉粥样硬化斑块内显著增加,并促进多种炎症基因表达[19-20],同时,IFN-γ也可通过诱导泡沫细胞活化、氧自由基的形成、刺激氧化应激的发生等进而促进动脉粥样硬化的进程[21]。这些研究提示YKL-40对动脉粥样硬化病灶的影响可能是通过影响CXCL2及IFN-γ来实现。本实验同时检测冠状动脉血管及病灶内IFN-γ和CXCL2表达水平,发现CHD组IFN-γ、CXCL2水平均显著高于对照组,而CHD猝死组中两者表达水平又明显高于CHD组,表明人冠状动脉病灶内YKL-40表达与CXCL2、IFN-γ表达的关联性,YKL-40对动脉粥样病灶稳定性的影响可能是通过CXCL2、IFN-γ等因子的作用来实现。
综上所述,人冠状动脉粥样硬化斑块内YKL-40表达水平普遍增高,但在CHD猝死案例中表达水平增高更加显著,YKL-40高表达可引起冠状动脉粥样硬化病灶内坏死灶增大、纤维帽变薄等,从而使病灶稳定性下降,进而引起继发病变导致包括猝死在内的急性CHD事件发生,而YKL-40对粥样硬化病灶结构及稳定性影响的可能机制是通过调节CXCL2和IFN-γ的表达来实现。

