微小RNA-22-3p调控Kruppel样因子6表达对骨髓间充质干细胞心肌样分化的影响
钟晓鸣 张蕾 姚新亮 刘洪洋 张媛 万琪琳 李彦明 程冠昌


摘要:目的 探究微小RNA-22-3p(miR-22-3p)调控Kruppel样因子6(KLF6)表达对骨髓间充质干细胞(BMSC)心肌样分化的影响。方法 分离并培养大鼠BMSC,将第3代BMSC分为对照组、5-氮杂胞苷(5-AZA)组、模拟物阴性对照组、miR-22-3p模拟物组、miR-22-3p模拟物+空载质粒组、miR-22-3p模拟物+KLF6过表达质粒组;实时荧光定量PCR(qRT-PCR)检测细胞中miR-22-3p及KLF6表达;免疫荧光化学染色法检测细胞结蛋白(Desmin)、肌钙蛋白T(cTnT)、间隙连接蛋白43(Cx43)表达;Western blot检测Desmin、cTnT、Cx43、KLF6蛋白表达;流式细胞术检测BMSC凋亡情况;采用双荧光素酶报告基因实验分析miR-22-3p和KLF6的靶向关系。结果 与对照组比较,5-AZA组BMSC中miR-22-3p(q=7.971,P<0.001)、Desmin(q=7.876,P<0.001)、cTnT(q=10.272,P<0.001)、Cx43表达(q=6.256,P<0.001)以及细胞凋亡率(q=12.708,P<0.001)显著增加,而KLF6 mRNA(q=20.850,P<0.001)及蛋白表达(q=11.080,P<0.001)显著降低;与5-AZA组和模拟物阴性对照组比较,miR-22-3p模拟物组BMSC中miR-22-3p(q=3.591,P<0.001;q=11.650,P<0.001)、Desmin(q=5.975,P<0.001;q=13.579,P<0.001)、cTnT(q=7.133,P<0.001;q=17.548,P<0.001)、Cx43表达(q=4.571,P=0.037;q=11.068,P<0.001)显著增加,而KLF6 mRNA(q=7.384,P<0.001;q=28.234,P<0.001)及蛋白表达(q=4.594,P=0.036;q=15.945,P<0.001)显著降低,miR-22-3p模拟物组细胞凋亡率显著低于5-AZA组(q=8.216,P<0.001);與miR-22-3p模拟物+空载质粒组比较,miR-22-3p模拟物+KLF6过表达质粒组KLF6 mRNA(q=23.891,P<0.001)及蛋白表达(q=13.378,P<0.001)显著增加,Desmin(q=9.505,P<0.001)、cTnT(q=10.985,P<0.001)、Cx43表达(q=8.301,P<0.001)显著降低,细胞凋亡率增加(q=4.713,P=0.029)。双荧光素酶报告基因实验发现KLF6是miR-22-3p的潜在靶基因。结论 miR-22-3p通过抑制KLF6表达来促进BMSC心肌样分化。
关键词:微小RNA-22-3p;Kruppel样因子6;骨髓间充质干细胞;心肌样分化
中图分类号: R541.9 文献标志码: A 文章编号:1000-503X(2023)01-0001-08
DOI:10.3881/j.issn.1000-503X.15052
MicroRNA-22-3p Regulates the Expression of Kruppel-like Factor 6 to Affect the Cardiomyocyte-like Differentiation of Bone Marrow Mesenchymal Stem Cell
ZHONG Xiaoming,ZHANG Lei,YAO Xinliang,LIU Hongyang,ZHANG Yuan,WAN Qilin,LI Yanming,CHENG Guanchang
Department of Cardiovascular Medicine,Huaihe Hospital,Henan University,Kaifeng,Henan 475000,China
Corresponding author:LI Yanming Tel:0371-23906832,E-mail:yanminglee@163.com
ABSTRACT:Objective To explore the effect of microRNA-22-3p (miR-22-3p) regulating the expression of Kruppel-like factor 6 (KLF6) on the cardiomyocyte-like differentiation of bone marrow mesenchymal stem cell (BMSC).Methods Rat BMSC was isolated and cultured,and the third-generation BMSC was divided into a control group,a 5-azacytidine(5-AZA)group,a mimics-NC group,a miR-22-3p mimics group,a miR-22-3p mimics+pcDNA group,and a miR-22-3p mimics+pcDNA-KLF6 group.Real-time fluorescent quantitative PCR (qRT-PCR) was carried out to determine the expression of miR-22-3p and KLF6 in cells.Immunofluorescence staining was employed to detect the expression of Desmin,cardiac troponin T (cTnT),and connexin 43 (Cx43).Western blotting was employed to determine the protein levels of cTnT,Cx43,Desmin,and KLF6,and flow cytometry to detect the apoptosis of BMSC.The targeting relationship between miR-22-3p and KLF6 was analyzed by dual luciferase reporter gene assay.Results Compared with the control group,5-AZA up-regulated the expression of miR-22-3p (q=7.971,P<0.001),Desmin (q=7.876,P<0.001),cTnT (q=10.272,P<0.001),and Cx43 (q=6.256,P<0.001),increased the apoptosis rate of BMSC (q=12.708,P<0.001),and down-regulated the mRNA (q=20.850,P<0.001) and protein (q=11.080,P<0.001) levels of KLF6.Compared with the 5-AZA group and the mimics-NC group,miR-22-3p mimics up-regulated the expression of miR-22-3p (q=3.591,P<0.001;q=11.650,P<0.001),Desmin (q=5.975,P<0.001;q=13.579,P<0.001),cTnT (q=7.133,P<0.001;q=17.548,P<0.001),and Cx43 (q=4.571,P=0.037;q=11.068,P<0.001),and down-regulated the mRNA (q=7.384,P<0.001;q=28.234,P<0.001) and protein (q=4.594,P=0.036;q=15.945,P<0.001) levels of KLF6.The apoptosis rate of miR-22-3p mimics group was lower than that of 5-AZA group (q=8.216,P<0.001).Compared with the miR-22-3p mimics+pcDNA group,miR-22-3p mimics+pcDNA-KLF6 up-regulated the mRNA(q=23.891,P<0.001) and protein(q=13.378,P<0.001)levels of KLF6,down-regulated the expression of Desmin (q=9.505,P<0.001),cTnT (q=10.985,P<0.001),and Cx43 (q=8.301,P<0.001),and increased the apoptosis rate (q=4.713,P=0.029).The dual luciferase reporter gene experiment demonstrated that KLF6 was a potential target gene of miR-22-3p.Conclusion MiR-22-3p promotes cardiomyocyte-like differentiation of BMSC by inhibiting the expression of KLF6.
Key words:microRNA-22-3p;Kruppel-like factor 6;bone marrow mesenchymal stem cell;cardiomyocyte-like differentiation
Acta Acad Med Sin,2023,45(1):1-8
急性心肌梗死(acute myocardial infarction,AMI)是由冠状动脉闭塞引起的急性缺血缺氧造成不可逆的心肌细胞坏死和心脏功能障碍,是全球人类疾病死亡的主要原因之一[1-2]。挽救濒死心肌,恢复心脏功能是治疗AMI的关键,许多研究学者认为骨髓间充质干细胞(bone marrow mesenchymal stem cell,BMSC)分化为心肌样细胞对修复梗死心肌组织具有重要作用,因此,促进BMSC心肌样分化对于治疗AMI至关重要[3]。微小RNA(microRNA,miRNA)作为内源性的小分子非编码RNA,可通过结合靶基因信使RNA的3′非翻译区,调节基因表达,其已被证实在细胞生理病理过程中具有重要的调控作用[4]。有研究发现,miR-22参与心脏重塑及心肌细胞肥大过程,miR-22-3p在AMI小鼠中表达下调,促进其表达可改善心肌损伤[2,5]。此外,miR-22-3p过表达还可促进BMSC成骨分化[6],但关于其是否参与BMSC心肌样分化还未可知。Kruppel样因子6(Kruppel-like factor 6,KLF6)作为KLF家族成员之一,参与心肌、骨骼肌、平滑肌的发育及功能调控[7-8]。本研究通过探究miR-22-3p调控KLF6表达对BMSC心肌样分化的影响,为BMSC向心肌样细胞分化的分子机制及AMI治疗提供参考。
材料和方法
实验动物 7周龄SPF级健康雄性SD大鼠10只(体重235~270 g)购自济南朋悦实验动物繁育有限公司,生产许可证号:SCXK(鲁)2019-0003。饲养于河南大学淮河医院动物房,使用许可证号:SYXK(豫)2020-0002。在温度22~24 ℃,湿度55%~65%,12 h/12 h昼夜交替环境中适应1周后进行实验。本研究通过河南大学淮河医院动物伦理委员会批准(伦理审批编号:20201124)。
主要试剂和仪器 DMEM培养基(批号:D5546)购自上海辅泽商贸有限公司;5-氮杂胞苷(5-azacytidine,5-AZA)(批号:30046554)购自深圳海思安生物技术有限公司;兔抗β-actin、肌钙蛋白T(cardiac troponin T,cTnT)、間隙连接蛋白43(connexin 43,Cx43)、KLF6抗体、辣根过氧化物酶标记山羊抗兔IgG(批号:4970、5593、3512、7074)购自美国Cell Signaling Technology公司;结蛋白(Desmin)抗体(批号:ab15200)购自英国Abcam公司;CD90-PE-CyTM7(批号:555596)、CD29-PE(批号:555443)、CD45-FITC抗体(批号:553088)购自美国BD Biosciences公司;FITC标记的山羊抗小鼠IgG(批号:115-095-003)购自美国Jackson ImmunoResearch公司;蛋白定量试剂盒(批号:E162)购自北京康润诚业生物科技有限公司;蛋白提取试剂盒(批号:KGP250)购自江苏凯基生物技术股份有限公司;反转录试剂盒(批号:J-SRP1105-50)购自上海研谨生物科技有限公司;实时荧光定量PCR(real-time fluorescent quantitative PCR,qRT-PCR)检测试剂盒(批号:P7640L)购自苏州蚂蚁淘生物科技有限公司;Lipofectamine 2000转染试剂盒(批号:11668019)购自北京智杰方远科技有限公司;双荧光素酶报告基因检测试剂盒(批号:Omt-05)购自北京奥秘佳得医药科技有限公司;EXFLOW流式细胞仪购自北京达科为生物技术有限公司;Axygen凝胶成像系统购自广州科适特科学仪器有限公司;MA-5000型96孔qRT-PCR购自苏州雅睿生物技术股份有限公司;模拟物阴性对照(5 CTCAACTGGTGTCGTGGA 3)、miR-22-3p模拟物(5 AAGCTGCCAGTTGAAGAACTG 3)由北京达科为生物技术有限公司合成。
BMSC分离与细胞培养 将SD大鼠颈椎脱臼处死后浸泡于75%乙醇中,10 min后置于超净工作台中进行股骨分离,暴露骨髓腔,用含血清培养基冲洗骨髓,收集骨髓细胞混匀,离心弃上清液后使用5 ml含15%胎牛血清的DMEM培养基重悬,接种于培养瓶中,置入37 ℃、5% CO2恒温培养箱中培养,48 h后光镜下观察细胞贴壁情况,每3 d更换1次培养基,待细胞融合度达80%后,0.25%胰酶消化并进行传代,培养至第3代后进行后续实验,采用倒置相差显微镜观察细胞形态。大鼠心肌H9c2细胞采用含10%胎牛血清、1%青霉素-链霉素的DMEM培养基培养、消化和传代。
BMSC鉴定 取第3代BMSC进行胰酶消化,添加常规培养基终止消化后离心(1000 r/min,r=8 cm)5 min弃上清液,300 μl PBS重悬细胞并将细胞浓度调整为1×1010/L,取200 μl细胞悬液至EP管中,分别添加CD90-PE-CyTM7、CD29-PE、CD45-FITC抗体(5 μl)和同型对照抗体,混匀后避光孵育0.5 h,流式细胞仪检测BMSC表面标志分子。
细胞转染及分组 将第3代BMSC以1×104个/ml密度接种于6孔板中,每孔100 μl,按照Lipofectamine 2000转染试剂盒说明书将miR-22-3p模拟物及模拟物阴性对照、KLF6过表达质粒及空载质粒转染至相应细胞中培养48 h。根据处理情况,将细胞分为6组:(1)对照组:正常培养基培养;(2)5-AZA组:8 μmol/L 5-AZA诱导BMSC心肌样分化24 h;(3)模拟物阴性对照组:转染模拟物阴性对照;(4)miR-22-3p模拟物组:转染miR-22-3p模拟物;(5)miR-22-3p模拟物+空载质粒组:miR-22-3p模拟物与空载质粒共转染;(6)miR-22-3p模拟物+KLF6过表达质粒组:miR-22-3p模拟物与KLF6过表达质粒共转染。
qRT-PCR检测细胞中miR-22-3p及KLF6表达 采用Trizol法提取各组细胞总RNA后进行反转录得到cDNA,再进行qRT-PCR扩增,反应程序:95 ℃ 20 s、95 ℃ 10 s、60 ℃ 20 s和70 ℃ 10 s,40个循环。KLF6及miR-22-3p分别以GAPDH和U6作为内参,采用2-ΔΔCt方法计算KLF6及miR-22-3p的相对表达水平。qRT-PCR引物序列见表1。
免疫荧光化学染色法检测细胞Desmin、cTnT、Cx43表达 将各组细胞以1×108个/L密度接种于24孔板中,培养24 h后多聚甲醛固定,PBS洗涤后添加0.05% Triton X-100溶液孵育0.5 h,使用枸橼酸盐缓冲液进行抗原修复后山羊血清封闭0.5 h,分别加入Desmin、cTnT、Cx43抗体(1∶1000)4 ℃孵育过夜,洗涤后加入山羊抗兔荧光二抗(1∶300)孵育1 h,DAPI染色剂避光孵育5 min后封片剂封片,荧光显微镜下观察各组细胞荧光表达情况。
Western blot检测Desmin、cTnT、Cx43、KLF6蛋白表达 收集各组细胞,使用RIPA裂解液进行裂解提取细胞总蛋白,BCA蛋白检测试剂盒测定蛋白浓度,吸取30 μg蛋白样品进行SDS-PAGE凝胶电泳,低温下转至PVDF膜上,5%牛血清白蛋白封闭60 min,加入兔抗Desmin、cTnT、Cx43、KLF6、β-actin抗体(1∶1000)4 ℃孵育过夜,然后加入二抗(1∶5000)室温孵育2 h,使用ECL发光试剂显影,于蛋白凝胶电泳成像仪中成像,Image J软件分析条带灰度,计算蛋白相对表达量。
流式细胞术检测BMSC凋亡 收集各组BMSC,PBS洗涤2次,添加500 μl缓冲液重悬细胞,依次加入10 μl AnnexinV-FITC染色液避光孵育15 min及PI染色液避光孵育10 min后,于流式细胞仪中检测BMSC凋亡情况。
双荧光素酶报告基因实验分析miR-22-3p和KLF6的靶向关系 使用TargetScan数据库(https://www.targetscan.org/vert_72/)进行miR-22-3p和KLF6结合位点分析,经qRT-PCR扩增KLF6 3′-UTR片段来构建野生型KLF6表达载体(pGL3-KLF6-wt),并根据位点定向突变试剂盒说明书构建突变型KLF6表达载体(pGL3-KLF6-mut),分别与miR-22-3p模拟物和模拟物阴性对照共转染至BMSC中,分为4组:pGL3-KLF6-wt+miR-22-3p模拟物组、pGL3-KLF6-wt+模拟物阴性对照组、pGL3-KLF6-mut+miR-22-3p模拟物组、pGL3-KLF6-mut+模拟物阴性对照组,48 h后弃培养基,使用200 μl细胞裂解液将细胞裂解,离心后取上清液,使用双荧光素酶试剂盒染色,以萤火虫荧光素酶活性与海肾荧光素酶活性的比值来表示荧光素酶相对活性。
统计学处理 采用SPSS 23.0统计软件,符合正态分布的计量资料以均数±标准差表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,并采用SNK-q检验进行两两比较。P<0.05为差异有统计学意义。
结 果
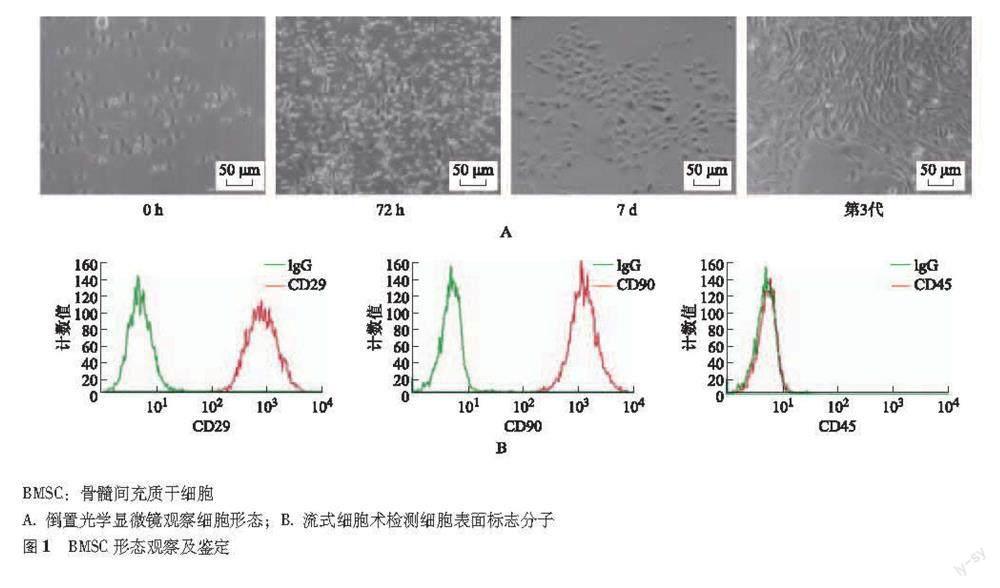
BMSC形态观察及鉴定 BMSC在培养初期呈圆形、并处于悬浮状态;72 h细胞呈短梭形、三角形,突起向外延伸;7 d细胞体积增大、呈扁平状;第3代BMSC形态呈较为均一的纺锤形,旋涡状或平行样分布。流式细胞术检测细胞表面抗体CD29(95.97%)、CD90(97.82%)呈高表达,而CD45(2.01%)呈低表达(图1)。
BMSC和H9c2细胞miR-22-3p的表达水平 qRT-PCR检测结果显示,与BMSC比较,H9c2细胞中miR-22-3p表达显著增加(1.86±0.12比1.00±0.00;t=15.065,P<0.001)。
不同处理后BMSC中miR-22-3p及KLF6的表达水平 与对照组比较,5-AZA组miR-22-3p表达显著增加(1.91±0.21比1.00±0.00;q=7.971,P<0.001),而KLF6 mRNA(0.52±0.03比1.00±0.00;q=20.850,P<0.001)及蛋白表达(0.59±0.07比1.49±0.09;q=11.080,P<0.001)显著降低;与5-AZA组和模拟物阴性对照组比较,miR-22-3p模拟物组miR-22-3p表达显著增加(2.32±0.34比1.91±0.21;q=3.591,P<0.001和2.32±0.34比0.99±0.08;q=11.650,P<0.001),而KLF6 mRNA(0.35±0.03比0.52±0.03;q=7.384,P<0.001和0.35±0.03比1.00±0.05;q=28.234,P<0.001)及蛋白表达(0.38±0.07比0.59±0.07;q=4.594,P=0.036和0.38±0.07比1.51±0.28;q=15.945,P<0.001)显著降低;与miR-22-3p模拟物+空载质粒组比较,miR-22-3p模拟物+KLF6过表达质粒组BMSC中KLF6 mRNA(0.89±0.10比0.34±0.04;q=23.891,P<0.001)及蛋白表达(1.33±0.27比0.39±0.06;q=13.378,P<0.001)顯著增加(图2)。
不同处理后BMSC中Desmin、cTnT、Cx43的表达水平 与对照组比较,5-AZA组Desmin(1.42±0.21比0.84±0.10;q=7.876,P<0.001)、cTnT(1.15±0.18比0.43±0.05;q=10.272,P<0.001)、Cx43表达(1.55±0.20比1.03±0.12;q=6.256,P<0.001)显著增加;与5-AZA组和模拟物阴性对照组比较,miR-22-3p模拟物组Desmin(1.86±0.22比1.42±0.21;q=5.975,P<0.001和1.86±0.22比0.86±0.09;q=13.579,P<0.001)、cTnT(1.65±0.20比1.15±0.18;q=7.133,P<0.001和1.65±0.20比0.42±0.07;q=17.548,P<0.001)、Cx43表达(1.93±0.18比1.55±0.20;q=4.571,P=0.037和1.93±0.18比1.01±0.18;q=11.068,P<0.001)显著增加;与miR-22-3p模拟物+空载质粒组比较,miR-22-3p模拟物+KLF6过表达质粒组Desmin(1.16±0.11比1.86±0.20;q=9.505,P<0.001)、cTnT(0.87±0.10比1.64±0.24;q=10.985,P<0.001)、Cx43表达(1.21±0.16比1.90±0.25;q=8.301,P<0.001)显著降低(图3)。
miR-22-3p及KLF6过表达对BMSC凋亡的影响 与对照组比较,5-AZA组BMSC凋亡率显著增加[(59.01±10.34)%比(23.39±4.18)%;q=12.708,P<0.001];与5-AZA组比较,miR-22-3p模拟物组细胞凋亡率显著降低[(35.98±5.20)%比(59.01±10.34)%;q=8.216,P<0.001];与模拟物阴性对照组比较,miR-22-3p模拟物组细胞凋亡率显著增加[(35.98±5.20)%比(22.12±5.81)%;q=4.945,P=0.020];与miR-22-3p模拟物+空载质粒组比较,miR-22-3p模拟物+KLF6过表达质粒组细胞凋亡率显著增加[(49.22±5.07)%比(36.01±4.98)%;q=4.713,P=0.029](圖4)。
miR-22-3p靶向KLF6调控其表达 通过TargetScan网站查询发现,miR-22-3p和KLF6之间存在结合位点。双荧光素酶报告基因实验分析显示,与pGL3-KLF6-wt+模拟物阴性对照组比较,pGL3-KLF6-wt+miR-22-3p模拟物组荧光素酶相对活性显著降低(0.45±0.05比0.91±0.09;t=9.991,P<0.001);而pGL3-KLF6-mut+miR-22-3p模拟物组和pGL3-KLF6-mut+模拟物阴性对照组之间差异无统计学意义(0.87±0.09比0.88±0.10;t=0.166,P=0.872)。
讨 论
AMI可导致心肌细胞死亡,由于成熟心肌细胞缺乏再生能力,损伤后难以自我修复。而BMSC具有自主分化能力,将其移植到受损心肌组织中,可通过分化为心肌样细胞来修复受损的心肌组织[4,9-12]。5-AZA是诱导BMSC心肌样分化的有效制剂,但具有一定的细胞毒性,因此,有必要对BMSC心肌样分化机制进行探讨,以寻找新的更为安全的方法[13]。本研究分离培养大鼠BMSC,经鉴定BMSC表面抗体CD29、CD90高表达,而CD45低表达,表明实验获得高纯度BMSC,可用于后续实验。
miRNA是一种小分子非编码RNA,已被证实与心房颤动、心肌病、心肌梗死、心力衰竭等心脏疾病有关[14]。miR-22-3p广泛表达于肌肉组织中,可通过调控炎症反应、氧化应激、细胞凋亡参与多种心血管疾病的发生[15-16]。有研究显示,miR-22-3p可通过负向调控肥胖相关基因表达来促进BMSC成骨分化[6]。本研究结果显示,5-AZA及miR-22-3p过表达可显著增加BMSC中Desmin、cTnT、Cx43的表达及细胞凋亡率,且与5-AZA相比,miR-22-3p过表达促进Desmin、cTnT、Cx43表达的作用更显著,但对细胞凋亡的影响相对较小。Desmin、Cx43及cTnT是公认的心肌特异性蛋白,其中,Desmin是肌细胞重要组成成分,在核膜连接及信号传导中发挥重要作用[13,17-19]。本研究结果表明,5-AZA及miR-22-3p过表达可促进BMSC心肌样分化,并且miR-22-3p过表达促BMSC心肌样分化能力更强,细胞毒性作用更弱,其有作为促BMSC心肌样分化作用靶点的潜能。
双荧光素酶报告基因实验分析发现KLF6是miR-22-3p的潜在靶基因。KLF是一类能够结合多种特异性蛋白的转录因子,参与动物和人骨骼肌、心肌的发育及功能调控[8]。KLF6作为锌指转录因子家族成员之一,主要表达于骨髓细胞,参与心脏的发育[20-21]。此外,KLF6还参与心脏重塑、内外部刺激的响应等病理过程。研究发现,KLF6低表达可通过促进心肌细胞中细胞外基质因子、血小板反应蛋白4的表达来抑制心脏纤维化[21]。本研究结果显示,5-AZA及miR-22-3p过表达可显著降低BMSC中KLF6的表达。因此,miR-22-3p可能通过靶向抑制KLF6的表达来促进BMSC心肌样分化。为了验证这一结论,本研究在miR-22-3p过表达的基础上过表达KLF6,结果发现KLF6过表达可减弱miR-22-3p过表达的促BMSC心肌样分化的作用。
综上,本研究结果表明,miR-22-3p通过抑制KLF6表达来促进BMSC心肌样分化,其有作为促BMSC心肌样分化作用靶点的潜能。本研究为BMSC在AMI治疗中的应用提供了实验数据支持,后续还将对miR-22-3p的下游调控机制进行深入探究。
参 考 文 献
[1]Yan X,Hou J.MiR-22 host gene enhances nuclear factor-kappa b activation to aggravate hypoxia-induced injury in AC16 cardiomyocytes [J].Cell Transplant,2021,30(1):963689721990323.DOI:10.1177/0963689721990323.
[2]Li H,Zhang P,Li F,et al.Plasma miR-22-5p,miR-132-5p,and miR-150-3p are associated with acute myocardial infarction [J].Biomed Res Int,2019,2019:5012648.DOI:10.1155/2019/5012648.
[3]李娇,吕洋,刘洋,等.成纤维细胞生长因子2和丹参酮ⅡA在大鼠骨髓间充质干细胞向心肌样细胞分化中的作用 [J].解剖学报,2020,51(4):520-527.DOI:10.16098/j.issn.0529-1356.2020.04.008.
[4]张文才,宫俊龙,杨帆,等.miR-148a通过靶定DNMT1调节大鼠间充质干细胞向心肌细胞的分化 [J].武汉大学学报(医学版),2019,40(1):11-16.DOI:10.14188/j.1671-8852.2018.0447.
[5]Wang L,Wang L,Wang Q.Constitutive activation of the NEAT1/miR-22-3p/Ltb4r1 signaling pathway in mice with myocardial injury following acute myocardial infarction [J].Aging (Albany NY),2021,13(11):15307-15319.DOI:10.18632/aging.203089.
[6]Zhang X,Wang Y,Zhao H,et al.Extracellular vesicle-encapsulated miR-22-3p from bone marrow mesenchymal stem cell promotes osteogenic differentiation via FTO inhibition [J].Stem Cell Res Ther,2020,11(1):227.DOI:10.1186/s13287-020-01707-6.
[7]Yu L,Zheng WJ,Li CQ,et al.MiR-22-3p/KLF6/MMP14 axis in fibro-adipogenic progenitors regulates fatty infiltration in muscle degeneration [J].FASEB J,2020,34(9):12691-12701.DOI:10.1096/fj.202000506R.
[8]莊兆辉,仲永,陈月婵,等.Krüppel样因子在肌肉组织中的功能研究进展 [J].遗传,2018,40(9):733-748.DOI:10.16288/j.yczz.18-095.
[9]Chen TP,Zhang NJ,Wang HJ,et al.Knockdown of circ-ROBO2 attenuates acute myocardial infarction through regulating the miR-1184/TRADD axis [J].Mol Med,2021,27(1):21.DOI:10.1186/s10020-021-00275-6.
[10]刘洋,吕洋,王浩宇,等.1,25-维生素-D3体外诱导骨髓间充质干细胞向心肌样细胞分化的最适浓度 [J].解剖学报,2019,50(5):580-588.DOI:10.16098/j.issn.0529-1356.2019.05.007.
[11]李艳君,唐艳红,陈元秀,等.TBX18腺病毒使成鼠骨髓间充质干细胞分化为心肌样细胞的研究 [J].疑难病杂志,2019,18(1):72-75,85,109.DOI:10.3969/j.issn.1671-6450.2019.01.017.
[12]宋忠阳,张志明,雍文兴,等.诱导骨髓间充质干细胞向心肌细胞分化研究进展 [J].中国组织化学与细胞化学杂志,2019,28(5):456-461.DOI:10.16705/j.cnki.1004-1850.2019.05.011.
[13]赵静苗,胡继宏,王秋萍.黄芪甲苷诱导大鼠骨髓间充质干细胞向心肌样细胞分化的研究 [J].中国全科医学,2017,20(21):2635-2639.DOI:10.3969/j.issn.1007-9572.2017.05.y11.
[14]Pan X,He Y,Chen Z,et al.Circulating miR-130 is a potential bio signature for early prognosis of acute myocardial infarction [J].J Thorac Dis,2020,12(12):7320-7325.DOI:10.21037/jtd-20-3207.
[15]Zhang BF,Jiang H,Chen J,et al.LncRNA H19 ameliorates myocardial infarction-induced myocardial injury and maladaptive cardiac remodelling by regulating KDM3A [J].J Cell Mol Med,2020,24(1):1099-1115.DOI:10.1111/jcmm.14846.
[16]Zhao XS,Ren Y,Wu Y,et al.MiR-30b-5p and miR-22-3p restrain the fibrogenesis of post-myocardial infarction in mice via targeting PTAFR [J].Eur Rev Med Pharmacol Sci,2020,24(7):3993-4004.DOI:10.26355/eurrev_202004_20869.
[17]韩析言.加味丹参饮体外诱导骨髓间充质干细胞向心肌样细胞分化的实验研究 [J].中国比较医学杂志,2016,26(11):43-48, 5.DOI:10.3969/j.issn.1671-7856.2016.11.008.
[18]贺继刚,王梓豪,谢巧丽,等.过表达GATA-4骨髓间充质干细胞分泌的外泌体促进骨髓间充质干细胞向心肌样细胞分化 [J].中国组织工程研究,2020,24(19):2965-2971.DOI:10.3969/j.issn.2095-4344.2056.
[19]吴凤新.碳纤维增强聚乙烯醇导电水凝胶制备及工程化心肌样组织构建研究[D].北京:北京协和医学院,2019.
[20]Kim GD,Ng HP,Patel N,et al.Kruppel-like factor 6 and miR-223 signaling axis regulates macrophage-mediated inflammation [J].FASEB J,2019,33(10):10902-10915.DOI:10.1096/fj.201900867RR.
[21]Sawaki D,Hou L,Tomida S,et al.Modulation of cardiac fibrosis by Krüppel-like factor 6 through transcriptional control of thrombospondin 4 in cardiomyocytes [J].Cardiovasc Res,2015,107(4):420-430.DOI:10.1093/cvr/cvv155.
(收稿日期:2022-04-15)

