超声造影肝脏影像报告和数据系统分类LR-5对肝细胞肝癌诊断价值的Meta分析
颜晓一 吕珂 陈天娇 李建初

摘要:目的 系統评价超声造影(CEUS)肝脏影像报告和数据系统(LI-RADS)分类LR-5对肝细胞肝癌(HCC)的诊断价值。方法 检索PubMed、Embase、Cochrane Library、中国知网及万方数据库,收集从建库至2021年11月14日发表的关于CEUS LI-RADS分类诊断HCC的相关文献,由两位研究者根据文献纳入及排除标准独立进行文献筛选,使用数据提取和质量评价量表评价文献质量,采用RevMan 5.4、Meta Disc 1.4及Stata 16.0软件分析LR-5在高危人群中对HCC的诊断效能。结果 最终纳入20个原始研究共6131个病灶,其中HCC 5142个。Meta分析结果显示,CEUS LI-RADS中LR-5诊断高危人群HCC的合并敏感度为0.72(95%CI=0.66~0.77),合并特异度为0.93(95%CI=0.87~0.96),合并阳性似然比为9.89(95%CI=5.31~18.41),合并阴性似然比为0.30(95%CI=0.25~0.37),合并受试者工作特征曲线下面积为0.88(95%CI=0.85~0.91)。各项研究间存在异质性(I2=95.31,P<0.001);漏斗图显示文献存在发表偏倚(P=0.04)。结论 CEUS LI-RADS分类LR-5对高危人群HCC可能具有较高的诊断价值。
关键词:超声造影;肝脏影像报告和数据系统;肝细胞肝癌
中图分类号: R445.1 文献标志码: A 文章编号:1000-503X(2023)01-0057-07
DOI:10.3881/j.issn.1000-503X.15048
Performance of Contrast-enhanced Ultrasound Liver Imaging Reporting and Data System LR-5 in the Diagnosis of Hepatocellular Carcinoma:A Meta-analysis
YAN Xiaoyi,L Ke,CHEN Tianjiao,LI Jianchu
Department of Ultrasound,PUMC Hospital,CAMS and PUMC,Beijing 100730,China
Corresponding author:L Ke Tel:010-69155493,E-mail:lvke@163.com
ABSTRACT:Objective To evaluate the performance of contrast-enhanced ultrasound (CEUS) liver imaging reporting and data system (LI-RADS) LR-5 in the diagnosis of hepatocellular carcinoma (HCC).Methods The clinical research reports with the application of CEUS LI-RADS in the diagnosis of HCC were collected from PubMed,Embase,Cochrane Library,CNKI,and Wanfang Data from inception to November 14,2021.Two researchers respectively screened the literature and extracted relevant information.The Quality Assessment of Diagnostic Accuracy Studies (QUADAS) was used to evaluate the quality of all the included articles.RevMan 5.4,Meta disc 1.4,and Stata 16.0 were employed to analyze the diagnostic performance of LR-5 for HCC in high-risk patients.Results Twenty original studies were included,involving a total of 6131 lesions,of which 5142 were HCC.The results of meta-analysis showed that the LR-5 in CEUS LI-RADS for diagnosing HCC in the high-risk population had the overall sensitivity of 0.72 (95%CI=0.66-0.77),the overall specificity of 0.93 (95%CI=0.87-0.96),the overall positive likelihood ratio of 9.89 (95%CI=5.31-18.41),the overall negative likelihood ratio of 0.30 (95%CI=0.25-0.37),and the area under the summary receiver operating characteristic curve of 0.88 (95%CI=0.85-0.91).There was heterogeneity among the included studies (I2=95.31,P<0.001).The funnel plot indicated the existence of publication bias (P=0.04).Conclusion The CEUS LI-RADS can effectively diagnose HCC in high-risk patients based on the LR-5 criteria.
Key words:contrast-enhanced ultrasound;liver imaging reporting and data system;hepatocellular carcinoma
Acta Acad Med Sin,2023,45(1):57-63
據统计,肝细胞肝癌(hepatocellular carcinoma,HCC)是全球第4位常见致死性恶性肿瘤,占肝脏恶性肿瘤的80%以上,肝炎、酒精、非酒精性脂肪肝等均为HCC常见危险因素[1-3]。中国是乙肝大国,HCC致死率位列恶性肿瘤的第2位,严重威胁人民的生命及健康。早期HCC可通过手术根治,但多数患者确诊时已进展为中晚期,错过了最佳治疗时机。早期诊断对HCC治疗方案的选择及预后至关重要。2011年美国放射学会发布了CT和MRI诊断HCC的肝脏影像报告和数据系统(liver imaging reporting and data system,LI-RADS),广泛应用于临床。随着超声造影(contrast-enhanced ultrasound,CEUS)技术的发展,2016年美国放射学会又发布了CEUS LI-RADS,并于2017年进行了更新[4-5],该报告系统中将LR-5类病灶(肝脏局部病灶直径≥1 cm,病灶呈动脉期高增强且延迟(≥60 s)轻度廓清)归为HCC。现有研究表明CEUS LI-RADS可以有效鉴别诊断HCC及其他肝脏局灶性病变,但目前有关该报告系统诊断效能的研究存在研究人群单一、高危因素存在地域差异等局限性,造成结果的不一致。一项Meta分析评估了CEUS LR-5及LR-M的诊断效能,发现LR-5诊断HCC的合并特异度高,敏感度较低,LR-5和LR-M可以有效地鉴别HCC及其他肝脏恶性肿瘤[6];此外,Qin等[7]分析LI-RADS每一级别中HCC占比,发现分级越高,HCC发病风险越高。但既往分析纳入的原始研究数量较少,且只纳入了英文文献,缺少对中国临床研究数据的荟萃分析。因此,本研究检索国内外相关文献,旨在采用循证医学方法评估CEUS LI-RADS在HCC高危人群中的诊断效能,以期为HCC的诊断和临床管理提供较为客观全面的依据。
资料和方法
检索策略 检索PubMed、Embase、Cochrane Library、中国知网及万方数据库,采用中文及英文主题词加自由词的检索方式,检索时间为从建库至2021年11月14日。英文检索式为(LI-RADS OR LIRADS OR(liver imaging reporting and data system)) AND (HCC OR hepatocellular carcinoma);中文检索式为(肝细胞肝癌OR肝癌OR HCC)AND(LI-RADS OR LIRADS OR肝脏影像报告和数据系统)。
文献筛选 纳入标准:(1)采用CEUS LI-RADS中LR-5诊断HCC;(2)回顾性队列研究;(3)病理或临床诊断明确,临床诊断指影像学恶性征象典型或良性可能且在随访过程中(至少1年)病灶大小无明显变化;(4)研究人群为HCC高危人群,包括慢性病毒性肝炎、肝硬化、酒精性肝病等;(5)能直接提取、从表格和图片或根据敏感度、特异度和病例数计算出真阳性(true positive,TP)、假阳性(false positive,FP)、假阴性(false negative,FN)、真阴性(true negative,TN)。排除标准:(1)重复发表文献;(2)文献类型为病例报告、综述、会议、学位论文等;(3)数据不完整,无法提取TP、FP、FN、TN。
文献质量评价及数据提取 由2位研究者根据文献纳入及排除标准独立进行文献检索、筛选及信息提取,当存在不同意见时,两人共同协商或由第3位研究者进行共同讨论。提取内容主要包括第1作者、发表年份、国家、研究类型、研究时间、诊断金标准、LI-RADS标准及TP、FP、FN、TN。采用Cochrane协作网推荐的数据提取和质量评价量表(Quality Assessment of Diagnostic Accuracy Studies-2,QUADAS-2)进行文献质量评价[8],通过RevMan 5.4获取质量评价图。
统计学处理 采用Meta disc 1.4及Stata 16.0软件进行阈值效应及统计分析,计算或直接提取敏感度、特异度、阳性似然比、阴性似然比及其95%置信区间(95%CI)。采用综合受试者工作特征(summary receiver operating characteristic,SROC)曲线获取曲线下面积(area under the curve,AUC),其中AUC越接近1诊断效能越高。采用卡方检验(Q检验)和不一致性指数(I2)检测各结局指标研究间的异质性,如果P<0.1或I2≥50%,则认为存在异质性;通过Meta回归探索异质性来源。通过敏感性分析评估结果的稳健性。以Deek漏斗图评估发表偏倚。
结 果
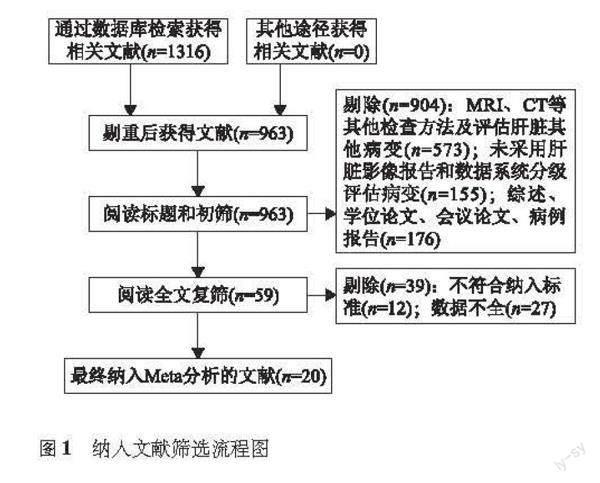
检索结果 最终纳入20个原始研究(英文文献16篇、中文文献4篇),共6131个病灶,其中HCC 5142个(图1)。
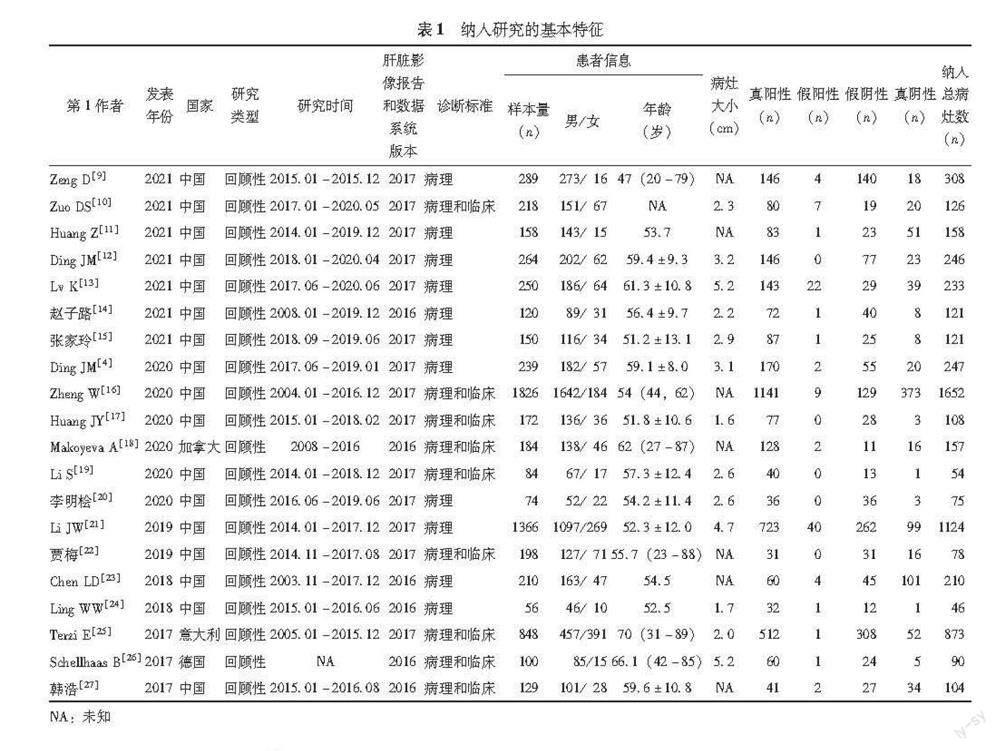
文献基本特征及质量评价 纳入研究的具体特征见表1。采用QUADAS-2工具对纳入文献进行质量评价,结果显示纳入文献的偏倚风险较低(图2)。
异质性检验 阈值效应分析显示,Spearman相关系数为0.171,P=0.470,提示不存在因阈值效应引起的异质性;异质性检验结果显示,敏感度I2=95.31(P<0.001)、特异度I2=85.94(P<0.001),存在异质性,故采用随机效应模型合并,绘制SROC曲线。
CEUS LI-RADS中LR-5诊断效能 CEUS LI-RADS中LR-5诊断高危人群HCC的合并敏感度为0.72(95%CI=0.66~0.77),合并特异度为0.93(95%CI=0.87~0.96)(图3),合并阳性似然比为9.89(95%CI=5.31~18.41),合并阴性似然比为0.30(95%CI=0.25~0.37),AUC为0.88(95%CI=0.85~0.91)(图4)。
敏感性分析與发表偏倚 依次排除单个研究进行敏感性分析,结果显示,各合并效应量未发现明显变化(敏感度取值范围0.70~0.73,I2=90.48~95.60;特异度取值范围0.92~0.94,I2=79.04~86.82)。将研究地区、LI-RADS标准版本及纳入病灶大小协变量分组进行Meta回归分析结果显示,地区因素为敏感度来源(P=0.03),且国外研究诊断敏感度更高(表3)。Deeks漏斗图分析显示,散点在直线两侧分布不均匀,提示纳入文献存在发表偏倚(P=0.04)(图5)。
讨 论
原发性肝癌主要包括HCC、肝内胆管癌(intrahepatic cholangiocarcinoma,ICC)及混合型肝细胞癌-胆管癌3种不同病理学类型,三者在发病机制、生物学行为、病理组织学、治疗方法以及预后等方面差异较大,其中,HCC发病率最高[28]。CEUS可以实时、动态、连续显像,在肝癌的早期诊断、分级以及治疗和预后中占有重要地位,同时,由于超声造影剂为纯血池显像剂,不进入周围间质,因此CEUS在显示造影剂廓清上更具优势[4,18]。有研究显示,CEUS诊断HCC的敏感度达84.4%[4,29],但目前诊断标准尚不统一,对疾病及征象的描述往往存在差异,导致影像科医师之间、影像科医师与临床医师之间沟通困难甚至理解错误[27]。美国放射学会LI-RADS分类标准依据HCC高危人群中肝脏局灶性病变的最大径线、各期强化特点以及造影剂廓清时间、程度、方式等超声造影表现制定了CEUS检查结果标准化报告系统,该标准将病灶划分为LR-1~5、LR-M及LR-TIV等几大类,旨在将CEUS的诊断准确性与LI-RADS的标准化相结合,进一步提高诊断效能,同时便于医生交流[30]。本研究对CEUS LI-RADS分类中LR-5对高危人群HCC的诊断效能进行了系统评价,共纳入20个原始研究,结果显示LR-5诊断高危人群HCC的合并敏感度为0.72(95%CI=0.66~0.77),合并特异度为0.93(95%CI=0.87~0.96),AUC为0.88(95%CI=0.85~0.91),提示诊断效能尚佳,与已有Meta分析结果近似(敏感度为71%,特异度为88%)[3]。
LR-5诊断特异度较高,可以有效降低误诊率,这与LI-RADS分类提出的目标—使高危人群HCC影像学诊断特异度最大化,从而在无病理诊断时也能做出准确诊断[18]相契合;但其敏感度较低,可能是由于部分中、低分化及>3 cm的HCC可表现为早期廓清,导致现有LI-RADS分级标准可能将部分HCC诊断为其他恶性肿瘤[4],同时,部分高分化的HCC无廓清现象,可能被纳入L3~4类。研究表明LR-4联合LR-5可提高CEUS LI-RADS分类对HCC的诊断敏感度[15,26]。此外,高危人群HCC发病率高,如不采用具体的标准,超声医师诊断时倾向于更多地做出HCC的诊断,因此,采用LI-RADS标准可以提高诊断特异度,减少误诊率。
动脉期高增强、门脉期和延迟期廓清为HCC CEUS表现,但50%肝硬化合并ICC患者也可表现为动脉期高增强伴门脉期及延迟期廓清,导致约1%的肝脏局灶性病变会被误诊为HCC[31-32],因此,2011年美国肝病研究学会及2012年欧洲肝病研究学会发布的指南中未将CEUS列入肝癌常规影像诊断方式[9,25]。但后续研究发现ICC廓清时间更早且廓清程度更显著,因此LI-RADS分类对病灶大小、廓清时间和程度进行了严格分类,进一步规范了诊断标准,提高了CEUS在高危人群中的鉴别诊断能力[16]。
Meta回归分析结果显示敏感度的异质性与研究人群所在地区有关,国外研究的敏感度更高,这可能与不同背景人群的高危因素不同有关。Terzi等[25]及Schellhaas等[26]纳入研究对象的高危因素为肝硬化,而国内大部分研究对象的高危因素为乙型肝炎及肝硬化。未合并肝硬化的HCC可在门脉期和延迟期不出现廓清,需与肝腺瘤及局灶性结节增生相鉴别[33],因此国内研究的敏感度可能较国外研究低;此外,西方国家丙型肝炎及非酒精性脂肪肝更常见,不同的肝脏背景均可能对肝占位的成像及分析产生不同的影响,因此尚不能排除高危因素不同所致的异质性。文献质量、研究样本量及医师诊断水平等也可能为异质性的来源。
本研究纳入的原始研究多数来自中国,因此结果在国内适用性较高,但也存在一定的局限性:(1)纳入研究存在发表偏倚,可能原因是本研究仅纳入公开发表的中、英文文献;(2)纳入研究大多数为回顾性研究;(3)病理诊断不是唯一的诊断金标准;(4)合并敏感度、特异度的异质性较大且来源不明确。
综上,本研究结果显示,CEUS LI-RADS分类标准中LR-5对高危人群HCC可能具有较高的诊断价值,同时LI-RADS分类标准有利于促进国内CEUS诊断HCC报告的规范化。
参 考 文 献
[1]Global Burden of Disease Cancer Collaboration,Fitzmaurice C,Allen C,et al.Global,regional,and national cancer incidence,mortality,years of life lost,years lived with disability,and disability-adjusted life-years for 32 cancer groups,1990 to 2015:a systematic analysis for the global burden of disease study[J].JAMA Oncol,2017,3(4):524-548.DOI:10.1001/jamaoncol.2016.5688.
[2]Yang JD,Hainaut P,Gores GJ,et al.A global view of hepatocellular carcinoma:trends,risk,prevention and management[J].Nat Rev Gastroenterol Hepatol,2019,16(10):589-604.DOI:10.1038/s41575-019-0186-y.
[3]Li J,Yang L,Ma L,et al.Diagnostic accuracy of contrast-enhanced ultrasound liver imaging reporting and data system (CEUS LI-RADS) for differentiating between hepatocellular carcinoma and other hepatic malignancies in high-risk patients:a meta-analysis[J].Ultraschall Med,2021,42(2):187-193.DOI:10.1055/a-1309-1568.
[4]Ding J,Long L,Zhang X,et al.Contrast-enhanced ultrasound LI-RADS 2017:comparison with CT/MRI LI-RADS[J].Eur Radiol,2021,31(2):847-854.DOI:10.1007/s00330-020-07159-z.
[5]Kono Y,Lyshchik A,Cosgrove D,et al.Contrast enhanced ultrasound (CEUS) liver imaging reporting and data system (LI-RADS):the official version by the American College of Radiology (ACR) [J].Ultraschall Med,2017,38(1):85-86.DOI:10.1055/s-0042-124369.
[6]Son JH,Choi SH,Kim SY,et al.Accuracy of contrast-enhanced ultrasound liver imaging reporting and data system:a systematic review and meta-analysis [J].Hepatol Int,2020,14(6):1104e13.DOI:10.1007/s12072-020-10102-5.
[7]Qin Z,Zhou Y,Ding J,et al.Risk stratification for hepatocellular carcinoma of contrast-enhanced ultrasound liver imaging reporting and data system (LI-RADS) and the diagnostic performance of LR-5 and LR-M:a systematic review and meta-analysis[J].Clin Radiol,2022,77(4):e280-e286.DOI:10.1016/j.crad.2022.01.041.
[8]Whiting PF,Rutjes AW,Westwood ME,et al.QUADAS-2:a revised tool for the quality assessment of diagnostic accuracy studies[J].Ann Intern Med,2011,155(8):529-536.DOI:10.7326/0003-4819-155-8-201110180-00009.
[9]Zeng D,Xu M,Liang JY,et al.Using new criteria to improve the differentiation between HCC and non-HCC malignancies:clinical practice and discussion in CEUS LI-RADS 2017[J].Radiol Med,2022,127(1):1-10.DOI:10.1007/s11547-021-01417-w.
[10]Zuo D,Yang K,Wu S.Diagnostic performance of intravascular perfusion based contrast-enhanced ultrasound LI-RADS in the evaluation of hepatocellular carcinoma[J].Clin Hemorheol Microcirc,2021,78(4):429-437.DOI:10.3233/CH-211164.
[11]Huang Z,Zhou P,Li S,et al.MR versus CEUS LI-RADS for distinguishing hepatocellular carcinoma from other hepatic malignancies in high-risk patients[J].Ultrasound Med Biol,2021,47(5):1244-1252.DOI:10.1016/j.ultrasmedbio.2021.01.020.
[12]Ding J,Qin Z,Zhou Y,et al.Impact of revision of the LR-M criteria on the diagnostic performance of contrast-enhanced ultrasound LI-RADS[J].Ultrasound Med Biol,2021,47(12):3403-3410.DOI:10.1016/j.ultrasmedbio.2021.08.007.
[13]Lv K,Cao X,Dong Y,et al.CT/MRI LI-RADS version 2018 versus CEUS LI-RADS version 2017 in the diagnosis of primary hepatic nodules in patients with high-risk hepatocellular carcinoma[J].Ann Transl Med,2021,9(13):1076.DOI:10.21037/atm-21-1035.
[14]赵子路,唐少珊,彭珊珊,等.超声造影LI-RADS分类在小肝癌诊断中的应用价值[J].中国医科大学学报,2021,50(7):641-645.DOI:10.12007/j.issn.0258-4646.2021.07.014.
[15]张家玲,葛晖,武文娟.超声造影LI-RADS分类标准对肝细胞癌的诊断价值[J].中华全科医学,2021,19(5):833-837.DOI:10.16766/j.cnki.issn.1674 -4152.001929.
[16]Zheng W,Li Q,Zou XB,et al.Evaluation of contrast-enhanced US LI-RADS version 2017:application on 2020 liver nodules in patients with hepatitis B infection[J].Radiology,2020,294(2):299-307.DOI:10.1148/radiol.2019190878.
[17]Huang JY,Li JW,Lu Q,et al.Diagnostic accuracy of CEUS LI-RADS for the characterization of liver nodules 20 mm or smaller in patients at risk for hepatocellular carcinoma[J].Radiology,2020,294(2):329-339.DOI:10.1148/radiol.2019191086.
[18]Makoyeva A,Kim TK,Jang HJ,et al.Use of CEUS LI-RADS for the accurate diagnosis of nodules in patients at risk for hepatocellular carcinoma:a validation study[J].Radiol Imaging Cancer,2020,2(2):e190014.DOI:10.1148/rycan.2020190014.
[19]Li S,Zhou L,Chen R,et al.Diagnostic efficacy of contrast-enhanced ultrasound versus MRI liver imaging reporting and data system (LI-RADS) for categorising hepatic observations in patients at risk of hepatocellular carcinoma[J].Clin Radiol,2021,76(2):161.e1-161.e10.DOI:10.1016/j.crad.2020.10.009.
[20]李明桧,唐荣,陈孙斌.基于LI-RADS分类标准的超声造影技术对肝细胞癌诊断的可行性研究[J].肝脏,2020,25(8):822-824.DOI:10.14000/j.cnki.issn.1008-1704.2020.08.016.
[21]Li J,Ling W,Chen S,et al.The interreader agreement and validation of contrast-enhanced ultrasound liver imaging reporting and data system[J].Eur J Radiol,2019,120:108685.DOI:10.1016/j.ejrad.2019.108685.
[22]賈梅,张梅,杨兵,等.基于超声图像的肝脏LI-RADS分类标准规范化应用及关键技术的研究[J].中国实验诊断学,2019,23(1):74-76.DOI:10.3969/j.issn.1007-4287.2019.01.029.
[23]Chen LD,Ruan SM,Lin Y,et al.Comparison between M-score and LR-M in the reporting system of contrast-enhanced ultrasound LI-RADS[J].Eur Radiol,2019,29(8):4249-4257.DOI:10.1007/s00330-018-5927-8.
[24]Ling W,Wang M,Ma X,et al.The preliminary application of liver imaging reporting and data system (LI-RADS) with contrast-enhanced ultrasound (CEUS) on small hepatic nodules (≤2 cm) [J].J Cancer,2018,9(16):2946-2952.DOI:10.7150/jca.25539.
[25]Terzi E,Iavarone M,Pompili M,et al.Contrast ultrasound LI-RADS LR-5 identifies hepatocellular carcinoma in cirrhosis in a multicenter restropective study of 1006 nodules[J].J Hepatol,2018,68(3):485-492.DOI:10.1016/j.jhep.2017.11.007.
[26]Schellhaas B,Gortz RS,Pfeifer L,et al.Diagnostic accuracy of contrast-enhanced ultrasound for the differential diagnosis of hepatocellular carcinoma:ESCULAP versus CEUS-LI-RADS[J].Eur J Gastroenterol Hepatol,2017,29(9):1036-1044.DOI:10.1097/MEG.0000000000000916.
[27]韩浩,孔文韬,仇毓东,等.LI-RADS超声造影分类标准对肝细胞癌的诊断价值[J].临床超声医学杂志,2017,8(19):505-509.DOI:10.16245/j.cnki.issn1008-6978.2017.08.001.
[28]国家卫生健康委办公厅.原发性肝癌诊疗指南(2022年版) [J].临床肝胆病杂志,2022,21(2):143-168.DOI:10.19538/j.cjps.issn1005-2208.2022.03.01.
[29]Hanna RF,Miloushev VZ,Tang A,et al.Comparative 13-year meta-analysis of the sensitivity and positive predictive value of ultrasound,CT,and MRI for detecting hepatocellular carcinoma[J].Abdom Radiol,2016,41(1):71-90.DOI:10.1007/s00261-015-0592-8.
[30]尚婧莹,何秀丽,郭玲玲.超声造影LI-RADS分类在肝细胞癌诊断及鉴别诊断中的应用价值[J].中国现代医学杂志,2022,32(1):6-12.DOI:10.3969/j.issn.1005-8982.2022.01.002.
[31]Vilana R,Forner A,Bianchi L,et al.Intrahepatic peripheral cholangiocarcinoma in cirrhosis patients may display a vascular pattern similar to hepatocellular carcinoma on contrast-enhanced ultrasound[J].Hepatology,2010,51(6):2020-2029.DOI:10.1002/hep.23600.
[32]Galassi M,Iavarone M,Rossi S,et al.Patterns of appearance and risk of misdiagnosis of intrahepatic cholangiocarcinoma in cirrhosis at contrast enhanced ultrasound[J].Liver Int,2013,33(5):771-779.DOI:10.1111/liv.12124.
[33]Dietrich CF,Nolse CP,Barr RG,et al.Guidelines and good clinical practice recommendations for contrast enhanced ultrasound (CEUS) in the liver -Update 2020 -WFUMB in cooperation with EFSUMB,AFSUMB,AIUM,and FLAUS[J].Ultraschall Med,2020,41(5):562-585.DOI:10.1055/a-1177-0530.
(收稿時间:2022-04-14)

