大黄素对膝骨关节炎大鼠软骨细胞铁死亡的影响及机制研究
王柯,叶寒露
膝骨关节炎(knee osteoarthritis,KOA)是导致老年患者残疾的最常见退行性关节疾病,发病机制复杂,以膝关节软骨退变、破坏和骨质增生为主要特征,治疗方案包括手术和非手术两种,且后者已成为近年研究的热点[1]。研究显示,青蒿素、大黄素等中药单体治疗KOA可取得良好疗效[2]。大黄素是从大黄的根茎中分离出来的天然蒽醌类化合物,具有抗菌、抗癌和抗炎等多种药理活性,可通过抗基质降解途径保护KOA 大鼠膝关节软骨[3]。目前,有关大黄素保护KOA 膝关节软骨的作用机制尚不明确。铁死亡是以铁失衡和脂质过氧化为特征的细胞死亡方式,在骨质疏松症等骨疾病的发生中发挥重要作用[4]。有研究认为,抑制软骨细胞铁死亡、激活核因子E2 相关因子2(nuclear factor E2-related factor 2,Nrf2)/血红素加氧酶-1(heme oxygenase-1,HO-1)通路活化可减轻KOA中软骨细胞损伤[5]。大黄素能通过激活Nrf2/HO-1 信号通路来抑制脂多糖诱导的RAW264.7细胞炎症和氧化应激[6]。基于此,笔者推测大黄素可能通过激活Nrf2/HO-1信号通路来抑制KOA 大鼠软骨细胞铁死亡,从而保护膝关节软骨。本研究通过构建KOA大鼠模型并采用大黄素干预,观察软骨细胞铁死亡变化及Nrf2/HO-1信号通路在此过程中的作用,从而探索大黄素治疗KOA的分子机制,为大黄素用于KOA治疗提供新的理论依据。
1 材料与方法
1.1 主要材料 SPF级健康雄性SD大鼠96只,10~12周龄,体质量(350±20)g,购自湖北省实验动物研究中心,动物生产许可证号:SCXK(鄂)2015-0018。所有大鼠在(25±1)℃、相对湿度60%~65%的环境下饲养,每天12 h 光照∶12 h 黑暗,自由摄食饮水。本研究动物实验严格遵循3R原则并经过武汉市中医医院实验动物伦理委员会批准(批准号:2021005)。大黄素(美国Sigma 公司);Nrf2 抑制剂ML385(美国MCE 公司);肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、前列腺素E2(prostaglandin E2,PGE2)酶联免疫吸附试验(enzymelinked immunosorbent assay,ELISA)试剂盒(武汉菲恩生物科技有限公司);一氧化氮(nitric oxide,NO)ELISA试剂盒(江西艾博因生物科技有限公司);改良番红O-固绿软骨染色液(北京索莱宝科技有限公司);原位末端标记(TdT-mediated dUTP nick end labeling,TUNEL)凋亡检测试剂盒(南京诺唯赞生物科技股份有限公司);丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、亚铁离子(Fe2+)比色法测试盒和活性氧(reactive oxygen species,ROS)荧光法测试盒(DCFH-DA,武汉伊莱瑞特生物科技股份有限公司);兔抗鼠Ⅱ型胶原α1(collagen type Ⅱα1,COL2A1)抗体(上海联迈生物工程有限公司);兔抗鼠基质金属蛋白酶(matrix metalloproteinase,MMP)-3 抗体、兔抗鼠MMP-13、兔抗鼠前列腺素内过氧化物合酶2(prostaglandin-endoperoxide synthase 2,PTGS2)抗体、兔抗鼠谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)抗体、兔抗鼠Nrf2抗体、兔抗鼠甘油醛-3- 磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体、兔抗鼠Histone H3 抗体和辣根过氧化物酶(HRP)标记羊抗兔IgG(英国Abcam 公司);长链脂酰辅酶A 合成酶4(acyl-CoA synthetase long chain family member 4,ACSL4)、HO-1抗体(美国Invitrogen公司)。
1.2 研究方法
1.2.1 模型构建与分组干预 大鼠适应性饲养2周后按随机数表法分为假手术(Sham)组、KOA 组、大黄素(EMO)组、大黄素+Nrf2 抑制剂(EMO+ML385)组,每组24 只。除Sham 组外,其余组大鼠采用改良Hulth法构建KOA模型[7]:大鼠仰卧位固定,麻醉后从膝关节内侧入路,将内侧副韧带切断,摘除内侧半月板,并切断前交叉韧带。Sham组仅打开关节腔,韧带和半月板均保持完整。整个造模过程均保持无菌,术中实时监测大鼠的呼吸和心率,术后连续3 d肌内注射20万U 青霉素。大鼠醒来后正常喂食饮水,并自由走动。从造模第4周开始,EMO 组大鼠腹腔注射80 mg/kg 大黄素[3];EMO+ML385 组大鼠腹腔注射80 mg/kg 大黄素和30 mg/kg ML385[8];Sham 组、KOA 组分别注射等量生理盐水和二甲基亚砜(dimethyl surfoxide,DMSO)的混合物(大黄素、ML385 均经DMSO溶解后使用生理盐水稀释),1次/d,连续3周。
1.2.2 ELISA检测血清TNF-α、NO、PGE2水平 各组大鼠麻醉后于腹主动脉取血4 mL,3 500 r/min离心10 min,取上层血清并于-20 ℃冰箱保存。每组随机取8 只大鼠的血清,参照ELISA 试剂盒说明书用酶标仪测定450 nm 波长处光密度(OD)值,绘制标准曲线,根据曲线方程计算各组大鼠血清炎性因子TNF-α、NO、PGE2水平。
1.2.3 膝关节形态观察 取血后处死大鼠,肉眼观察患肢膝关节软骨、滑膜的颜色、形态等大体情况。番红O-固绿染色观察膝关节软骨组织病理形态学变化:每组随机取8只大鼠患肢膝关节并于4%多聚甲醛固定24 h,以10%乙二胺四乙酸(EDTA)溶液脱钙处理2周,脱水、透明后石蜡包埋并切片(厚度5 μm)。石蜡切片脱蜡至水,Weigent 染液染色5 min,酸性乙醇分化后固绿染液染色5 min,蒸馏水冲洗后Safranin O染液孵育2 min。在显微镜下观察拍照(软骨基质呈红色)。并根据关节软骨组织的结构、着色程度及软骨细胞的分布、坏死程度等进行国际骨关节炎研究协会(Osteoarthritis Research Society International,OARSI)评分[9],总分越高膝关节炎程度越严重。
1.2.4 TUNEL染色检测膝关节软骨细胞凋亡率 取1.2.3中制备的石蜡切片,脱蜡至水后添加蛋白酶K 于37 ℃孵育15 min,添加TUNEL 反应混合液于37 ℃避光孵育1 h,DAPI染核,荧光显微镜观察并采集图像。随机读取6 个视野,Image J 软件统计TUNEL 阳性染色细胞(即凋亡细胞,呈红色)和总细胞(呈蓝色),计算凋亡率。凋亡率(%)=凋亡细胞数/总细胞数×100%。
1.2.5 实时荧光定量PCR(qRT-PCR)检测膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2 mRNA 表达水平 每组随机取8只大鼠的患肢膝关节置于-80 ℃冰箱保存。取出每只大鼠部分膝关节软骨,使用Trizol 试剂提取组织中总RNA 并将其反转录为cDNA,以cDNA 为模板配制反应体系(20 μL):50 mg/L cDNA 2 μL,10 μmol/L 上、下游引物各1 μL,SYBR Green Mix 10 μL,无菌ddH2O 6 μL。引物由武汉金开瑞生物工程有限公司合成,序列见表1。反应条件:95 ℃预变性5 min;95 ℃变性15 s,60 ℃退火30 s,40个循环。获取循环阈值(Ct 值)。以GAPDH 为内参基因,2-ΔΔCt法计算MMP-3、MMP-13、COL2A1 及PTGS2 的mRNA 相对表达水平。

Tab.1 Primer sequence表1 引物序列
1.2.6 生化试剂盒检测膝关节软骨组织中MDA、ROS、GSH、Fe2+水平 每组取剩余8只大鼠的患肢膝关节制备新鲜软骨组织匀浆液,12 000 r/min 离心15 min 获取上清液,二喹啉甲酸(bicinchoninic acid,BCA)法定量蛋白浓度后,参照各自测试盒说明书,使用酶标仪或分光光度计检测MDA(波长532 nm)、ROS(激发波长500 nm,发射波长525 nm)及GSH(波长412 nm)、Fe2+(波长593 nm)水平。
1.2.7 免疫组化染色检测膝关节软骨组织中GPX4、ACSL4阳性表达 取1.2.3中制备的膝关节软骨组织行常规石蜡切片,脱蜡至水后滴加3%过氧化氢以灭活内源性过氧化物酶,置于枸橼酸盐缓冲液中煮沸以行抗原热修复,正常山羊血清封闭后滴加一抗GPX4(1∶100)、ACSL4(1∶500),4 ℃孵育过夜,滴加生物素标记二抗(1∶4 000)37 ℃孵育1 h,DAB 试剂显色,苏木精染核。在显微镜下观察拍照(阳性染色细胞呈棕褐色或棕黄色),使用Image J 软件计数阳性染色细胞数目,计算阳性细胞比例。
1.2.8 蛋白免疫印迹检测膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2、GPX4、ACSL4、Nrf2、HO-1 蛋白表达水平 取出-80 ℃冰箱保存的剩余部分膝关节软骨,使用RIPA裂解液提取组织中总蛋白,细胞核和质提取试剂盒分离胞核和胞质蛋白,BCA法定量蛋白浓度。每泳道上样20 μg变性蛋白(20 μL)进行凝胶电泳,切胶后将蛋白转至聚偏二氟乙烯膜,5%牛血清白蛋白封闭膜2 h,膜与一抗MMP-3(1∶2 000)、MMP-13(1∶3 000)、COL2A1(1∶1 500)及PTGS2、GPX4、ACSL4、Nrf2、HO-1、Histone H3(均1∶1 000)、GAPDH(1:10 000)4 ℃孵育过夜,与HRP 标记羊抗兔IgG(1∶5 000)37 ℃孵育45 min,化学发光试剂显色。MMP-3、MMP-13、COL2A1、PTGS2、GPX4、ACSL4、胞质Nrf2、HO-1 以GAPDH为内参,胞核Nrf2 以Histone H3 为内参,凝胶成像系统扫描图像后使用Image J软件分析蛋白相对表达量。
1.3 统计学方法 采用Graphpad Prism 8.0软件进行数据分析。符合正态分布的计量数据以表示,多组间比较采用单因素方差分析,组间多重比较采用SNK-q检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠血清TNF-α、NO 以及PGE2 水平比较 与Sham 组比较,KOA 组大鼠血清TNF-α、NO、PGE2 水平升高(P<0.05);与KOA 组比较,EMO 组大鼠血清TNF-α、NO、PGE2 水平降低(P<0.05);与EMO 组比较,EMO+ML385 组大鼠血清TNF-α、NO、PGE2水平升高(P<0.05),见表2。
Tab.2 Comparison of serum TNF-α,NO and PGE2 levels between the four groups of rats表2 各组大鼠血清TNF-α、NO、PGE2水平比较(n=8,)
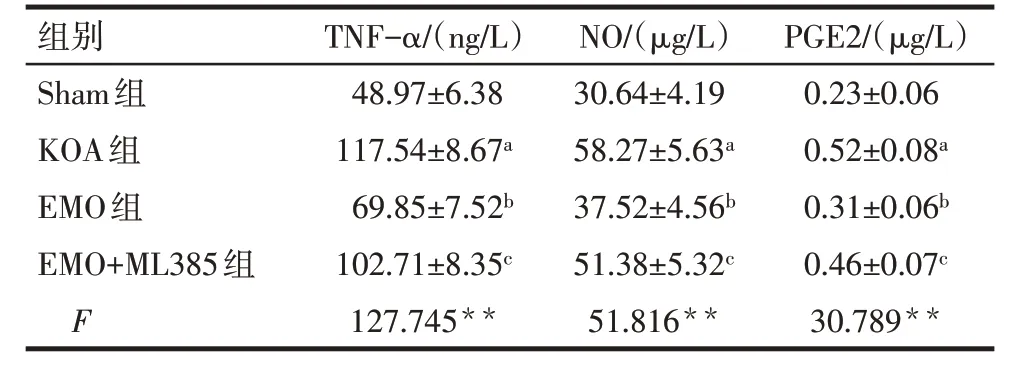
Tab.2 Comparison of serum TNF-α,NO and PGE2 levels between the four groups of rats表2 各组大鼠血清TNF-α、NO、PGE2水平比较(n=8,)
**P<0.01;a与Sham 组比较,b与KOA 组比较,c与EMO 组比较,P<0.05;表3—8同。
?
2.2 各组大鼠膝关节大体形态和软骨组织病理形态学 Sham组大鼠关节软骨表面光滑,滑膜未见肥厚,软骨细胞排列整齐、呈红色染色,潮线清晰;KOA组大鼠关节软骨表面不规则且粗糙有裂纹,滑膜明显增厚,软骨层变薄并出现裂隙样破坏,存在肥大的软骨细胞;EMO 组大鼠关节软骨表面更加光滑,裂纹减少,滑膜增厚减轻,软骨层变厚且裂隙样破坏明显改善;EMO+ML385 组大鼠关节软骨破坏较EMO组加重,见图1、2。与Sham 组比较,KOA 组大鼠OARSI 评分升高(P<0.05);与KOA 组比较,EMO 组大鼠OARSI 评分降低(P<0.05);与EMO 组比较,EMO+ML385 组大鼠OARSI 评分升高(P<0.05),见表3。
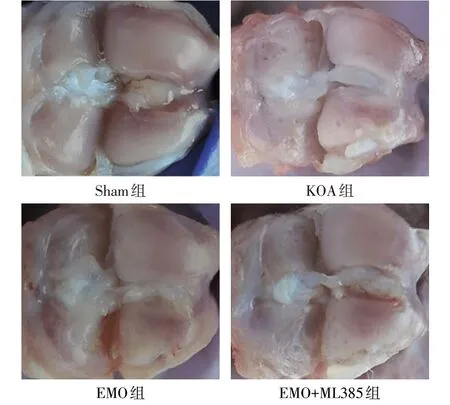
Fig.1 General morphology of knee joint of rats in each group图1 各组大鼠膝关节大体形态
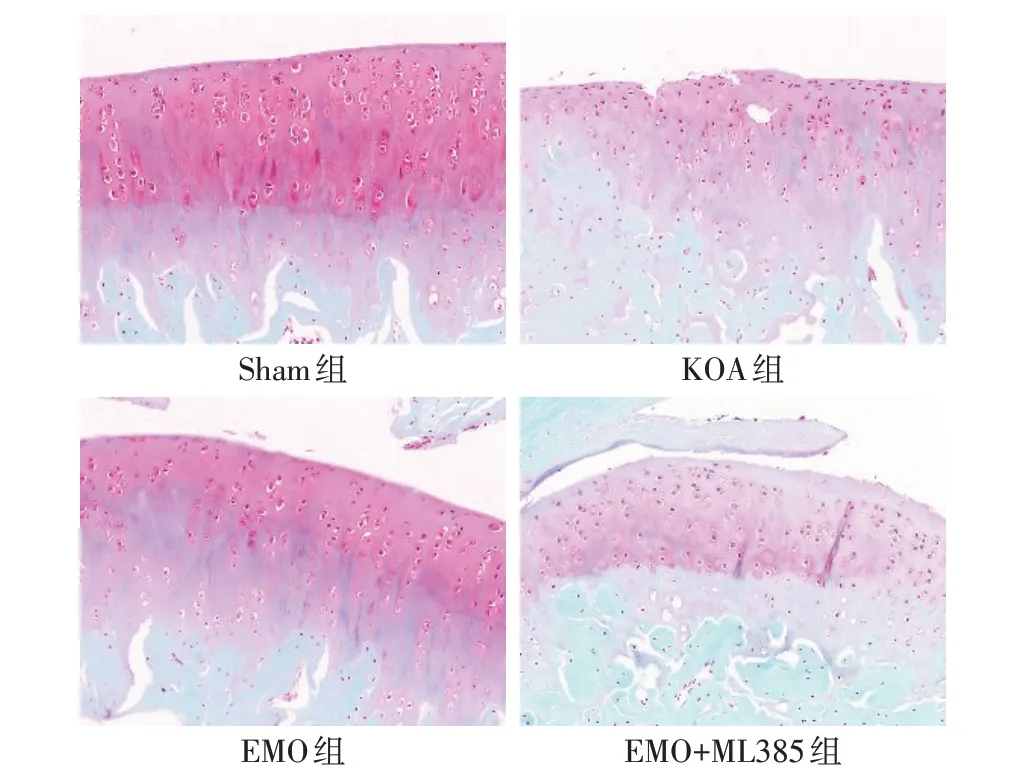
Fig.2 Pathological changes of knee joint cartilage tissue of rats in each group(safranine O-solid green staining,×200)图2 各组大鼠膝关节软骨组织病理形态学变化(番红O-固绿染色,×200)
Tab.3 Comparison of OARSI score of knee joint cartilage and apoptosis rate of chondrocytes between the four groups of rats表3 各组大鼠膝关节软骨OARSI评分和软骨细胞凋亡率比较(n=8,)
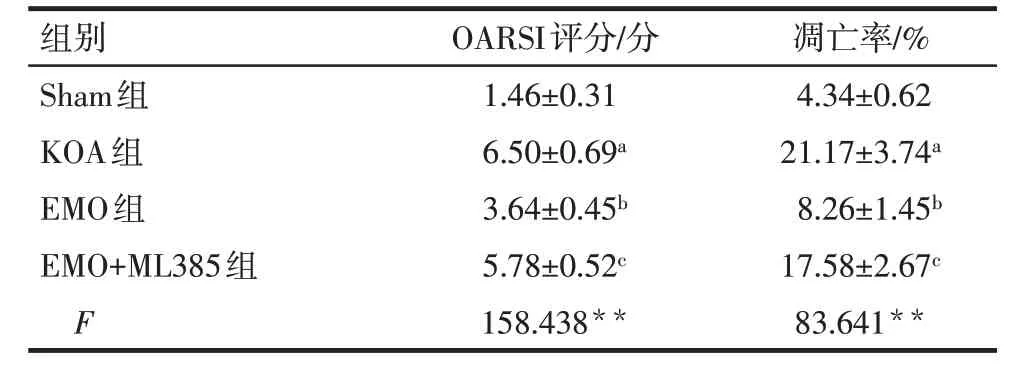
Tab.3 Comparison of OARSI score of knee joint cartilage and apoptosis rate of chondrocytes between the four groups of rats表3 各组大鼠膝关节软骨OARSI评分和软骨细胞凋亡率比较(n=8,)
?
2.3 各组大鼠膝关节软骨细胞凋亡情况 与Sham组比较,KOA 组大鼠膝关节软骨细胞凋亡率升高(P<0.05);与KOA组比较,EMO组大鼠膝关节软骨细胞凋亡率降低(P<0.05);与EMO 组比较,EMO+ML385 组大鼠膝关节软骨细胞凋亡率升高(P<0.05),见表3、图3。
2.4 各组大鼠膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2 mRNA 相对表达水平比较 与Sham组比较,KOA 组大鼠膝关节软骨组织中MMP-3、MMP-13、PTGS2 mRNA 相对表达水平升高,COL2A1 mRNA 相对表达水平降低(P<0.05);与KOA 组比较,EMO 组大鼠膝关节软骨组织中MMP-3、MMP-13、PTGS2 mRNA 相对表达水平降低,COL2A1 mRNA 相对表达水平升高(P<0.05);与EMO 组比较,EMO+ML385 组大鼠膝关节软骨组织中MMP-3、MMP-13、PTGS2 mRNA 相对表达水平升高,COL2A1 mRNA 相对表达水平降低(P<0.05),见表4。
Tab.4 Comparison of MMP-3,MMP-13,COL2A1 and PTGS2 mRNA relative expression levels in knee joint cartilage between the four groups of rats表4 各组大鼠膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2 mRNA相对表达水平比较(n=8,)
?
2.5 各组大鼠膝关节软骨组织中MDA、ROS、GSH、Fe2+水平比较 与Sham 组比较,KOA 组大鼠膝关节软骨组织中MDA、ROS、Fe2+水平升高,GSH 水平降低(P<0.05);与KOA组比较,EMO组大鼠膝关节软骨组织中MDA、ROS、Fe2+水平降低,GSH 水平升高(P<0.05);与EMO 组比较,EMO+ML385 组大鼠膝关节软骨组织中MDA、ROS、Fe2+水平升高,GSH 水平降低(P<0.05),见表5。
Tab.5 Comparison of MDA,ROS,GSH and Fe2+levels in knee joint cartilage of rats between the four groups表5 各组大鼠膝关节软骨组织中MDA、ROS、GSH、Fe2+水平比较(n=8,)
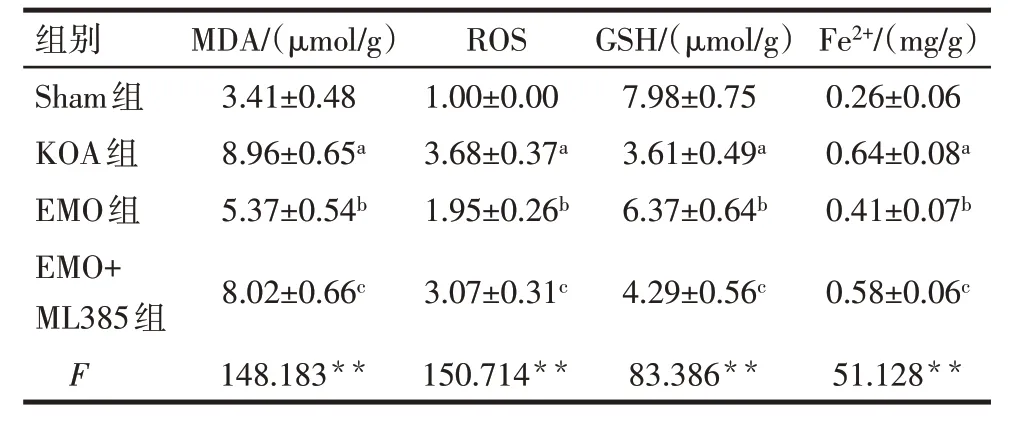
Tab.5 Comparison of MDA,ROS,GSH and Fe2+levels in knee joint cartilage of rats between the four groups表5 各组大鼠膝关节软骨组织中MDA、ROS、GSH、Fe2+水平比较(n=8,)
?
2.6 各组大鼠膝关节软骨组织中GPX4、ACSL4 阳性细胞比例比较 Sham 组可见大量呈棕褐色或棕黄色的GPX4 阳性细胞,少量呈棕褐色或棕黄色的ACSL4 阳性细胞;与Sham 组比较,KOA 组大鼠膝关节软骨组织中GPX4 阳性细胞比例降低,ACSL4 阳性细胞比例升高(P<0.05);与KOA组比较,EMO组大鼠膝关节软骨组织中GPX4 阳性细胞比例升高,ACSL4 阳性细胞比例降低(P<0.05);与EMO 组比较,EMO+ML385 组大鼠膝关节软骨组织中GPX4 阳性细胞比例降低,ACSL4 阳性细胞比例升高(P<0.05),见表6、图4。
Tab.6 Comparison of the proportion of GPX4 and ACSL4 positive cells in knee joint cartilage between the four groups of rats表6 各组大鼠膝关节软骨组织中GPX4、ACSL4阳性细胞比例比较(n=8,%,)
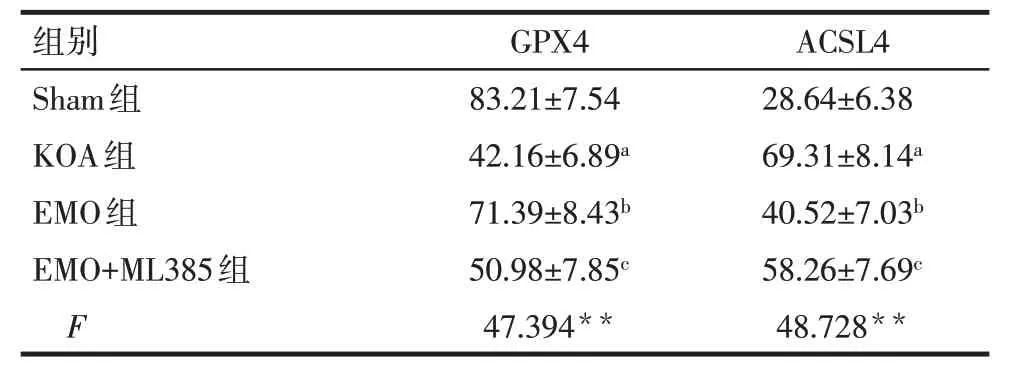
Tab.6 Comparison of the proportion of GPX4 and ACSL4 positive cells in knee joint cartilage between the four groups of rats表6 各组大鼠膝关节软骨组织中GPX4、ACSL4阳性细胞比例比较(n=8,%,)
?
2.7 各组大鼠膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2 蛋白相对表达水平比较 与Sham组比较,KOA 组大鼠膝关节软骨组织中MMP-3、MMP-13、PTGS2蛋白相对表达水平升高,COL2A1蛋白相对表达水平降低(P<0.05);与KOA 组比较,EMO 组大鼠膝关节软骨组织中MMP-3、MMP-13、PTGS2蛋白相对表达水平降低,COL2A1蛋白相对表达水平升高(P<0.05);与EMO 组比较,EMO+ML385组大鼠膝关节软骨组织中MMP-3、MMP-13、PTGS2蛋白相对表达水平升高,COL2A1蛋白相对表达水平降低(P<0.05),见图5、表7。
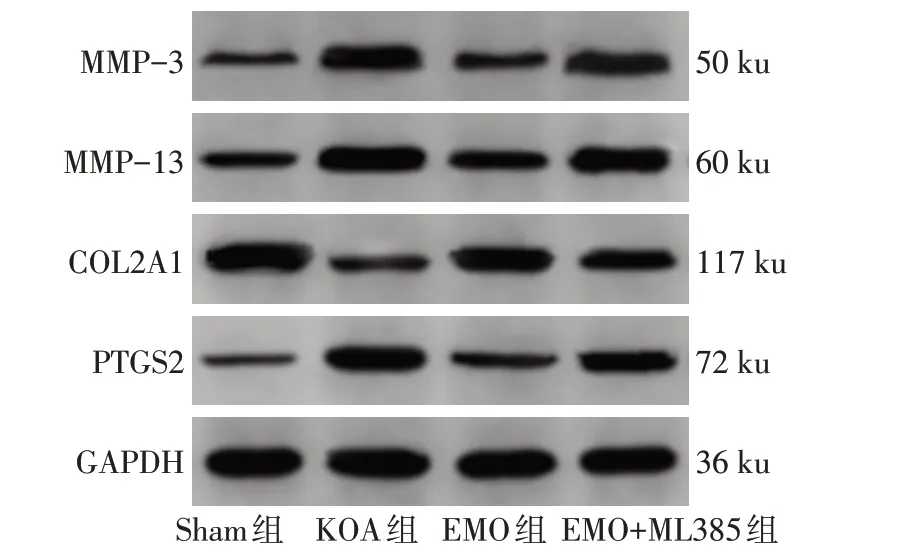
Fig.5 Protein expression of MMP-3,MMP-13,COL2A1 and PTGS2 in knee joint cartilage of rats in each group图5 各组大鼠膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2蛋白表达
Tab.7 Comparison of the protein relative expression levels of MMP-3,MMP-13,COL2A1 and PTGS2 in knee joint cartilage between the four groups of rats表7 各组大鼠膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2蛋白相对表达水平比较(n=8,)
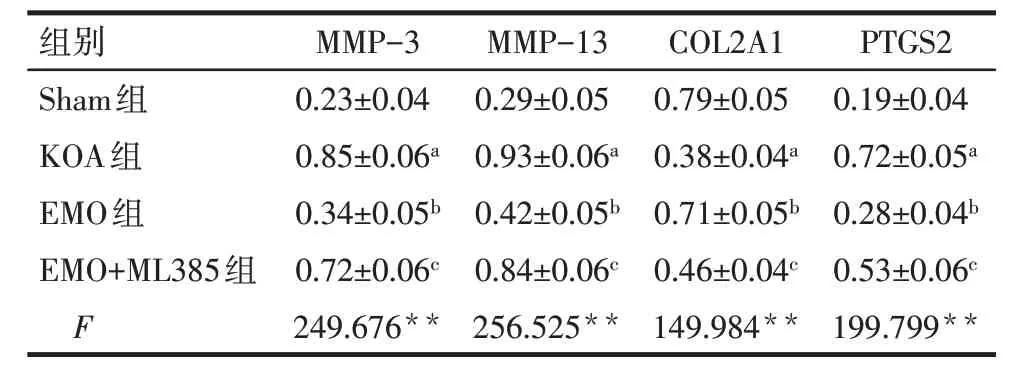
Tab.7 Comparison of the protein relative expression levels of MMP-3,MMP-13,COL2A1 and PTGS2 in knee joint cartilage between the four groups of rats表7 各组大鼠膝关节软骨组织中MMP-3、MMP-13、COL2A1、PTGS2蛋白相对表达水平比较(n=8,)
?
2.8 各组大鼠膝关节软骨组织中GPX4、ACSL4、Nrf2、HO-1 蛋白相对表达水平比较 与Sham 组比较,KOA 组大鼠膝关节软骨组织中GPX4、胞质Nrf2蛋白相对表达水平降低,ACSL4、胞核Nrf2、HO-1蛋白相对表达水平升高(P<0.05);与KOA 组比较,EMO 组大鼠膝关节软骨组织中GPX4、胞核Nrf2、HO-1 蛋白相对表达水平升高,ACSL4、胞质Nrf2 蛋白相对表达水平降低(P<0.05);与EMO 组比较,EMO+ML385 组大鼠膝关节软骨组织中GPX4、胞核Nrf2、HO-1 蛋白相对表达水平降低,ACSL4、胞质Nrf2蛋白相对表达水平升高(P<0.05),见图6、表8。
Tab.8 Comparison of the protein relative expression levels of GPX4,ACSL4,Nrf2 and HO-1 in knee joint cartilage of rats between the four groups表8 各组大鼠膝关节软骨组织中GPX4、ACSL4、Nrf2、HO-1蛋白相对表达水平比较(n=8,)
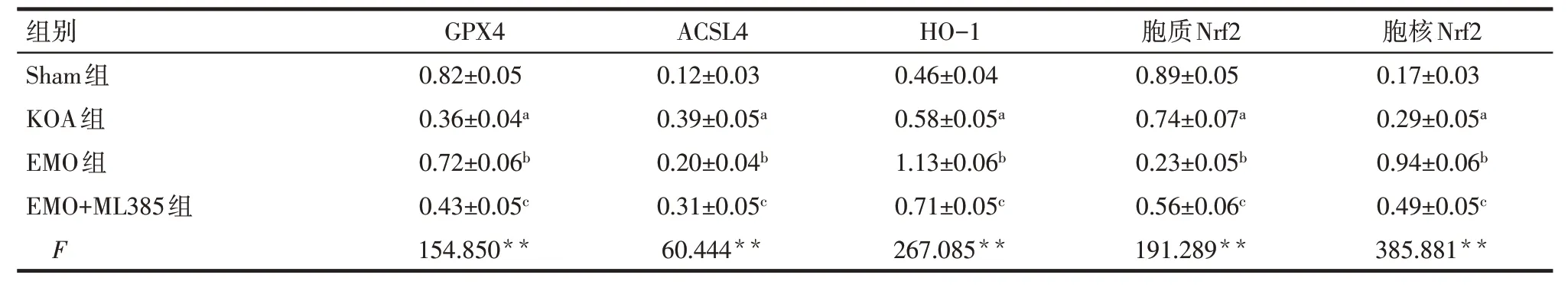
Tab.8 Comparison of the protein relative expression levels of GPX4,ACSL4,Nrf2 and HO-1 in knee joint cartilage of rats between the four groups表8 各组大鼠膝关节软骨组织中GPX4、ACSL4、Nrf2、HO-1蛋白相对表达水平比较(n=8,)
?
3 讨论
KOA 为一种退行性慢性关节疾病,主要损害关节软骨,导致关节周围疼痛、肿胀和僵硬,是诱发残疾主要原因,且随着人口老龄化和肥胖患病率的增加,其患病率亦逐渐升高[10]。研究显示,大黄素在体外和体内均可通过抑制NF-κB 和Wnt/β-catenin 信号通路改善KOA 中软骨退化[11]。大黄素通过抑制ERK 和Wnt/β-catenin 通路下调软骨细胞中一系列炎症介质的表达,促进软骨细胞增殖[12]。大黄素可减少软骨基质的降解,保护膝关节软骨[4]。此外,炎症反应在KOA的发病机制中起重要作用,受损的软骨细胞、滑膜细胞可在炎性因子诱导下释放炎性介质和酶类等,从而加速软骨细胞外基质(extracellular matrix,ECM)降解和软骨损伤、退化,故KOA发生时表现为软骨组织、关节液及血清中炎性介质均呈高水平[13-14]。本研究结果显示,KOA 模型大鼠血清炎性介质(TNF-α、NO、PGE2)水平以及膝关节软骨组织OARSI评分、ECM降解酶(MMP-3、MMP-13)mRNA 和蛋白相对表达水平较Sham 组升高,同时软骨细胞分泌的ECM 主要成分COL2A1 的mRNA 和蛋白相对表达水平降低,且膝关节软骨明显破坏;而大黄素可降低KOA 大鼠血清TNF-α、NO、PGE2 水平以及OARSI 评分,抑制MMP-3、MMP-13表达并促进COL2A1表达,同时明显改善膝关节软骨破坏,表明大黄素可减轻炎症反应,缓解软骨基质降解,进而对KOA大鼠膝关节软骨发挥保护作用,与既往研究结果[4,11-12]相一致。
软骨细胞作为关节软骨中唯一的细胞组成成分,主要通过平衡ECM的合成和降解来维持软骨的完整,故软骨细胞损伤是骨关节炎进展中的一个重要问题。研究表明,软骨细胞铁死亡可促进骨关节炎的进展[15]。在铁死亡途径中,铁依赖性的MDA等脂质过氧化物的生成、细胞内GSH消耗和ROS的蓄积是铁死亡的必要条件和基本特征,PTGS2、GPX4、ACSL4等是铁死亡的关键调节因子[16]。本研究结果显示,KOA 模型大鼠膝关节软骨细胞凋亡率以及组织中MDA、ROS、Fe2+水平、PTGS2 mRNA和蛋白相对表达、ACSL4 阳性细胞比例和蛋白相对表达水平均升高,同时GSH水平、GPX4阳性细胞比例和蛋白表达水平降低,表明本研究构建的KOA模型大鼠膝关节软骨细胞发生铁死亡。大黄素干预治疗后,KOA大鼠膝关节软骨细胞凋亡率及MDA、ROS、Fe2+水平和PTGS2、ACSL4表达均降低,同时GSH水平、GPX4表达升高,表明大黄素对KOA大鼠膝关节软骨细胞铁死亡具有一定改善作用,提示大黄素可能通过抑制KOA 大鼠软骨细胞铁死亡,减轻膝关节软骨退化,进而发挥保护膝关节软骨作用。李哲等[17]通过生物信息学分析与实验验证亦发现,靶向抑制铁死亡或许是一种较快且有效延缓骨关节炎中软骨退变的方法。
研究表明,药用植物及其次级代谢产物可通过NF-κB、Nrf2等信号通路以及细胞凋亡、焦亡和铁死亡等细胞死亡模式,发挥抗KOA作用[18]。Nrf2/HO-1 信号通路是机体调节氧化应激的重要信号通路,正常情况下,Nrf2 与其抑制蛋白Keap1 以二聚体形式存在于细胞质中,而当其受到外界不利环境刺激后,Nrf2与Keap1解离活化,进入细胞核,促进SOD、HO-1 等Nrf2 下游:靶基因表达,发挥抗氧化作用[19]。研究显示,激活Nrf2/HO-1 信号通路能够保护滑膜细胞并减轻KOA[20]。此外,激活Nrf2/HO-1信号通路能够抑制2型糖尿病性骨质疏松症中高糖诱导的成骨细胞铁死亡[21]。本研究中,KOA模型大鼠膝关节软骨组织中胞核Nrf2、HO-1蛋白相对表达水平升高,同时胞质Nrf2蛋白相对表达水平降低,表明KOA 发生后Nrf2/HO-1 信号通路被激活,缓解了膝关节软骨组织氧化应激损伤,但其抗氧化应激能力有限,所以膝关节软骨组织仍存在较严重的病理损伤。大黄素干预治疗后,KOA 大鼠膝关节软骨组织中胞核Nrf2、HO-1 蛋白相对表达水平进一步升高,同时胞质Nrf2蛋白相对表达水平进一步降低,表明大黄素可能通过促进KOA 大鼠膝关节软骨组织中Nrf2/HO-1信号通路激活,抑制软骨细胞铁死亡。另有文献报道,大黄素通过激活Nrf2/HO-1 通路减轻炎症和氧化应激,保护败血症相关的肠黏膜屏障损伤[22]。ML385 既是Nrf2 的特异性抑制剂,也是铁死亡的激活剂[23]。本研究进一步分析发现,ML385可抑制Nrf2/HO-1 通路激活,减弱大黄素对KOA 大鼠膝关节软骨组织损伤和软骨细胞铁死亡的改善作用。以上这些结果表明,大黄素可能通过激活Nrf2/HO-1 通路抑制软骨细胞铁死亡,保护KOA 大鼠膝关节软骨。
综上所述,大黄素可抑制KOA大鼠软骨细胞铁死亡,保护膝关节软骨,其作用机制可能与促进Nrf2/HO-1 信号通路激活有关。大黄素是一种很有前景的预防和治疗KOA的药物,但本研究仅通过体内动物实验进行了初步验证,后续将就软骨组织和关节液中炎性介质水平等进行深入分析。

