马钱子苷抑制CXCL12/CXCR4信号通路对腰椎间盘突出症大鼠疼痛反应的影响
乔松,胡艳平,何生华
腰椎间盘突出症(lumbar disc herniation,LDH)是腰痛和神经放射性腿疼的常见原因,具有病程长、易复发的特点,严重影响患者生活质量[1]。LDH 主要是由于腰神经根受到机械性压迫或髓核局部炎症引起,炎性介质可引起胶质细胞激活及炎性因子、趋化因子的释放,导致神经病理性疼痛的产生[2]。CXC 趋化因子配体12(CXC chemokine ligand 12,CXCL12)又称基质细胞衍生因子-1(stromal cellderived factor-1,SDF-1),主要来源于活化的神经胶质细胞,可与其特异性受体CXC 趋化因子受体4(CXC chemokine receptor 4,CXCR4)结合并激活下游通路,参与神经系统功能的调节[3]。研究显示,CXCL12/CXCR4通路参与脊神经结扎诱导的神经性疼痛,使用CXCL12 中和抗体或CXCR4 拮抗剂AMD3100可抑制神经性疼痛的发生,减少脊髓背角中星形胶质细胞标志物——胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP)和小胶质细胞标志物——离子钙结合衔接分子1(ionized calcium binding adapter molecule 1,Iba-1)的表达[4]。马钱子苷(loganin)是从中药山茱萸中提取的环烯醚萜苷类化合物,具有抗炎、抗氧化和保护神经元的作用[5]。研究显示,马钱子苷可抑制氧化应激和核因子κB(nuclear factor kappa-B,NF-κB)活化,改善糖尿病神经病变介导的疼痛,从而改善神经性疼痛[6]。本研究基于CXCL12/CXCR4 信号通路,探讨马钱子苷治疗神经性疼痛的分子机制。
1 材料与方法
1.1 材料 (1)实验动物。6~8 周龄SPF 级SD 雄性大鼠50只,体质量210~230 g,购自河南省实验动物中心,动物生产许可证号:SCXK(豫)2022-0001,动物饲养于温度25 ℃,相对湿度55%的环境中,12 h 昼、夜循环照明,保持环境通风整洁,大鼠正常饮食水。(2)主要试剂与仪器。马钱子苷(纯度:98%)购自Sigma公司;CXCL12及CXCR4拮抗剂AMD3100购自MedChemExpress 公司;大鼠肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-1β、IL-6 酶联免疫吸附试验(ELISA)试剂盒购自上海酶联生物科技有限公司;CXCL12、CXCR4、NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)、胱天蛋白酶1(caspase-1)、IL-1β、Iba-1 及异硫氰酸荧光素(FITC)标记的IgG 二抗购自Abcam 公司。BME-403 Von Frey 纤维丝测痛仪、BME-410C 全自动热痛刺激仪(中国医学科学院生物医学工程研究所);iMark680 多功能酶标仪(美国Bio-Rad 公司);BX53 荧光显微镜(日本Olympus 公司);ST8R 高速离心机(美国Thermo Scientific公司)。
1.2 研究方法
1.2.1 实验动物分组及模型制备 大鼠适应性饲养1周后,将50 只大鼠按随机数字表法抽取10 只为假手术组(Sham组),其余40 只大鼠制备LDH 模型[7],腹腔注射戊巴比妥钠(40 mg/kg)麻醉,于背部正中切开约4 cm 皮下组织,暴露双侧L4—L5椎板并切除半椎板,暴露L5神经根,从尾椎间盘取出约10 mg 髓核置于L5 神经根上,避免压迫,术后每日于臀大肌注射40万U青霉素预防感染,连续给药3 d。Sham组大鼠切开皮肤后仅暴露L4—L5椎板。
造模成功后,将40 大鼠随机分为Model 组、CXCR4 拮抗剂组(AMD3100 组)、马钱子苷组、马钱子苷+CXCL12 组,每组10 只。AMD3100 组给予大鼠鞘内注射20 μg 的AMD3100,马钱子苷组给予大鼠5 mg/kg 的马钱子苷腹腔注射,马钱子苷+CXCL12 组同时给予大鼠腹腔注射5 mg/kg 的马钱子苷及鞘内注射250 ng 的CXCL12,给药剂量参照文献[5,8],Sham 组与Model 组大鼠同时腹腔注射及鞘内注射等量的生理盐水,每天1次,连续给药2周。
1.2.2 大鼠热撤足反应潜伏期检测 分别于造模后1 d及治疗后3、7、14 d,采用红外辐射测温法评估大鼠热撤足反应潜伏期,将大鼠置于玻璃笼中1 h以适应环境,玻璃表面温度保持在30 ℃,在右后爪下方放置辐射热源,使用足底镇痛仪测定30 s内的热撤足反应潜伏期,测量3次,取平均值。
1.2.3 机械性撤足阈值检测 分别于造模后1 d 及治疗后3、7、14 d,使用BME-410C 全自动热痛刺激仪检测机械性撤足阈值,以von Frey 纤维丝(2.5~50 g)刺激大鼠右肢足底二、三跖骨处,每次刺激测试间隔5 min,连测3次,取平均值。
1.2.4 脊髓背角组织形态学观察 麻醉处死大鼠,取L4—L6节段脊髓背角组织,每组随机抽取5 只大鼠脊髓背角组织,4%多聚甲醛固定,石蜡包埋并切片(4 μm),HE染色,显微镜下观察脊髓背角组织形态学变化。剩余大鼠脊髓背角组织置于液氮中保存。
1.2.5 ELISA 法检测脊髓背角组织TNF-α、IL-1β、IL-6 水平 取50 mg 脊髓背角组织,按照质量体积比1∶9 的比例加入生理盐水,匀浆后,以离心半径10 cm,5 000 r/min 离心20 min,留取上清液于-20 ℃保存,参照试剂盒说明书检测上清液中TNF-α、IL-1β、IL-6水平。
1.2.6 免疫荧光染色检测脊髓背角组织小胶质细胞的激活情况 取液氮中保存的脊髓背角组织,切成10 μm 的切片,室温干燥后,使用丙酮在4 ℃条件下固定10 min,磷酸盐缓冲液(PBS)洗涤后,加入1.2%过氧化氢孵育30 min,再使用0.3% Triton X-100 透化30 min,加入Iba-1 抗体(1∶100 稀释),4 ℃孵育过夜,再加入FITC标记的IgG二抗(1∶100)室温孵育1 h,荧光显微镜下观察并拍照。
1.2.7 Western blot 检测脊髓背角组织蛋白表达 取冻存的脊髓背角组织,研磨后加入RIPA裂解液提取组织总蛋白,二辛可宁酸(dicinchonic acid,BCA)法检测蛋白浓度,十二烷基磺酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离并转膜;封闭后加入CXCL12、CXCR4、NLRP3、caspase-1、IL-1β、β-actin抗体稀释液(1∶1 000),4 ℃孵育过夜;洗涤后,加入二抗(1∶2 000)室温孵育1 h。采用Image-Quant 软件分析CXCL12、CXCR4、NLRP3、caspase-1、IL-1β 蛋白相对表达量,以βactin为内参。
1.3 统计学方法 采用SPSS 25.0软件进行数据分析。符合正态分布的计量资料以表示,多组间比较采用单因素方差分析,组间多重比较行LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组大鼠热撤足反应潜伏期、机械性撤足阈值比较 建模后1 d,与Sham组比较,其余组大鼠热撤足反应潜伏期、机械性撤足阈值降低(P<0.05)。在治疗后3 d、7 d 及14 d,与Sham 组比较,Model 组大鼠热撤足反应潜伏期、机械性撤足阈值降低(P<0.05),与Model 组比较,AMD3100 组与马钱子苷组大鼠热撤足反应潜伏期、机械性撤足阈值升高(P<0.05);在治疗后7 d 及14 d,与马钱子苷组比较,马钱子苷+CXCL12 组大鼠热撤足反应潜伏期、机械性撤足阈值降低(P<0.05),见表1、2。
Tab.1 Comparison of incubation period of hot withdrawal reaction between the five groups of rats表1 各组大鼠热撤足反应潜伏期比较 (n=10,s,)
**P<0.01;a与Sham 组比较,b与Model 组比较,c与马钱子苷组比较,P<0.05;表2—4同。
?
Tab.2 Comparison of mechanical withdrawal threshold of rats between the five groups表2 各组大鼠机械性撤足阈值比较(n=10,g,)
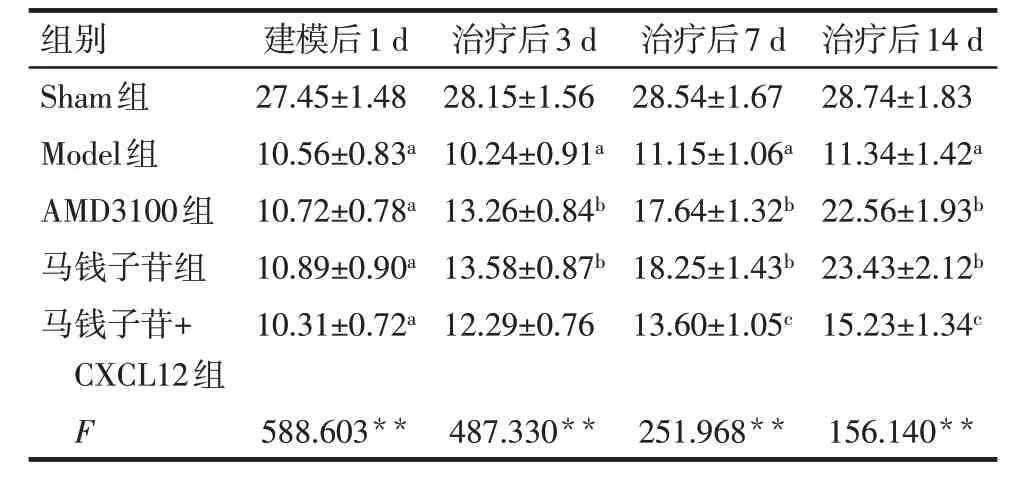
Tab.2 Comparison of mechanical withdrawal threshold of rats between the five groups表2 各组大鼠机械性撤足阈值比较(n=10,g,)
?
2.2 各组大鼠脊髓背角组织形态学变化 Sham 组脊髓背角组织结构完整,细胞形态规则,核仁清晰可见,胞浆内尼氏小体颗粒丰富;Model 组脊髓背角组织损伤严重,炎性细胞浸润,细胞形态不规则,核仁及轮廓不清,胞浆中尼氏小体排列不均匀,胞浆呈空泡样变化;AMD3100组与马钱子苷组脊髓背角组织损伤明显改善,细胞形态尚规则,细胞核边缘与核仁较为清晰,胞浆内尼氏小体分布较为均匀,有少量细胞固缩、坏死;马钱子苷+CXCL12 组脊髓背角组织较马钱子苷组病理损伤加重,炎性细胞增多,细胞形态不规则,细胞核边缘模糊,见图1。
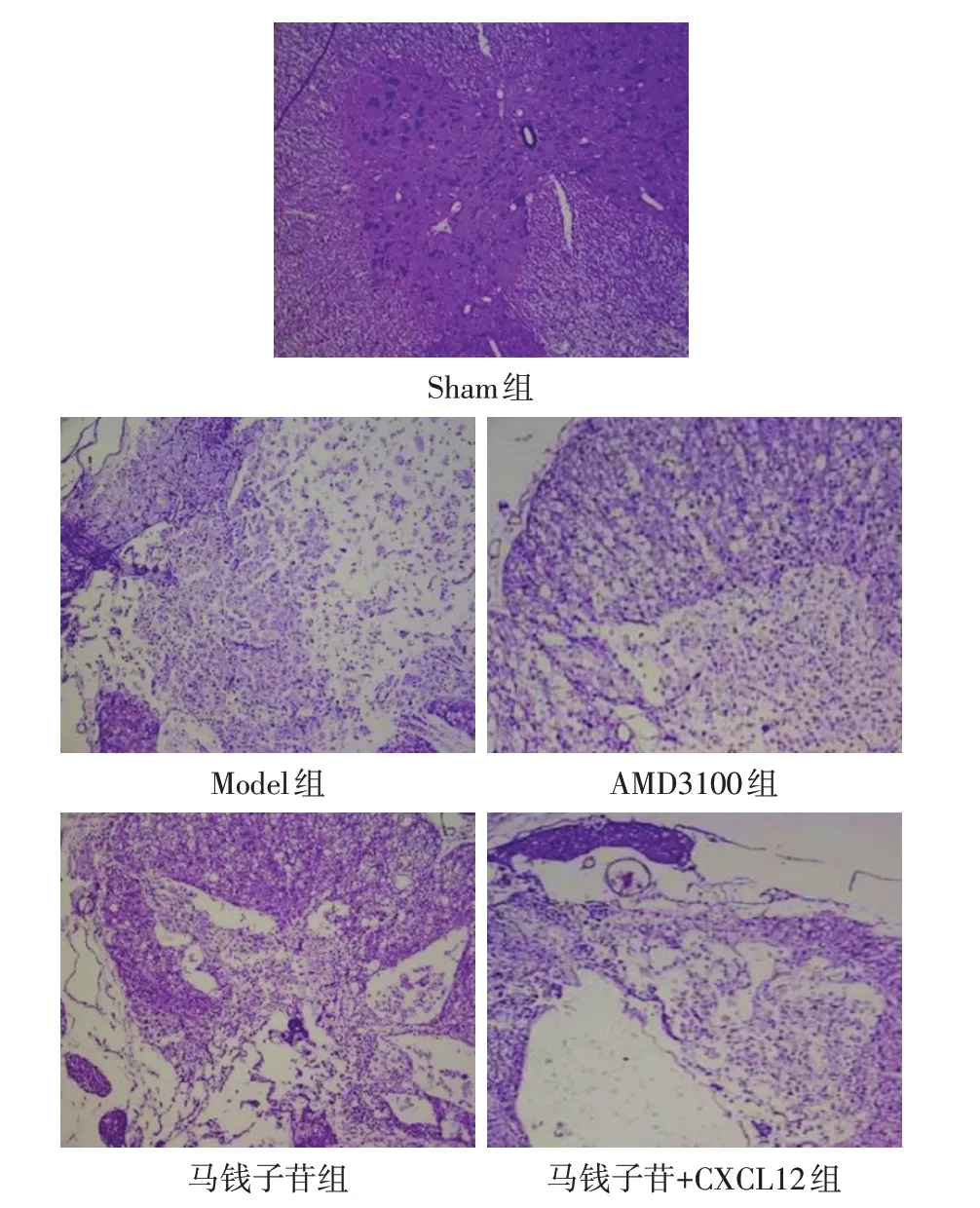
Fig.1 Histomorphologic changes of spinal dorsal horn in five groups(HE staining,×100)图1 各组脊髓背角组织形态学变化(HE染色,×100)
2.3 各组大鼠脊髓背角组织小胶质细胞活化情况比较 与Sham组比较,Model组绿色荧光增加,Iba-1阳性表达增多;与Model组比较,AMD3100组与马钱子苷组Iba-1 阳性表达减少;与马钱子苷组比较,马钱子苷+CXCL12组绿色荧光增多,Iba-1阳性表达增加,见图2。
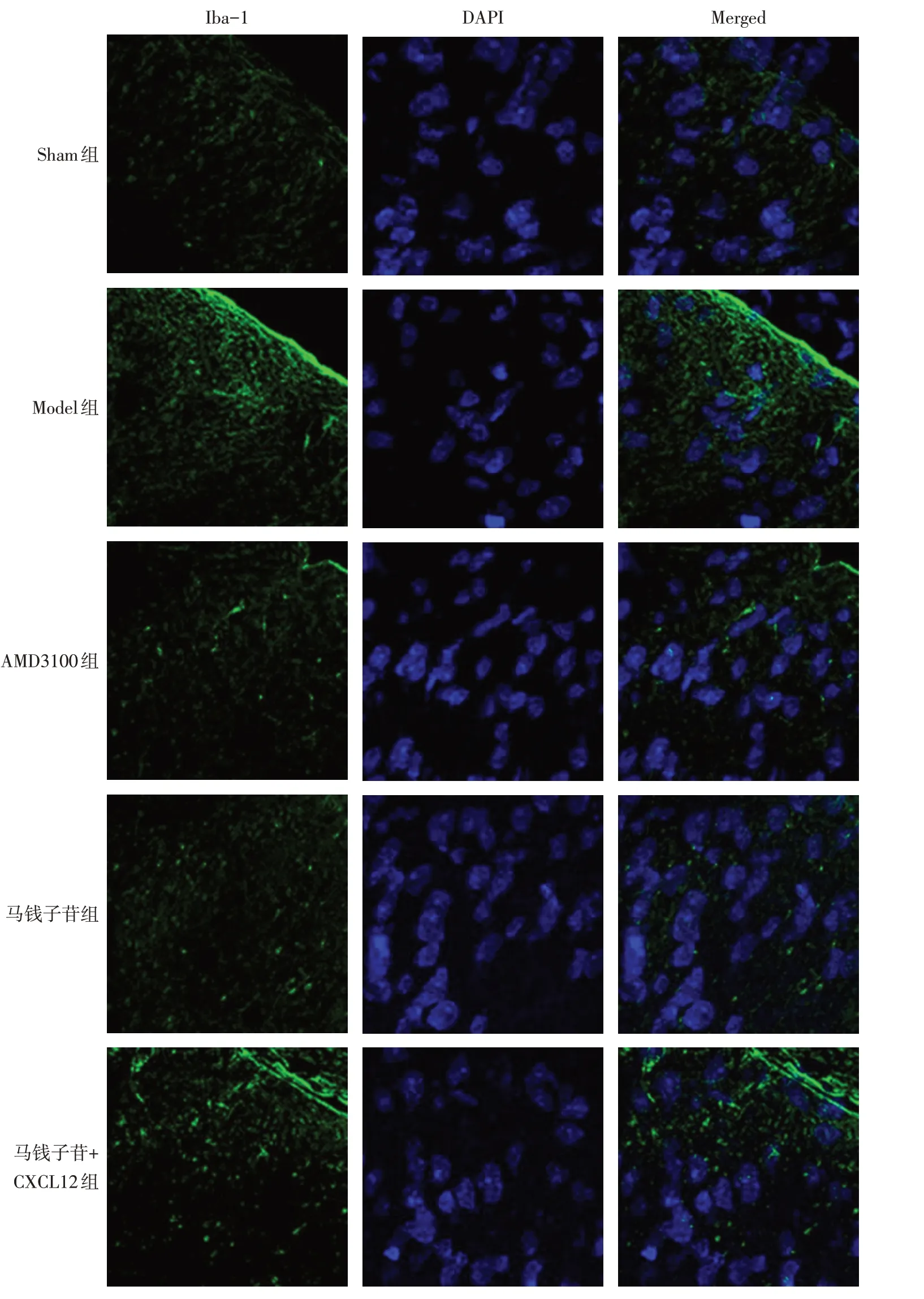
Fig.2 Activation of microglia in each group(immunofluorescence staining,×400)图2 各组小胶质细胞的活化(免疫荧光染色,×400)
2.4 各组大鼠脊髓背角组织TNF-α、IL-1β、IL-6水平比较 与Sham 组比较,Model 组大鼠脊髓背角组织TNF-α、IL-1β、IL-6 水平升高(P<0.05);与Model 组比较,AMD3100 组与马钱子苷组脊髓背角组织TNF-α、IL-1β、IL-6 水平降低(P<0.05);与马钱子苷组比较,马钱子苷+CXCL12 组脊髓背角组织TNF-α、IL-1β、IL-6水平升高(P<0.05),见表3。
Tab.3 Comparison of levels of TNF-α,IL-1β and IL-6 in spinal dorsal horn of rats between five groups表3 各组大鼠脊髓背角组织TNF-α、IL-1β、IL-6水平比较(n=10,ng/L,)
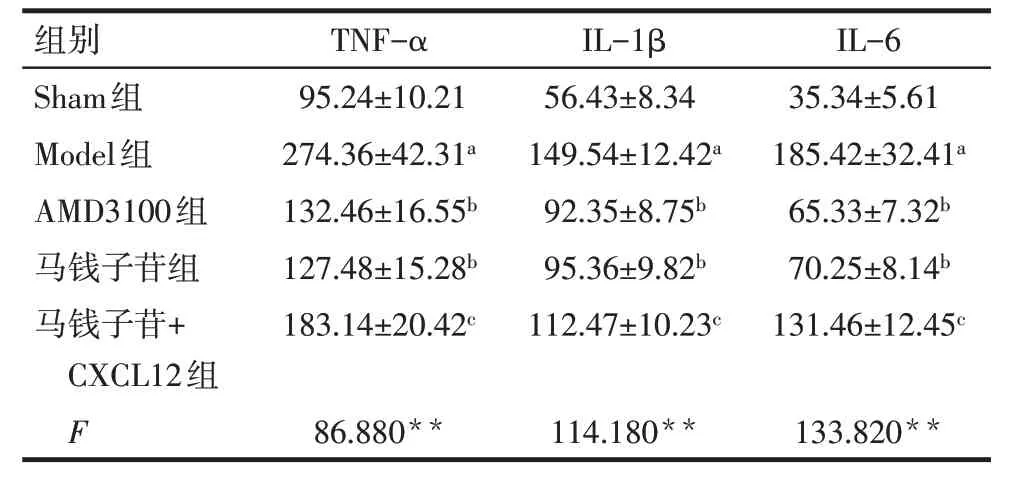
Tab.3 Comparison of levels of TNF-α,IL-1β and IL-6 in spinal dorsal horn of rats between five groups表3 各组大鼠脊髓背角组织TNF-α、IL-1β、IL-6水平比较(n=10,ng/L,)
?
2.5 各组大鼠脊髓背角组织蛋白表达 与Sham 组比较,Model 组大鼠脊髓背角组织CXCL12、CXCR4、NLRP3、caspase-1、IL-1β 表达水平升高(P<0.05);与Model 组比较,AMD3100 组与马钱子苷组CXCL12、CXCR4、NLRP3、caspase-1、IL-1β 表达水平降低(P<0.05);与马钱子苷组比较,马钱子苷+CXCL12 组CXCL12、CXCR4、NLRP3、caspase-1、IL-1β表达水平升高(P<0.05),见表4、图3。
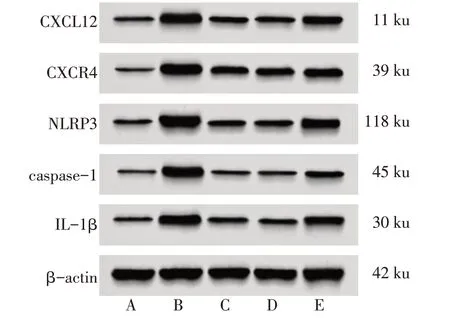
Fig.3 Expression levels of CXCL12,CXCR4,NLRP3,caspase-1 and IL-1b in spinal dorsal horn of rats in each group图3 各组大鼠脊髓背角组织CXCL12、CXCR4、NLRP3、caspase-1、IL-1β蛋白表达
Tab.4 Comparison of protein expressions of CXCL12,CXCR4,NLRP3,caspase-1 and IL-1β in spinal dorsal horn of rats between five groups表4 各组大鼠脊髓背角组织CXCL12、CXCR4、NLRP3、caspase-1、IL-1β蛋白表达比较(n=5,)
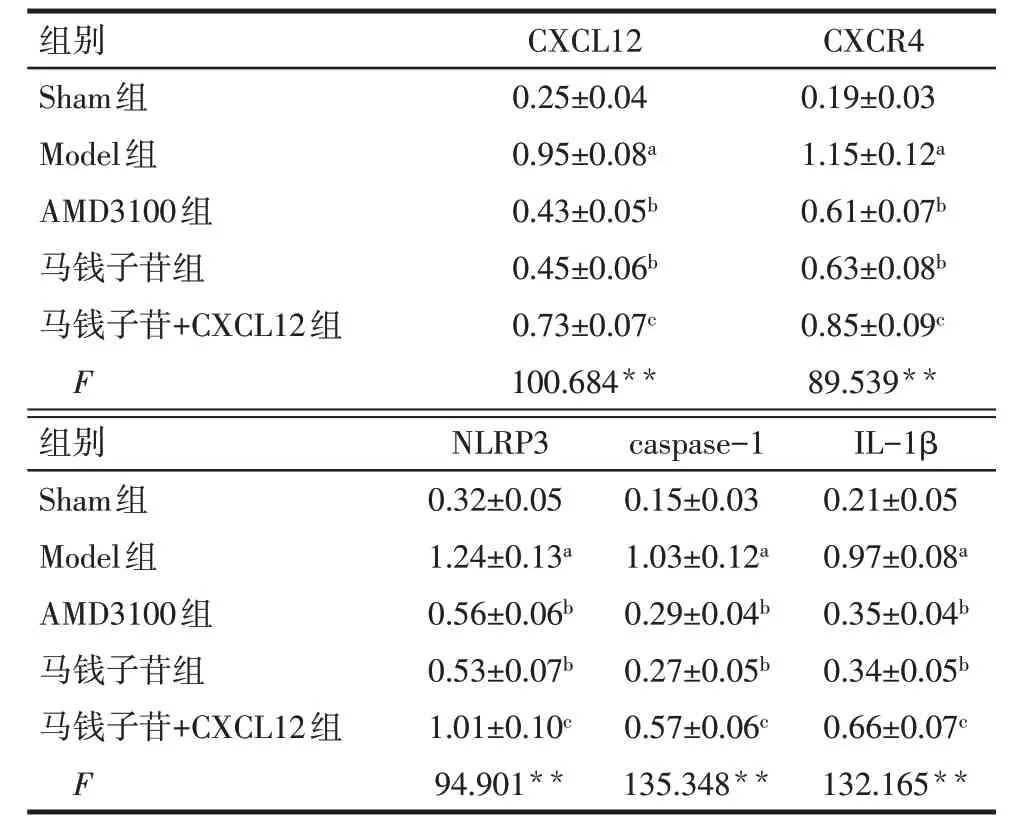
Tab.4 Comparison of protein expressions of CXCL12,CXCR4,NLRP3,caspase-1 and IL-1β in spinal dorsal horn of rats between five groups表4 各组大鼠脊髓背角组织CXCL12、CXCR4、NLRP3、caspase-1、IL-1β蛋白表达比较(n=5,)
?
3 讨论
LDH 多发于中年男性,主要表现为反复腰痛和坐骨神经痛;髓核对神经根的机械压迫是产生疼痛的主要原因,神经根在炎症状态下,可激发机体免疫反应并激活小胶质细胞,促进炎性因子释放,引发疼痛[9]。本研究显示,马钱子苷可改善LDH 大鼠疼痛反应,减轻大鼠脊髓背角组织病理损伤,降低炎性因子水平,提示马钱子苷可抑制炎症反应改善LDH大鼠疼痛反应。
小胶质细胞参与中枢神经系统的免疫反应,活化的小胶质细胞可通过分泌TNF-α、IL-1β 等促炎因子,促进神经炎症反应,引起痛觉过敏[10]。IL-6、IL-1β 等炎性因子水平变化与疼痛程度密切相关,临床上,LDH 患者经过治疗后血清中TNF-α、IL-1β等因子水平下降,神经痛缓解[11]。在LDH动物模型中,抑制脊髓小胶质细胞活化和神经炎症反应可治疗大鼠神经性疼痛[12]。马钱子苷在心血管系统、炎症性疾病与中枢神经系统疾病中具有广泛的应用[13]。据报道,马钱子苷可通过抑制NF-κB 激活,抑制促炎细胞因子TNF-α、IL-1β的释放,改善慢性压迫性损伤诱导的神经炎症和疼痛行为[14];马钱子苷还可抑制Aβ1~42诱导的小胶质细胞激活,抑制炎症反应[15]。本研究结果亦证实,使用马钱子苷干预后,大鼠脊髓背角组织小胶质细胞活化减少,同时脊髓背角组织TNF-α、IL-1β、IL-6 水平降低,提示马钱子苷可抑制小胶质细胞活化,抑制脊髓炎症反应,进而改善LDH大鼠疼痛反应。
CXCL12属于趋化因子家族,除了具有趋化淋巴细胞的作用外,还可调节神经信号传递,CXCL12 与其受体CXCR4在神经元、星形胶质细胞及小胶质细胞均有表达,CXCL12/CXCR4 通路可激活外周伤害性感觉神经元,引发痛觉敏化,在骨癌疼痛、糖尿病引起的疼痛、部分坐骨神经结扎诱导的神经疼痛中发挥重要作用[16-17]。研究显示,在脊髓损伤小鼠模型中,抑制CXCL12/CXCR4 通路可抑制星形胶质细胞的活化和炎症反应,减轻神经性疼痛[18]。Cheng等[8]研究显示,马钱子苷可通过抑制CXCL12/CXCR4 通路介导的NLRP3 炎性小体的激活来减轻坐骨神经慢性压迫损伤诱导的神经性疼痛。在本研究中,Model 组大鼠脊髓背角组织中CXCL12、CXCR4、NLRP3、caspase-1、IL-1β 表达水平较Sham组均升高,表明CXCL12/CXCR4信号通路被激活;给予马钱子苷治疗后,大鼠脊髓背角组织中CXCL12、CXCR4、NLRP3、caspase-1、IL-1β 表达水平均降低,提示马钱子苷对LDH 大鼠疼痛反应的改善作用可能与抑制CXCL12/CXCR4 信号通路激活有关。此外,CXCR4 拮抗剂AMD3100 可改善LDH 大鼠脊髓背角组织病理损伤,马钱子苷与AMD3100的作用结果一致;而在马钱子苷干预的基础上给予模型大鼠鞘内注射CXCL12 后,马钱子苷对模型大鼠疼痛反应的改善作用被明显减弱,提示马钱子苷可能通过抑制CXCL12/CXCR4 信号通路的激活,抑制小胶质细胞活化与炎症反应,改善LDH大鼠疼痛反应。
综上所述,马钱子苷可改善LDH 大鼠疼痛反应,可能与抑制CXCL12/CXCR4信号通路活性有关。本研究从体内水平初步探究了马钱子苷治疗神经性疼痛的分子机制,除CXCL12/CXCR4信号通路外,马钱子苷能否通过其他因子或通路发挥作用仍需进一步探究,在未来的研究中将结合体外细胞实验深入验证马钱子苷的作用机制。

