外源菌剂对稻秆腐解及微生物群落结构的影响
邵社刚, 李婷, 柳勇, 林兰稳, 张东, 倪栋, 李俊杰, 朱立安*
(1.交通运输部公路科学研究院,公路交通环境保护技术交通运输行业重点实验室,北京 100088;2.广东省科学院生态环境与土壤研究所,华南土壤污染控制与修复国家地方联合工程研究中心,广东省农业环境综合治理重点实验室,广州 510650)
中国是世界秸秆生产大国,2014—2018 年仅谷类秸秆年均产量为6.5×108t,其中稻谷秸秆年均产量2.1×108t,占谷类秸秆年均产量的32.3%[1]。作物秸秆具有较高的氮、磷、钾等养分,其肥料化利用具有直接替代化肥的潜力,其产量可分别直接替代中国2019 年农用氮、磷、钾肥施用量的22.5%、20.2%、142%[2]。作物秸秆还田可降低土壤容重、稳定土壤结构[3],增加土壤有机碳含量,促进土壤无机氮的生物固定[4],提高土壤总磷脂脂肪酸及细菌、放线菌生物量[5],从而改善土壤物理、化学及生物学性质,促进作物生长并提高产量[3]。但我国作物秸秆还田比例低于发达国家,还田成本高且缺乏高效还田技术[6],极大地限制了秸秆还田在农业生产中的应用。
作物秸秆主要由32%~47%纤维素、19%~27%半纤维素和5%~24%木质素组成[7]。与直接还田、燃烧还田、过腹还田等方式相比,秸秆腐熟还田不仅可有效缓解其他还田方式带来的养分供应不及时、资源浪费、环境污染等问题[8],还可加快还田秸秆腐熟下沉,利于下茬农作物的播种和定植,实现秸秆的高效利用。秸秆腐解主要靠微生物的分解作用,是秸秆本身有机碳矿化、养分释放与土壤有机碳和养分再平衡的过程[9]。促腐菌剂一般为微生物菌剂,可加速秸秆等有机废弃物的腐解[10],而其对秸秆腐解的促进作用受本身特性[11]和腐解原料[12]的影响,可改变堆体理化性质[13]和微生物群落结构[14-15],而理化性质和微生物群落结构相互关联,也影响堆体腐解。基于此,为进一步阐明外源微生物对秸秆腐解所产生的影响,本研究将0.5%促腐菌剂接种到水稻秸秆堆肥中,通过测定理化性质指标并利用高通量测序技术,分析促腐菌剂对水稻秸秆腐解过程中理化参数和微生物群落结构演替的影响,以明确水稻秸秆堆肥过程对促腐菌剂的响应,为提高水稻秸秆还田利用率提供理论支撑。
1 材料与方法
1.1 试验材料
供试水稻秸秆来自广东省中山市沙溪镇聚龙围农场,水洗烘干后粉碎过5 mm 筛,其基本理化性质为:含水率7.5%,总有机碳40.8%,全氮0.8%,全磷0.1%,碳氮比(C/N) 54.1。供试促腐菌剂由佛山金葵子植物营养有限公司提供,主要成分是多粘类芽孢杆菌、枯草芽孢杆菌、短短芽孢杆菌和地衣芽孢杆菌,均属于厚壁菌门,有效活菌数量≥0.5×108cfu·g-1。供试氮肥、磷肥分别为尿素、过磷酸钙,均为分析纯试剂。腐解试验所用容器为380 mm×280 mm×160 mm泡沫箱。
1.2 试验设计
腐解试验于2019 年5—6 月在广东省科学院生态环境与土壤研究所实验室进行。以1 000 g(干质量)水稻秸秆为腐解原料,加入尿素、过磷酸钙、去离子水,调节初始C/N、碳磷比(C/P)、含水量,使其分别为25、120、70%。试验设置2 个处理:添加0.5%促腐菌剂处理(JF)和未添加促腐菌剂对照(CK),每处理重复3 次。水稻秸秆腐解最佳初始C/N、C/P、含水量和最佳促腐菌剂施用量由课题组前期研究所得[8]。将上述材料在泡沫箱内混合均匀并放置在实验室内进行腐解,箱盖上均匀设有数个10 mm×10 mm 的通气小孔,保持室内空气流通。腐解过程中分别在培养的第0、3、8、14、28 天进行取样,采用多点取样法分次取样并混合均匀,将样品均分为2 份,分别用于理化性质和生物信息学分析。
1.3 理化性状测定
采用温度计于每日9∶00和16∶00测定堆体温度和环境温度,分别求取平均值作为当天的堆体温度和环境温度。腐解率采用称重法测定,参照姚云柯等[16]方法计算。pH 采用去离子水浸提(土液质量体积比为1∶10),用Sartorius PB-10 型酸度计和Sartorius pH/ATC 复合电极测定[17]。总有机碳(total organic carbon,TOC)采用高温外加热重铬酸钾氧化法测定[17]。全氮、全磷均通过H2SO4-H2O2消煮,分别用扩散法、钼锑抗比色法测定[18]。水溶性有机碳采用去离子水(质量体积比为1∶10)浸提,用Shimadzu TOC-V CPH 型总有机碳分析仪测定,其紫外-可见光谱参数采用北京普析TU-1950 型紫外-可见光分光光度计进行扫描测定[8]。铵态氮、硝态氮采用2 mol·L-1氯化钾(质量体积比为1∶10)浸提,SKALAR San++型连续流动分析仪测定[19]。有效磷采用0.5 mol·L-1碳酸氢钠(pH 8.5,质量体积比为1∶20)浸提,钼锑抗比色法测定[17]。
1.4 生物信息学分析
样品生物信息分析工作由上海派诺森生物科技股份有限公司完成。细菌16S rRNA 基因(v3~v4 区)使用通用引物序列为338F (5’-ACTCCTACGGGAGGCAGCA-3’)和806R (5’-GGACTACHVGGGTWTCTAAT-3’),真菌18S rRNA 基因使用通用引物序列为ITS1(5’-TCCGTAGGTGAACCTGCGG-3’)和ITS4(5’-TCCTCCGCTTATTGATATGC-3’)。样品采用MP Biomedicals FastDNAR Spin试剂盒提取总DNA,使用Illumina MiSeq 平台对群落DNA 片段进行双端(paired-end)测序,通过Vsearch方法进行序列操作分类单元 (operational taxonomic units, OTUs)聚类,然后对每个去重序列(amplicon sequence variants, ASVs)的特征序列或每个OTU 的代表序列进行物种分类学注释。依据物种分类学注释产生的ASV/OTU 丰度,利用QIIME2 (2019.4)、R 语言ggplot2 软件包等,统计每个样本中的微生物群落在各分类水平的具体组成表,计算并选取各样品在门、属分类水平上相对丰度排名前10 的物种生成堆积柱状图,以直观查看、比较各样品在不同分类水平上相对丰度较高的物种及优势微生物群落。利用QIIME2(2019.4)进行Alpha 多样性分析,计算各样品微生物群落的Chao1指数、Shannon指数、覆盖率指数,比较、检验各样品微生物群落结构的多样性和丰富度,其中Chao1 指数(C)、Shannon 指数(S)、覆盖率指数(G)的计算公式如下。
式中,Sobs是实际测得的OTUs 数量,F1和F2分别为只含1 条序列和2 条序列的OTU 数量,s是实际测得的OTU 数量,pi是OTUi所代表物种的比例,N是个体总数(所有OTU的丰度总和)。
1.5 数据处理
采用Microsoft Excel 2010 对试验数据进行统计处理,运用SPSS 21.0进行数据分析,对所有数据进行正态性和方差齐性检验。符合正态分布和方差齐次,则对同一处理不同腐解时间的差异进行单因素方差(ANOVA)分析,使用Tukey检验,反之则使用韦尔奇方差(Welch’s ANOVA)分析,使用Games-Howell 检验;对同一腐解时间不同处理的差异进行2 个独立样本t检验(t-test),P<0.05 表示差异显著。使用Canoco 5.0对理化性质和细菌、真菌在前15 个属分类水平上通过去趋势对应分析(detrending correspondence analysis, DCA)判别排序模型,梯度长度(lengths of gradient)大于4,选用典型对应模型(canonical correspondence analysis,CCA)进行排序分析。
2 结果与分析
2.1 外源促腐菌剂对稻秆腐解过程中理化性质的影响
2.1.1 温度变化 稻秆腐解过程中,堆体温度在CK、JF 处理下均表现为先升高后降低,并逐渐与环境温度持平(图1)。2个处理均在腐解第4天达到最高温度,第15 天降至环境温度水平,均不存在持续升温过程,在腐解的第0~4天为升温期,第5~14天为冷却期,第15~28天为成熟期。其中,JF处理的堆体温度在取样的第3、8 和28 天大于CK处理。
2.1.2 理化性质变化 稻秆腐解过程中,各处理下堆体腐解率和pH 动态变化见图2。堆体腐解率在2 个处理下均随腐解时间的延长呈上升趋势,在第0~8 天堆体腐解率表现为CK>JF,第14~28 天表现为JF>CK,第28 天CK、JF 堆体腐解率分别为61.1%、61.9%。2个处理下堆体pH 在腐解过程中均整体呈上升趋势,第0~8 天CK、JF 处理间pH 差异显著(P<0.05);CK 处理的pH 由第0 天的6.01 显著(P<0.05)增加至第28 天的8.13,增幅为35.2%;JF 处理的pH 在第3 天达到最大值,为8.29,随后下降再上升,第28 天为8.16,较第0 天的5.92显著(P<0.05)增加37.8%。
稻秆腐解过程中堆体理化性质和碳氮比、氮磷比随腐解时间的变化见表1、表2。腐解第8天,JF处理下有机碳含量较第0天显著(P<0.05)下降6.6%,但CK 处理下无显著差异。腐解第28 天,CK、JF 处理下堆体有机碳含量较第0 天分别显著(P<0.05)下降13.4%、17.6%,表明添加促腐菌剂可在一定程度上促进堆体有机碳的降解。腐解第28 天,CK、JF 处理下堆体全氮含量较第0 天分别显著(P<0.05)增加55.4%、48.1%,但CK、JF 处理间无显著差异,表明添加促腐菌剂不能增加腐解产物全氮含量。腐解第28 天,JF 处理下堆体全磷含量较CK 显著(P<0.05)增加8.4%,且CK、JF 处理下堆体全磷含量较第0 天分别显著(P<0.05)增加79.3%、87.5%。此外,腐解第3 和第14~28 天,堆体全磷含量表现为JF>CK,且差异显著(P<0.05),表明添加促腐菌剂可以增加稻秆腐解产物全磷含量。腐解第28 天,CK、JF 处理下堆体C/N 较第0 天分别显著(P<0.05)下降44.4%、44.3%,堆体C/P 分别显著(P<0.05)下降51.7%和56.0%,且JF 处理下堆体C/P较CK 处理显著(P<0.05)降低9.1%,表明添加促腐菌剂可以降低腐解产物C/P。
表2 腐解过程中硝态氮、铵态氮、有效磷和特征紫外吸光度的变化Table 2 Changes of -N, -N, Olsen-P and SUVA254 during the decomposing process

表2 腐解过程中硝态氮、铵态氮、有效磷和特征紫外吸光度的变化Table 2 Changes of -N, -N, Olsen-P and SUVA254 during the decomposing process
注:同列不同英文字母表示相同处理不同腐解时间间差异在P<0.05水平显著, 同列不同希腊字母表示相同腐解时间不同处理间差异在P<0.05水平显著。Note:Different English letters in same column indicate significant differences at P<0.05 level among different decomposing times under same treatment,different Greek letters indicate significant differences at P<0.05 level among different treatments under same decomposing time.
?
腐解第8 天,CK、JF 处理下堆体硝态氮含量均显著(P<0.05)增加;第28 天,2 个处理下堆体硝态氮含量差异显著(P<0.05),较第0 天分别显著(P<0.05)增加60.1%、38.8%。CK、JF 处理下堆体铵态氮含量在腐解第3 天显著(P<0.05)增加,第8~28 天又显著(P<0.05)下降,且第8~28 天堆体铵态氮含量均表现为JF>CK,且差异显著(P<0.05),说明添加促腐菌剂可以增加腐解产物铵态氮含量。腐解第28 天,CK、JF 处理下堆体有效磷含量较第0 天分别显著(P<0.05)降低82.9%、82.3%,两处理间差异不显著。腐解过程中,特征紫外吸光度(SUVA254)值呈先降后升趋势,第 0~3 天JF 处理的SUVA254值显著(P<0.05)高于CK 处理,表明JF 处理能增加堆体升温期SUVA254值。
2.2 外源促腐菌剂对稻秆腐解过程中微生物群落的影响
2.2.1 外源促腐菌剂对微生物群落丰度和多样性的影响 稻秆腐解过程中细菌、真菌群落Alpha指数变化见表3,细菌、真菌样品覆盖率变化范围分别为99.1%~99.7%、99.9%~100%,表明微生物群落检测较为完全。Chao1 指数、Shannon 指数可分别指示群落的丰度和多样性。CK处理下细菌、真菌Chao1 指数最大值出现在腐解第8 天,JF 处理下细菌、真菌Chao1 指数最大值出现在腐解第3 天,2 个处理细菌和真菌Shannon 指数最大值均出现在腐解第3 天,随后呈下降趋势,在腐解第28 天,细菌、真菌Chao1 指数和Shannon 指数均有所增加,表明细菌、真菌群落不同腐解时期表现出不同的丰度和多样性。

表3 腐解过程中细菌、真菌群落丰富度与多样性的变化Table 3 Changes of bacterial and fungal community diversity and richness indices during the decomposing process
2.2.2 外源促腐菌剂对微生物群落结构的影响分别选取在细菌、真菌门(Phylum)和属(Genus)分类水平上平均丰度排名前10 的物种生成堆积柱状图,分析各处理之间细菌、真菌群落优势物种的差异。在门分类水平上,相对丰度占优势的细菌群落分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)(图3A),其相对丰度之和占细菌16S rRNA 基因序列总数的91.4%~99.8%。其中,Proteobacteria 是整体上最占优势的门,CK、JF处理的Proteobacteria 丰度在第0~8 天呈上升趋势,第8天达到峰值,丰度分别为71.1%、76.4%,JF处理的Proteobacteria 丰度在第0~8 天较CK 高1.1%~5.2%,表明JF 可促进堆体第0~8 天Proteobacteria 繁殖。Firmicutes 丰度在升温期后迅速降低,JF 对Firmicutes 的生长繁殖无促进作用。Bacteroidetes 和Actinobacteria 丰度在腐解过程中均呈上升趋势,第3 天丰度最小,冷却期和成熟期丰度较高,JF 处理的Bacteroidetes 丰度在第28 天较CK 高1.4%,Actinobacteria 丰度在第8~28 天较CK 高9.9%~15.6%,表明JF 可促进堆体成熟期Bacteroidetes和Actinobacteria的生长繁殖。
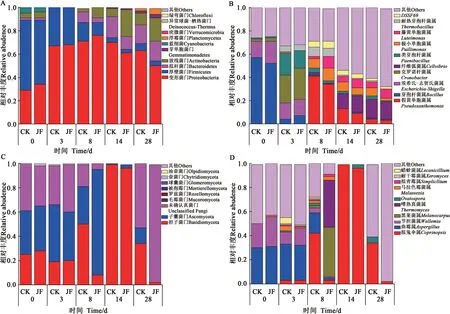
图3 细菌、真菌群落在门和属分类水平的分布特征变化Fig. 3 Analysis of distribution characteristics of bacterial and fungal communities at phylum and genus level
在属分类水平上,相对丰度占优势的前6 个细 菌 群 落 分 别 为 假 黄 单 胞 菌 属(Pseudoxanthomonas)、芽孢杆菌属(Bacillus)、埃希氏-志贺氏菌属(Escherichia-Shigella)、克罗诺杆菌属(Cronobacter)、纤维弧菌属(Cellvibrio)、类芽孢杆菌属(Paenibacillus)( 图3B),Bacillus和Paenibacillus属 Firmicutes 门 ,其 余 属 于Proteobacteria 门 。 CK、 JF 处 理 下Pseudoxanthomonas丰度在第8 天剧烈增加,达到峰值,分别为40.6%、34.2%,随后丰度下降;Escherichia-Shigella丰度峰值出现在第0 天,丰度分别为14.1%、18.6%,第3 天丰度分别为14.0%、14.2%,JF 处理下其丰度在升温期较CK 高0.3%~4.5%。Cronobacter丰度主要在0~3 d 占优势,随后丰度急剧下降,JF 处理的Cronobacter丰度在升温期较CK高1.3%~3.1%。Cellvibrio丰度在冷却期和成熟期呈上升趋势,最大值出现在第28天,CK、JF处理下丰度分别为15.7%、15.2%,JF对Cellvibrio的生长繁殖无促进作用。Bacillus和Paenibacillus丰度分别在第0和3天达到峰值,随后丰度呈下降趋势,JF 对堆体Bacillus和Paenibacillus的生长繁殖无促进作用。
门分类水平上相对丰富度占优势的真菌群落为担子菌门(Basidiomycota)、子囊菌门(Ascomycota)和未确认真菌门(Unclassified Fungi),(图3C)。CK、JF 处理的Basidiomycota 丰度在第0天分别为25.4%、27.9%,第14天分别剧烈增加至99.5%、96.5%,随后丰度降低,JF 处理下堆体升温期Basidiomycota 丰度较CK 高0.6%~2.5%,但随着腐解的进行,JF 对其生长繁殖无促进作用。CK、JF处理的Ascomycota在第8天丰度分别为30.7%、86.6%,第14 天分别降至0.5%、3.4%,JF 处理下冷却期Ascomycota 丰度较CK 高2.9%~56.1%。Unclassified Fungi 丰度在第28 天剧烈增加,CK、JF 处理下丰度分别为52.6%、97.3%,JF 处理下成熟期Unclassified Fungi 丰度较CK 高0.1%~44.7%,表明JF 可促进成熟期Unclassified Fungi 的生长繁殖。
在属分类水平上,相对丰富度占优势的前5个真菌群落分别为拟鬼伞属(Coprinopsis)、曲霉属(Aspergillus)、节担菌属(Wallemia)、黑果菌属(Melanocarpus)、嗜热真菌属(Thermomyces)(图3D)。其中,Coprinopsis、Wallemia属于Basidiomycota门,Aspergillus、Melanocarpus、Thermomyces属于Ascomycota 门。Coprinopsis丰度在第14 天剧烈增加,CK、JF 处理下丰度分别为99.4%、96.4%,随后丰度降低;Aspergillus丰度在腐解过程中呈下降趋势,JF处理对Coprinopsis、Aspergillus丰度无促进作用。Wallemia丰度随着腐解进行呈下降趋势,第0 天为最大值,CK、JF 处理下丰度分别为20.4%、24.9%,第3 天分别降至9.6%、13.5%,JF 处理下堆体升温期Wallemia丰度较CK 高3.9%~4.5%。CK、JF 处理下,堆体Melanocarpus、Thermomyces丰度在第8 天剧烈增加,分别为1.5%、40.7% 和0.3%、39.4%,与CK 处理相比,JF 处理下堆体第8 天Melanocarpus、Thermomyces丰度较CK 高39.2%、39.1%。
2.3 微生物群落结构与理化性质的相关性分析
通过典型对应分析,分析了pH、全氮、全磷、温度、有效磷等理化参数与前15 个属分类水平上细菌、真菌群落之间的相关性(图4)。就细菌而言,第1、第2 轴可分别解释其变异率的45.5%、26.1%,其中全氮(解释总方差的43.2%,P=0.002)、铵态氮(26.3%,P=0.002)、全磷(12.6%,P=0.002)、pH(3.6%,P=0.002)、有效磷(3.4%,P=0.002)、SUVA254(3.1%,P=0.004)与细菌群落的丰度和多样性显著相关,可共同解释细菌群落与环境积累变化率的92.2%。就真菌而言,第1、第2轴可分别解释其变异率的27.6%、22.7%,其中有效磷(26.7%,P=0.002)、SUVA254(11.5%,P=0.002)、C/N 比(9.5%,P=0.004)与真菌群落的丰度和多样性显著相关,可共同解释真菌群落与环境积累变化率的47.7%。腐解第8、第14、第28 天细菌群落结构表现出一定相似性,真菌群落结构在腐解过程中差异较大。
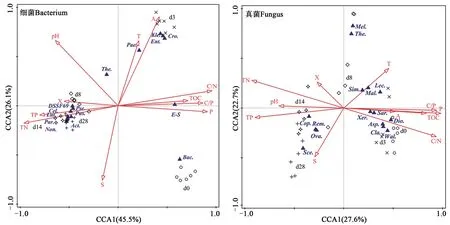
图4 属水平上微生物群落结构与理化性质的CCA分析Fig. 4 Analysis of RDA of microbial community structure and physical and chemical properties at genus level
3 讨论
在堆肥过程中,温度、pH、C/N、有机碳等参数的变化常用来检测堆肥的成熟度和质量[20]。本试验条件下,促腐菌剂可有效增加堆体全磷含量,这与李荣华等[21]研究结果一致。可归因于磷本身不易分解转化及“浓度效应”[21-22]使堆体全磷含量显著增加。促腐菌剂有助于促进堆体有机碳的降解,但未及显著程度,这与Wang 等[23]研究类似。有机碳作为微生物生长、活动的主要能量源,在堆体腐解过程中,其代谢、分解过程使大部分有机碳分解转化为CO2和H2O,从而造成碳损失[20]。堆体全磷含量显著增加而有机碳含量下降,这共同解释了堆体C/P 显著下降的原因。研究表明,SUVA254越高,有机质芳香度越高,可指示堆体有机物分子复杂程度和腐殖化程度[24]。促腐菌剂可显著增加堆体升温期SUVA254值,与唐朱睿等[25]研究结果具有相似性,表明促腐菌剂能较好促进稻秆腐解升温期非腐殖质类物质向腐殖质类物质转化[26],这可能是由于稻秆腐解升温期溶解性有机质丰富,有机质聚合作用使其芳香度增加[25]。
Alpha多样性指数中Chao1和Shannon指数可表征微生物群落多样性和丰富度,Chao1 指数越高表明微生物群落丰富度越高,Shannon 指数越高表明微生物群落多样性和异质性越高[27]。促腐菌剂处理的细菌、真菌Chao1和Shannon指数最大值均出现在第3 天,表明该阶段细菌、真菌群落最复杂。门分类水平上细菌群落Proteobacteria、Firmicutes、Bacteroidetes 和Actinobacteria 相对丰度之和占细菌16S rRNA 基因序列总数的91.4%~99.8%,与Feng 等[27]在稻秆堆肥中发现的优势细菌门类似。Proteobacteria 是相对丰度整体最占优势的门,研究表明,Proteobacteria 相对于其他微生物组分在秸秆分解中占主导地位[9],夏金利等[28]研究促腐菌剂对园林废弃物堆肥中微生物群落变化规律发现Proteobacteria 丰度最高,与本试验结果具有一致性。此外,促腐菌剂有助于堆体第0~8 天Proteobacteria 的生长繁殖,研究表明,Proteobacteria 在碳、氮循环及有机质矿化中发挥重要作用,表明该细菌群落对稻秆腐解具有关键作用[29-30]。Firmicutes 丰度在升温期后迅速降低,Liu 等[29]研究表明,Firmicutes 丰度在堆肥早期最高,但随着堆肥成熟度增加其丰度逐渐降低,与本研究结果具有一致性。究其原因在于Firmicutes为嗜热细菌[27],多在中高温阶段占据主导地位[30],通常高温阶段结束后不会存留在堆肥中[31]。Bacteroidetes 和Actinobacteria 丰度在冷却期和成熟期较高,研究表明,Bacteroidetes和Actinobacteria对高温敏感,其丰度在嗜热期呈下降趋势,在冷却期和成熟期呈上升趋势[23],这与本研究Bacteroidetes和Actinobacteria 的丰度趋势具有一致性。且促腐菌剂可促进成熟期Bacteroidetes 和Actinobacteria的生长繁殖,其中Bacteroidetes 被证实是专门降解高分子量化合物的细菌群落[29],而Actinobacteria 是重要的木质纤维素降解菌[32],可以通过诱导产生木质纤维素水解酶对木质纤维素的降解产生积极影响[28],表明促腐菌剂通过促进Bacteroidetes和Actinobacteria繁殖,有助于稻秆成熟期腐解效率的提高。本试验条件下,Bacillus和Paenibacillus丰度均在升温期达到峰值,可能由于其均属芽孢杆菌科 (Bacillaceae),研究表明,属于芽孢杆菌科的物种与较高的温度显著相关[27],故Bacillus和Paenibacillus丰度在高温阶段后大幅下降。促腐菌剂使堆体升温期Escherichia-Shigella和Cronobacter丰度均高于对照,Escherichia-Shigella、Cronobacter属于Proteobacteria 门,有助于堆体碳、氮循环及有机质矿化。
门分类水平上相对丰度占优势的真菌群落为Basidiomycota、Ascomycota、Unclassified Fungi,与Wang 等[33]在稻草猪粪共堆肥中报道的优势真菌门具有相似性。促腐菌剂可促进堆体升温期Basidiomycota 和冷却期Ascomycota 的生长繁殖,与Tian 等[34]在中草药残留物堆肥中报道的Basidiomycota、Ascomycota 丰度变化具有相似性。Wang 等[33]研究表明,Ascomycota 可促进多种纤维素酶和半纤维素酶的分泌,与Basidiomycota 是堆肥过程中主要的木质纤维素降解菌,表明促腐菌剂通过提高Basidiomycota、Ascomycota 的丰度增强升温期和冷却期堆体木质纤维素的降解。另外,腐解第14 天Basidiomycota 丰度剧烈增加而Ascomycota 丰度迅速减少,可归因于受堆肥温度、腐殖物质和分解的有机物的影响,使Basidiomycota 和Ascomycota 群落演替出现较大波动[35]。Aspergillus可促进有机物的降解,为嗜热真菌属[36],Aspergillus丰度在腐解过程中呈下降趋势,符合其嗜热特性。Melanocarpus、Thermomyces属于Ascomycota 门,可以产生木聚糖酶降解半纤维素[27],Thermomyces可以降解堆肥中的原生秸秆,是木质纤维素的重要降解物[35],促腐菌剂可促进堆体升温期Wallemia丰度和冷却期Melanocarpus、Thermomyces的生长繁殖,提高升温期和冷却期堆体木质纤维素的降解效率。
堆体腐解过程亦为微生物群落结构的演替过程,理化参数的变化对微生物的活性有直接和间接的影响,可影响微生物群落结构。典型对应分析表明,全氮是细菌群落结构变化的关键因子,与Yun 等[37]研究具有一致性,在一定程度上归因于细菌群落结构的变化受制于氮源的质量和数量[38]。有效磷、SUVA254对真菌群落结构的影响最大,已有研究表明,核苷酸和磷脂中磷的代谢与真菌群落的发育密切相关[39]。SUVA254可指示堆体有机质的芳香程度,而真菌群落在堆肥过程中对有机质降解和碳循环起着关键作用[40],这在一定程度上解释了SUVA254对真菌群落结构的影响大于其他理化参数的原因。
综上所述,本试验条件下,添加促腐菌剂可降低稻秆腐解产物C/P,增加全磷含量,影响稻秆腐解成熟度指标;促进堆体不同腐解时期优势细菌门(Proteobacteria、Bacteroidetes、Actinobacteria)、属(Escherichia-Shigella、Cronobacter)和 优 势 真菌门(Basidiomycota、Ascomycota)、属(Wallemia、Melanocarpus、Thermomyces)的生长繁殖,从而促进稻秆腐解。理化性状对细菌和真菌群落结构影响的相关性存在差异,全氮、有效磷分别是影响细菌、真菌群落最重要的环境指标。

