小麦盐胁迫响应的代谢组学分析
姜雪敏, 陈向前, 李红燕, 姜奇彦*
(1.中国农业科学院作物科学研究所,北京 100081; 2.济宁学院生命科学与生物工程学院,山东 曲阜 273155)
全球气候变化正在进一步加速土壤盐碱化的过程[1]。盐碱胁迫是制约作物生产力的主要不利环境因素之一,世界上大面积的盐碱地严重影响小麦等作物生长[2-3]。植物对盐胁迫的响应机制可以从生理学、基因组学、转录组学、蛋白质组学、代谢组学等方面[4-7]进行分析。其中,代谢组学是继基因组学、转录组学、蛋白质组学后发展起来的一门学科[8],在基因的功能注释及细胞和分子、生物和非生物应激反应的机理解析中起着关键作用[9]。
盐渍土壤中过量的可溶性盐对大多数植物有害。高盐对植物造成渗透胁迫、离子胁迫以及氧化胁迫等二次胁迫,使植物在离子稳态、细胞活性反应等方面发生变化[10]。植物可以通过可溶性调节物质(如脯氨酸和可溶性糖)的积累增强对渗透胁迫的耐受性;通过调节Na+/K+的稳态,增加对离子毒害的耐受性;抗氧化保护系统通过清除活性氧(reactive oxygen species,ROS)增强植物对氧化胁迫的耐受性[11]。植物生长中产生的次生代谢物质(如黄酮类化合物等)参与活性氧的清除[12],可以提高其对氧化胁迫的耐受性。这些响应高盐胁迫的物质都可以通过代谢组学分析进行鉴定。另外,通过代谢组学分析还发现氨基酸代谢相关的物质的积累变化也是植物响应逆境胁迫的主要方式之一。Matsunami 等[13]报道了在聚乙二醇(PEG)6000诱导下耐旱和旱敏感水稻根系的代谢谱变化,抗旱品种IR58 的根中大多蛋白质原性氨基酸积累增加,如脯氨酸、丝氨酸、谷氨酰胺和天冬酰胺等,另外三羧酸循环中间体柠檬酸、顺式乌头酸、异柠檬酸、延胡索酸、苹果酸等也得到维持或增加,这些代谢物的增加有助于维持能量代谢和抗氧化防御等重要的生物功能,促进渗透胁迫下根系发育。Zhang 等[14]对盐胁迫下野生大豆和栽培大豆幼苗叶片代谢物质变化进行了研究,发现盐胁迫下野生大豆叶中苯丙氨酸、天冬氨酸、柠檬酸和α-酮戊二酸等含量高于栽培大豆。
植物具有复杂的调控网络应对逆境胁迫,涉及多种代谢物质的积累变化。Niu等[15]报道,与济麦19 相比,盐胁迫下抗逆转基因小麦T349 的种子中,多种氨基酸、维生素、有机酸、脂类等代谢物质的积累都发生了改变。You 等[16]对干旱胁迫下芝麻耐旱型和敏感型材料的转录组和代谢组学分析表明,在干旱胁迫下积累的重要代谢产物包括ABA、氨基酸和有机酸。Chen 等[17]研究了干旱胁迫条件下水稻叶片代谢物的变化,涉及多种游离氨基酸(脯氨酸等)、胆碱、5-羟色胺、咖啡酸、泛酸、芥子酸、Sn-甘油3 磷酸胆碱、芹菜甙元、亚麻酸、亚油酸及ABA 在内的多种植物激素等。植物代谢物包括初生代谢物和次生代谢物,前者如糖类、氨基酸类及三羧酸循环中间物质,主要参与植物的生长发育,后者如萜类、生物碱类等,主要参与植物信号转导及植物防御等[18]。
质谱鉴定技术结合广谱代谢组学分析可以靶向更多代谢物质的变化,成为解析植物逆境胁迫下代谢物变化规律的重要技术手段。本研究采用超高效液相色谱-串联质谱(ultra performance liquid chromatography tandem mass spectrometry,UPLC-MS/MS)检测技术分析NaCl 处理24 h 和正常生长条件下的小麦根和叶的靶向代谢谱变化,旨在从代谢组学层面探讨盐胁迫对小麦根和叶的影响,进一步解析小麦的耐盐机理。
1 材料与方法
1.1 材料培养
供试材料为小麦品种济麦19,由中国农业科学院作物科学研究所提供,该品种综合农艺性状优良、适应性广。参考Jiang 等[19]的方法用Hoagland 溶液培养小麦幼苗,置于(25±1)°C 恒温箱中培养。培养箱设置参数为光照强度150 μmol·m-2·s-1,光周期为14 h 光照/10 h 黑暗。小麦幼苗生长至4叶龄,用350 mmol·L-1NaCl处理24 h后,采集幼苗的根和叶,用蒸馏水冲洗3次,放入液氮中冷冻,以正常生长的植株根和叶为对照。所有样品贮存于-80°C 备用。样品编号分别标记为 CKR1、CKR2、CKR3、CKL1、CKL2、CKL3、S24R1、S24R2、S24R3、S24L1、S24L2、S24L3,表示正常生长的根(CKR)和叶(CKL)、盐处理24 h的根(S24R)和叶(S24L)的3次重复。
1.2 样品的准备和提取
将冻干的样品在混合磨机(MM400,Retsch)中用直径4 mm 钢珠在30 Hz 下研磨1.5 min。分别称取100 mg 粉末,加入1.0 mL 含有0.1 mg·L-1利多卡因(内标)的70%甲醇溶液,4 ℃下过夜提取各样品总代谢物。10 000g离心10 min 后,吸取上清,用微孔滤膜(SCAA-104, 0.22 μm 孔径;ANPEL,上海)过滤样品,并保存于进样瓶中,用于非靶向UPLC-MS/MS分析。
1.3 UPLC-MS/MS分析
数据采集仪器系统主要包括超高效液相色谱(UPLC)(Shim-pack UFLC SHIMADZU CBM30A,http://www.shimadzu.com.cn/)和串联质谱(MS/MS)(Applied Biosystems 6500 QTRAP,http://www.appliedbiosystems.com.cn/)。
1.3.1 液相条件 色谱柱为Waters ACQUITY UPLC HSS T3 C18,1.8 μm×2.1 mm×100 mm;流动相:水相为超纯水(加入0.04%的乙酸),有机相为乙腈(加入0.04%的乙酸);洗脱梯度∶水∶乙腈(体积比)0 min 为95∶5,11.0 min 为5∶95,12.0 min 为5∶95,12.1 min 为95∶5 ,15.0 min 为95∶5;流速0.4 mL·min-1;柱温40 ℃;进样量2 μL。
1.3.2 质谱条件 电喷雾离子源(electrospray ionization,ESI)源操为离子源、涡轮喷雾,源温度500 ℃;离子喷雾电压(Iron spray voltage, IS)5 500 V;离子源气体Ⅰ(ion source gas Ⅰ,GSI)、气体Ⅱ(GSⅡ)、气帘气(curtain gas, CUR)分别设为55、60和25 psi;碰撞诱导电离(collision-activated dissociation,CAD)参数设置为高。分别以10 和100 μmol·L-1聚丙烯乙二醇溶液在QQQ 和LIT 模式下进行仪器调谐和质量校准。MRM 实验中碰撞气体(氮气)设定为5 psi,完成三重四级杆(LIT and triple quadrupole, QQQ)扫描,每个离子对根据优化的去簇电压(declustering potential,DP)和碰撞能(collision energy,CE)进行扫描检测。
1.4 数据分析
对UPLC-MS/MS 原始数据转换,利用XCMS软件进行峰值选择、峰值对齐、峰值滤波和峰值填充。转换后数据中保留时间(retention time,RT)、质荷比(m/z)、观测值(样本)和峰值强度进行归一化处理。归一化数据导入SIMCA-P(11.0)进行分析,用t检验来识别差异代谢物(P<0.05),利用在线数据库 Metlin(https://metlin.scripps.edu)搜索代谢物种类。代谢通路利用MetaboAnalyst 3.0 软件分析构建。代谢物富集的通路数据从KEGG 数据库下载(P<0.05)。通过R 软件(www.r-project.org/)进行不同样本间积累模式的聚类分析。样品分为4 组:CKR、CKL、S24R 和S24L。差异代谢物筛选标准为代谢物差异倍数(fold change)≥2 和fold change≤0.5,即代谢物在相比较的两组中fold change 值为2 以上(上调)或0.5 以下(下调),则认为差异显著。根据代谢物Log2(fold change)值对4组样品的代谢物进行聚类分析。
2 结果与分析
2.1 盐胁迫响应代谢物质分析
对CKR、CKL、S24R、S24L 4组样品进行了质谱定性定量分析,共鉴定到759 个代谢物质,包含有机酸及其衍生物、黄酮、氨基酸及其衍生物、核苷酸及其衍生物等33类,每种物质占比情况详见表1。
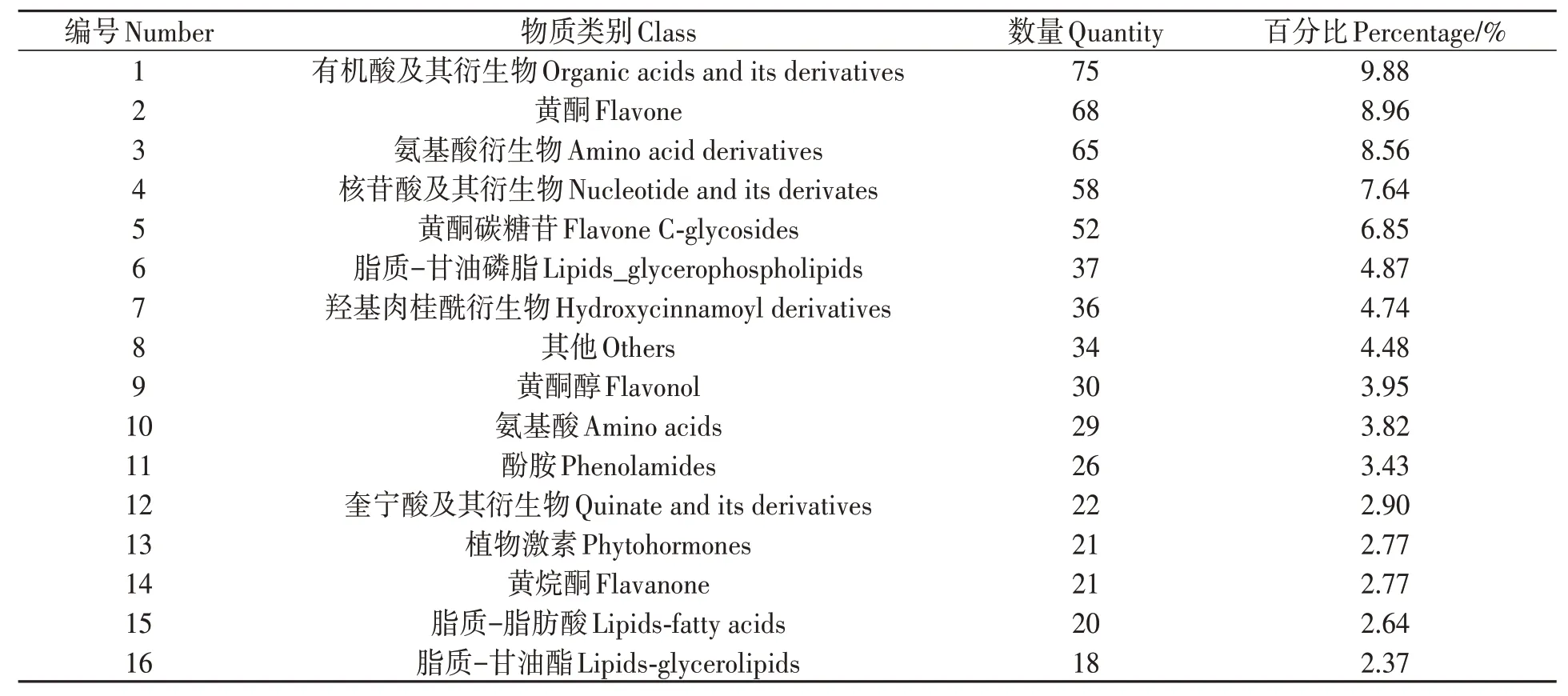
表1 本研究鉴定到的不同类别代谢物质占比情况Table 1 Proportions of different categories of metabolites identified in this study
2.2 盐胁迫对小麦根和叶代谢物质积累的影响
CKR/CKL、S24R/S24L、CKR/S24R、CKL/S24L分别比较,发现根、叶不同组织或盐胁迫处理造成不同样品间代谢物质积累差异显著(图1A)。

图1 盐胁迫下小麦根和叶中代谢物质的差异积累Fig. 1 Differential accumulation of metabolites in the roots and leaves of wheat under salt stress
2.2.1 正常和盐胁迫条件根、叶代谢物差异 正常条件下小麦根和叶之间(CKR/CKL)共有208 个差异积累代谢物,和根相比,77个在叶中下调,131个在叶中上调;盐胁迫后小麦根和叶之间(S24R/S24L)共有216个差异积累代谢物,99个在叶中下调,117个在叶中上调(图1B)。CKR/CKL和S24R/S24L比较,有163个代谢物在两组都发生变化,45个只在CKR/CKL 中出现,53 个只在S24R/S24L 中出现(图1C)。这163个差异积累代谢物中,109个在叶中正常和盐胁迫条件下都比根中积累的多,53个在叶中积累的少,D(+)-松三糖在正常生长叶中含量增加,在盐处理叶中含量下降。只在CKR/CKL 中出现的45 个差异代谢物中21 个在叶中含量增加,24 个在叶中含量下降。只在S24R/S24L中出现的53 个差异代谢物中8 个在叶中含量增加,45个在叶中含量下降。以上结果说明,根和叶由于植物组织的不同引起了代谢物积累的差异,在叶中上调的差异代谢物较多。
2.2.2 盐胁迫下根、叶代谢谱变化 和正常生长的根相比,盐处理条件下小麦根中(CKR/S24R)共207 个代谢物差异积累,其中71 个下调,136 个上调;而小麦叶片在盐处理后(CKL/S24L)共有147个代谢物差异积累,其中78 个下调,69 个上调(图1B)。CKR/S24R和CKL/S24L两组比较,即盐处理后叶片和根中共同发生差异积累的代谢物有56 个,151 个只在根中差异积累(CKR/S24R),上调101 个,下调50 个;91 个只在叶中差异积累(CKL/S24L),上调41个,下调50个(图1C)。盐胁迫条件下,和叶片相比,小麦根中差异积累的代谢物更多,且多为上调,可能由于根是最先感应土壤中盐胁迫信号的部位。而根和叶片共同发生差异积累的代谢物相对较少,根和叶片特异积累的代谢物更多,说明根和叶片响应盐胁迫的代谢谱变化不同。
2.3 差异积累代谢物的功能分析
2.3.1 根和叶差异积累的代谢物分析 无论正常生长还是盐胁迫处理,小麦根和叶片之间主要差异积累代谢物都是黄酮类化合物,占总差异积累代谢物的约50%,其次是有机酸及其衍生物、脂类物质、核苷酸及其衍生物,三者占比约为25%。黄酮类化合物主要在叶中积累,脂类物质、核苷酸及其衍生物主要在根中积累(图2A和2B)。表2中列出了根和叶中差异积累的代谢物上调和下调倍数分别排在前10 位的差异积累代谢物质,其中在叶中积累较多的主要是黄酮碳糖苷类物质,在根中积累较多的主要是香豆素及其衍生物(秦皮甲素)、羟基肉桂酰衍生物(香豆醛、氢化肉桂酸)、吲哚及其衍生物(5-甲氧基-吲哚-3-甲醛)等。
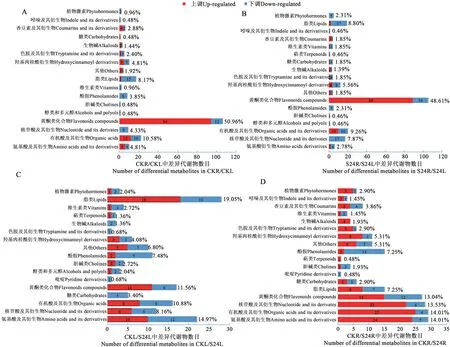
图2 差异积累代谢物种类及数目Fig. 2 Types and numbers of differentially accumulated metabolites

表2 各分组中排在前20名的差异代谢物Table 2 Differentially accumulated metabolites ranked in the top 20 in each group
2.3.2 根和叶响应盐胁迫差异积累的代谢物分析 盐胁迫处理后小麦叶中变化较多的代谢物主要有脂类物质(19.05%)、氨基酸及其衍生物(14.97%)、黄酮类化合物(11.56%)、有机酸及其衍生物(10.88%)、核苷酸及其衍生物(8.16%)等,这些类别的代谢物质在盐胁迫处理后在叶片中都是大约一半上调,一半下调。而糖类中5 个代谢物质、生物碱类中2 个代谢物质都在盐胁迫处理后下调(图2C)。具体上调或下调倍数前10 名的代谢物质种类很多,如上调的有木犀草素O-己糖基-O-葡萄糖酸、L-半胱氨酸等,下调的有3-羟基丁酸、2-脱氧核糖1-磷酸等(表2)。
盐处理后根中变化较多的代谢物主要有氨基酸及其衍生物(14.01%)、有机酸及其衍生物(14.01%)、核苷酸及其衍生物(13.53%)、黄酮类化合物(13.04%),这些代谢物质在盐处理后的根中多数上调,盐胁迫处理后多上调的还有羟基肉桂酰衍生物、色胺及其衍生物、植物激素类物质等。生物碱类中4 个代谢物质都为上调,而酚胺、胆碱类盐胁迫后在根中多为下调(图2D)。上调或下调倍数排名前10 的代谢物质多为黄酮类化合物,另外,盐胁迫处理后,3,4-二羟基杏仁酸、N-乙酰葡萄糖胺 1-磷酸两种物质在根和叶片中上调倍数都排在前10(表2)。
2.4 小麦盐胁迫响应网络
通过KEGG 富集分析发现,盐胁迫处理后,在小麦叶片中(CKL/S24L)差异积累的代谢物对应的基因被富集的KEGG 通路主要有:代谢途径(metabolic pathways)、谷胱甘肽代谢(glutathione metabolism)、半胱氨酸和蛋氨酸的代谢(cysteine and methionine metabolism),烟酸盐和烟酰胺的代谢(nicotinate and nicotinamide metabolism)、光合作用(photosynthesis)、光合生物体中的碳固定作用(carbon fixation in photosynthetic organisms)、淀粉和蔗糖代谢(starch and sucrose metabolism)、赖氨酸生物合成(lysine biosynthesis)、半乳糖代谢(galactose metabolism)等(图3A)。
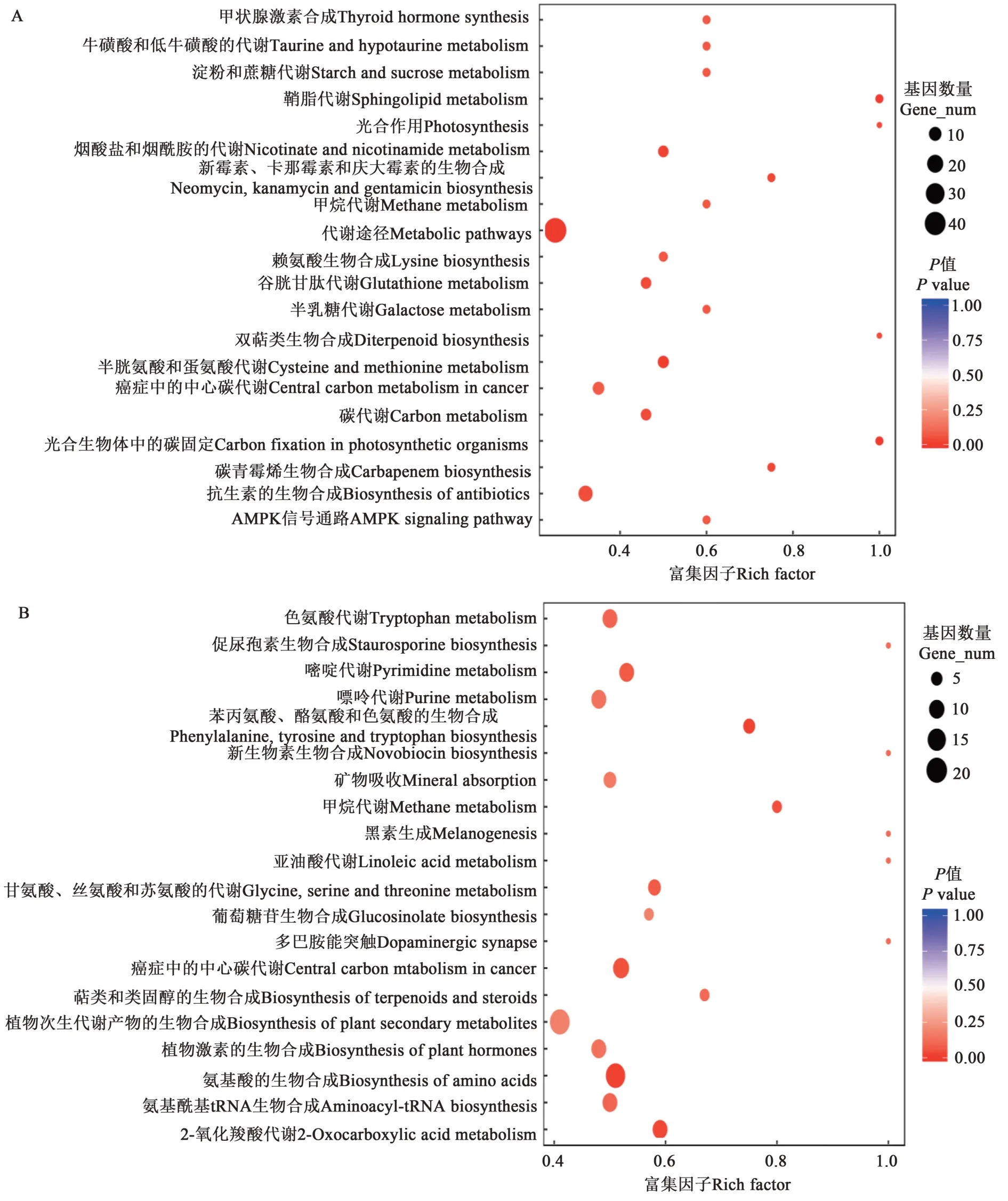
图3 不同分组中KEGG富集的20条通路Fig. 3 20 pathways enriched by KEGG in different groups
盐胁迫处理后,在小麦根(CKR/S24R)中差异积累的代谢物对应的基因被富集的KEGG 通路主要有:植物次生代谢产物的生物合成(biosynthesis of plant secondary metabolites),氨基酸的生物合成(biosynthesis of amino acids),氨基酰基tRNA生物合成(aminoacyl-tRNA biosynthesis),色氨酸代谢(tryptophan metabolism),甘氨酸、丝氨酸和苏氨酸的代谢(glycine, serine and threonine metabolism),植物激素的生物合成(biosynthesis of plant hormones),2-氧化羧酸代谢(2-oxocarboxylic acid metabolism),亚油酸代谢(linoleic acid metabolism),苯丙氨酸、酪氨酸和色氨酸的生物合成(phenylalanine, tyrosine and tryptophan biosynthesis)等(图3B)。
KEGG 各通路之间也是有关联的,如CKL/S24L中代谢途径(metabolic pathways)被富集,该通路包括本研究中抗生素生物合成(biosynthesis of antibiotics) 、谷 胱 甘 肽 代 谢(glutathione metabolism)、碳代谢(carbon metabolism)、光合作用(photosynthesis)、淀粉和蔗糖代谢(starch and sucrose metabolism)等所有差异代谢物对应的基因。参与某一代谢通路的一些基因同时也参与到其他通路中,如吲哚-3-乙酸(IAA)参与了色氨酸代谢(tryptophan metabolism)、植物激素的生物合成(biosynthesis of plant hormones)、植物激素信号转导(plant hormone signal transduction)等代谢通路。
植物响应盐胁迫涉及复杂的调控网络。如以植物呼吸代谢的糖酵解和柠檬酸循环途径为核心(图4),本研究中盐胁迫下小麦根和叶中发生变化的代谢物质由此核心向外涉及多种物质的代谢,包括氨基酸及其衍生物代谢、有机酸及其衍生物代谢、脂类物质代谢、植物激素代谢、黄酮类化合物代谢、核苷酸及其衍生物代谢等,形成了复杂的盐胁迫应答网络。如盐胁迫处理根和叶中都涉及多种氨基酸及其衍生物的变化,包括天冬氨酸、同型丝氨酸、苏氨酸、蛋氨酸、谷氨酸、瓜氨酸、鸟氨酸、组氨酸等,它们和柠檬酸循环中的有机酸及其衍生物代谢密切相连,而柠檬酸、顺乌头酸、苹果酸、延胡索酸、琥珀酸、α-酮戊二酸等在盐胁迫后也发生变化。由乙酰辅酶A衍生的多种脂类物质以及植物激素赤霉素、脱落酸在盐胁迫处理的根和叶中发生变化。由磷酸烯醇式丙酮酸衍生出来的莽草酸途径涉及氨基酸代谢、植物激素生长素代谢、黄酮类化合物代谢等途径中多种代谢物质的变化。糖类物质葡萄糖-6磷酸及果糖-6磷酸在盐胁迫下也发生变化,与它们相关的多种核苷酸及其衍生物也在盐胁迫处理后的根和叶中发生上调或下调变化。
3 讨论
3.1 根和叶代谢物质具有组织特异性
根和叶中代谢物有较大的差异,这些差异与它们各自的功能有关。本研究发现,根和叶中差异最多的代谢物为黄酮类化合物,占总差异积累代谢物的约50%,它们主要在叶中积累,这与在半枫荷[20]、狭叶柴胡[21]等植物中的研究结果一致。黄酮类化合物可以减少紫外辐射对植物造成的伤害,因此叶比根需要更多的黄酮类化合物来增强对植物保护[21]。根和叶差异较多的代谢物还包括有机酸及其衍生物、脂类物质、核苷酸及其衍生物,三者占比约25%,脂类物质和核苷酸及其衍生物主要在根中积累,它们都是植物体内重要的内源性物质,参与细胞的多种生命过程,很多脂类物质和核苷酸及其衍生物都参与信号通路转导[22],它们在根中积累可能与根接收环境信号并向植物其他组织传递信号的功能有关。通过差异积累代谢物质聚类分析也发现,正常和盐胁迫下根的差异积累代谢物质聚为一大类,正常和盐胁迫下叶的差异积累代谢物质聚为另一大类。在每一大类中,正常条件和盐胁迫处理下的3 个重复再分别聚为一小类(图1A),说明组织之间的代谢物质差异比盐胁迫处理造成的代谢物差异更大,可能根和叶片有不同的盐胁迫响应机制,但这些差异积累代谢物质是否与根和叶的这些功能相关还需要进一步验证。
3.2 小麦根和叶中多种代谢物质参与盐胁迫响应
响应盐胁迫过程中,小麦根和叶的代谢谱显著不同,其中氨基酸及其衍生物、黄酮类化合物、有机酸及其衍生物、核苷酸及其衍生物在小麦根和叶差异积累代谢物中占比约50%,除此之外,脂类物质在叶的差异积累代谢物中占比约20%。这些物质在叶中主要参与代谢途径、光合作用、碳固定作用、糖代谢等通路,在根中主要参与次生代谢、氨基酸合成等通路。
氨基酸及其衍生物自身或者作为某些物质的前体在植物抗逆过程中发挥重要作用。如本研究发生变化的脯氨酸是植物中公认的一种渗透调节物质,在多种胁迫下发挥着重要作用[23];色氨酸参与渗透调节、气孔调节和活性氧清除等过程来应答逆境胁迫[24]。而有些氨基酸(如苯丙氨酸、色氨酸、酪氨酸等芳香族氨基酸)是生物碱、黄酮类化合物、植物生长素和细胞壁成分等天然产物的前体,在植物生长和应对环境胁迫中起重要作用[23],本研究中它们在盐胁迫后的根中都上调。另外游离氨基酸的增加还可能与盐胁迫下蛋白质的降解[25]或抑制蛋白质合成有关[26]。Guo 等[27]比较了小麦抗盐碱胁迫的代谢反应和适应性策略,盐胁迫可以引起糖类的增加,导致代谢向糖异生转变以避免渗透胁迫,在盐碱胁迫下,小麦幼苗的根和叶中都出现差异代谢物,这些代谢物包括与TCA循环和糖酵解相关的物质,还包括了氨基酸、糖类和多元醇类。在其他很多植物(如棉花[28]、高粱[29]、甜菜[30]、玉米[31]等)进行盐胁迫下代谢组学或转录组学研究中也发现有大量的氨基酸及其衍生物的差异变化,如脯氨酸在多种植物响应盐胁迫时都会发生变化,而本研究除了发现参与渗透调节类氨基酸(如脯氨酸)的变化外,还发现根中一些芳香族氨基酸也差异积累,它们在根中主要参与次生代谢,参与合成抗氧化胁迫、渗透胁迫、信号传导等途径的相关物质响应高盐胁迫。
黄酮类化合物是植物中较具生物活性的次生代谢物之一,它们在生理学、生物化学和生态学方面表现出广泛的功能,在植物抗逆方面也起着重要作用[32]。“抗氧化”类黄酮是单线态氧的清除者和叶绿体外膜的稳定剂[33]。Ma 等[29]报道,在盐碱胁迫下,高粱叶片中黄酮类化合物(如黄酮、类黄酮、黄酮醇、异黄酮、花青素)含量增加。本研究中根和叶片响应盐胁迫的差异积累代谢物质中黄酮类化合物占比较高,小麦可能通过黄酮类化合物的积累,减轻高盐环境带来的氧化胁迫对植物造成的伤害,这类机制被称为非酶调节机制[34]。
本研究中有些有机酸及其衍生物(如顺式乌头酸、苹果酸、柠檬酸、α-酮戊二酸等)参与植物呼吸代谢途径中的三羧酸循环,这些有机酸及其衍生物的增加可能与盐胁迫下植物呼吸作用增强有关,其中有些有机酸如柠檬酸本身可以使植物对非生物胁迫产生耐受性。有研究表明,外源柠檬酸的施用可提高不同非生物胁迫条件下作物的生长和产量,通过诱导抗氧化防御系统,促进叶绿素含量的增加,并影响次生代谢,从而限制植物在逆境条件下的生长限制[35]。在棉花响应盐碱胁迫过程中,也有大量的有机酸发生变化,包括TCA 循环中积累的有机酸[28]。这些有机酸的积累可能中和掉细胞中过多的阳离子来调节细胞内的pH,同时TCA 循环也是盐碱胁迫下植物代谢能量的重要来源。
本研究还有大量的脂类物质在盐胁迫下发生变化,它们很多是包括质膜在内的生物膜的主要组成部分之一,是细胞和环境之间的界面。膜脂作为底物可以产生大量的信号脂质,可能参与了盐胁迫信号传导过程[36,38]。如本研究中多个溶血磷脂类物质(溶血磷脂类乙醇胺、溶血磷脂酰胆碱、溶血磷脂酰丝氨酸等)在盐胁迫条件下的叶中多为上调积累,它们都是细胞膜成分,可能在盐胁迫应答过程中发挥维持细胞膜完整和盐胁迫信号传导的重要作用。
除此之外,还有具有广泛生物学功能的核苷酸及其衍生物,以及一些糖类、激素类、甜菜碱等多种代谢物质在盐胁迫下发生变化,它们相互关联,组成了小麦应答盐胁迫的复杂的调控网络,从整体上影响植株对盐胁迫的响应及盐胁迫下的生长发育。

