糜子PmNAC1 的克隆及生物信息学分析
辛旭霞 ,郑香然 ,王海岗 ,陈 凌 ,Santra Dipak K ,王瑞云 ,,乔治军
(1.山西农业大学 农学院,山西 太谷030801;2.山西农业大学 农业基因资源研究中心/农业农村部黄土高原作物基因资源与种质创制重点实验室/杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太原 030031;3.内布拉斯加大学 林肯分校农艺系小宗粮豆研究与推广中心,美国 内布拉斯加州 69361)
糜子(Panicum miliaceumL.)又称黍稷,属于禾本科黍属,是古老的粟类作物,其遗传变异丰富[1],谷粒富含抗性淀粉,可降低血糖和血脂,是保持肠道健康的功能食品[2]。此外,糜子具有独特的营养价值,是一种保健的好食品,其在禾谷类作物中的碱性蛋白质含量较高,并且还含有丰富的容易吸收的维生素、微量元素、氨基酸等[3]。与其他作物相比,糜子是一种抗旱性极强的1 年生草本作物,具有耐盐碱、耐瘠,以及生育周期较短等特点[4-5]。干旱是主要的非生物胁迫之一,严重影响植物的生长发育、产量、品质及种植范围,进而影响农业生产[6]。王纶等[7]研究表明,黍稷资源的抗旱性在每个个体中都表现出比较大的差异[8]。
糜子起源于我国黄河流域黄土高原地区,山西的种质资源数量占全国第一[9],是我国最早的农作物,大约在8 000 a 前开始在我国种植[10],3 000 a 前左右流传到欧洲和世界各地,被广泛种植于欧亚大陆,全球种植糜子的栽培面积有550 万~600 万hm2。我国糜子的种植区域非常广泛,几乎各个省市均有种植,但是主要产区集中于我国北方地区,平均每年种植面积多达50 万~60 万hm2[11]。在禾谷类作物中,粟类作物是除水稻、小麦、玉米、大麦、高粱外的第六大作物,养育着全世界1/3 以上的人口[12]。尽管我国糜子的栽培历史悠久,但是和水稻、玉米、小麦等相比种植面积较少,因此,其关注程度较低。糜子是我国北方旱区主要制米作物之一,主要分布在我国西北、华北、东北干旱、半干旱地区[13],也是干旱和半干旱地区主要的粮食作物之一[14],在遭受严重的干旱后遇水能够快速生长[15],植物表皮蜡质可以通过减少植物表皮水分的散失,从而对植物起到保水抗旱的作用[16],是理想的复种作物,因此,糜子尤其适宜在较为干旱的地方种植。不仅给我国干旱半干旱地区的广大人们带来了食物支撑,而且成为该地区最主要的救灾备荒作物[17],在我国的国民经济中占据重要地位。
在陆生植物所具有的转录因子中,NAC 转录因子所占的比例是最大的,其名称是由拟南芥ATAF1/2基因、矮牵牛(Petunia hybridaVilm.)NAM基因以及CUC1/2基因的缩写字母组成[18-19],NAC 转录因子包括ATAF、NAM、CUC 等3 个家族[20],而本试验所研究的基因正是属于NAM 家族的基因。NAC 结构域是指具有一个和NAM 蛋白高度同源的NAC 蛋白N 端的高度保守氨基酸序列,NAC 结构域最初的特征在于来自NAM、ATAF1/2 和CUC2 的共有序列。NAC 蛋白含有结合DNA 的NAC 结构域,其大约150 个氨基酸位于蛋白质的N 末端,形成了5 个亚结构区域[21],其中,A、C、D 3 个亚结构域是非常保守的[22],它具有与蛋白质或DNA 结合的作用,亚结构域A 可能与NAC 蛋白形成二聚体,亚结构域B、E 变化多样,会赋予NAC基因不同的功能。NAC 家族的蛋白序列通常包含大约400 个氨基酸,包括典型和非典型2 种不同结构[23],NAC 转录因子参与调控植物生长发育、相关目的基因的表达、响应非生物胁迫及激素信号转导,包括次生壁合成[24]、叶片衰老[25]、细胞扩增[26]等多种植物生命活动过程,对增强植株的抗逆性发挥着重要作用。许多NAC 蛋白具有类似的二聚体结合位点,因此,大部分的NAC 蛋白均以同源二聚体的形式发挥作用[27]。目前,人们对水稻、玉米、小麦等作物中的NAC 转录因子进行了大量研究。NURUZZAMAN 等[28]的研究证实了TRR基序对于某个特殊的NAC 亚家族来说是比较保守的,结果在不同亚家族间存在差异。KUSANO等[29]在水稻中分离得到了1 个NAC 转录因子,属于NAM 亚组。HU 等[30]克隆了水稻抗旱基因SNACI,促进了水稻逆境条件下的基因表达。邵欢欢[31]通过PEG 模拟干旱胁迫从256 份材料鉴定出40 份糜子芽期强抗旱材料和10 份苗期强抗旱材料,并利用二代重测序技术对糜子芽期和苗期抗旱性基因进行GWAS 分析,注释到糜子染色体13 和染色体16 上有2 个NAC 蛋白结构域。
通过结合前期转录测序[14]和邵欢欢[31]的研究结果对糜子基因组染色体16 上注释的NAC基因进行克隆,包括糜子基因组DNA 的提取、引物设计及纯化产物测序等过程;将对检测得到的序列进行生物信息学研究分析,通过预测该蛋白的保守结构域及二、三级结构等,探讨在非生物胁迫下,糜子中NAC 转录因子的反应。本试验通过克隆糜子PmNAC基因及生物信息学分析,以期为糜子抗逆分子育种提供候选基因资源和理论依据。
1 材料和方法
1.1 试验材料
本试验所选材料由中国农业科学院作物科学研究所资源中心谷子高粱糜子课题组提供,分别为晋黍9 号(00009143)、鸭爪白(00000832)、大白黍(00006586)、紫秆大糜(00001178)、硬地黄(00001284)、黄糜子(00003199)、太原1084(00006539)。
克隆载体及菌株的选择:pMDTM19-T Vector,购自宝日医生物技术(北京)有限公司(TaKaRa);大肠杆菌DH5α感受态细胞(E.coli DH5α Competent Cells),购自生工生物工程(上海)股份有限公司。
1.2 试验方法
1.2.1 引物设计 根据已发布的NCBI 糜子基因组(登录号:GCA 003046395.2)染色体16 上注释的NAC基因序列为模板,PCR 反应程序为:2×Taq PCR MasterMix 10 μL,CBR-KF 0.8 μL,CBR-KR 0.8 μL,糜子gDNA 1 μL,ddH2O 7.4 μL。将扩增后的产物经过琼脂糖凝胶电泳(缓冲液为TBE)检测后,使用DiaSpin DNA Gel Extraction Kit 试剂盒胶回收纯化。
试验所用上游引物序列(NAC-S):5'-CTAGC CCATCCACCCCTGCG-3';下游引物序列(NACX):5'-ATGTATAGGTTAGCATGGCTTCTGT TAAAGGTACC-3'。
PCR 反应条件:94 ℃预变性5 min;94 ℃变性40 s,65.8 ℃退火40 s,72 ℃延伸2 min,34 个循环;72 ℃延伸10 min,4 ℃ 30 min。
1.2.2 T-A 克隆 将PCR 纯化产物通过连接克隆载体pMD19-T 进行T 载体连接转化(连接体系见TaKaRa pMDTM19-T Vector 说明书)至DH5α感受态细胞,培养单菌落,送至上海生工生物工程有限公司,利用菌落PCR(通用引物M13)提取阳性克隆的质粒测序,检查该序列是否为目标序列。
1.2.3 生物信息学分析 使用Primer premier 5.0软件进行设计引物扩增全长序列,将引物交到上海生工生物工程股份有限公司进行合成,进行PCR扩增获得目的片段,同时,用生物信息学分析所测序的正确序列。利用NetNGlyc 1.0 软件预测编码蛋白的糖基化位点;使用NetPhos 3.1 软件预测编码蛋白的磷酸化位点;使用SMART(https://services.healthtech.dtu.dk/)在线软件对蛋白跨膜区域进行预测;用ProtScale 程序对蛋白进行疏水性分析;使用SignalP-5.0 识别蛋白的信号肽;利用PSIPRED 在线工具(http://bioinfadmin.cs.ucl.ac.uk/downloads/psipred/old_versions/psipred3.5. tar.gz)对蛋白的二级结构进行预测;利用在线程序SWISS-MODEL(https://swissmodel.expasy.org/)对PmNAC1基因编码蛋白进行3D 结构模拟;使用MEGA 7.0 及GeneDoc 在线软件(https://www.omicsclass.com/article/502)进行氨基酸序列多重比对及系统进化树的构建;利用DNAMAN 6.0 软件对测序基因序列进行比较。
2 结果与分析
2.1 糜子NAC1 目的基因的获得
对糜子DNA 进行提取,以该DNA 为模板克隆糜子NAC基因,经过PCR 扩增序列全长为1 634 bp,结果如图1 所示。胶回收纯化后将目的片段与pMD19-T 载体连接,连接产物导入到大肠杆菌DH5α感受态细胞,将菌液送至上海生工生物工程有限公司利用菌落PCR(通用引物M13)提取阳性克隆的质粒测序,将测序结果通过DNAMAN 进行序列对比,结果与CM009705.2 上注释序列一致(图2)。由图3 可知,基因编码423 个氨基酸。
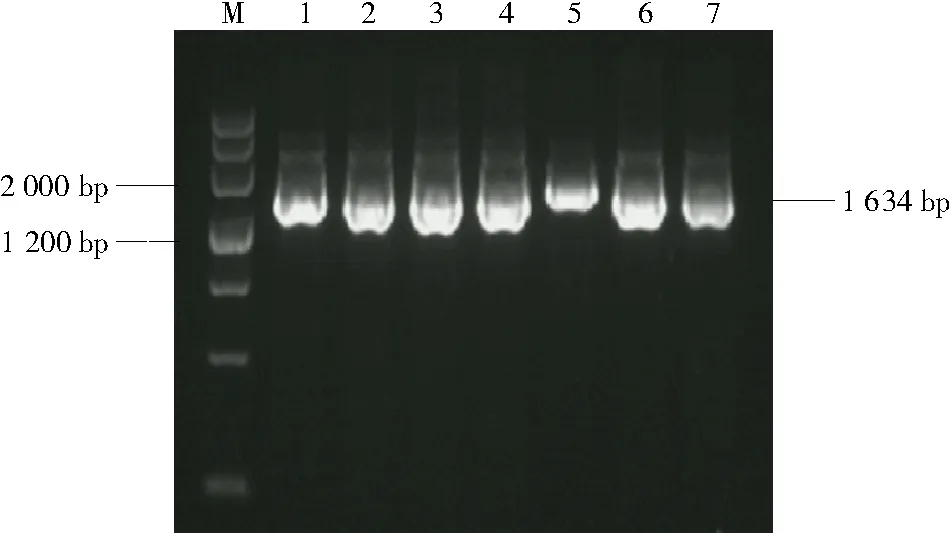
图1 NAC-S/NAC-X 扩增产物电泳分析Fig.1 Electrophortic pattern analysis of NAC-S/NAC-X amplification products

图2 DNAMAN 序列比对结果Fig.2 DNAMAN sequence alignment results
2.2 生物信息学分析
2.2.1 PmNAC1 蛋白的理化性质 利用Protparam 分析基因编码蛋白理化性质,PmNAC1基因编码蛋白的分子式为C703H1034N182O214S11,原子总数为2 144 个,带负电残基总数为18 个,带正电残基总数为7 个。NAC 蛋白包括的氨基酸有Ala(9.5%)、Arg(2.7%)、Asn(2.0%)、Asp(8.8%)、Cys(1.4%)、Gln(6.1%)、Glu(3.4%)、Gly(13.6%)、His(1.4%)、Ile(0.7%)、Leu(6.1%)、Lys(2.0%)、Met(6.1%)、Phe(6.1%)、Pro(7.5%)、Ser(6.8%)、Thr(2.0%)、Trp(2.7%)、Tyr(3.4%)和Val(7.5%)。PmNAC1 蛋白与NAM 蛋白家族类似(图4)。使用Prot Scale 程序对蛋白进行疏水性分析,结果显示(图5),氨基酸Score 值在第150 位最低(-3.267),在第107 位最高(1.644),平均疏水性为-0.811 5,属于亲水蛋白。保守位点73~211 号,有一个前肽裂解位点153 号,并且有精氨酸和亮氨酸的核输出信号(图6)。
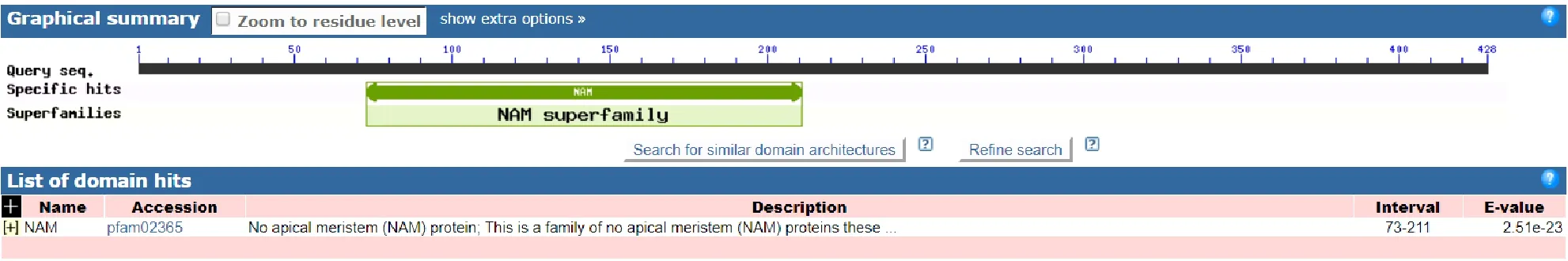
图4 PmNAC1 蛋白结构域预测Fig.4 Protein domain prediction of PmNAC1 protein
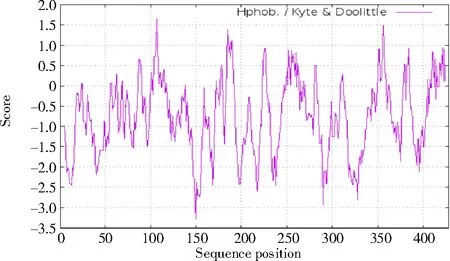
图5 PmNAC1 蛋白序列的亲疏水性预测Fig.5 Prediction of hydrophilicity and hydrophobicity of PmNAC1 protein
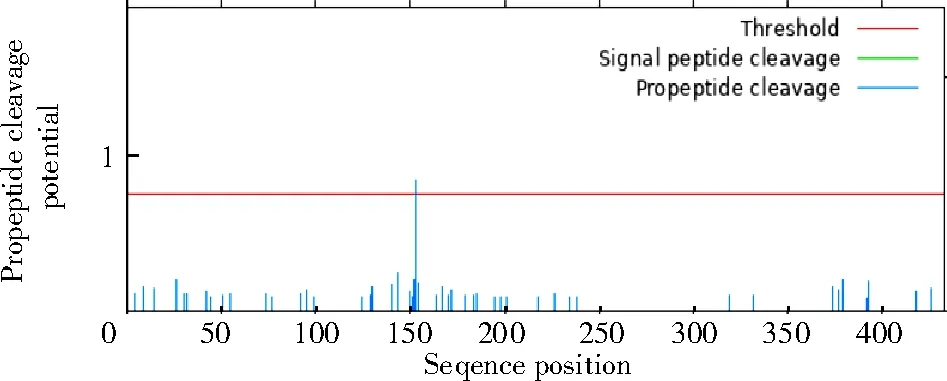
图6 PmNAC1 蛋白序列的核输出位点Fig.6 Nuclear export sites of PmNAC1 protein
2.2.2 PmNAC1 蛋白的跨膜结构、信号肽和二、三级结构 采用TMHMM 2.0 预测糜子NAC 蛋白,结果如图7 所示。
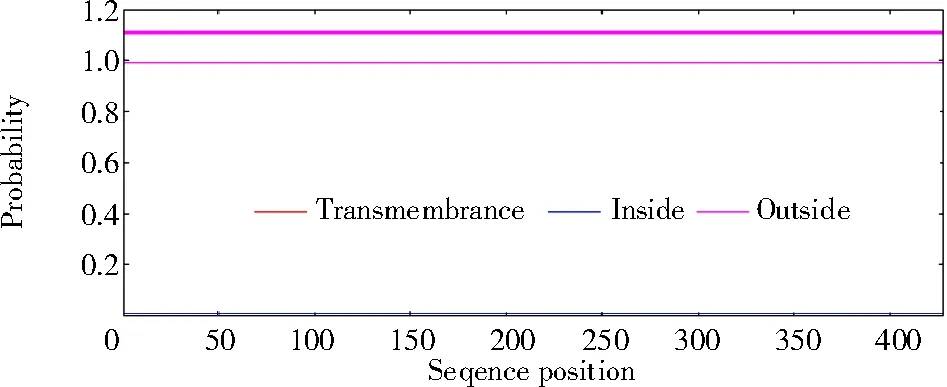
图7 PmNAC1 蛋白序列的跨膜结构域预测Fig.7 Transmembrane domain prediction of PmNAC1 protein sequence
由图7 可知,NAC 蛋白不存在跨膜结构域。利用SignalP-5.0 识别到该蛋白不具有信号肽序列(图8),该蛋白可能并非分泌蛋白。利用SOPMA预测蛋白的二级结构,结果显示(图9),在二级结构中氨基酸主要由8 个α-螺旋、14 个β-折叠、延伸链和无规则卷曲组成,其中,β-折叠占比为15.19%,含量最高,α-螺旋占比为0.03%。利用在线程序SWISS-MODEL 对PmNAC1基因编码蛋白进行3D 结构模拟,以水稻NAC 催化结构域的晶体结构(SMTL ID:3ulx.1 序列号)为模板预测PmNAC1 3D 结构,发现该蛋白包括8 个α-螺旋和14 个β-折叠(图10)。

图8 PmNAC1 蛋白序列的信号肽预测Fig.8 Signal peptide prediction of PmNAC1 protein sequence

图9 预测PmNAC1 蛋白二级结构Fig.9 Prediction of the secondary structure of PmNAC1 protein
2.2.3PmNAC1编码蛋白的糖基化位点和磷酸化位点 使用NetNGlyc 1.0 在线软件,预测编码蛋白的糖基化位点,超出水平线0.5 的有糖基化位点(图11)。通过NetPhos 3.1 在线软件对编码蛋白激酶进行磷酸化位点预测,从图12 可以看出,蛋白磷酸化位点共计59 个,包含丝氨酸(S)31 个、苏氨酸(T)22 个、酪氨酸(Y)6 个。参考蛋白激酶的分级标准,特异性激酶包括属于ACG 组依赖环腺苷酸(cAMP)的蛋白激酶PKA、依赖磷脂的蛋白激酶PKC、依赖环鸟甘酸(cGMP)的蛋白酶PKG 和钙以及近亲激酶PKB,属于传统PTK 组的EGFR,属于CMGG 组的作用于下游的磷酸化级联系统以及其他的植物蛋白激酶。
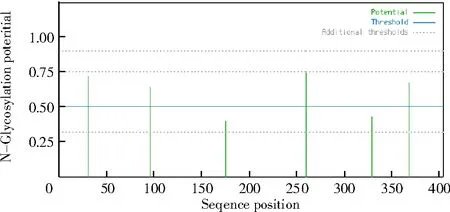
图11 NAC 蛋白糖基化位点预测Fig.11 Prediction of glycosylation sites of NAC protein
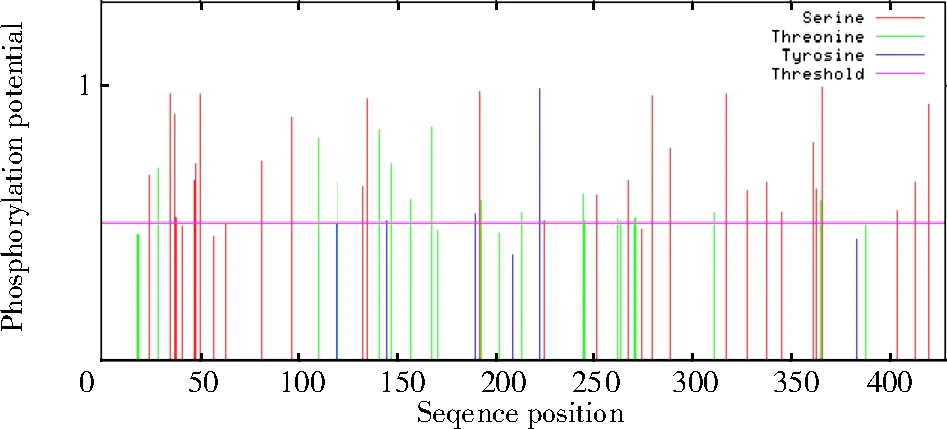
图12 NAC 蛋白磷酸化位点预测Fig.12 Prediction of phosphorylation sites of NAC protein
2.2.4 PmNAC1 蛋白序列系统进化树构建 将研究克隆所得到的PmNAC1编码蛋白序列进行序列对比,从NCBI 上下载玉米(Zea mays)、高粱(Sorghum bicolor)、小麦(Triticum aestivum)等与Pm-NAC1编码蛋白序列相似性较高的NAC 转录因子氨基酸序列,通过MEGA 7.0 中的ClustalW 比对,构建糜子转录因子NAC 氨基酸序列系统发育进化树。结果表明(图13),PmNAC1 蛋白与柳枝稷(Panicum virgatum)CUC2 的亲缘关系最近,二者的遗传变异系数为0.06,都为禾本科作物,可能为旁系同源基因,与番茄的亲缘关系最远,可见隶属于同一科的作物蛋白序列更容易聚为一类。
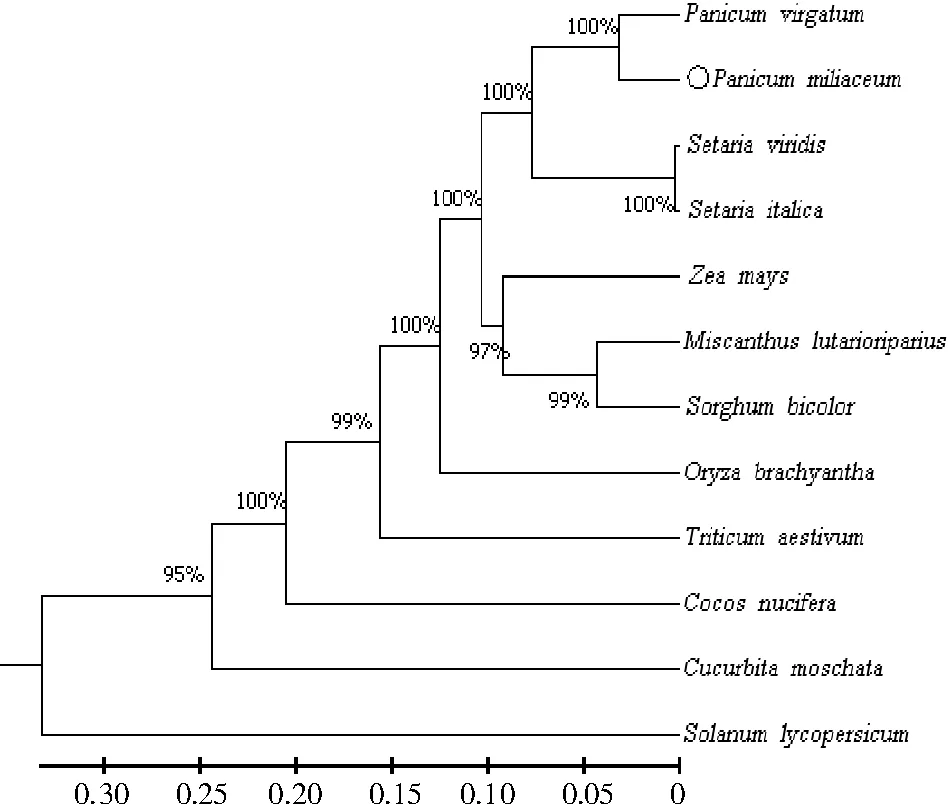
图13 PmNAC1 与其他NAC 家族蛋白序列进化树构建Fig.13 Phylogenetic tree construction of PmNAC1 and other NAC family proteins
3 结论与讨论
目前,人们对于植物NAC 转录因子有进一步研究,其具有NAM 功能域,在单、双子叶植物中具有高度保守性,但现在研究最多的是拟南芥等植物。本试验通过对糜子NAC基因克隆并测序,获得了1 条总长度为1 634 bp 的核苷酸序列,编码423 个氨基酸;生物信息学预测编码的PmNAC1 蛋白属于亲水性蛋白,无跨膜结构,不能产生信号肽,含有59 个磷酸化位点,说明不是膜结合蛋白[32]。
空间结构在很大程度上决定了蛋白质的功能,通过对糜子蛋白的二、三级结构进行预测可知,NAC 蛋白由8 个α-螺旋和14 个β-折叠组成,该蛋白以无规则卷曲为主。何姗等[33]使用玉米骨干自交系Mo17,通过RT-PCR 克隆得到了玉米转录因子NAC 78,分析得到NAC 78 蛋白质N 端含有1 个NAM 保守结构域,由8 个α-螺旋和7 个β-折叠构成。本试验研究发现,PmNAC1 蛋白质的N-端含有1个编码423个氨基酸的NAC 保守结构域,由8个α-螺旋和14 个β-折叠构成。该结构与何姗等[33]对玉米、田云等[34]对烟草和赵才美等[20]对水稻NAC转录因子的保守结构域之间存在着一定同源性。系统发育进化树分析结果显示,NAC 蛋白与柳枝黍(Panicum virgatum)CUC2 的亲缘关系最近,表明二者可能由同一个祖先进化而来,与番茄的亲缘关系最远;且与谷子、玉米、狗尾草、野生稻等都有较高的同源性,表明NAC 转录因子在植物中可能具有相同的功能。
蛋白质磷酸化是在植物蛋白激酶和细胞信号转导的过程中起关键作用的一种技术,也是生物界最常见、最重要的一种蛋白质翻译后修饰[35]。蛋白质磷酸化是调控和调节蛋白质的活性和功能最基本、最关键的机制。蛋白质磷酸化的功能主要有3个方面:第一是植物体内信号的传导有磷酸化蛋白质的参与;第二是影响蛋白质之间的相互作用;第三是受体蛋白质的活性通过磷酸化修饰而改变[36]。本研究表明,糜子NAC 蛋白磷酸化位点总计59 个,包含31 个丝氨酸、22 个苏氨酸以及6 个酪氨酸。推测糜子NAC 转录因子可能存在多种翻译后水平的修饰作用以调节其自身的表达水平。
转录因子在植物抗性生理中扮演着非常重要的角色,分离鉴定逆境相关转录因子,揭示其调控的分子机制是植物抗性研究的首要任务。NAC 转录因子在调控机制上的研究取得了一定的进展,但仍不完善。NAC 转录因子在拟南芥和水稻2 种模式植物中的研究较为成熟,在大豆、烟草等植物中都有所报道,本试验通过克隆糜子NAC 转录因子,并进行生物学信息分析,为研究糜子生物学功能提供了理论依据。农业部黄土高原作物基因资源与种质创制重点实验室正创建表达糜子PmNAC1 材料,NAC 转录因子在糜子中的功能有利于阐明PmNAC1 转录因子在糜子中的生物学功能及其分子机理,为NAC 转录因子在糜子育种中的应用提供依据。

