微RNA-140-5p靶向调节血管内皮生长因子表达对高糖诱导的人视网膜血管内皮细胞增殖、迁移和管腔形成的影响
郑洪祥,李庆航,李亚男,蒋曦曦,吕建平,张婷娉,王 淼,2
(1.济宁市第二人民医院眼科,山东 济宁 272000;2.英吉沙县人民医院眼科,新疆 英吉沙 834800)
糖尿病视网膜病变是慢性高血糖引起的视网膜微血管并发症,其病变发生率较高,是造成视力丧失的重要因素[1-2]。糖尿病视网膜病变早期毛细血管周细胞丢失和基底膜增厚,进而导致内皮细胞过度增殖,最终诱发视网膜血管异常生成,形成糖尿病视网膜病变[3]。研究表明,血管内皮生长因子(vascular endothelial growth factor,VEGF)高表达会使血管异常生长,导致糖尿病视网膜病变的恶化[4];而抗VEGF药物可抑制眼底新生血管,阻止糖尿病性黄斑水肿,提高糖尿病视网膜病变远期预后[5]。微RNA(microRNA,miRNA)是小型、高度保守的非编码RNA,可结合并降解靶mRNA,或抑制其翻译,进而调节转录后基因表达。miR-140-5p是由多个核苷酸组成的非编码RNA,参与胚胎发育、骨骼代谢、心脏重构、细胞分化等生物学过程,且与多种疾病的发生发展密切相关。研究发现,miR-140-5p可以靶向VEGF调节血管生成,进而保护缺血性脑损伤及抑制乳腺癌细胞的扩散[6-7]。糖尿病视网膜病变为视网膜处的微血管异常生成导致的疾病,miR-140-5p是否通过VEGF调节糖尿病视网膜微血管的增生尚有待研究。本课题组前期实验验证了miR-140-5p和VEGF可靶向结合,本研究采用高糖培养人视网膜血管内皮细胞(human retinal vascular endothelial cells,hRECs)模拟高血糖诱发视网膜病变,探讨miR-140-5p对高糖诱导的hRECs增殖、迁移和成管能力的影响及其靶向VEGF机制,旨在为miR-140-5p治疗糖尿病视网膜病变提供实验依据。
1 材料与方法
1.1 动物
7周龄雄性无特定病原体级Sprague Dawley大鼠40只,体质量190~210 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。本研究符合实验动物伦理,经济宁市第二人民医院伦理委员会审核批准。
1.2 细胞、主要试剂与仪器
hRECs购自中国科学院上海细胞研究所;达尔伯克改良伊格尔培养基(Dulbecco′s modified Eagle′s medium,DMEM)、胰蛋白酶、磷酸盐缓冲液(phosphate buffer saline,PBS)、青链双抗和总RNA抽提试剂均购自上海白鲨生物科技有限公司,胎牛血清购自美国Gibco公司,miR-140-5p模拟物(miR-140-5p mimics)、阴性对照模拟物(mimics negative control,mimics NC)、VEGF-3′UTR WT序列、VEGF-3′UTR MUT序列由上海亚载生物科技有限公司合成,pmiGLO载体购自上海泽叶生物科技有限公司,双荧光素酶报告基因检测试剂盒、Lipofectamine 2000 试剂盒购自美国Invitrogen公司,反转录聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)试剂盒、二喹啉甲酸法蛋白定量试剂盒购自南京诺唯赞生物科技股份公司,基质胶购自美国BD公司,硝酸纤维素膜购自美国millipore公司,VEGF、β-actin一抗及二抗购自北京博奥森生物技术有限公司,噻唑蓝、链脲佐菌素(streptozotocin,STZ)、戊巴比妥钠购自美国Sigma公司,多聚甲醛、无菌无酶处理水购自上海碧云天生物技术有限公司,二甲基亚砜、氯仿、异丙醇、无水乙醇、丙烯酰胺、十二烷基磺酸钠购自国药集团化学试剂上海有限公司;8孔腔室载玻片购自美国BD公司,96孔板、6孔板和Transwell小室购自美国Corning公司,Scientific 8000细胞培养箱和VARIOSKAN LUX型全波长酶标仪购自美国Thermo公司,DMI3000B倒置拍照显微镜购自德国Leica公司,3K15低温冷冻离心机购自美国Sigma公司,LightCycler®480II 荧光定量PCR仪购自瑞士Roche公司,一体式化学发光成像仪购自美国BIO-RAD公司。
1.3 实验方法
1.3.1 细胞培养
将hRECs加入含体积分数10%胎牛血清和体积分数1%青链双抗的DMEM中,置于37 ℃、含体积分数5% CO2的饱和湿度培养箱中培养,隔日换1次培养基,融合度达90%左右时传代。
1.3.2 细胞转染
取对数生长期hRECs,调整细胞密度为1×108L-1,分别接种至6孔板,每孔2 mL,培养24 h后,待细胞生长至融合度80%~90%时进行转染:将6孔板中的培养液吸弃,PBS清洗,按照Lipofectamine 2000脂质体转染试剂盒说明书混合工作液后,用无血清DMEM培养基稀释,每孔加入2 mL工作液后,再加入50 μL miR-140-5p mimics或mimics NC,混合均匀,放入细胞培养箱中转染24 h后进行后续实验。
1.3.3 细胞分组及处理
(1)取对数生长期hRECs,分为正常对照组、高糖组;正常对照组细胞调整细胞密度为1×108L-1,取2 mL接种于6孔板中,给予DMEM完全培养基,置于细胞培养箱中继续培养24 h;高糖组细胞调整细胞密度为1×108L-1,取2 mL接种于6孔板中,给予含30 mmol·L-1葡萄糖的DMEM完全培养基,置于细胞培养箱中继续培养24 h。(2)另取“1.3.2”项中转染miR-140-5p mimics或mimics NC的hRECs 2 mL,调整细胞密度为1×108L-1,接种于6孔板中,分别设为miR-140-5p组、阴性对照 (negative control,NC)组,给予DMEM完全培养基,置于细胞培养箱中继续培养 24 h。(3)取“1.3.2”项中转染miR-140-5p mimics的hRECs 2 mL,调整细胞密度为1×108L-1,接种于6孔板中,设为高糖+miR-140-5p组,给予含30 mmol·L-1葡萄糖的DMEM完全培养基,置于细胞培养箱中继续培养24 h。
1.3.4 RT-PCR法检测各组细胞中miR-140-5p的表达
取“1.3.3”项中培养的各组细胞,胰蛋白酶消化,2 000 r·min-1离心10 min,收集细胞,用总RNA抽提试剂提取总RNA,并使用反转录试剂盒将RNA反转录为cDNA,严格按照试剂盒说明书进行操作。将cDNA作为模板,以U6为内参基因,应用RT-PCR技术检测miR-140-5p的Ct值。反应体系:cDNA 2.0 μL,2×SYBR Premix Ex TaqⅡ 5.0 μL,上下游引物各0.4 μL,无酶水2.2 μL。反应条件:95 ℃预变性30 s,95 ℃变性5 s,65 ℃退火30 s,共40个循环。所用引物由上海生工生物工程技术服务有限公司合成,miR-140-5p上游引物序列为5′-CGGACAGTGGTTTTACCC-3′,下游引物序列为5′-CTCAACTGGTGTCGTGGA-3′;U6上游引物序列为5′-CTCGCTTCGGCAGCACA-3′,下游引物序列为5′-AACGCTTCACGAATTTGCGT-3′。采用2-△△Ct法计算miR-140-5p的相对表达量。实验重复3次,取均值。
1.3.5 噻唑蓝法测定各组细胞增殖能力
取“1.3.3”项中培养的各组细胞,调整细胞浓度为5×107L-1,每孔200 μL接种于96孔板,每组设8个复孔,置于37 ℃、含体积分数5% CO2的饱和湿度培养箱内培养24、48、72 h,每孔加入5 g·L-1噻唑蓝溶液20 μL,继续孵育4 h后,弃去孔内上清液,每孔加入200 μL 二甲基亚砜,室温振荡5 min,结晶物充分溶解后,用酶标仪在490 nm波长处检测各孔吸光度值,以吸光度值代表细胞增殖能力,吸光度值越高代表增殖能力越高,计算细胞增殖率(细胞增殖率=处理组吸光度值/正常对照组吸光度值×100%)。实验重复3次,取均值。
1.3.6 Transwell法测定各组细胞迁移能力
取“1.3.3”项中培养的各组细胞,更换为无血清培养基继续培养24 h,胰蛋白酶消化细胞后用无血清培养液重悬,于Transwell小室中加入300 μL浓度为1×108L-1的无血清细胞悬液后,将Transwell小室置于24孔板上,再向24孔板中每孔加入600 μL完全培养基,每组设3个复孔,继续培养24 h后,取出Transwell小室,弃去Transwell小室内液体,PBS漂洗2次,用棉签擦拭掉Transwell小室底膜上层细胞,对Transwell小室底膜下层细胞用预冷的40 g·L-1多聚甲醛固定30 min,结晶紫染色10 min,随机选取5个视野进行显微镜拍照并计数迁移细胞数,取均值。迁移细胞数越多表示细胞迁移能力越强。
1.3.7 管腔形成实验测定各组细胞成管能力
4 ℃下融化基质胶,于8孔腔室载玻片中每孔加入10 μL基质胶,然后将8孔腔室载玻片置于含少量水的培养皿中,将培养皿放入37 ℃培养箱中静置30 min,使基质胶凝固。将“1.3.3”项中培养24 h的各组细胞,更换为无血清培养基继续培养24 h,胰蛋白酶消化细胞后用无血清培养液重悬至2×108L-1,加入到铺好基质胶的8孔腔室载玻片中,每孔50 μL,每组设3个复孔,置于37 ℃、含体积分数5% CO2的饱和湿度培养箱内培养8 h后,显微镜下观察,随机选取5个视野拍照并计数形成管腔数,取均值。以管腔数量表示细胞的成管能力,管腔数越多表示细胞成管能力越强。
1.3.8 Western blot 法检测各组细胞中VEGF蛋白的表达
取“1.3.3”项中培养24 h的各组细胞,用预冷PBS漂洗3遍,加入含蛋白酶抑制剂的预冷裂解液,充分震荡,置于冰上静置30 min,细胞刮收取细胞后,4 ℃ 12 000 r·min-1离心10 min,取上清,使用二喹啉甲酸法测定上清液蛋白浓度,沸水浴10 min使蛋白充分变性。取每组蛋白样品30 μg,用体积分数12%分离胶进行十二烷基磺酸钠-聚丙烯酰胺凝胶电泳,电泳电压为恒压60 V,之后将蛋白采用350 mA 恒流电转移2 h至硝酸纤维素膜上,取出硝酸纤维素膜,使用5 g·L-1脱脂奶粉封闭2 h,4 ℃一抗(VEGF、β-actin;滴度为11 000)孵育12 h,缓冲液洗膜后加二抗(滴度为12 000)室温孵育1 h,缓冲液冲洗后进行电化学发光,用一体式化学发光成像仪拍照并分析灰度值,VEGF蛋白相对表达量以VEGF条带灰度值与内参(β-actin)灰度值的比值表示。实验重复3次,取均值。
1.3.9 苏木精-伊红(hematoxylin-eosin,HE)染色观察 miR-140-5p对糖尿病模型大鼠视网膜血管生成的影响
按随机数字表法将40只SD大鼠分为正常对照组、糖尿病模型组、糖尿病+NC组和糖尿病+miR-140-5p组,每组10只。正常对照组大鼠腹腔注射生理盐水(10 mL·kg-1);糖尿病模型组、糖尿病+miR-140-5p组和糖尿病+NC组大鼠腹腔注射6.5 g·L-1链脲佐菌素(10 mL·kg-1),7 d后大鼠血糖值>16.7 mmol·L-1为造模成功。第8天,正常对照组和糖尿病模型组大鼠经尾静脉注射200 μL生理盐水,糖尿病+NC组大鼠经尾静脉注射 200 μL mimics NC(200 nmol·L-1),糖尿病+miR-140-5p组大鼠经尾静脉注射200 μL miR-140-5p mimics(200 nmol·L-1),每日1次,持续给药7 d。大鼠继续饲养8周后,腹腔注射3 g·L-1戊巴比妥钠(10 mL·kg-1)麻醉大鼠,快速完整摘除右眼球,置于多聚甲醛固定液中,3 d后用PBS洗涤3次,用尖头镊子去除前眼角膜和晶状体,PBS 溶液冲洗掉玻璃体,剥离出内壁的视网膜层,胰蛋白酶消化,再用生理盐水反复冲洗视网膜,以去除黏附在视网膜血管网上的细胞,直至视网膜中的血管网呈现透明状,将视网膜转移至石蜡防脱玻片上,使视网膜完全展开,自然晾干后,HE染色,脱水,透明,中性树脂封固,镜下观察比较各组大鼠视网膜毛细血管病变情况。当大鼠视网膜血管整体呈“树状结构”,视盘处毛细血管分布较致密均匀,外极部毛细血管分布较疏松,为正常视网膜血管形态;当大鼠视网膜血管整体“树状结构”被破坏,毛细血管分布不均匀,出现毛细血管瘤,为糖尿病视网膜病变。
1.4 统计学处理
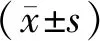
2 结果
2.1 5组细胞中miR-140-5p相对表达量比较
正常对照组、高糖组、miR-140-5p组、NC组、高糖+miR-140-5p组细胞中miR-140-5p相对表达量分别为1.00±0.05、0.49±0.09、3.70±0.21、1.04±0.08、0.83±0.06。5组细胞中miR-140-5p相对表达量比较差异有统计学意义(F=389.100,P<0.01)。高糖组、高糖+miR-140-5p组细胞中miR-140-5p相对表达量显著低于正常对照组,miR-140-5p组细胞中miR-140-5p相对表达量显著高于正常对照组,差异有统计学意义(P<0.01);NC组与正常对照组细胞中miR-140-5p相对表达量比较差异无统计学意义(P>0.05)。miR-140-5p组、NC组、高糖+miR-140-5p组细胞中miR-140-5p相对表达量显著高于高糖组,差异有统计学意义(P<0.01)。NC组、高糖+miR-140-5p组细胞中miR-140-5p相对表达量显著低于miR-140-5p组,差异有统计学意义(P<0.01)。高糖+miR-140-5p组细胞中miR-140-5p相对表达量显著低于NC组,差异有统计学意义(P<0.05)。
2.2 5组细胞增殖能力比较
培养24、48、72 h时,5组细胞增殖能力比较差异有统计学意义(F=5.629、32.410、55.430,P<0.01)。培养24、48、72 h时,高糖组细胞增殖率均显著高于正常对照组,差异有统计学意义(P<0.01);miR-140-5p组、NC组与正常对照组细胞增殖率比较差异均无统计学意义(P>0.05)。培养24 h时,高糖+miR-140-5p组与正常对照组细胞增殖率比较差异无统计学意义(P>0.05);培养48、72 h时,高糖+miR-140-5p组细胞增殖率显著高于正常对照组,差异有统计学意义(P<0.01)。培养24、48、72 h时,miR-140-5p组、NC组、高糖+miR-140-5p组细胞增殖率均显著低于高糖组,差异有统计学意义(P<0.05)。培养24、48、72 h时,NC组与miR-140-5p组细胞增殖率比较差异均无统计学意义(P>0.05)。培养24 h时,高糖+miR-140-5p组与miR-140-5p组、NC组细胞增殖率比较差异无统计学意义(P>0.05);培养48、72 h 时,高糖+miR-140-5p组细胞增殖率显著高于miR-140-5p组和NC组,差异有统计学意义(P<0.01)。结果见表1。

表1 5组细胞增殖能力比较
2.3 5组细胞迁移能力比较
正常对照组、高糖组、miR-140-5p组、NC组、高糖+miR-140-5p组迁移细胞数分别为83.00±9.17、175.00±8.00、29.33±4.04、62.67±5.03、82.00±6.00。5组迁移细胞数比较差异有统计学意义(F=194.400,P<0.01)。高糖组迁移细胞数显著高于正常对照组,miR-140-5p组、NC组迁移细胞数显著低于正常对照组,差异有统计学意义(P<0.01)。高糖+miR-140-5p组与正常对照组迁移细胞数比较差异无统计学意义(P>0.05)。miR-140-5p组、NC组、高糖+miR-140-5p组迁移细胞数显著低于高糖组,差异有统计学意义(P<0.01)。NC组、高糖+miR-140-5p组迁移细胞数均显著高于miR-140-5p组,差异有统计学意义(P<0.01)。高糖+miR-140-5p组迁移细胞数显著高于NC组,差异有统计学意义(P<0.01)。结果见图1。

A:正常对照组;B:高糖组;C:miR-140-5p组;D:NC组;E:高糖+miR-140-5p组。
2.4 5组细胞成管能力比较
正常对照组、高糖组、miR-140-5p组、NC组、高糖+miR-140-5p组细胞管腔形成数量分别为102.70±7.64、165.70±9.45、61.33±6.03、77.33±5.69、102.00±9.54。5组细胞管腔形成数量比较差异有统计学意义(F=75.520,P<0.01)。高糖组管腔形成数量显著高于正常对照组,miR-140-5p组、NC组细胞管腔形成数量显著低于正常对照组,差异有统计学意义(P<0.01);高糖+miR-140-5p组与正常对照组细胞管腔形成数量比较差异无统计学意义(P>0.05)。miR-140-5p组、NC组、高糖+miR-140-5p组细胞管腔形成数量均显著低于高糖组,差异有统计学意义(P<0.01)。NC组、高糖+miR-140-5p组细胞管腔形成数量均显著高于miR-140-5p组,差异有统计学意义(P<0.05)。高糖+miR-140-5p组细胞管腔形成数量显著高于NC组,差异有统计学意义(P<0.05)。结果见图2。

A:正常对照组;B:高糖组;C:miR-140-5p组;D:NC组;E:高糖+miR-140-5p组。
2.5 5组细胞中VEGF蛋白相对表达量比较
正常对照组、高糖组、miR-140-5p组、NC组、高糖+miR-140-5p组细胞中VEGF蛋白相对表达量分别为1.00±0.09、2.34±0.17、0.46±0.04、1.10±0.11、1.47±0.27。5组细胞中VEGF蛋白相对表达量比较差异有统计学意义(F=58.080,P<0.01)。高糖组、高糖+miR-140-5p组细胞中VEGF蛋白相对表达量显著高于正常对照组,miR-140-5p组细胞中VEGF蛋白相对表达量显著低于正常对照组,差异有统计学意义(P<0.05);NC组与正常对照组细胞中VEGF蛋白相对表达量比较差异无统计学意义(P>0.05)。miR-140-5p组、NC组、高糖+miR-140-5p组细胞中VEGF蛋白相对表达量显著低于高糖组,差异有统计学意义(P<0.01)。NC组、高糖+miR-140-5p组细胞中VEGF蛋白相对表达量均显著高于miR-140-5p组,差异有统计学意义(P<0.01)。高糖+miR-140-5p组细胞中VEGF蛋白相对表达量显著高于NC组,差异有统计学意义(P<0.05)。结果见图3。
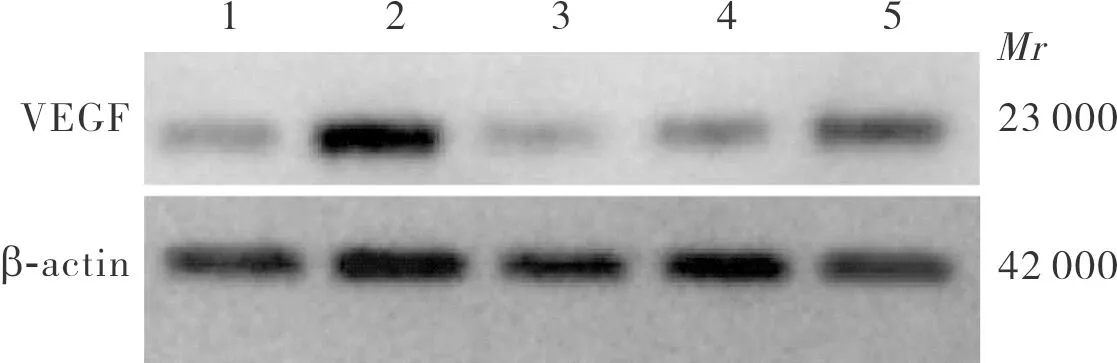
1:正常对照组;2:高糖组;3:miR-140-5p组;4:NC组;
2.6 miR-140-5p对糖尿病模型大鼠视网膜血管生成的影响
正常对照组大鼠靠近视乳头处的视网膜血管整体呈“树状结构”,内极部毛细血管分布较致密,外极部毛细血管分布较疏松,血管壁均匀(图4A)。糖尿病模型组大鼠视网膜血管的“树状结构”被破坏,毛细血管分布不均匀,毛细血管瘤形成(图4B)。糖尿病+NC组大鼠视网膜血管损伤与糖尿病模型组相当(图4C)。糖尿病+miR-140-5p组大鼠视网膜血管的损伤情况有所好转,毛细血管分布较均匀,毛细血管瘤减少(图4D)。

A:正常对照组;B:糖尿病模型组;C:糖尿病+NC组;D:糖尿病+miR-140-5p组。
3 讨论
2020年糖尿病视网膜病变患者约为1.03亿人,预计到2045年其将增加至约1.61亿人[8]。但糖尿病视网膜病变的发病机制和诊疗措施仍不十分明确,有待继续研究[9]。多种miRNA和细胞因子参与视网膜血管内皮细胞的病变,选择有效靶点成为治疗糖尿病视网膜病变的关键。
高糖培养视网膜血管内皮细胞是目前糖尿病视网膜病变研究的重要模型之一[10]。高血糖条件下多种miRNA表达异常,是诱发糖尿病视网膜病变的基础[11-12]。miR-140-5p对多种疾病具有调控作用,如GUO等[13]研究发现,敲除miR-140-5p可以促进大鼠骨髓干细胞的成骨作用;TOURY等[14]研究发现,miR-140-5p在抗衰老中具有重要作用;ZHANG等[15]研究显示,上调miR-140-5p可减轻小鼠关节炎的发生。本研究采用高糖培养条件诱导hRECs损伤,并探讨miR-140-5p在糖尿病视网膜病变中的作用,结果显示,高糖组hRECs细胞中miR-140-5p 相对表达量显著低于正常对照组,提示高糖培养会降低hRECs细胞中miR-140-5p的表达;miR-140-5p组hRECs细胞中miR-140-5p相对表达量显著高于正常对照组,而NC组hRECs细胞中miR-140-5p相对表达量与正常对照组相比无显著变化,说明hRECs细胞转染miR-140-5p成功;此外,高糖+miR-140-5p组hRECs细胞中miR-140-5p相对表达量显著高于高糖组,提示转染miR-140-5p后的hRECs细胞在高糖培养条件下仍然高表达miR-140-5p。
有研究显示,高糖环境下hRECs的增殖、迁移和成管能力增加[16-17],这可能是糖尿病视网膜血管病变的细胞学基础。机体内的血糖水平会随着饮食和昼夜节律变化而波动,当机体糖代谢系统出现紊乱时,体内血糖处于持续高水平状态,会对视网膜等血管内皮细胞的生长产生促进作用[18],这可能是hRECs细胞在高糖培养条件下增殖、迁移和成管能力增强的原因。因此,抑制高糖环境下hRECs生物学特性的异常改变,将对治疗糖尿病视网膜病变产生积极作用。本研究进一步观察了高糖培养及miR-140-5p对hRECs细胞增殖、迁移和管腔形成的影响,结果显示,高糖组hRECs细胞的增殖、迁移和成管能力均显著高于正常对照组;而高糖+miR-140-5p组hRECs细胞的增殖能力、迁移能力和成管能力则均显著低于高糖组,说明hRECs细胞转染miR-140-5p后可以缓解高糖造成的细胞损伤,提示miR-140-5p可能具有调节视网膜血管的作用,这为开发基于miR-140-5p治疗糖尿病视网膜病变的药物提供了参考。
VEGF过表达是糖尿病视网膜微血管病理性增生的重要原因之一。研究显示,糖尿病视网膜病变患者的视网膜色素上皮细胞中VEGF蛋白水平显著增加[19]。而VEGF高表达可进一步促进血管的异常生长,导致糖尿病视网膜病变的发生[20]。抗VEGF药物治疗可显著提高视网膜病变患者视力[21]。本研究结果显示,高糖组hRECs细胞中VEGF蛋白相对表达量显著高于正常对照组,而高糖+miR-140-5p组细胞中VEGF蛋白相对表达量显著低于高糖组;提示高糖诱导会导致VEGF的表达增高,而miR-140-5p水平的增高会抑制VEGF的表达,miR-140-5p可能是通过靶向VEGF调控hRECs细胞免受高糖损伤。以上结果初步提示,miR-140-5p是通过靶向减少VEGF表达来调控hRECs的增殖、迁移和成管能力。
糖尿病视网膜病变早期特征为视网膜血管内皮细胞损伤,晚期病理改变为微血管瘤以及新生血管的形成[22]。PARK等[23]研究发现,链脲佐菌素选择性破坏大鼠胰岛β细胞,使大鼠持续高血糖,8周后会产生早期的视网膜病变。TROST等[24]报道,糖尿病大鼠视网膜血管结构损伤、毛细血管分布改变、毛细血管瘤形成的可能原因为长期高血糖造成视网膜毛细血管的周细胞减少及内皮细胞增生所致。为验证miR-140-5p对糖尿病视网膜病变的治疗作用,本研究构建了链脲佐菌素诱导的大鼠糖尿病模型,结果显示,正常对照组大鼠靠近视乳头处的视网膜血管整体呈“树状结构”,内极部毛细血管分布较致密,外极部毛细血管分布较疏松,血管壁均匀;糖尿病模型组大鼠视网膜血管的“树状结构”被破坏,毛细血管分布不均匀,毛细血管瘤形成;糖尿病+NC组大鼠视网膜血管损伤与糖尿病模型组相当;糖尿病+miR-140-5p组大鼠视网膜血管的损伤情况有所好转,毛细血管分布较均匀,毛细血管瘤减少。给予miR-140-5p干预后,大鼠视网膜血管的损伤好转。以上结果说明,高糖会造成hRECs增殖、迁移和成管能力增加,这可能是糖尿病大鼠视网膜血管病理改变的细胞学基础;而miR-140-5p干预后,会显著抑制高糖诱导的hRECs增殖、迁移和成管能力,使大鼠视网膜血管免受高糖的损伤。
4 结论
miR-140-5p可以抑制hRECs在高糖条件下的增殖、迁移及成管能力,缓解糖尿病大鼠视网膜血管病变,其作用可能是通过miR-140-5p靶向调控VEGF的表达而实现。

