促红细胞生成素基因修饰的人脐带间充质干细胞对神经元周期和凋亡的调控作用及机制
班跃耀,孙 蕾,马保东,靳冉冉,李瑞博,孔 宁,张 辉
(1.新乡医学院研究生院,河南 新乡 453003;2.郑州市中心医院神经外科,河南 郑州 450007;3.郑州大学,河南 郑州 450007)
缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是由各种因素引起脑缺氧或缺血导致的脑损伤,在儿童中较多见。HIE在成人中主要是由于呼吸骤停、心脏骤停、休克、中毒、抽搐等原因引起的神经系统缺血和缺氧导致的脑损伤[1-2]。HIE病理性损伤最主要的特征是神经元凋亡,控制神经元凋亡可以改善脑损伤。间充质干细胞(mesenchymal stem cells,MSCs)是非免疫原性干细胞,易增殖,具有分化成包括神经元在内的多种类型细胞的独特能力;而且MSCs来源广泛,不存在伦理问题,可穿过血脑屏障(blood brain barrier,BBB),因此,MSCs在脑损伤的治疗中具有重要的临床意义[3-4]。研究证明,血管内皮生长因子(vascular endothelial growth factor,VEGF)是在缺血缺氧条件下增强BBB通透性的关键因子之一[5];在某些情况下,VEGF与细胞凋亡、促炎细胞因子水平、星形细胞增多症和小胶质细胞活化减少有关[6]。促红细胞生成素(erythropoietin,EPO)具有神经保护和神经再生作用,对于正常的神经发育和损伤修复至关重要[7-9]。 基于此,本研究观察过表达EPO基因的MSCs对缺氧缺血神经元SH-SY5Y细胞系细胞周期、凋亡的影响,探讨MSCs对HIE的保护作用及机制,以期为临床HIE的治疗提供新的思路。
1 材料与方法
1.1 细胞、主要试剂与仪器
人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)由河南省人民医院科教大厦实验室提供,SH-SY5Y细胞系购自武汉普诺赛生命科技有限公司,过表达EPO慢病毒载体、对照病毒感染空载体及慢病毒溶液助转剂购自上海吉凯基因科技有限公司,胰蛋白酶购自北京雷根生物技术有限公司,EPO一抗和二抗购自英国Abcam公司,酶联免疫吸附测定法(enzyme linked immunosorbent assay,ELISA)检测试剂盒购自赛默飞世尔科技(中国)有限公司;细胞培养箱购自力新仪器(上海)有限公司,倒置显微镜、荧光显微镜购自德国Carl Zeiss 公司。
1.2 实验方法
1.2.1 细胞培养
hUC-MSCs培养:取装有hUC-MSCs的冷冻管,立即置于37 ℃水槽中快速解冻,按5×109L-1接种到T75培养瓶中,置于37 ℃、含体积分数5%CO2细胞培养箱中培养,间隔3~4 d换液并观察贴壁细胞生长情况,待细胞达到70%~80%融合时进行传代培养;去除培养瓶中的培养基,使用磷酸缓冲盐溶液(phosphate buffered saline,PBS)清洗细胞1~2次,滴加2.5 g· L-1胰蛋白酶消化液2 mL,轻微转动培养瓶,使消化液覆盖整个培养瓶底,去除多余胰蛋白酶消化液,在37 ℃温浴1~2 min;倒置显微镜下观察细胞回缩变圆后,加入10 mL完全培养基终止消化;用吸管轻轻吹打混匀,按12或13适当的比例进行接种传代,补充新鲜完全培养基至10 mL,置于 37 ℃、含体积分数5%CO2饱和湿度的细胞培养箱中培养;待细胞完全贴壁后,每隔2~3 d更换新鲜的完全培养基,取对数生长期细胞用于后续实验。
SH-SY5Y细胞系培养:取装有SH-SY5Y细胞系的冷冻管,立即置于37 ℃水槽中快速解冻,按5×109L-1浓度接种到T75培养瓶中,置于37 ℃、含体积分数5%CO2细胞培养箱中培养,间隔3~4 d换液并观察贴壁细胞生长情况,待细胞达到70%~80%融合时进行传代培养;先尽量吸干净T75瓶专用培养基,再加3~4 mL 常温PBS轻轻润洗细胞10~20 s,滴加1 mL胰蛋白酶,轻轻晃动培养瓶使胰蛋白酶均匀铺在瓶底细胞层,将培养瓶置于37 ℃培养箱中消化细胞,专用培养基终止胰蛋白酶消化;混匀细胞,按 13比例进行接种传代,补充专用完全培养基至10 mL,置于37 ℃、含体积分数5%CO2饱和湿度的细胞培养箱中培养;待细胞完全贴壁后,每隔2~3 d更换新鲜的专用培养基,取对数生长期细胞用于后续实验。
1.2.2 过表达EPO的MSCs构建
取对数生长期hUC-MSCs接种于6孔板上,待细胞稳定生长至融合度达30%时,加入过表达EPO慢病毒载体、对照病毒感染空载体(11 000),混匀后继续培养3 d;应用2 mg·L-1嘌呤霉素进行抗生素抗性筛选,待观察到贴壁细胞发出荧光即为病毒感染成功;换液除去悬浮死细胞,继续培养,待细胞融合度达80%~90%时消化细胞;应用流式细胞仪分选荧光强度较强的细胞并收集,将收集的细胞置入T75培养瓶扩大培养,其中携带EPO基因的MSCs定义为EPO-MSCs,携带空载慢病毒的MSCs定义为NC-MSCs,置于液氮中冻存,用于后续实验。
1.2.3 Western blot检测MSCs组、EPO-MSCs组及NC-MSCs组细胞中EPO蛋白表达
取hUC-MSCs组、EPO-MSCs组及NC-MSCs组细胞,使用放射免疫沉淀裂解缓冲液裂解hUC-MSCs、EPO-MSCs及NC-MSCs,提取总蛋白;然后,使用加热块在100 ℃下变性,使用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量的蛋白质,电转移到聚偏二氟乙烯膜上;用脱脂牛奶封闭,滴加EPO一抗(滴度为 15 000),4 ℃下孵育过夜;滴加山羊抗兔IgG二抗(滴度为 15 000)孵育;然后,使用增强电化学发光试剂显影,应用 Image J软件分析灰度值,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)为内参,EPO蛋白的相对表达量以EPO灰度值与GAPDH灰度值的比值表示。实验重复3次,取均值。
1.2.4 实时荧光定量聚合酶链反应检测hUC-MSCs组、EPO-MSCs组及NC-MSCs组细胞中EPO mRNA表达
取hUC-MSCs组、EPO-MSCs组及NC-MSCs组细胞,使用细胞总 RNA 提取试剂盒提取总 RNA,并使用 Prime Script 反转录酶(TaKaRa D6210S) 将总 RNA 反转录为 cDNA。设计荧光定量 PCR EPO引物:上游引物序列为5′-GCTGCATGTGGATAAAGCCG-3′,下游引物序列为5′-AGACTCGGAAGAGTTTGCGG-3′,以β-actin为内参。每个反应设3个平行管,总反应体系为10 μL,包含Faststart Universal SYBR green master mix 5.0 μL,上、下游引物各0.5 μL,反转录反应产物模板1.0 μL,灭菌水3.0 μL。反应条件:94 ℃预变性10 min,94 ℃ 变性15 s, 60 ℃退火1 min,共40 个循环;72 ℃终末延伸 50 s;应用2-△△Ct法计算EPO mRNA相对表达量。实验重复3次,取均值。
1.2.5 ELISA 法检测hUC-MSCs、EPO-MSCs及NC-MSCs上清液中 EPO 蛋白表达
将hUC-MSCs、EPO-MSCs及NC-MSCs接种至含不完全培养基培养瓶中培养,培养24 h后用移液枪吸取上清液;分别将100 μL标准品及待测上清液加入酶标板中,37 ℃孵育2 h,用洗涤液充分洗涤板,用滤纸吸干板中的残余液体;然后,每孔分别加入 100 μL的EPO一抗,轻轻混匀,室温孵育1 h,洗涤液充分洗涤3次;再于每孔中加入 100 μL的酶标二抗,混匀,室温孵育1 h,洗涤液充分洗涤3次;然后,每孔加入100 μL的底物液,轻轻混匀,室内温度避光孵育 30 min;每孔加入50 μL终止液,用酶标仪在450 nm 波长处测定吸光度值。按照说明书的浓度梯度稀释标准品,制备标准曲线,根据标准曲线计算EPO蛋白水平。实验重复3次,取均值。
1.2.6 缺氧缺血性神经元细胞制备
将SH-SY5Y细胞和MSCs接种至Transwell细胞培养板中,置于37 ℃、含体积分数5%O2培养箱中共培养。取相同数量SH-SY5Y细胞分为常氧组和缺氧缺血组;将常氧组细胞于37 ℃、含体积分数5%O2培养箱中培养,即为常氧SH-SY5Y细胞;将缺氧缺血组SH-SY5Y细胞接种在下部隔室中,置于含体积分数0.5%O2三气体培养箱中24 h造成细胞缺血缺氧,即缺氧缺血SH-SY5Y细胞。
1.2.7 MSCs、NC-MSCs、EPO-MSCs与缺血缺氧SH-SY5Y细胞共培养
从仿真结果可以看出,本文方法能够保证在较高精确性的前提下,较好地解决局部噪声斑块的解缠问题.与传统最小二乘迭代法的解缠效果相比,经掩膜滤波和质量图法重新定义权值的四向加权最小二乘迭代法效果更好,填充速度更快,减少了一半的迭代次数,且解缠结果也较好.
取缺氧缺血SH-SY5Y细胞接种至细胞共培养皿中,随机分为MSCs共培养组、NC-MSCs共培养组、EPO-MSCs共培养组;将MSCs、NC-MSCs、EPO-MSCs 分别接种至共培养皿跨孔膜插入物上,置于含体积分数0.5%O2三气体培养箱中孵育24 h。
1.2.8 流式细胞术检测缺氧缺血SH-SY5Y细胞及共培养细胞周期
取SH-SY5Y细胞、缺氧缺血SH-SY5Y细胞、MSCs共培养组细胞、NC-MSCs共培养组细胞、EPO-MSCs共培养细胞,用2.5 g·L-1胰蛋白酶消化,PBS洗涤1次,室温下1 500 r·min-1离心10 min,弃去上清液;使用400 μL PBS溶液将细胞吹打后转移至10 mL体积分数 70%冰冷乙醇中,过夜固定;然后,加入等量PBS溶液稀释,1 600 r·min-1离心10 min,弃上清;再加入200 μL PBS稀释后转移至流式管中,2 000 r·min-1离心10 min,弃上清;加入 500 μL碘化丙啶(propidium iodide,PI)溶液,5 min 后100目滤网过滤,使用流式细胞仪检测细胞周期。实验重复3次,取均值。
1.2.9 流式细胞术检测缺氧缺血SH-SY5Y细胞及共培养细胞情况
取SH-SY5Y细胞、缺氧缺血SH-SY5Y细胞、MSCs 共培养组细胞、NC-MSCs共培养组细胞、EPO-MSCs 共培养组细胞各约5×106个,分别加入500 μL PBS洗涤,3 000 r·min-1离心 10 min,弃上清;用1 mL Annexin V Binding Buffer溶液重悬浮;然后,滴加5 μL FITC-Annexin溶液、10 μL PI溶液染色,室温下避光静置15 min,使用流式细胞仪检测细胞凋亡情况。实验重复3次,取均值。
1.2.10 RNA-Seq分析转录组学水平上差异基因表达
选取缺氧缺血SH-SY5Y细胞作为B组,与NC-MSCs、EPO-MSCs分别共培养48 h后的缺氧缺血SH-SY5Y细胞为C组(缺氧缺血SH-SY5Y+NC-MSCs组)和T组(缺氧缺血SH-SY5Y+EPO-MSCs组);使用三唑试剂提取3组细胞总RNA,并在转录后行RNA-Seq分析。基因表达量由每百万个片段映射的每千基转录本片段数(fragments per kilobase of exon model per million mapped fragments,FPKM)计算。log2(折叠变化)>1和Q<0.001的基因被认为是差异表达基因(differential gene,DEG)。基于DEG进行火山图、维恩图、基因C光泽和富集京都基因和基因组百科全书(kyoto encyclopedia of genes and genomes,KEGG)通路分析。
1.3 统计学处理
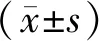
2 结果
2.1 EPO-MSCs和NC-MSCs的转染效率
A:EPO-MSCs白光下的细胞形态;B:EPO-MSCs蓝光下绿色荧光细胞形态;C:NC-MSCs白光下的细胞形态;D:NC-MSCs蓝光下绿色荧光细胞形态。

A:EPO-MSCs慢病毒感染效率;B:NC-MSCs慢病毒感染效率。
2.2 MSCs 组、NC-MSCs组和EPO-MSCs组细胞中EPO蛋白及mRNA相对表达量比较
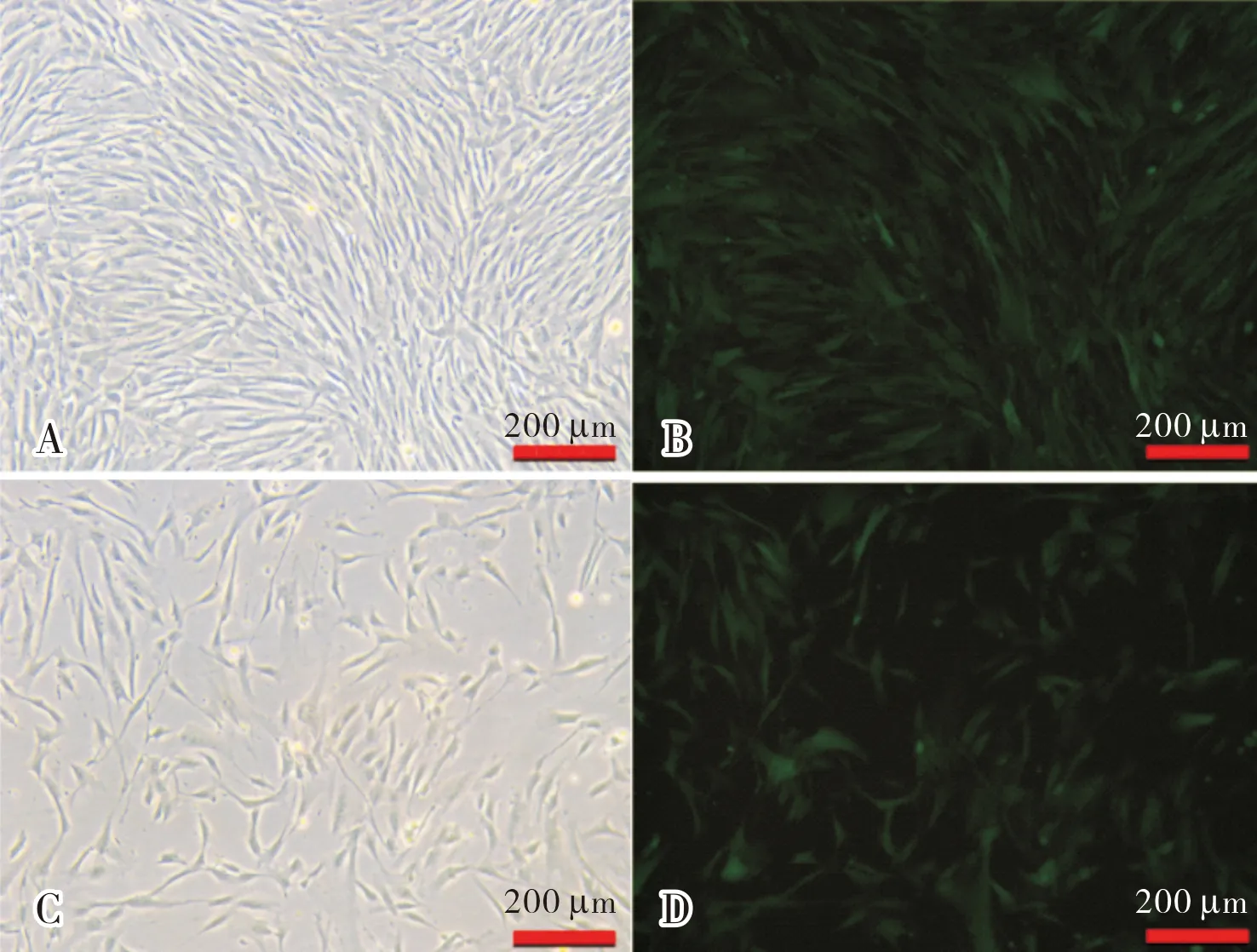
MSCs组、NC-MSCs组和EPO-MSCs组细胞中EPO蛋白相对表达量分别为 177 543.00±10 026.09、156 848.67±11 020.44、224 622.33±1 124.30,EPO mRNA相对表达量分别为 1.17±0.00、0.49±0.00、46.25±0.00 ;3组间EPO蛋白和mRNA相对表达量比较差异有统计学意义(F=31.40、968.69,P<0.05);EPO-MSCs组细胞中EPO蛋白和mRNA相对表达量显著高于MSCs组和NC-MSCs组,差异有统计学意义(P<0.05); MSCs组与NC-MSCs组中EPO蛋白和mRNA相对表达量比较差异无统计学意义(P>0.05)。结果见图3。
1:MSCs组;2:NC-MSCs组;3:EPO-MSCs组。
2.3 MSCs组、NC-MSCs组和EPO-MSCs组细胞上清液中EPO蛋白表达水平比较
MSCs组、NC-MSCs组和EPO-MSCs组细胞上清液中EPO蛋白表达水平分别为0.19±0.00、0.23±0.00、3.23±0.00。3组细胞上清液中EPO蛋白表达水平比较差异有统计学意义(F=2 219.69,P<0.05);EPO-MSCs组细胞上清液中EPO蛋白表达水平显著高于MSCs组和NC-MSCs组,差异有统计意义(P<0.05);MSCs组与NC-MSCs组细胞上清液中EPO表达水平比较差异无统计学意义(P>0.05)。
2.4 常氧组、缺氧缺血组、MSCs共培养组、NC-MSCs共培养组及EPO-MSCs共培养组SH-SY5Y细胞凋亡率比较
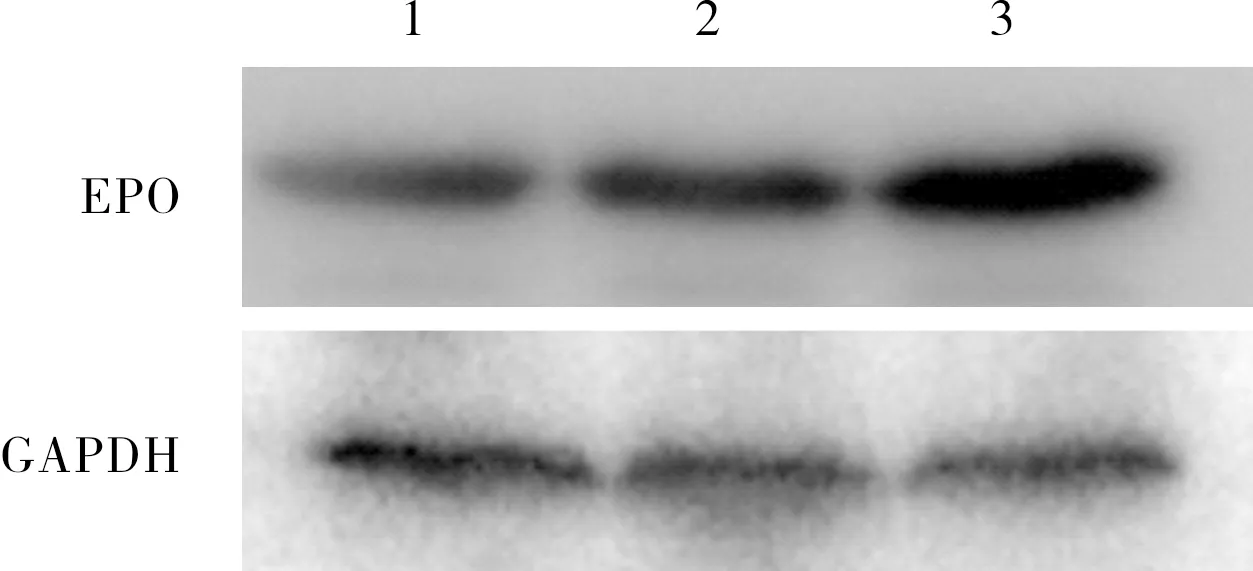
常氧组和缺氧缺血组SH-SY5Y细胞凋亡率分别为(0.73±0.12)%、(40.76±1.50)%;缺氧缺血组SH-SY5Y细胞凋亡率显著高于常氧组,差异有统计学意义(t=37.520,P<0.05)。MSCs共培养组、NC-MSCs共培养组和EPO-MSCs共培养组SH-SY5Y细胞凋亡率分别为(28.37±2.30)%、(23.50±1.78)%、(6.40±0.77)%;3组SH-SY5Y细胞凋亡率比较差异有统计学意义(F=88.600,P<0.05);EPO-MSCs共培养组SH-SY5Y细胞凋亡率显著低于MSCs共培养组和NC-MSCs共培养组,差异有统计学意义(t=12.830、3.810,P<0.05);MSCs共培养组与NC-MSCs共培养组SH-SY5Y细胞凋亡率比较差异无统计学意义(t=2.370,P>0.05)。MSCs共培养组、NC-MSCs共培养组和EPO-MSCs共培养组SH-SY5Y细胞凋亡率显著低于缺氧缺血组,差异有统计学意义(t=6.395、5.520、28.760,P<0.05)。结果见图4。
A:常氧组;B:缺氧缺血组;C:MSCs共培养组;D:NC-MSCs共培养组;E:EPO-MSCs共培养组。
2.5 常氧组、缺氧缺血组、MSCs共培养组、NC-MSCs共培养组及EPO-MSCs共培养组SH-SY5Y细胞周期比较
常氧组和缺氧缺血组G0-G1期SH-SY5Y细胞比例分别为(76.04±2.58)%、(93.97±1.02)%;缺氧缺血组G0-G1期SH-SY5Y细胞比例显著高于常氧组,差异有统计学意义(t=9.120,P<0.05)。MSCs共培养组、NC-MSCs共培养组和EPO-MSCs共培养组G0-G1期SH-SY5Y细胞比例分别为(85.20±1.34)%、(81.29±1.16)%、(70.25±1.61)%,3组G0-G1期SH-SY5Y细胞比例比较差异有统计学意义(F=88.600,P<0.05);EPO-MSCs共培养组G0-G1期SH-SY5Y细胞比例显著低于MSCs共培养组和NC-MSCs共培养组,差异有统计学意义(t=10.110、7.880,P<0.05);MSCs共培养组与NC-MSCs共培养组G0-G1期SH-SY5Y细胞比例比较差异无统计学意义(t=3.120,P>0.05)。MSCs共培养组、NC-MSCs共培养组和EPO-MSCs共培养组G0-G1期SH-SY5Y细胞比例显著低于缺氧缺血组,差异有统计学意义(t=7.360、11.590、17.610,P<0.05)。结果见图5。
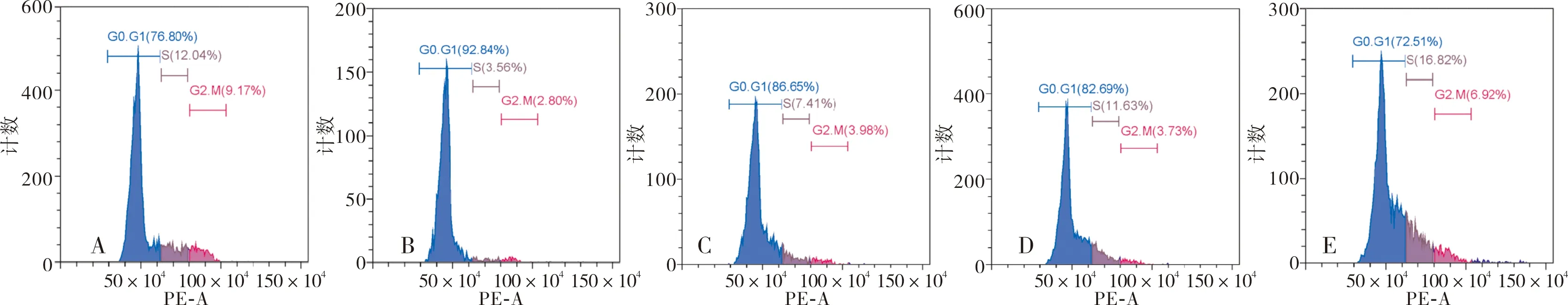
A:常氧组;B:缺氧缺血组;C:MSCs共培养组;D:NC-MSCs共培养组;E:EPO-MSCs共培养组。
2.6 EPO 过表达对MAPK信号通路的影响
在B组和T组之间共鉴定出4 726个上调基因和4 405 个下调基因,共9 131个DEG(图6A)。在B组和C组之间共发现4 352个上调基因和4 809个下调基因,共9 161个DEG(图6A)。在所有DEG中,3组均表达的基因有116个(图6B)。基因聚类分析发现,相较于B组,T组的基因差异表达更为显著(图6C)。KEGG途径富集结果显示,MAPK信号通路和细胞凋亡通路是B组和T组中富集程度最高的通路(图6D)。RNA-seq鉴定显示,p53途径的激活在细胞凋亡的调节中起关键作用。
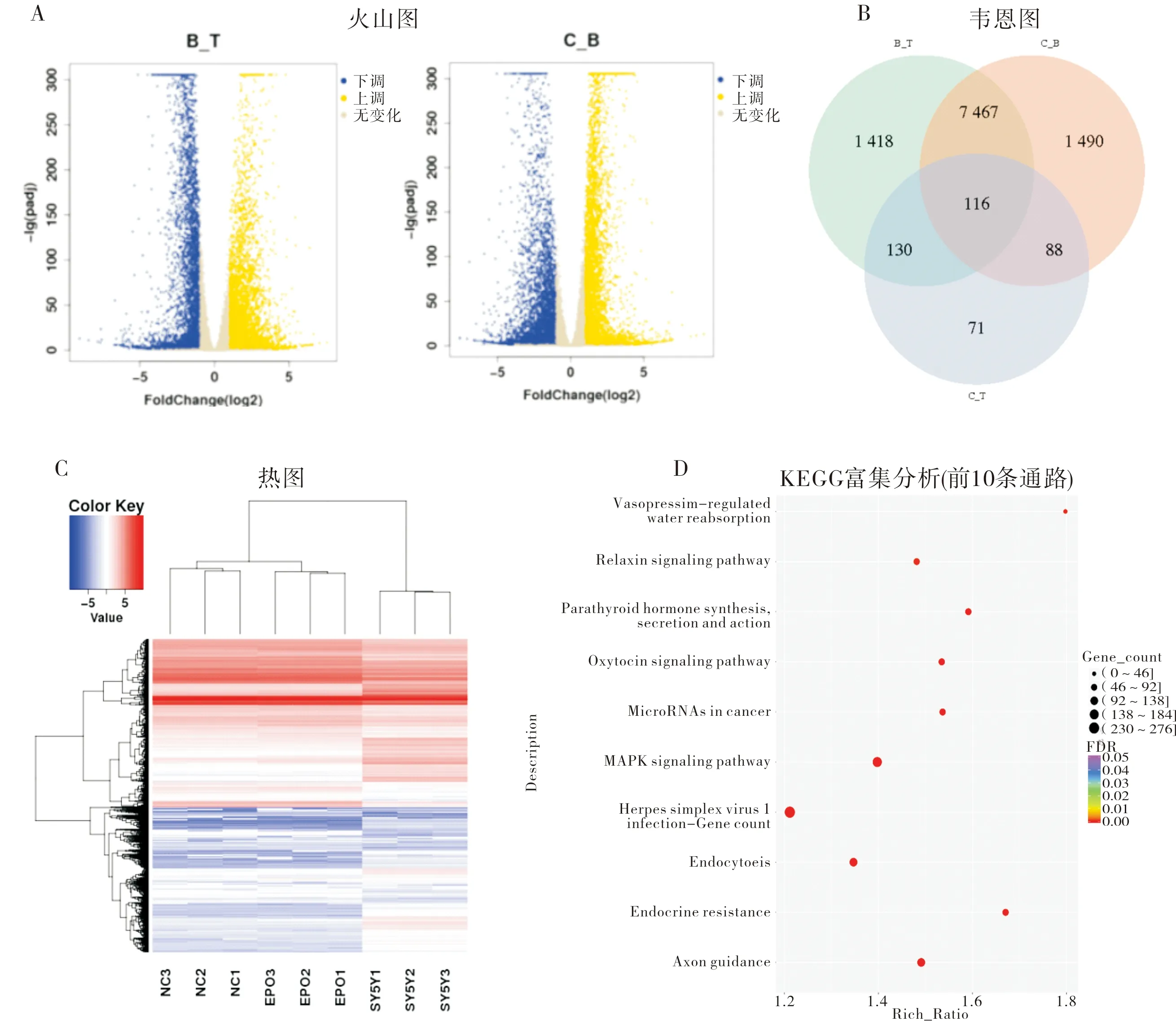
A:T组、C组与B组间的DEG火山图,以 P<0.001 为阈值确定 DEG 的显著性,黄点表示上调的 DEG,蓝点表示下调的 DEG,灰点表示2组之间无显著变化的转录本;B:T组、C组与B组之间DEG 数;C:基因聚类分析,X 轴表示不同的样本,而 Y 轴表示DEG,颜色从蓝色到红色表示从低到高的 DEG 表达式强度;D:KEGG途径富集分析,X轴显示富集因子,左侧 Y 轴显示前 10 个正 KEGG 通路名称,颜色越深表示 q 值越小,气泡大小表示 DEG 数。
3 讨论
HIE是一种由各种因素引起的脑血流量减少导致的脑损伤性病,会遗留各种并发症,包括癫痫发作、意识改变、呼吸困难、肌张力差或代谢异常等急性症状以及脑性瘫痪、癫痫、智力障碍、行为障碍等慢性疾病,甚至导致过早死亡,给患者及其家庭带来极其沉重的负担。目前,尚无 HIE 临床治疗很有效的方法。因此,研究新型治疗HIE的方法、作用机制并尽早应用于临床中具有重要意义。EPO 主要由肾脏球旁器颗粒细胞产生,但在小胶质细胞、星形胶质细胞和神经元细胞等细胞表面亦可见到EPO受体大量表达,低氧使EPO/EPO受体明显上调,作为一种内源性神经保护机制在缓解缺氧导致脑损伤中发挥重要作用;但在正常状态下,仅1%~2% EPO能通过BBB,故需补充外源性EPO以发挥脑保护作用。研究表明,通过脑内或全身注射EPO可减轻脑损伤[10]。MSCs是非免疫原性干细胞,易于增殖,并具有分化成多种细胞类型的独特能力[4]。研究报道,MSCs迁移到炎症部位,可发挥抗炎作用并减少活性氧[11]。PARK等[12]研究报道,MSCs可减少因缺氧缺血导致的神经元凋亡,减轻神经元缺氧损伤。成人临床试验已经证明,MSCs在骨科损伤、心血管疾病、肝脏疾病、自身免疫疾病和移植物抗宿主病中可发挥再生潜力[13]。但关于基于EPO研究MSCs 在HIE治疗中的作用和机制较少。
本研究结果显示,EPO-MSCs慢病毒转染效率为98.51%,NC-MSCs慢病毒转染效率为97.83%;EPO-MSCs组细胞中EPO蛋白和mRNA相对表达量显著高于MSCs和NC-MSCs,MSCs与NC-MSCs中EPO蛋白和mRNA相对表达量比较差异无统计学意义;且EPO-MSCs上清液中EPO蛋白表达水平显著高于MSCs和NC-MSCs, MSCs与NC-MSCs上清液中EPO表达水平比较差异无统计学意义。这一结果说明,过表达MSCs构建成功,EPO-MSCs归巢到受损的神经细胞部分时,EPO-MSCs可以大量释放EPO到细胞外,从而发挥其免受NMDA 受体介导的谷氨酸毒性,并通过抑制细胞凋亡来发挥神经保护作用[14-16]。
本研究将SH-SY5Y细胞暴露于含体积分数0.5%O2中24 h造成细胞缺氧缺血,并将缺氧缺血SH-SY5Y细胞与MSCs、NC-MSCs、EPO-MSCs共培养,流式细胞术检测显示,EPO-MSCs共培养组SH-SY5Y 细胞凋亡率显著低于MSCs 共培养组和NC-MSCs共培养组, MSCs共培养组与NC-MSCs共培养组SH-SY5Y细胞凋亡率比较差异无统计学意义,MSCs共培养组、NC-MSCs共培养组和EPO-MSCs共培养组SH-SY5Y细胞凋亡率显著低于缺氧缺血组;EPO-MSCs共培养组G0-G1期SH-SY5Y细胞比例显著低于MSCs共培养组与NC-MSCs共培养组,MSCs共培养组和NC-MSCs共培养组G0-G1期SH-SY5Y细胞比例比较差异无统计学意义,MSCs共培养组、NC-MSCs共培养组和EPO-MSCs共培养组G0-G1期SH-SY5Y细胞比例显著低于缺氧缺血组。这说明,EPO-MSCs可显著抑制缺血缺氧神经元凋亡,减少细胞间期阻滞,进而发挥脑损伤的保护作用。JUUL等[17]研究也发现,内源性EPO增加可预防脑组织缺血损伤。此外,本研究对缺氧缺血SH-SY5Y细胞以及与NC-MSCs、EPO-MSCs共培养缺氧缺血SH-SY5Y细胞进行RNA提取和转录,并行RNA-Seq分析,结果显示,MAPK信号通路和细胞凋亡通路是与NC-MSCs共培养缺氧缺血SH-SY5Y细胞、EPO-MSCs共培养缺氧缺血SH-SY5Y细胞中富集程度最高的通路, p53途径的激活在细胞凋亡的调节中起关键作用;这说明,EPO介导的MAPK通路对神经元有重要影响,可减少氧化应激[18-19];EPO-MSCs可进一步增强MSCs对缺氧诱导的SH-SY5Y细胞损伤的保护作用,这可能通过MAPK-p53途径实现。
4 结论
EPO过表达的MSCs可显著抑制缺氧缺血神经元凋亡,减少细胞间期阻滞,EPO基因修饰可增强MSCs对HIE的保护作用,其 机 制 可 能 与EPO过表达的MSCs激活MAPK-p53信号通路有关,但其具体的调控机制还需进一步研究;这为EPO基因修饰MSCs应用于临床HIE的治疗提供一定依据。

