少突胶质样细胞条件培养液通过调节Sirt1/PGC-1α通路改善SH-SY5Y细胞氧化应激损伤
牛冬冬, 凌亚亭, 吕孝瑞, 王子瑜, 胡嘉波
(1. 江苏大学医学院, 江苏 镇江 212013; 2. 海尔施生物医药股份有限公司医学检验所, 浙江 宁波 315042)
人胚胎干细胞源神经干细胞(human neural stem cells,hNSCs)是一种多能干细胞,具有自我更新、多向分化潜力[1]。少突胶质细胞是中枢神经系统的调节细胞,不仅可以在中枢神经系统中包裹轴突形成髓鞘,还可以通过旁分泌作用支持保护神经元,抑制神经元凋亡[2]。然而临床上原代的少突胶质细胞来源受限,难以体外大量扩增[3]。基于移植细胞在体内迁移能力较差且存活率低[4],少突胶质细胞的旁分泌作用成为关注焦点。神经退行性疾病与氧化应激损伤密切相关[5],人神经干细胞源少突胶质样细胞条件培养液(oligodendrocytes-like conditioned medium,OCM)成分丰富,可以很好地在体外模拟少突胶质样细胞(oligodendrocytes-like,OLs)的旁分泌作用。hNSC-OLs可以在体外大量扩增,有望成为理想的种子细胞,为组织工程源源不断地提供生物材料应用于神经退行性疾病的治疗。本研究旨在探究OLs是否具备体外成髓鞘能力及OCM在人神经母细胞瘤细胞(SH-SY5Y)氧化应激损伤中的作用,为神经退行性疾病的治疗提供新思路。
1 材料与方法
1.1 主要试剂与仪器
人神经母细胞瘤SH-SY5Y细胞(北京四正柏生物科技有限公司);NSCs由人胚胎干细胞诱导分化所得[6]。DMEM、DMEM/F12、FBS、Neurobasal培养基(美国Gibco公司),人表皮细胞生长因子(EGF)、碱性成纤维细胞生长因子(bFGF)、血小板衍生生长因子-AA(PDGF-AA)、神经营养因子-3(NT-3)、脑源性生长因子(BDNF,美国PeproTech公司),佛司可林(FSK,上海源叶生物科技有限公司),B27、NEAA(美国Thermo Fisher公司),基质胶(美国Corning公司),视黄酸(RA)、维生素C(vitamin C,Vc)、Accutase(美国Sigma公司),青霉素-链霉素双抗(美国Invitrogen公司),CCK-8(美国APExBIO公司),DAPI、线粒体膜电位检测试剂盒、还原型谷胱甘肽(GSH)含量检测试剂盒(北京索莱宝科技有限公司),兔抗Olig2抗体、兔抗SOX10抗体、鼠抗Tuj抗体(英国Abcam公司),CyTM3-偶联亲和纯化山羊抗兔IgG二抗(美国Jackson公司),山羊抗小鼠IgG-Alexa Fluor488二抗(美国Thermo Fisher公司),活性氧检测试剂盒(大连美仑生物技术有限公司),乳酸脱氢酶(LDH)检测试剂盒、丙二醛(MDA)检测试剂盒、超氧化物歧化酶(SOD)检测试剂盒(南京建成生物工程研究所),Annexin V-FITC/PI凋亡试剂盒(南京诺唯赞公司),单克隆兔抗β-肌动蛋白抗体(美国CST公司),兔抗Bax抗体(英国Abcam公司),兔抗Bcl-2抗体、兔抗Sirt1抗体、兔抗PGC-1α抗体(美国Affinity公司),山羊抗兔HRP标记二抗(苏州睿瀛生物技术公司),Sirt1抑制剂EX527(美国Selleck公司)。激光共聚焦显微镜(德国Carl Zeiss公司),荧光显微镜(日本Olympus公司),多功能酶标仪(Cytation5,美国Biotek公司),超速离心机(美国Thermo Fisher公司),流式细胞仪(美国贝克曼公司)。
1.2 方法
1.2.1 细胞培养 SH-SY5Y细胞培养在含10% FBS的DMEM中,细胞汇合度达90%时进行传代。NSCs由人胚胎干细胞分化得到,培养在含1% NEAA、20 ng/mL EGF、20 ng/mL bFGF、2% B27、100 U/mL青霉素-链霉素双抗的无血清DMEM/F12中。NSCs汇合度达90%时进行传代。在37 ℃、5% CO2饱和湿度条件下培养SH-SY5Y细胞和NSCs。
1.2.2 hNSC-OLs分化 使用P4~P18(第4代至第18代)NSCs进行OLs分化,在NSCs汇合度达60%左右时弃去原有的培养液,用无血清DMEM/F12清洗3遍,换成含10% FBS、10 ng/mL PDGF-AA、10 ng/mL NT-3、20 ng/mL bFGF、35 ng/mL RA、5 μmol/L FSK、100 U/mL双抗的DMEM/F12。首次替换OLs分化培养基的细胞命名为第0代少突胶质样细胞(P0-OLs),当P0-OLs汇合度达90%时进行细胞传代。
1.2.3 免疫荧光鉴定OLs 6孔板中放置爬片,铺置基质胶,将NSCs和P0-OLs用Accutase消化,终止消化后将NSCs和P0-OLs以5×104/mL的密度铺置在6孔板中,分别使用NSCs培养液和OLs培养液继续培养。48 h后弃去各自的培养液,PBS洗涤1遍,4%多聚甲醛固定5 min,PBS洗涤1遍,0.1% Triton X-100透化5 min,PBS洗涤1遍,1% BSA封闭1 h。1 ∶160稀释兔抗Olig2抗体,1 ∶200稀释兔抗SOX10抗体,4 ℃孵育过夜。弃去一抗工作液,PBS洗涤1遍,1 ∶200配制CyTM3-偶联亲和纯化山羊抗兔IgG(H+L)二抗,二抗孵育1 h,PBS洗涤4次,每次30 min,加入DAPI染细胞核,覆盖住细胞表面即可,室温孵育4 min,PBS洗涤3次,每次20 min,封片,激光共聚焦显微镜观察。
1.2.4 hNSCs神经元分化 使用P4~P18 NSCs进行神经元分化,在NSCs汇合度达40%左右时弃去原有的培养液,使用Neurobasal培养液清洗3遍,换成补充10 ng/mL BDNF、2% B27、20 ng/mL bFGF、100 U/mL双抗的Neurobasal培养基,每2~3 d换1次液,2周之后拍照记录。
1.2.5 OLs与神经元共培养及共聚焦显微镜检测髓鞘形成 在神经元分化2周时,将OP1(P0-OLs传代得到,即第一代少突胶质样细胞)以5×104/mL密度消化后接种在神经元上,使用OLs培养液继续培养,3 d后进行免疫荧光染色。1 ∶160稀释兔抗Olig2抗体,1 ∶2 000稀释鼠抗Tuj抗体,4 ℃孵育过夜。弃去一抗工作液,1 ∶200配制 CyTM3-偶联亲和纯化山羊抗兔IgG(H+L)二抗,1 ∶500配制山羊抗小鼠IgG(H+L)-Alexa Fluor488二抗,孵育后,激光共聚焦观察。
1.2.6 OLs条件培养液(OCM)的收集 收集P0-OLs传代后的1~2代(P1~P2)OCM。当OLs细胞汇合度达90%左右时,弃去原来的培养液,用无血清DMEM轻轻洗涤细胞5次,再加入无血清DMEM继续培养。12 h后收集上清液,以2 000 r/min离心20 min沉淀细胞碎片,随后将收集的上清液用0.22 μm滤器进行过滤,得到OCM。分装,置于-80 ℃保存备用。
1.2.7 CCK-8测定细胞活力 将SH-SY5Y细胞以1×104/孔接种于96孔板中,加入SH-SY5Y细胞完全培养基培养24 h后,正常对照组(NC组)使用无血清DMEM继续培养24 h,加药组设置50、100、200、400 μmol/L 4个浓度的H2O2处理细胞,24 h后吸去原有的培养液,加入100 μL CCK-8工作液,20 min后测定光密度,后续实验均选用200 μmol/L H2O2处理细胞。设置含200 μmol/L H2O2的25%、50%、75%、100%的OCM处理SH-SY5Y细胞,24 h后同上述方法测定光密度。后续实验均使用75% OCM处理SH-SY5Y细胞,即简称为H2O2+OCM组。H2O2+Vc组在含200 μmol/L H2O2的DMEM中补充100 μmol/L Vc,作为阳性对照。细胞处理24 h到达实验终点,取上清液,应用LDH试剂盒测定细胞毒性。光学显微镜观察SH-SY5Y细胞形态。
1.2.8 流式细胞术检测活性氧 将SH-SY5Y细胞以1×105/mL密度接种于6孔板中,完全培养基培养24 h后,NC组细胞处理如“1.2.7”所述,H2O2组替换为含200 μmol/L H2O2的DMEM处理24 h,H2O2+OCM组替换为含200 μmol/L H2O2的75% OCM处理24 h,H2O2+Vc组在含200 μmol/L H2O2的DMEM中补充100 μmol/L Vc处理24 h。实验终点,弃上清液,参照说明书将SH-SY5Y细胞和DCFH-DA(1 μmol/L)探针避光孵育30 min,阴性对照组不添加探针,PBS洗涤3次,流式细胞仪检测。
1.2.9 化学发光法检测SOD、GSH、MDA含量 将SH-SY5Y细胞以1×105/mL密度接种于大皿后使用完全培养基培养24 h,NC组、H2O2组、H2O2+OCM组、H2O2+Vc组细胞处理如“1.2.8”所述,弃上清液,PBS洗涤3遍,超声破碎裂解细胞,收集离心后测定蛋白浓度。MDA含量及SOD、GSH活性根据试剂盒说明书进行测定。
1.2.10 荧光探针检测线粒体膜电位 将SH-SY5Y细胞以1×105/mL密度接种于6孔板后使用完全培养基培养24 h,如“1.2.8”所述,NC组、H2O2组、H2O2+OCM组、H2O2+Vc组细胞处理12 h。参照说明书配制线粒体膜电位检测探针,将不同处理组细胞与探针37 ℃孵育20 min,弃去探针工作液,加入2 mL完全培养基,荧光显微镜观察。
1.2.11 流式细胞术测定SH-SY5Y细胞凋亡 SH-SY5Y细胞以1×105/mL的密度接种于6孔板中,完全培养基培养24 h,NC组、H2O2组、H2O2+OCM组细胞处理如“1.2.8”所述,弃去各处理组的培养液,PBS洗涤3次,用不含EDTA的胰酶消化细胞,60 s后加入培养液终止消化,收集细胞在EP管中,1 000 r/min、4 ℃离心5 min,弃上清液,PBS洗涤2次,加入100 μL缓冲液重悬细胞,加入5 μL Annexin V-FITC和5 μL PI荧光探针室温避光孵育10 min后再加入400 μL缓冲液混匀,置于冰盒中,流式细胞仪检测。
1.2.12 EX527处理SH-SY5Y细胞 NC组、H2O2组、H2O2+OCM组细胞处理如“1.2.7”所述,H2O2+OCM+EX527组,使用20 μmol/L Sirt1特异性抑制剂EX527预处理SH-SY5Y细胞2 h后,使用含200 μmol/L H2O2的OCM处理24 h;NC+EX527组,使用20 μmol/L Sirt1特异性抑制剂EX527预处理SH-SY5Y细胞2 h后,使用无血清DMEM继续培养24 h。
1.2.13 蛋白质印迹法检测细胞凋亡和Sirt1相关蛋白表达 NC组、H2O2组、H2O2+OCM组、H2O2+OCM+EX527组、NC+EX527组,细胞处理如“1.2.8”和“1.2.12”所述,实验终点,弃上清液,用预冷的PBS洗涤细胞1遍,每孔加入100 μL含1% PMSF的RIPA裂解液,细胞刮刀刮取细胞后充分研磨并置于EP管中,冰上裂解1 h,裂解期间每隔15 min剧烈振荡1次;12 000×g离心10 min,收取上清液测定蛋白浓度,按照4 ∶1的比例加入上样缓冲液,混匀,100 ℃金属浴10 min,-20 ℃保存。等量上样,行SDS-PAGE,蛋白转印至PVDF膜,TBST洗涤5 min,5% BSA封闭2 h,TBST清洗2次,每次5 min,将PVDF膜置于一抗工作液中,4 ℃冰箱摇床孵育过夜。使用的一抗包括:兔抗Bax抗体(1 ∶800)、兔抗Bcl-2抗体(1 ∶1 000)、兔抗Sirt1抗体(1 ∶1 000)、兔抗PGC-1α抗体(1 ∶1 000)、抗β-肌动蛋白抗体(1 ∶2 000)。第二天将膜取出,摇床上使用TBST清洗3次,每次10 min,1 ∶1 000稀释二抗,将膜充分浸泡在对应的二抗中,室温孵育1 h,TBST清洗3次,每次10 min。ECL显色系统曝光,观察条带并保存图像,使用Image J软件分析条带灰度值。
1.3 统计学分析

2 结果
2.1 NSCs分化为OLs
对比NSCs,OLs凸起明显变长,细胞呈纺锤状,多边长梭形,与NSCs玫瑰花环样结构有明显不同(图1A)。激光共聚焦结果显示,OLs表达少突胶质细胞标志物Olig2和SOX10,而NSCs则几乎不表达(图1B、1C)。
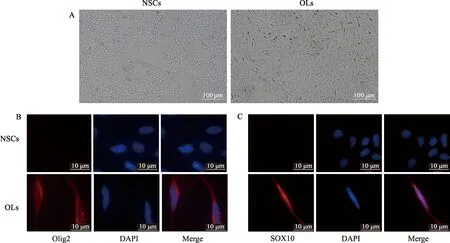
A:NSCs与OLs形态学比较;B:少突胶质细胞标志物Olig2激光共聚焦图;C:少突胶质细胞标志物SOX10激光共聚焦图图1 NSC-OLs的鉴定
2.2 NSC-OLs体外包裹轴突形成髓鞘结构
如图2A、2B所示,由NSCs定向分化所得的神经元轴突细长,神经元标志物Tuj1免疫荧光染色阳性。激光共聚焦显微镜检测到Olig2红色标记的OLs包裹Tuj1绿色标记的神经元轴突、NSC-OLs与神经元之间的相互作用形成髓鞘样结构,见图2C箭头。

A:人神经干细胞源神经元图;B:神经元标志物Tuj1免疫荧光染色图;C:激光共聚焦显微镜检测体外OLs包裹神经元轴突(白色箭头处形成髓鞘样结构)图2 体外观察NSC-OLs包裹轴突形成髓鞘
2.3 OCM修复SH-SY5Y细胞损伤
与NC组比较,200 μmol/L H2O2组SH-SY5Y细胞存活率大约下降至50%(t=12.670,P<0.01),见图3A。200 μmol/L H2O2刺激条件下,75% OCM表现出和100% OCM相似的保护效果,见图3B。实验选用Vc作为阳性对照,75% OCM表现出和Vc相似的保护效果,CCK-8结果显示,OCM处理显著提升了SH-SY5Y细胞存活率(t=6.923,P<0.01),降低了LDH的释放(t=11.680,P<0.01),见图3C、图3D。
2.4 OCM改善SH-SY5Y细胞氧化应激
流式结果显示,与NC组相比,H2O2组平均荧光强度显著升高,而OCM处理显著降低了荧光强度(t=8.109,P<0.01),提示OCM处理降低了活性氧水平,和Vc处理组效果相似(图4A)。OCM处理提升了SH-SY5Y细胞中SOD(t=4.908,P<0.01)、GSH(t=9.679,P<0.01)的活性,降低了MDA含量(t=11.960,P<0.01),见图4B~4D。此外还使用线粒体膜电位探针(JC-1)检测了线粒体膜电位的高低,线粒体膜电位的下降是细胞凋亡早期的一个标志性事件,在线粒体膜电位较高时,JC-1聚集在线粒体基质中,形成聚合物,产生红色荧光;当线粒体膜电位较低时,JC-1不能聚集在线粒体的基质中,此时JC-1为单体,产生绿色荧光。结果显示,H2O2组线粒体膜电位最低,而OCM处理提升了线粒体膜电位,见图4E。
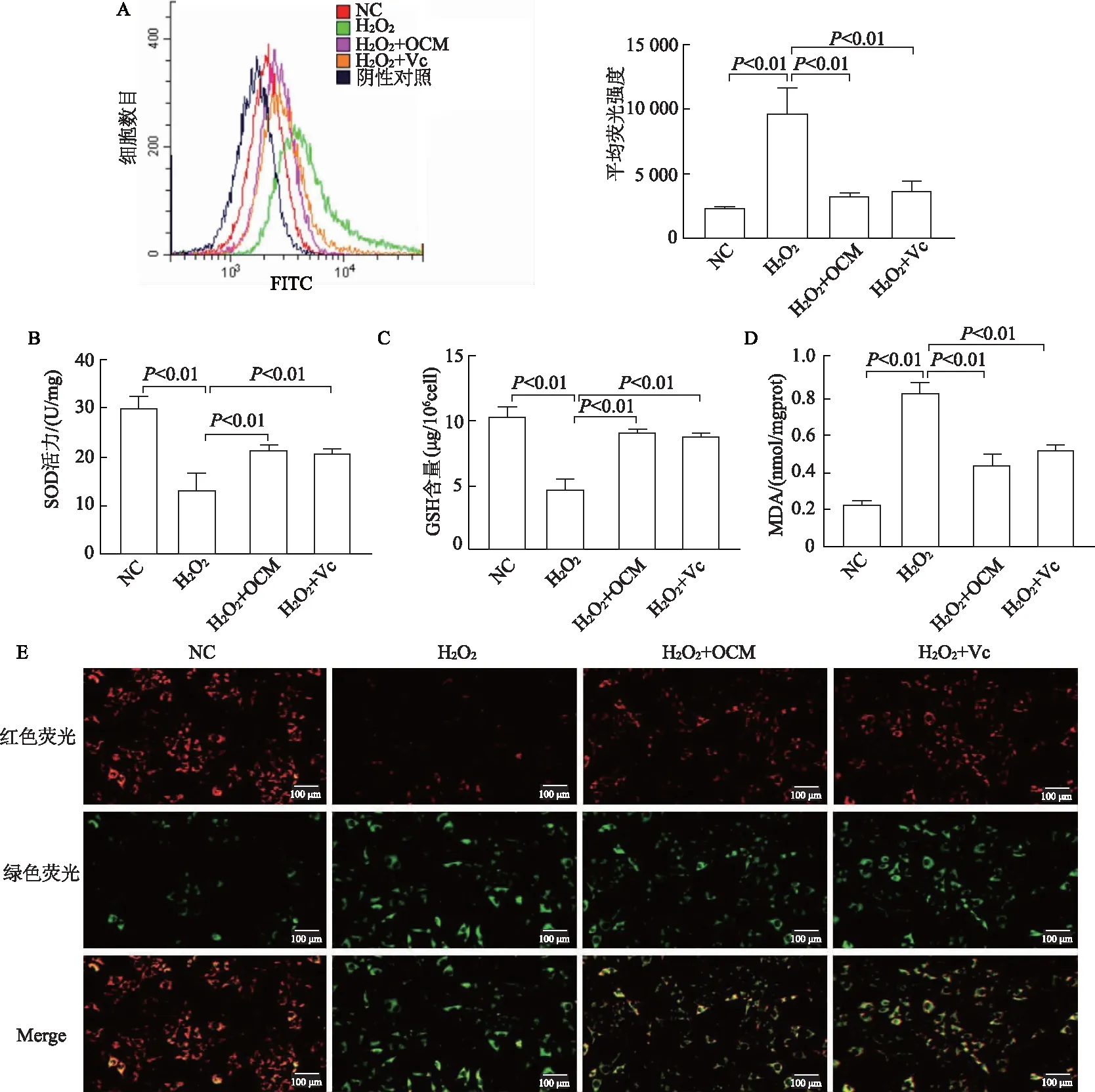
A:DCFH-DA探针检测SH-SY5Y细胞活性氧及定量分析;B~D:化学发光法检测SH-SY5Y细胞SOD、GSH、MDA含量;E:线粒体膜电位检测代表性荧光图像;标尺=100 μm图4 OCM在体外改善了H2O2诱导的SH-SY5Y细胞氧化应激损伤
2.5 OCM抑制SH-SY5Y细胞凋亡
结果显示,与NC组相比,H2O2组SH-SY5Y细胞凋亡率明显升高,而OCM处理降低了SH-SY5Y细胞凋亡(t=13.510,P<0.01),见图5A。蛋白质印迹检测结果显示,与H2O2组相比,OCM处理降低了H2O2诱导的促凋亡蛋白Bax升高(t=3.226,P<0.05)、抑制了H2O2诱导的抗凋亡蛋白Bcl-2降低(t=3.056,P<0.05),见图5B。

A:流式细胞仪检测细胞凋亡及凋亡细胞百分比;B:蛋白质印迹检测凋亡相关蛋白Bax、Bcl-2相对表达及灰度分析图5 OCM降低了H2O2诱导的SH-SY5Y细胞凋亡
2.6 OCM通过激活Sirt1/PGC-1α通路修复SH-SY5Y细胞损伤
蛋白质印迹检测结果显示,OCM处理提高了SH-SY5Y细胞中Sirt1(t=3.394,P<0.05)、PGC-1α(t=13.920,P<0.01)蛋白表达水平(图6A)。为了进一步验证OCM是否通过Sirt1/PGC-1α通路改善H2O2诱导的SH-SY5Y细胞损伤,使用Sirt1特异性抑制剂EX527抑制Sirt1信号通路的表达。EX527预处理后,OCM对H2O2诱导的SH-SY5Y细胞损伤的保护作用消失,细胞皱缩,数量减少(图6B)。蛋白质印迹检测结果显示,EX527预处理抑制了OCM处理所致的Sirt1(t=3.048,P<0.05)、PGC-1α(t=5.523,P<0.01)升高(图6C)。结果提示OCM可以通过激活Sirt1/PGC-1α通路保护SH-SY5Y细胞。

A:蛋白质印迹检测Sirt1、PGC-1α蛋白相对表达及灰度分析;B:SH-SY5Y细胞代表性图像;C:蛋白质印迹法检测EX527对SH-SY5Y细胞Sirt1、PGC-1α蛋白表达的影响及灰度分析图6 OCM通过激活Sirt1/PGC-1α通路保护SH-SY5Y细胞
3 讨论
神经退行性疾病病因多样、机制尚未明确,常致记忆、认知功能障碍,神经元丧失是其主要的病理特征[7]。相关研究表明,神经退行性疾病发展过程中会产生过量的自由基,如羟自由基、超氧阴离子、一氧化氮等[8],过量的自由基未得到及时清除导致体内氧化/抗氧化失衡,过量的活性氧会对神经组织造成氧化损伤,最终导致神经元凋亡甚至坏死[9]。H2O2作为活性氧家族的一员,可以穿过细胞膜,产生羟自由基,进而对细胞造成损伤,最终导致细胞凋亡。SH-SY5Y细胞为人神经母细胞瘤细胞,具备一定的神经元特征,常被用作理想的体外细胞模型。因此,本研究使用H2O2刺激SH-SY5Y细胞来模拟氧化应激引起的神经退行性疾病的发生发展。
越来越多的研究表明,NSCs对神经系统具有积极的支持保护作用[10]。NSCs是一种具有多向分化潜力的细胞,叶开等[11]发现NSCs可以分化为外周神经系统的施万样细胞,本实验探究NSCs能否分化为中枢神经系统的OLs且分化所得细胞是否对神经元氧化应激损伤具有积极的保护作用。基于少突胶质细胞的支持和营养作用,钟欣等[12]将体外培养的少突胶质细胞移植到大鼠脑白质部分,发现少突胶质细胞可以存活和生长,但是移植细胞的存活率较低。尽管对少突胶质细胞移植已经做了一定的工作,但是移植细胞不能很好地生长、存活率低等问题仍不能得到很好地解决,因此近年来少突胶质细胞的旁分泌作用受到越来越多的关注。OCM容易获得且生物安全性高,能够很好地模拟细胞的旁分泌作用,有望成为理想的生物材料。
本研究在体外将NSCs分化为OLs和神经元,利用形态学结合免疫荧光对OLs进行鉴定并在体外观察其髓鞘形成能力。OLs有望为组织工程提供源源不断的生物活性材料用于髓鞘缺失类疾病的治疗。本研究发现,OCM在体外提高了H2O2诱导的SH-SY5Y细胞活力,降低了SH-SY5Y细胞毒性。Vc为常用的抗氧化剂[13],参考郑金平课题组的实验方法[14],本研究设置100 μmol/L的Vc处理组作为阳性对照,结果显示OCM处理可以改善SH-SY5Y细胞氧化应激,降低细胞凋亡,提示OCM可以通过降低氧化应激水平来保护SH-SY5Y细胞免于H2O2诱导的细胞凋亡。
Sirt1是一种组蛋白脱乙酰化酶[15],PGC-1α是Sirt1的去乙酰化底物,二者共同参与细胞内氧化应激的调节[16]。研究表明,在神经退行性疾病患者的血清和大脑中Sirt1含量降低,激活Sirt1有利于神经退行性疾病的治疗[17]。在线粒体的生物发生过程中,PGC-1α被认为是核心调控因子[18],靶向Sirt1信号通路可以通过减少PGC-1α的乙酰化进行能量调节从而促进线粒体修复及生物合成,进而影响氧化应激相关进程[19]。本研究中,OCM处理提升了SH-SY5Y细胞内Sirt1、PGC-1α的蛋白表达,为了明确OCM对SH-SY5Y细胞的保护机制,使用Sirt1特异性抑制剂EX527预处理SH-SY5Y细胞,结果显示OCM处理所致的Sirt1、PGC-1α蛋白表达升高被抑制,且OCM对SH-SY5Y细胞的保护作用减弱。然而活性氧介导的氧化应激损伤细胞途径多样,机制复杂,互有交叉,如内质网应激、铁死亡等[20],有待进一步深入探讨。
本研究证明了人神经干细胞源OCM对H2O2诱导的SH-SY5Y细胞的保护作用,为临床治疗神经退行性疾病提供了新的治疗策略。但OCM的组分复杂,发挥保护作用的具体物质仍需进一步探索。

