肝细胞生长因子对CCl4致肝细胞损伤相关炎性因子的影响
段 琪,李思玥,李清兰,王 宇,郑 力
(海南医学院,海南 海口 571199)
吴斌等[7]对肝细胞生长因子对CCl4致急性肝损伤的保护作用进行研究,发现其对于受损肝细胞质膜有一定保护作用,邹原等[8]深入研究HGF 在发挥对受损肝细胞的保护作用时,可使肝再生相关基因表达水平提高[9]。另有研究表明HGF 可抑制大鼠急 性 肝 损 伤 中 炎 症 因 子TNF-α 的 释 放[10,11]。为 探讨HGF 对CCl4所致小鼠肝损伤保护作用的机制,本实验将通过建立CCl4损伤肝细胞小鼠模型,采用Elisa 法分别检测肝实质细胞和白细胞中炎性因子TNF-α、IL-8、IL-4、IL-21 的表达水平,研究肝细胞生长因子对CCl4致肝细胞损伤相关炎性因子的影响。
1 材料与方法
1.1 材料与仪器
小鼠购自长沙市天勤生物技术有限公司,Percoll 细胞分离液(Solarbio)、重组人HGF 蛋白购自海南省莱博科达科技有限公司,RPMI-1640 完全培养基购自Gibco 公司,小鼠IL-8、IL-21、TNF-αELISA试剂盒购自上海抚生实业有限公司,小鼠 IL-4 ELISA 试剂盒购自上海优宁生物科技股份有限公司,高速台式离心机购自Eppendorf 公司,SPX-250B-Z生化培养箱购自上海博讯实业有限公司医疗设备厂,电子天平购自上海上天精密仪器有限公司,Life Real P-800 多波段酶标仪购自杭州遂真生物科技有限公司。
1.2 动物分组及细胞处理
SPF 级雌性C57BL/6 小鼠6 只,体质量范围在18~22 g。将小鼠随机分为CCl4损伤组和正常对照组,每组各3 只。所有小鼠适应性喂养7 d,期间自由饮水、摄食。第8 天,给CCl4损伤组每只小鼠按10 mL/kg 的剂量腹腔注射0.2% CCl4蓖麻油溶液,复制小鼠急性肝损伤模型。正常对照组的小鼠,在同一部位注射相同剂量的蓖麻油溶液。
18 h 后,小鼠眼眶静脉丛取血后麻醉,充分暴露小鼠腹腔,采用三通管和静脉留置针将门静脉、蠕动泵软管以及下腔静脉连接成回路,自门静脉端注入37 ℃的0.2 mg/mL 的胶原酶液,调节蠕动泵转速为20 mL/min 行循环灌注,摘除肝脏剪切成小块组织,加入0.5 mg/mL 胶原酶液消化30 min 后碾碎[12]过200 目筛网,将过滤后的细胞混悬液置于33%Percoll 之上[13],梯度离心后上层为小鼠肝实质细胞,下层为红细胞与肝白细胞的混合细胞层。向其中加入红细胞裂解液后收集肝脏白细胞, PBS 洗涤两次后,细胞计数5×105/mL 后种24 孔板。
1.3 体内损伤实验分组
实验分为受损肝实质细胞组,10 ng/mL、25 ng/mL、50 ng/mL HGF 实验组。取24 孔板,每孔加入500 μL CCl4损伤组肝实质细胞。10 ng/mL 实验组加 入20 μL HGF,25 ng/mL 实 验 组 加 入50 μL HGF,50 ng/mL 实验组加入100 μL HGF;每组设两个复孔。肝脏白细胞刺激方法同上。
1.4 体外损伤实验分组
将正常对照组肝实质细胞及白细胞计数后种板,每孔2.5×105细胞于24 孔板37 ℃培养4 h 后,加入40 μL 100 mmol/L CCl4,以少量的二甲亚砜助溶,二甲亚砜终浓度为0.1%(体积分数),作用3 h。将处理后的肝实质细胞分为正常肝实质细胞组,CCl4损伤组,10 ng/mL、25 ng/mL、50 ng/mL HGF实验组,每孔加入500 μL 肝实质细胞,10 ng/mL 实验组加入20 μL HGF,25 ng/mL 实验组加入50 μL HGF,50 ng/mL 实验组加入100 μL HGF;每组设两个复孔。肝脏白细胞刺激方法同上。
1.5 Elisa 检测
收集各组上清液,按Elisa 检测试剂盒说明书检测IL-8、TNF-α、IL-4、IL-21 ,酶标仪450 nm 检测吸光度,计算浓度值。
1.6 统计学处理
数据统计分析采用GraphPad Prim 5.01,统计学方法使用t检验or Wilcoxon matched pairs test。当P<0.05 时,拒绝假设检验,存在显著性差异。
2 结果
2.1 HGF 对体内注射CCl4损伤模型肝实质细胞分泌IL-8、TNF-α、IL-4、IL-21 的影响
检测结果显示,对于CCl4体内损伤肝实质细胞产生TNF-α、IL-21,与损伤肝细胞组相比,HGF(10、25、50 ng/mL)组无统计学意义;组间亦无差异。见图1B,D。对于IL-8,与损伤肝细胞组相比,10 ng/mL HGF 组 表 达 水 平 降 低(t=2.876,P=0.045 2),而25 ng/mL、50 ng/mL HGF 组无统计学意义。50 ng/mL HGF 组与10 ng/mL HGF 组相比表达水平升高(t=3.551,P=0.023 8),其他组间相比均无差异。见图1A。对于IL-4,与损伤肝细胞组相比,25 ng/mL HGF 组表达水平降低(t=2.981,P=0.045 2),50 ng/mL HGF 组表达水平亦降低(t=3.097,P=0.023 8),而10 ng/mL HGF 组无统计学意义。见图1C。
按照每月练兵成绩,对照考核细则,对当月练兵成绩优秀的队员进行奖励,并对成绩不达标的队员进行惩罚,考核结果兑现在当月工资中。同时,全年的考核情况也为年底评先选优的重要依据,练兵中出现不合格情况的队员,不在岗位标准作业流程先进个人评选范围。
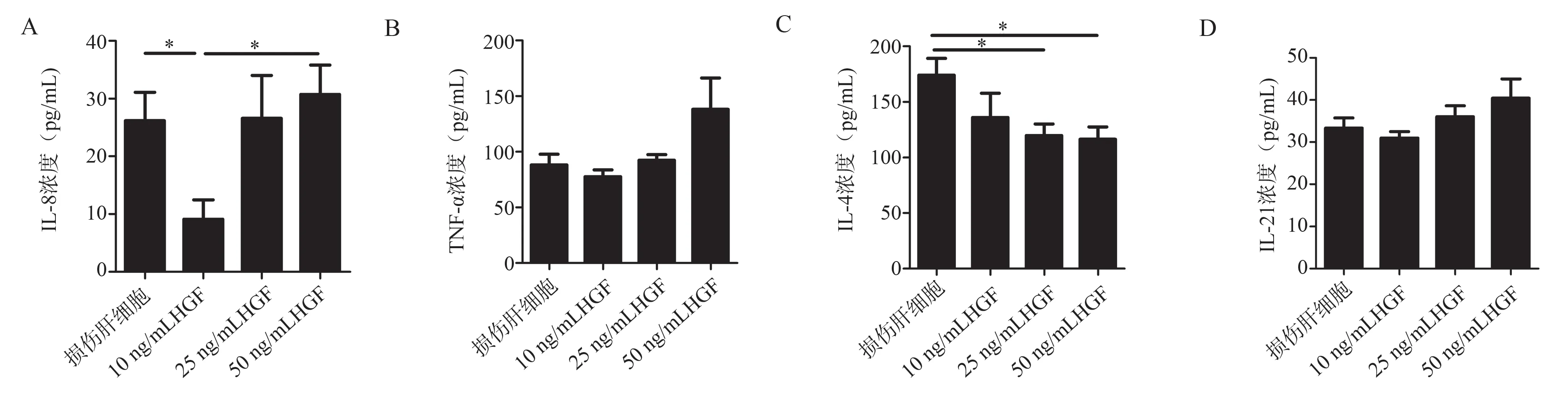
图1 不同浓度HGF 对CCl4体内损伤小鼠肝实质细胞分泌4 种细胞因子的影响Fig 1 Effects of different concentrations of HGF on the secretion of four cytokines by liver parenchymal cells in CCl4-induced liver injury mice
2.2 HGF 对体内注射CCl4损伤模型肝脏白细胞分泌IL-8、TNF-α、IL-4、IL-21 的影响
检测结果显示,对于CCl4体内损伤白细胞产生IL-8、IL-4、IL-21,与CCl4模型组相比,HGF 不同浓度(10、25、50 ng/mL)组无统计学意义;组间亦无差异。见图2A、C、D。对于TNF-α,与CCl4模型组相比,10 ng/mL HGF 组表达水平降低(t=2.534,P=0.032 2),25 ng/mL HGF 组表达水平亦降低(t=2.601,P=0.030 0),50 ng/mL HGF 组 无 差 异。HGF 不同浓度10、25、50 ng/mL 组之间比较差异无统计学意义。详见图2B。

图2 不同浓度HGF 对CCl4体内损伤小鼠肝脏白细胞分泌4 种细胞因子的影响Fig 2 Effects of different concentrations of HGF on the secretion of four cytokines by liver leukocytes in CCl4-induced liver injury mice
2.3 HGF 对CCl4体外损伤肝细胞分泌IL-8、TNF-α、IL-4、IL-21 的影响
检测结果显示,对于IL-8、IL-21,正常对照组与CCl4模型组相比无差异,HGF(10、25、50 ng/mL)组与正常对照组和CCl4模型组比较差异无统计学意义,组间亦无差异。见图3A、D。对于TNF-α,正常对照组,HGF(10、25、50 ng/mL)组与CCl4模型组相比无差异,组间亦无差异。对于正常对照组,与10 ng/mL HGF 组比较差异无统计学意义;25 ng/mL HGF 组比较表达水平降低(t=3.236,P=0.031 8),50 ng/mL HGF 组比较差表达水平亦降低(t=3.344,P=0.028 7)。见图3B。对于IL-4,正常对照组,HGF(10、25、50 ng/mL)组与CCl4模型组相比无差异,组间亦无差异。对于正常对照组,与10 ng/mL ,50 ng/mL HGF 组比较差异均无统计学意义,与25 ng/mL HGF 组相比表达水平降低(t=4.946,P=0.015 9)。见图3C。

图3 不同浓度HGF 对CCl4体外损伤小鼠肝实质细胞分泌4 种细胞因子的影响Fig 3 Effects of different concentrations of HGF on the secretion of four cytokines by liver parenchymal cells in CCl4-induced liver injury mice in vitro
2.4 HGF 对CCl4体外损伤白细胞分泌IL-8、TNFα、IL-4、IL-21 的影响
检测结果显示,对于IL-8、IL-4,正常对照组与CCl4模型组、10、25、50 ng/mL HGF 组相比,差异无统计学意义,组间亦无差异。详见图4A,4C。对于TNF-α,与CCl4模型组相比,正常对照组、HGF(10、25、50 ng/mL)组差异无统计学意义;组间亦无差异。50 ng/mL HGF 组与10 ng/mL HGF 组之间比较表达水平升高(t=9.168,P=0.000 8),而25 ng/mL HGF 组 与50 ng/mL HGF 10 ng/mL HGF 组 之间比较差异无统计学意义。详见图4B。对于IL-21, 正常对照组与CCl4模型组之间比较表达水平降低(t=3.208,P=0.009 4),与正常对照组相比,10 ng/mL HGF 组、25 ng/mL HGF 组、50 ng/mL HGF组与正常对照组之间比较表达水平均降低(t=2.889、P=0.013 6,t=3.020、P=0.012 9,t=2.789、P=0.023 6),HGF(10 ng/mL、25 ng/mL、50 ng/mL)组与CCl4模型组之间比较差异均无统计学意义,组间比较亦无差异。详见图4D。

图4 不同浓度HGF 对CCl4体外损伤小鼠肝脏白细胞分泌4 种细胞因子的影响Fig 4 Effects of different concentrations of HGF on the secretion of four cytokines by liver leukocytes in vitro in CCl4-induced liver injury mice
3 讨论
CCl4是一种选择性肝毒性物质,在肝内通过肝微粒体细胞色素酶P450 氧化酶激活后, 产生三氯甲基自由基,可引发活性氧自由基的产生和脂质过氧化反应, 损伤肝细胞从而分泌大量炎性因子[14]。为探究HGF 对受损肝脏产生炎症反应的作用,本研究使用不同浓度HGF 刺激,CCl4所致体内、体外损伤的小鼠肝实质细胞、肝脏白细胞,检测促炎因子IL-8,TNF-α,IL-21 及抗炎因子IL-4 的变化。
研究结果表明HGF 对CCl4体内损伤小鼠肝脏细胞炎性因子IL-8,IL-4 的表达均有抑制作用,且10 ng/mL HGF 为抑制IL-8 表达水平最适宜浓度。IL-8 是机体内重要的中性粒细胞趋化因子,其通过激活中性粒细胞,促进胞内溶酶体活化和吞噬,进而引起局部炎症反应[15],IL-4 是一种抗炎因子,具有抑制炎症反应、减轻肝脏损伤的作用[16]。与马玉珍等[17]不同,本实验建立18 h 内急性肝损伤模型,小鼠肝脏在早期炎症反应中IL-4 水平上升[18,19],实验结果中对于IL-4 浓度的降低提示HGF 对于肝实质细胞的炎症反应具有抑制作用。
CCl4体外刺激肝实质细胞实验结果显示,CCl4与HGF 联合刺激小鼠肝实质细胞可以使其分泌TNF-α、IL-4 的浓度降低,且10 ng/mL HGF 为抑制肝实质细胞TNF-α 表达水平最适宜浓度。TNF-α是一种主要由单核巨噬细胞系统产生的单核细胞因子,具有免疫调节和促炎活性,不仅能够活化单核细胞和巨噬细胞,提高其杀伤活性,还可诱导多种黏附因子的表达和细胞化学趋化素的产生。机体炎症、损伤和休克等可导致其异常分泌,是介导肝损伤的主要和终末介质[16,20-23]。贺芳等[24]研究表明,TNF-α 水平与体内炎症反应呈正相关,实验中CCl4损伤小鼠肝实质细胞后未见明显差异,可能是由于实验组小鼠数量较少。实验结果显示加入HGF 后TNF-α 表 达 水 平 明 显 降 低,提 示HGF 可 能具有抑制小鼠肝实质细胞分泌TNF-α 的作用。综上,HGF 可抑制受损小鼠肝脏细胞TNF-α 的表达水平,这与贾俊清等[25]实验结果相似。
在体内刺激中,HGF 对小鼠肝脏白细胞分泌炎性因子TNF-α 具有抑制作用,而对肝实质细胞的作用却不明显。这与李丽媛等[26]研究结果一致。实验使用密度梯度离心法,将肝脏细胞分为肝实质细胞及肝脏白细胞分别研究HGF 对于两种细胞分泌炎性因子TNF-α 的抑制作用。结果显示,HGF 对小鼠受损肝脏白细胞分泌炎性细胞因子TNF-α 的抑制作用更明显。在小鼠肝脏白细胞体外试验中,CCl4与HGF 联合刺激白细胞,HGF 浓度与IL-21 浓度水平无明显关联。而IL-21 作为启动或促进组织炎症反应并导致损伤的主要炎性因子,在类风湿关节炎、系统性红斑狼疮等与免疫相关的疾病中可高水平表达,并且随疾病的控制表达下降,这表明IL-21 在介导炎症的产生与加重、组织病理损伤的过程中可能具有促进作用[27]。与艾国等[28]IL-21 的表达水平与肝脏炎症活动呈正相关的研究结果不同,可能是由于在炎症早期肝脏白细胞的IL-21 尚未大量表达。
通过感染腺病毒的小鼠受损肝模型,有研究显示HGF 改善了病毒性肝炎症状,降低TNF-β、IFNγ 等表达[29]。而在通过α-萘异硫氰酸酯建立肝损伤模 型 中,HGF 能 使TNF-α 表 达 降 低,调 节 肝 炎 反应[30]。对于这两种肝损伤模型引起的肝脏炎症活动,HGF 均可通过降低其炎性因子的表达来改善肝脏炎症。
CCl4体内损伤肝细胞实验结果与体外刺激并不完全一致,这可能是因为体内途径损伤肝脏,刺激小鼠全身免疫细胞分泌细胞因子,而体外实验仅刺激的肝细胞。CCl4在体内引起的复杂的连锁反应尚需进一步实验探究。炎性因子作为肝脏产生炎症的先行者,可作为研究者判断组织受损程度及是否发生炎症反应的指标,而其引起肝脏炎症反应的机制尚待深入研究。
作者贡献度说明:
段琪、郑力:负责实验设计;段琪、李清兰、李思玥、王宇:主要参与验实施;段琪:负责数据分析;段琪、郑力:负责论文撰写和修改。
所有作者声明不存在利益冲突关系。

