异甘草素通过激活PPAR-γ 信号通路调控ox-LDL 稳定动脉粥样硬化斑块
许心蕊,高 照,张晴玥,杨漫芳,孙 浩,冯 露,王添钰,李 洋,娄利霞,吴爱明,聂 波,
(1.北京中医药大学东直门医院中医内科学教育部和北京市重点实验室,北京 100700;2.上海中医药大学附属龙华医院,上海200032;3.北京中医药大学中药学院,北京 100029;4.北京中医药大学东直门医院病理科,北京 100700)
动脉粥样硬化(atherosclerosis,AS)是脂质驱动的慢性炎症反应,是心血管疾病的主要病理基础,其特征是脂质代谢紊乱、内膜下氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)沉积和炎症反应,泡沫细胞积聚和斑块形成[1]。Ox-LDL 被认为是AS 进展的主要触发因素之一[2]。过氧化物酶体增殖物激活受体γ (peroxisome proliferator-activated receptor γ, PPAR-γ)信号通路能够调控脂代谢使其成为治疗代谢性疾病的关键靶点。在AS 进展中,通过改善ox-LDL 脂质代谢紊乱,发挥稳定粥样斑块作用,是防治AS 的重要机制之一[3]。本研究团队前期实验证实四妙勇安汤通过激活PPAR-γ,抑制FABP-4 表达,拮抗ox-LDL 脂代谢途径,从而稳定斑块,具有AS 保护作用[4]。采用UHPLC-LTQ-Orbitrap 技术在四妙勇安汤及其入血成分中均鉴定有异甘草素等原型成分[5]。在筛选的PPAR-γ 激动剂四妙勇安汤活性部位CS05中鉴定得到异甘草素[6],经过分子对接验证异甘草素具有较强激活PPAR-γ 的活性。网络药理学筛选出异甘草素是四妙勇安汤发挥抗炎作用的主要成分[5],文献报道异甘草素的研究主要集中在抗肿瘤方面[7],对AS 的药理作用及机制报道很少。因此,本研究在前期实验初步验证异甘草素具有抗AS 的作用基础上,从PPAR-γ 信号通路调控ox-LDL 代谢途径探讨异甘草素对于ApoE-/-小鼠AS的作用机制。
1 材料与方法
1.1 一般材料
1.1.1 实验动物与饲料 C57BL/6J 小鼠,雄性,7周龄;ApoE-/-小鼠,雄性,7 周龄,体重(20±2) g,由北京维通利华实验动物中心提供[许可证号:SCXK(京)2021-0011]。动物饲养于北京中医药大学东直门医院屏障级动物房(动物房编号:SYXK(京)2020-0013),饲养环境:温度恒定22~24 ℃,湿度50%,明暗交替12 h 一次。
高脂饲料配方由15% 脂肪、0.25% 胆固醇及84.75%基础饲料组成,购买于北京华阜康科技有限公司,其许可证号为:SCXK(京)2014-0008。
1.1.2 药物与试剂 异甘草素(批号:Y-008-181216),购买于成都瑞芬思生物科技有限公司。小鼠ox-LDL ELISA 检测试剂盒(货号:E-ELM0066c)购买于武汉Elabscience 生物科技有限公司。饱和油红O 染色液(货号:G1260)、改良Masson 三色染色试剂盒(货号:G1346-50)均购自北京索莱宝科技有限公司。 抗体α-SMA(货号:ab124964)、MOMA-2(货号:ab33451)、PPAR-γ(货号:ab45036)、LXR-α(货号:ab106464)、FABP-4(货号:ab92501)、MMP-2(货号:ab37150)、MMP-9(货号:ab38898)、GAPDH(货号:ab9485)均购自英国Abcam 公司。HRP 羊抗兔IgG 抗体(货号:C1309)、BCA 蛋白定量试剂盒(货号:P1511)、RIPA 裂解液(货号:C1053)、脱脂奶粉(货号:P1622)均购于北京普利莱基因技术有限公司。一步法PAGE 凝胶快速制备试剂盒(货号:PG212)购自上海雅酶生物医药科技有限公司。
1.1.3 主要仪器 AU5800 全自动生化测定仪(美国BECKMAN COULTER 公司);EG1150 组织包埋机(德国Arcadia 公司);RM2135 组织切片机(德国Arcadia 公司);MK3 全自动酶标仪(美国Thermo公司);LF-mini 3 小型垂直电泳槽、LF-ZY01 小型转印电泳槽(北京龙方科技有限公司);Tanon-5200 凝胶成像系统(上海天能科技有限公司)。
1.2 方法
1.2.1 模型制备及分组给药 参照文献[8],采用高脂饲料喂养联合右侧颈总动脉外置套管术(perivascular carotid collar placement,PCCP)制备AS 模型。20 只ApoE-/-小鼠适应性喂养1 周后,高脂喂养2 周,实行PCCP 术。小鼠麻醉后,颈部至腋下脱毛,于颈右侧部剪开约2 cm 切口,暴露右侧颈总动脉,将长度约2.5 mm,内径为0.3 mm 的硅胶套管套置于血管外周,并固定套管的上下端。术后将小鼠随机分为模型组和异甘草素组,每组10 只。PCCP 术后当天起,异甘草素组小鼠以40 mg/kg 的给药剂量每天灌胃给药1 次,连续灌胃8 周,同时高脂饲料喂养。模型组给予相同剂量的去离子水灌胃。10 只C57BL/6J 小鼠设为正常组,基础饲料喂养,灌胃相同剂量的去离子水,饲养周期与造模小鼠一致。
1.2.2 全自动生化仪检测血清中血脂含量 造模完成后对小鼠进行取材,以摘眼球取血的方式收集小鼠血液,4 ℃,3 000 r/min,离心15 min 后收集血清,采用全自动生化仪检测血清中总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)含量。
1.2.3 酶联免疫吸附(ELISA)检测血清中ox-LDL水平 按照ELISA 试剂盒操作说明,检测血清中ox-LDL 水平。
1.2.4 颈动脉斑块病理形态特征 小鼠取血后,取右侧颈动脉,经4% 多聚甲醛固定后,脱水后行OCT 包埋和石蜡包埋。HE 染色观察斑块病理形态。油红O 染色和Masson 染色用于斑块内脂质和胶原含量分析。MOMA-2 和α-SMA 免疫组化染色用于巨噬细胞和平滑肌细胞分析。应用Image Pro Plus 6.0 图像处理软件测量血管内膜厚度(IT)、中膜厚度(MT)、斑块面积(PA)和血管管腔面积(LA),并计算IT/MT 以及PA/LA[9],并对斑块内脂质、胶原、MOMA-2 和α-SMA 含量进行测定,计算易损指数,易损指数(%)=(MOMA-2 阳性面积百分比+脂质阳性面积百分比)/(胶原阳性面积百分比+α-SMA 阳性面积百分比)×100%。
1.2.5 Western blot 检 测 主 动 脉PPAR-γ、LXR-α、FABP-4、及MMP-2、MMP-9 蛋白表达 主动脉加入适量蛋白酶抑制剂,超声破碎,离心收集上清液,BCA 法测量蛋白浓度。取等量蛋白上样进行电泳,蛋白转移至NC 膜,5%脱脂奶粉室温封闭1 h,加入一抗PPAR-γ(1∶1 000)、LXR-α(1∶1 000)、FABP-4(1∶1 000)、MMP-2(1∶1 000)、MMP-9(1∶1 000)、GAPDH(1∶1 000),4 ℃孵育过夜。次日,TBST 洗膜后加入羊抗兔二抗(1∶5 000),室温摇床1 h,TBST 洗膜后,ECL 发光液显色,凝胶程序系统中曝光、拍照。使用Image J 软件分析条带灰度值。
1.3 统计学处理
采用SPSS 23.0 软件进行数据分析,计量资料以平均值±标准差(±s)表示,对数据进行正态性检验和方差齐性检验,符合正态分布且方差齐的多组间样本比较采用单因素方差分析,组间比较采用LSD 法。非正态分布采用非参数检验。P<0.05 为差异具有统计学意义。
2 结果
2.1 异甘草素对AS 小鼠血脂的影响
与正常组比较,模型组小鼠TC、TG、LDL-C 和HDL-C 均增加明显(P<0.01)。与模型组比较,异甘草素组TC、TG 和LDL-C 降低(P<0.05),HDLC 未见明显变化,差异无统计学意义(P>0.05),见图1。

图1 异甘草素对AS 小鼠血脂的影响Fig 1 Effect of isoliquiritigenin on lipids in AS mice
2.2 异甘草素对AS 小鼠血清ox-LDL 的影响
与正常组比较,模型组小鼠血清ox-LDL 显著升高(P<0.01);与模型组比较,异甘草素组小鼠血清中ox-LDL 明显降低(P<0.01),见图2。

图2 异甘草素对AS 小鼠ox-LDL 的影响Fig 2 Effect of isoliquiritigenin on ox-LDL in AS mice
2.3 异甘草素对AS 小鼠颈动脉病理形态的影响
正常组的血管壁完整光滑,内中膜结构完整,未见斑块生成。模型组可见内膜不光滑,内中膜厚度不均,中膜平滑肌细胞排列严重紊乱,内膜隆起形成斑块凸向管腔,IT 显著增厚(P<0.01),IT/MT明显增加(P<0.01),PA 明显增加(P<0.01),PA/LA 明显增加(P<0.01)。与模型组比较,异甘草素组颈动脉内膜不光滑,IT 降低(P<0.01),内中膜厚度不均,中膜增厚,IT/MT 降低(P<0.01),管腔内PA 明显减小(P<0.01),管腔阻塞程度降低,见图3,4。
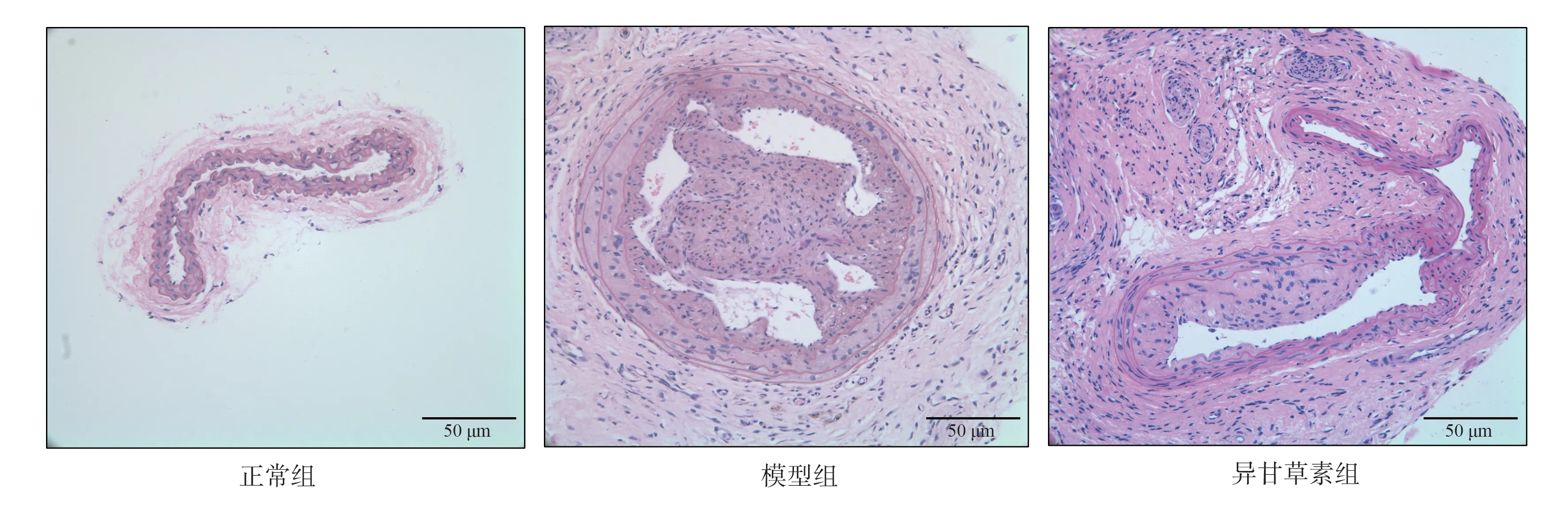
图3 异甘草素对AS 小鼠颈动脉病理形态的影响(HE 染色,×200)Fig 3 Effect of isoliquiritigenin on the pathological morphology of carotid artery in AS mice(HE staining, ×200)

图4 异甘草素对AS 小鼠颈动脉影响Fig 4 Effect of isoliquiritigenin on carotid in AS mice
2.4 异甘草素对AS 小鼠颈动脉斑块内脂质、胶原、MOMA-2、α-SMA 含量的影响
与正常组比较,模型组颈动脉斑块内脂质沉积和MOMA-2 含量较多(P<0.01),胶原含量和α-SMA 含量较少(P<0.01),斑块易损指数增加(P<0.01)。与模型组比较,异甘草素组斑块内脂质和MOMA-2 含量明显减少(P<0.01),胶原和α-SMA含量增加(P<0.01),斑块易损指数降低(P<0.01),见图5,6。

图5 异甘草素对AS 小鼠颈动脉斑块病理形态的影响(×200)Fig 5 Effect of isoliquiritigenin on pathological morphology of carotid plaque in AS mice(×200)
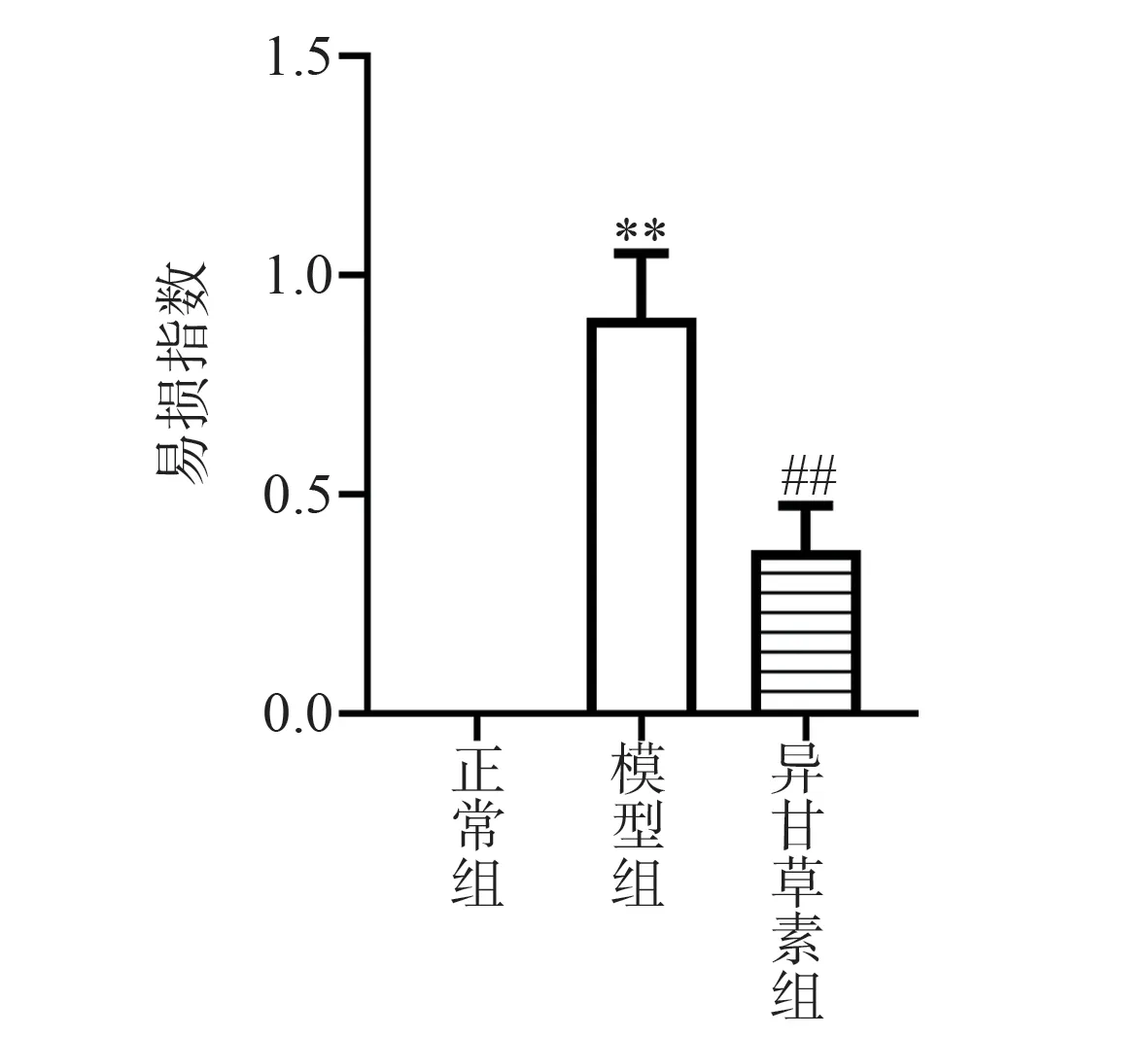
图6 异甘草素对AS 小鼠斑块易损指数的影响Fig 6 Effect of isoliquiritigenin on plaque vulnerability index in AS mice
2.5 异甘草素对AS 小鼠脂代谢PPAR-γ、LXR-α和FABP-4 蛋白表达的影响
与正常组比较,模型组PPAR-γ、LXR-α 蛋白表达水平明显减少(P<0.01)。与模型组比较,异甘草素 组PPAR-γ、LXR-α 蛋 白 表 达 水 平 增 加(P<0.01)。与正常组比较,模型组FABP-4 蛋白表达水平明显增加(P<0.01)。与模型组比较,异甘草素组FABP -4 蛋白表达水平明显减少(P<0.01),见图7。

图7 异甘草素对AS 小鼠PPAR-γ、LXR-α 和FABP-4 蛋白表达影响Fig 7 Effect of isoliquiritigenin on the expression of PPAR-γ, LXR-α and FABP-4 proteins in AS mice
2.6 异甘草素对AS 小鼠斑块稳定性蛋白MMP-2、MMP-9 表达的影响
与正常组比较,模型组MMP-2 和MMP-9 蛋白表达水平明显增加,差异具有统计学意义(P<0.01,P<0.05)。与模型组比较,异甘草素组MMP-2 和MMP-9 蛋白表达水平减少,差异具有统计学意义(P<0.05),见图8。
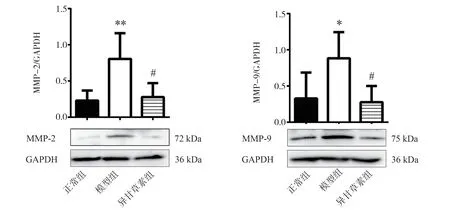
图8 异甘草素对AS 小鼠MMP-2 和MMP-9 蛋白表达的影响Fig 8 Effect of isoliquiritigenin on the expression of MMP-2 and MMP-9 proteins in AS mice
3 讨论
AS 是心血管疾病发病和死亡的主要原因[10],脂质代谢紊乱是AS 的病理基础。异甘草素是甘草中主要的黄酮类化合物[11],是四妙勇安汤的有效成分,具有抗炎、抗菌、抗氧化,以及免疫调节,保护心脏的作用[12]。研究表明异甘草素能够改善ApoE-/-小鼠血脂情况[13],本实验结果显示异甘草素能够降低AS 小鼠血清中TC、TG、LDL-C 和ox-LDL 的含量,改善AS 小鼠血脂情况。病理结果表明,模型组颈动脉内中膜厚度不均,管腔内有较大斑块堵塞。相较于模型组,异甘草素给药后,小鼠颈动脉血管IT、PA 减少,PA/LA 降低,斑块面积减小,管腔堵塞减轻,AS 小鼠颈动脉病理形态得到改善。可见,异甘草素能够降低血脂水平,减少ox-LDL 的含量,改善血管病理形态,发挥对AS 的保护作用。
易损斑块形成、斑块出血、破裂及血栓形成是导致急性心血管事件的主要原因[14]。Ox-LDL 与脂质坏死核心的形成有关,是易损斑块的重要特征[15]。巨噬细胞摄取ox-LDL 变为泡沫细胞[16],泡沫细胞形成、凋亡并融合演变成脂质坏死核心,降低斑块稳定性[17]。清除循环中ox-LDL 能够减少坏死核心并增加斑块稳定性,抑制AS 进展[18]。胶原是纤维帽内细胞外基质主要组成成分,斑块胶原含量在阻止斑块破裂方面具有重要作用,并且可以增加AS 斑块的稳定性[19]。本实验研究结果显示:模型组斑块内含有较多的脂质和MOMA-2 含量,而胶原和α-SMA 含量较少,表现出易损斑块特征。异甘草素能够降低ox-LDL 含量,减少斑块内脂质和MOMA-2 含量,增加胶原和α-SMA 含量,降低斑块易损指数,防止斑块破裂。
异甘草素对AS 的保护作用机制涉及PPAR-γ依赖性信号通路[20]。PPAR-γ 是一类配体激活的核受体,在维持代谢稳态方面起重要作用,能够促进细胞内胆固醇流出[21]。巨噬细胞经PPAR-γ 阻断后增加胆固醇蓄积,诱导泡沫细胞形成[22]。相反,激活PPAR-γ 增 加 下 游 蛋 白 肝X 受 体α(Liver X Receptor-α,LXR-α)转录[23],拮抗ox-LDL 摄入,增强胆固醇外排,减少脂质聚积[24],从而增加斑块的稳定性。脂肪酸结合蛋白4(Fatty acid binding protein 4,FABP-4)在脂质代谢中起着中心调节的作用,通过增加ox-LDL 诱导的细胞内脂质积聚促进泡沫细胞转 化[25],是PPAR-γ 的 主 要 靶 基 因,且 负 向 调 节PPAR-γ 表达,产生与其相反的作用[26]。本实验结果显示:模型组PPAR-γ、LXR-α 表达降低,FABP-4表达增加,斑块内脂质增多,不稳定性增加。异甘草 素 能 够 激 活PPAR-γ,增 加LXR-α 表 达,降 低FABP-4 表达,减少ox-LDL 摄入,减少斑块内脂质含量,从而稳定AS 斑块。
基质金属蛋白酶(matrix metalloproteinases,MMPs)是评价斑块不稳定性的重要指标[27]。Ox-LDL 水平升高加剧血管壁的损伤,增加泡沫细胞不断聚集,同时增加MMPs 的分泌[28],增加斑块不稳定性。MMP-2 和MMP-9 是影响斑块稳定性的主要蛋白酶,能降解细胞外基质中的胶原,使纤维帽变得薄弱而易于破裂[29]。PPAR-γ 在维持AS 斑块的稳定性方面起重要作用,在调控ox-LDL 的同时,能够抑制MMP-9 和MMP-2 表达[30]。本 研究结果显示异甘草素能够激活PPAR-γ,降低MMP-2 和MMP-9 的表达,从而增加AS 斑块稳定性。
综上,异甘草素能够通过激活PPAR-γ,上调LXR-α,减少FABP-4 表达,降低血脂和ox-LDL 水平,减少斑块不稳定性相关蛋白MMP-2 和MMP-9的表达,降低斑块易损指数,从而发挥抗AS 的作用。
前期的动物实验,分子对接和网络药理学综合说明异甘草素具有PPAR-γ 激动作用,并能起到抗AS 的作用。动物实验主要目的是进一步验证异甘草素的抗AS 的药效作用,并探讨其作用机制。深入的机制探讨将在后面的细胞实验中开展,进一步明确异甘草素是通过激活PPAR-γ 发挥抗AS 的作用机制。
作者贡献度说明:
聂波:实验设计、指导及论文校审;许心蕊:指标检测、数据分析、论文撰写;高照:实验造模、药物干预;孙浩:病理指标检测;张晴玥、冯露、杨漫芳、李洋、王添钰:实验取材及指标检测;吴爱明、娄利霞:病理实验及Western Blot 实验技术指导。
所有作者声明不存在利益冲突关系。

