TUSC3 在子痫前期胎盘组织中的表达及对滋养细胞功能的影响
李蒙勇威,康金雨,林 丹,孙 菲,揭秋玲,马燕琳
(1.海南医学院第一附属医院海南省人类生殖与遗传重点实验室,海南医学院第一附属医院海南省地方病(地中海贫血)临床医学研究中心,海南医学院生殖健康与相关疾病研究与转化教育部重点实验室,海南 海口571199;2.海口市人类遗传资源保藏重点实验室,海南医学院第一附属医院, 海南 海口571199)
子痫前期(preeclampsia, PE)是妊娠期特有的疾病,主要是指妊娠20 周后发生的以高血压、蛋白尿为主要临床表现的全身性综合征,以孕妇出现全身性的小血管痉挛、血管通透性增加及各系统或脏器的灌流减少为基本病理生理变化的疾病,是造成孕产妇和围产儿发病及死亡的重要原因[1,2]。PE 的发病机制迄今尚未阐明,缺乏早期预测及精准治疗的手段,终止妊娠仍是目前最有效的治疗方法。滋养细胞功能异常和子宫螺旋动脉重塑障碍是国内外公认的PE 发生的病理生理学基础[3]。因此,从病因入手,探讨研究调控滋养细胞侵袭的关键因子,针对PE 的发病机制,对PE 发生进行早期预测和干预具有重要的临床意义。
TUSC3(tumor suppressor candidate gene 3)基因1996 年被定位于8 号染色体短臂2 区2 带(8p22),在多种上皮细胞和组织(包括前列腺、结肠、肺、肝脏、卵巢、睾丸和脂肪组织)中高表达[4,5]。随着研究的逐渐深入,越来越多TUSC3 的重要功能被人类发现。TUSC3 通过与蛋白磷酸酶1(protein phosphatase 1,PPPC1A)相互作用影响镁离子(Mg2+)转运,参与调控人类学习和记忆的重要过程[6]。在胚胎发育过程中TUSC3 同样起着重要的作用,它参与调控细胞所必须的镁离子(Mg2+)的摄取。研究者还发现TUSC3是潜在的抑癌基因,与多种肿瘤的发生、发展密切相关[7]。我们的前期研究发现,TUSC3 通过抑制AKT 信号通路,调控宫颈癌细胞增殖、迁移与侵袭[8]。在公共数据库GSE12767 中,与对照 相比,TUSC3 在PE 的早孕绒毛组织中的表达显著升高。因此,我们推测TUSC3 可能调控滋养细胞功能,参与PE 的发生、发展。为此,本研究将进一步分析TUSC3 在PE 患者胎盘组织中的表达水平及其对滋养细胞功能的影响,深入探讨TUSC3 与PE 发病的相关性,为临床PE 早期预测和干预提供一定的理论基础。
1 材料与方法
1.1 一般材料
DMEM 培养基、胎牛血清、胰酶和双抗均购自于Gibco 公司,慢病毒TUSC3 过表达质粒(pLV[shRNA]:T2A:Puro-U)和对照质粒全部购自于上海吉凯基因化学技术有限公司。反转录试剂盒购自于Takara 公司,Transwell 细胞小室购自于BioJet公司,伤口愈合2 孔插件培养皿购自于Ibidi 公司。Trizol 裂解液购自于Invitrogen 公司,二甲苯、多聚甲醛、甲醇和无水乙醇购自于西陇科学。
1.2 胎盘组织样本
本实验入组的标本为2022 年1 月~2022 年12月在海南医学院第一附属医院进行剖宫产分娩的胎盘组织,其中包括10 例对照组正常妊娠产妇及10例PE 患者的胎盘组织。入组患者严格按照入组标准及排除标准进行选择,入组标准为:符合《妇产科学(第9 版)》对PE 的诊断,在怀孕20 周后出现的收缩压大于或等于140 mmHg 和(或)舒张压大于或等于90 mmHg,伴发尿蛋白大于或等于300 mg/24 h或随机阳性蛋白尿或虽无蛋白尿,但合并以下一项或多项者:肝功能异常(血清转氨酶水平超过正常值2 倍);血小板小于100×109/L;肺水肿;肾功能异常(血肌酐水平大于1.1 mg/dL 或超过正常值2倍);新出现的中枢神经系统异常或视觉障碍。入组产妇均无其他内外科疾病,且孕期无大量用药史,吸烟酗酒史等。同时,收集两组产妇的临床指标如产妇年龄、生育史、PE 患者发病孕周、分娩孕周、收缩压、舒张压、尿蛋白、新生儿性别、新生儿体重、胎盘重量等。标本收集已通过海南医学院第一附属医院伦理委员会审批,所有入组患者均已签署知情同意书。
1.3 细胞系及过表达TUSC3 细胞株
人绒毛膜滋养细胞(HTR8/SVneo,下文简称HTR8)购自中科院上海细胞生物学研究所,是具有EVT 表型的正常滋养细胞株。细胞培养条件DMEM (C11995500BT, Gibco, USA)+10%FBS(Gibco)+1%青霉素/链霉素,37 ℃,5%CO2。采用磷酸钙法包被逆转录病毒至293T 细胞中,转染后48 h 后,收集含病毒的培养基上清,离心力300 g 离心3 min,取上清。加入5×病毒浓缩液,4 ℃冰箱中沉淀过夜,以离心力300 g 离心15 min。去上清,PBS 重悬病毒沉淀转染细胞,构建稳定过表达TUSC3 细胞株。
1.4 总RNA 提取及qRT-PCR 检测
使用Trizol 法(Invitrogen)于胎盘组织中提取总RNA,检测RNA 纯度以及浓度后,逆转录试剂盒PrimeScriptTM-RT reagent Kit (Takara)合 成cDNA 并进行定量检测。根据Takara 公司的 SYBR Premix Ex Taq TMI Ⅱ说明书配置反应溶液,扩增条件为 95 ℃ 30 s,95 ℃ 5 s, 55 ℃ 30 s,72 ℃ 30 s,45 个循环,分析其溶解曲线及循环阈值(CT 值),采用2-ΔΔCt方法计算,并进行统计分析。引物序列见表1。
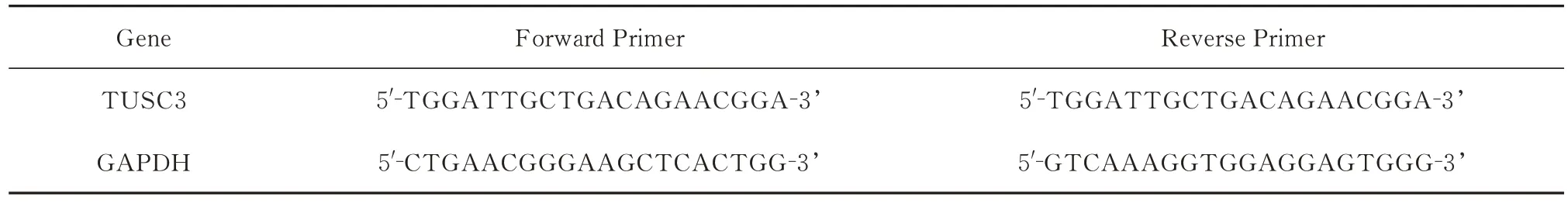
表1 主要引物序列Tab 1 The main primer sequence
1.5 免疫组化
取部分正常胎盘组织和PE 胎盘组织以4%多聚甲醛固定后,常规制备组织切片,厚度为4~5 μm,采用免疫组化染色法(SP)进行染色,一抗为多克隆兔抗人TUSC3 抗体(1∶500;no.ab230520; Abcam),二抗为山羊抗兔IgG,以PBS 代替一抗作为阴性对照,DBA 溶液显色后,采用苏木精复染,再用甘油明胶封片,然后在显微镜下观察结果。
1.6 划痕实验
准备1 mL 细胞重悬液,体积为6×105/mL。取出划痕实验小皿,在小皿中心小槽的左右小室中各加入70 μL 上述细胞悬液,静置2~5 min。将小皿转移至37 ℃培养箱,培养12 h 后,观察细胞贴壁情况。细胞贴壁后,用镊子将小槽拔除,1 mL PBS 轻轻洗涤2 次,随后加入1 mL 完全培养基。此时显微镜下拍照记录为0 h,之后每隔6 h 拍照一次,直至迁移融合。
1.7 Transwell 实验
在Transwell 小室的上室中加入100 μL 稀释后的Matrigel 胶,37 ℃培养箱中孵育1 h。计数细胞,密度调整为2.5×105/mL。弃去上室Matrigel 胶,每孔上室中加入200 μL 细胞悬液,下室中加入600 μL 完全培养基,37 ℃培养箱中培养24 h。培养24 h后,弃去上室培养基,用棉签轻轻擦去上室细胞,用PBS 清洗,重复两次。吸弃下室培养基,用PBS 清洗3 次。每孔中加入700 μL 4%多聚甲醛,室温下平衡放置固定30 min。去掉固定液,PBS 清洗2~3次,配制姬姆萨染色液(1 mL 姬姆萨原液+7 mL ddH2O),每孔加入700 μL 姬姆萨染色液,染色10~30 min,染色时间根据镜下观察细胞染色情况进行调整。用流水冲洗终止染色,晾干后在显微镜下进行拍照统计。
1.8 统计学处理
所有统计分析均采用统计软件SPSS23.0。临床指标分析中数据一般情况采用(±s),数据分析之前进行正态性检验,采用t 检验分析符合正态分布的计量资料的组间比较,采用秩和检验分析非正态分布的计量资料的组间比较,采用卡方检验分析计数资料的组间比较,P<0.05 视为差异有统计学意义。
2 结果
2.1 患者的临床指标分析
分别收集10 例 PE 组和正常对照组产妇的临床病理信息进行统计。与对照组相比,PE 组的收缩压(systolic blood pressure, SBP)和舒张压(diastolic blood pressure, DBP)均显著增高,蛋白尿比例上升(P<0.05),分娩孕周、新生儿出生体重明显降低(P<0.05),产妇年龄和新生儿性别无显着差异(P>0.05)(表2)。

表2 两组一般情况比较Tab 2 Comparison of general conditions between the two groups
2.2 TUSC3 在子痫前期胎盘组织中表达升高
首先,对公共数据GSE12767 中TUSC3 的表达进行了分析,该研究前瞻性收集了160 例10-12 周早孕绒毛,选取其中4 例妊娠时合并子痫前期,6 例正常妊娠早孕绒毛进行表达谱分析。结果显示,TUSC3 在子痫前期早孕绒毛中表达呈升高趋势(见图1A)。采用免疫组化分析10 例PE 和10 例对照组正常产妇晚期胎盘组织中TUSC3 的蛋白表达水平,结果显示TUSC3 在PE 组晚期胎盘组织中显著升高,与qRT-PCR 的结果一致(见图1B 和1C)。以上结果均说明TUSC3 在PE 组胎盘组织中表达显著升高。
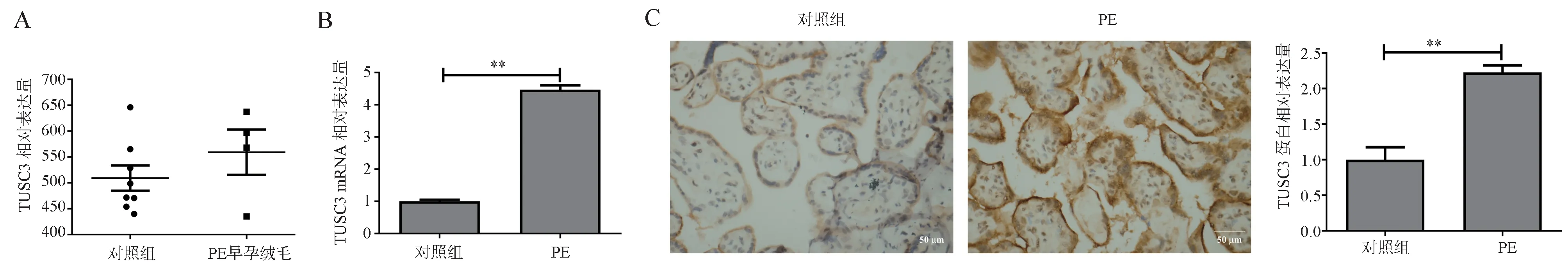
图1 TUSC3 在胎盘组织中的表达情况Fig 1 Expression of TUSC3 in placental tissue
2.3 TUSC3 高表达抑制HTR8 细胞迁移能力
采用划痕实验分析HTR8 稳定过表达TUSC3细胞株和对照组细胞株的迁移能力(见图2)。结果显示在9 h,过表达TUSC3 细胞与对照细胞出现明显迁移速率差异(P<0.01),过表达TUSC3 的细胞迁移率出现明显的下降。对照组细胞15 h 已发生融合,而过表达TUSC3 的HTR8 细胞株未发生融合(见图2B)(P<0.01)。融合距离测算后进行统计学分析,两组迁移速率具有显著统计学差异(见图2C)。结果提示过表达TUSC3 抑制HTR8 细胞的迁移能力。
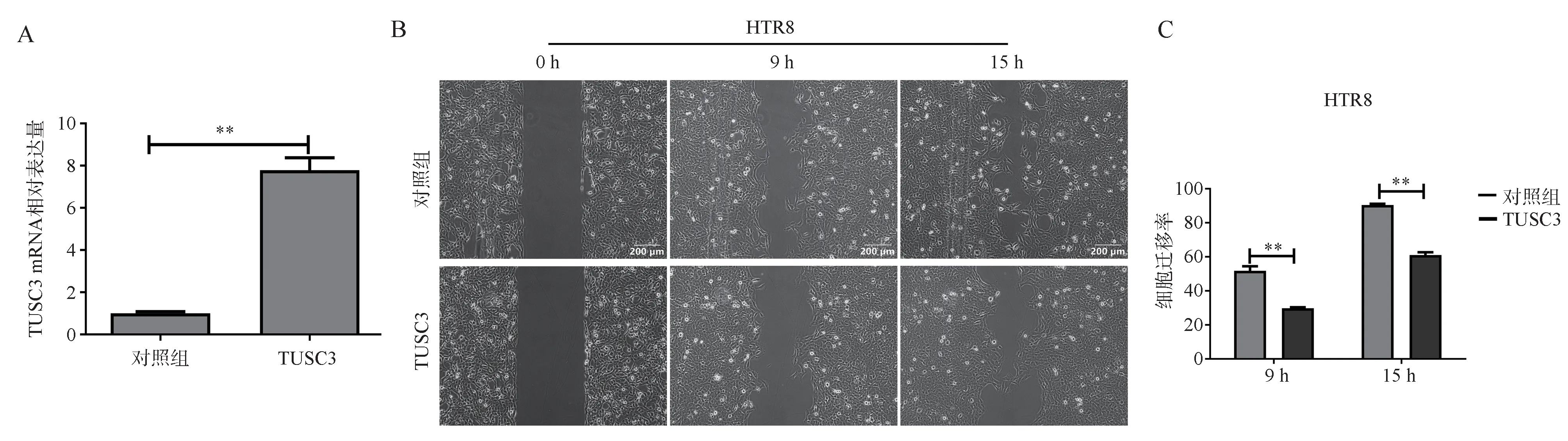
图2 细胞迁移实验Fig 2 Cell migration experiment
2.4 TUSC3 高表达抑制HTR8 细胞侵袭能力
采用Transwell 实验分析HTR8 稳定过表达TUSC3 细胞株和对照组细胞株的侵袭能力(见图3)。结果显示,与对照组细胞相比,过表达TUSC3后,HTR8 细胞株中侵入下室的细胞均显著减少(见图3A),侵入下室的细胞计数后进行统计学分析,两组侵入率具有显著统计学差异(见图3.B)(P<0.01)。结果提示过表达TUSC3 抑制HTR8 细胞的侵袭能力。
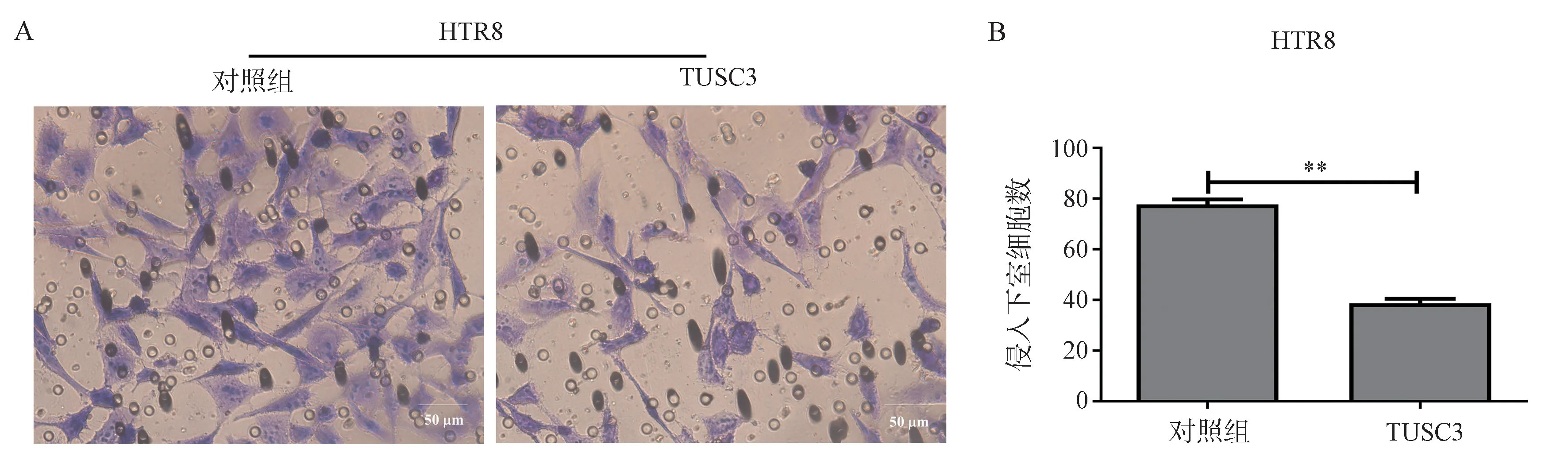
图3 细胞侵袭实验Fig 3 Cell invasion assay
3 讨论
PE 是妊娠期特异性疾病,其病因主要与病理性胎盘形成密切相关[9]。滋养细胞的迁移和侵袭功能障碍会损害胎盘的正常功能,是PE 发病的主要机制之一[10,11]。本研究结果显示TUSC3 的表达在PE患者的胎盘组织中显著升高,TUSC3 的上调抑制滋养细胞的迁移和侵袭。同时,我们在公共数据库中筛选了GSE12767 数据集,前瞻性收集160 例10-12 周早孕绒毛,选取其中4 例妊娠时合并PE,和6例正常妊娠的早孕绒毛进行表达谱分析[12],该结果显示TUSC3 在PE 早期绒毛组织中表达呈现上升趋势。推测TUSC3 表达异常导致滋养细胞功能障碍,进而造成胎盘浅着床,从而参与PE 的发生、发展。TUSC3 表达的异常可能在妊娠早期就影响滋养细胞的功能,参与PE 的发病。因此,TUSC3 有希望成为早期预测PE 发病的标志物,但仍需要进一步的研究。
滋养细胞是构成胎盘组织的重要部分。滋养细胞的主要功能是协助胚胎着床,并作为连接胚胎与母体子宫动脉间的桥梁,保证胚胎的营养供应,是胎儿发育的基础保障[13]。正常妊娠早期8~10周,低氧状态(2%)有利于滋养层细胞的增殖,增殖的滋养层细胞将胚泡固定在子宫内膜上,并堵塞胎盘蜕膜层内螺旋动脉的尖端,限制血液流动使氧进入绒毛间隙,促进滋养层细胞增殖。至妊娠12 周,胎盘通过建立含氧血液连续低流量灌注绒毛间隙,使含氧量升高至8.5%,促进增殖型滋养层细胞向侵袭型间质EVTs 分化,并迁移、侵袭入子宫壁及螺旋动脉血管内皮,破坏弹性蛋白并取代平滑肌细胞,重塑螺旋动脉,维持正常妊娠[14]。由此可见,滋养细胞的分化和侵袭是保证胎盘正常发育和维持妊娠发展的基础。
PE 的发病机制涉及母体、胎儿、胎盘等多个环节。有关病因和发病机制的主要学说包括胎盘浅着床、内皮细胞氧化应激、母胎免疫耐受失衡、遗传因素等[15]。其中,较为经典的是“两阶段”学说:第一阶段为临床前阶段,在孕早期,滋养细胞分化、迁移及侵袭等功能异常,不能有效侵入子宫肌层,导致子宫螺旋动脉“血管重塑”障碍,从而造成“胎盘浅着床”。第二阶段为临床阶段,由于“血管重塑”障碍,导致胎盘灌注不足,氧化应激增加,内皮细胞受损,引起胎盘源性的大量炎性因子释放入血,从而引起PE 的一系列临床症状[16]。在孕早期,滋养细胞侵袭功能异常,不能充分侵入子宫肌层,导致子宫螺旋动脉的血管重塑障碍从而导致胎盘浅着床是PE 发病的最主要原因[17]。滋养细胞侵袭功能的异常与多种因素相关,如滋养细胞氧化应激损伤、内质网应激、上皮间质转化功能异常、线粒体功能异常及信号通路的过度激活或抑制[18]。
滋养细胞也是一种“假肿瘤”细胞,具有类似肿瘤细胞迁移及侵袭的能力。我们前期研究发现,在宫颈癌细胞中,过表达TUSC3 通过调控AKT 信号通路抑制宫颈癌细胞的迁移及侵袭[8]。在小细胞肺癌中,TUSC3 表达下调促进淋巴结的转移,而在淋巴结阴性的组织中TUSC3 明显高于正常组织[19]。在肝癌中,过表达TUSC3 可以抑制LIPC/AKT 信号通路,从而抑制肝癌细胞EMT 进程,导致肝癌细胞增殖及侵袭能力下调[20],TUSC3作为“抑癌基因”参与调控细胞侵袭及迁移能力。本研究结果也同样表明,过表达TUSC3 的滋养细胞株迁移和侵袭能力明显减弱。因此,我们推测TUSC3 可能是参与调控滋养细胞功能全新的关键因子。同时,有文献报道TUSC3 参与N-糖基化的过程[21]。蛋白质糖基化过程发生在细胞内质网中,异常糖基化会破坏内质网内蛋白质的折叠,诱发内质网结构和功能发生改变,促发内质网应激[22,23]。过度的内质网应激通过TXNIP 途径激活NLRP3 炎性小体,诱发细胞焦亡促进PE 的发生、发展[24,25]。细胞焦亡是一种促炎的程序性细胞死亡方式[26],其特征为PAMPs/DAMPs 和ROS 等危险因素激活NLRP3 炎性小体及半胱天冬酶(主要是caspase-1,4,5,11),gasdermin 家族蛋白介导膜孔形成、膜通透性增加,导致大量炎症因子的快速释放。近期研究显示,在PE 孕妇外周血和胎盘组织中均可检测到高表达的NLRP3、Caspase-1、IL-1β 和 IL-18 等炎症因子,提示胎盘组织中细胞焦亡的活化与PE 发病风险显著相关[26]。PE 胎盘滋养细胞中细胞焦亡比例升高,使大量炎症因子和报警因子进入母体循环,诱发PE 发病过程中的无菌性炎症,促进全身性炎症级联反应[27]。有学者研究发现,当抑制胎盘滋养细胞NLRP3 活化,可以显著改善LPS 诱导的PE 样症状,这进一步证实滋养细胞NLRP3 上调、凋亡过度激活在PE 进展中发挥重要的作用[28]。因此,推测TUSC3 可能通过影响N-糖基化的过程诱发内质网应激,引起滋养细胞焦亡,从而参与PE 的发生、发展。TUSC3 调控滋养细胞功能的具体分子机制仍需深入的研究。
综上所述,PE 胎盘组织中TUSC3 表达上调,并抑制滋养细胞迁移和侵袭能力。同时,对TUSC3 调控的具体分子机制进行了初步的探讨,有望为PE 的防治策略提供新的思路和理论依据。
作者贡献度说明:
李蒙勇威、马燕琳:实验设计与论文撰写;林丹:细胞实验;康金雨:查阅文献;孙菲、揭秋玲:实验设计与数据分析。
所有作者声明不存在利益冲突关系。

