水溶性蜂胶抑制溃疡性结肠炎大鼠氧化损伤的作用
周 华,张 敏,姜文涛
(安徽医学高等专科学校生理学教研室, 安徽 合肥 230601)
溃疡性结肠炎(ulcerative colitis,UC)是一种使胃肠道衰弱的、特发性慢性炎症性结肠疾病,表现为肠黏膜的慢性反复炎症,会导致带血腹泻和严重腹痛等症状。组织损伤和修复的起伏最终导致黏膜功能的丧失,并引发结肠炎相关的癌症。已经证明UC 的发生与发展与多因素有关,其中活性氧(reactive oxygen species,ROS)和促炎细胞因子是触发器,它们触发和加剧肠黏膜屏障完整性破坏[1],引起肠腔内病原体的流入和随后异常激活的肠黏膜免疫反应[2],从而导致组织损伤,表现为UC 的各种临床症状。
目前常使用糖皮质类固醇、氨基水杨酸和肾上腺糖皮质激素等药物治疗UC,但大多数都有副作用。新的替代疗法是UC 治疗的研究热点,天然产物是该领域的来源。据文献报道,膳食多酚可减少ROS 对肠黏膜的损伤,增强细胞内的“自卫”,对抗氧化应激和炎症[3]。
蜂胶富含黄酮类化合物(一类广泛存在的生物活性多酚类化合物)。近期研究报道,蜂胶具有抗溃疡作用,可促进黏膜愈合和肉芽肿形成[4];蜂胶显著抑制细菌脂多糖诱导小鼠巨噬细胞炎症因子的表达与释放,缓解细胞内ROS 的累积,在炎症性疾病中发挥抗炎作用[5]。这些抗炎特性使得蜂胶成为一种很有前途的改善UC 的天然产物。既往的研究表明,蜂胶可缓解UC 大鼠结肠炎症,然而,蜂胶缓解UC 的机制仍有待阐明。
本研究中,利用葡聚糖硫酸钠(dextran sulfate sodium,DSS)制备UC 大鼠模型,探讨水溶性蜂胶(water-soluble propolis,WSP)对炎症结肠黏膜的抗氧化和抗炎作用,为临床治疗UC 等炎症性肠病提供新的治疗选择。
1 材料与方法
1.1 实验动物
SPF 级雄性SD 大鼠(许可证号:SCXK(鲁)20190003),40 只,体质量(180±20) g。质量检测单位:山东省实验动物中心。
1.2 药物和试剂
DSS(MW:36,000-50,000;MP Biomedicals,CANADA);超氧化物歧化酶(superoxide dismutase,SOD)ELISA 检测试剂盒 ,谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)ELISA 检测试剂盒,以上均购自CUSABIO 公司。ROS 检测ELISA 试剂盒,丙二醛(malondialdehyde,MDA),髓过氧化物酶(Myeloperoxidase,MPO)检测试剂盒,购自南京建成生物医学工程研究所。柳氮磺吡啶(Sulfasalazine,Sulfa)购自合肥志宏泰克生物技术有限公司。多聚甲醛,苏木素伊红均购自Biosharp公司。水溶性蜂胶购自广州市杰禾蜂业有限公司(批号:20210325-B)。
1.3 动物分组
48 只雄性SD 大鼠,实验前适应性喂养1 周。笼养于动物室内带有木屑的笼子里(23±2) ℃环境温度和12 h 的光-暗循环)。随机分为正常组(normal group,N 组)、对照组(control group,C 组)、阳性对照组(positive control group,P 组)、低剂量蜂胶组(low dose group,L 组)、中剂量蜂胶组(medium dose group,M 组)和高剂量蜂胶组(high dose group,H 组),每组8 只。
1.4 给药方法
实验采取先预给药再造模型的方式。在整个实验过程中,N 组和C 组经口灌胃蒸馏水,P 组经口灌胃柳氮磺吡啶100 mg/kg,灌胃剂量0.2 mL/10 g,L 组、M 组和H 组经口灌胃蜂胶,剂量分别为50、100 和200 mg/kg。给药7 d 后,N 组自由饮用蒸馏水7 d;C 组、P 组、L 组、M 组 和H 组 自 由 饮 用5%DSS 溶液7 d。最后,停止自由饮用DSS 溶液,各组均正常自由饮用蒸馏水饲养2 d(图1)。后颈椎脱臼处死大鼠。
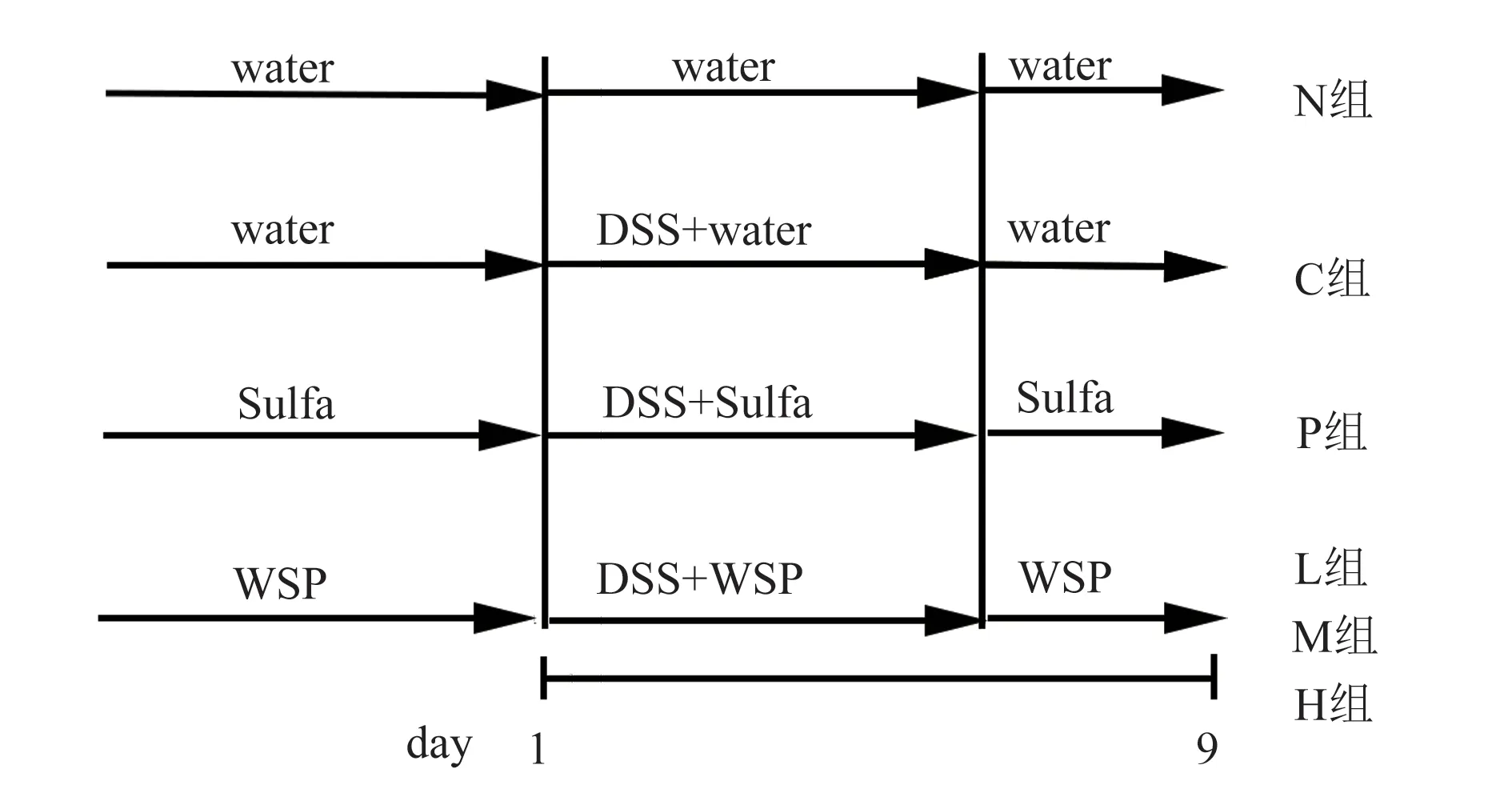
图1 UC 模型建立路线Fig 1 Ulcerative colits model design
1.5 体重变化及便血情况监测
从饮用DSS 第1 天开始,每天同一时间点观察各组大鼠体重、便血情况、粪便情况并详细记录数据,连续记录9 d,第10 天将动物处死。将第1 天体重标记为实验前起始体重。
体重变化(%)=[(第x 天体重-第1 天体重)/第1 天体重]×100%
使用隐血检测试剂盒检测大鼠便血情况。
1.6 疾病活动指数评分
从饮用DSS 第2 天开始基于体重变化、粪便性状及便血情况,根据以下标准评估疾病活动指数(disease activity index,DAI),DAI=体重减轻的评分+粪便性状的评分+便血情况的评分[6]。评分标准见表1。
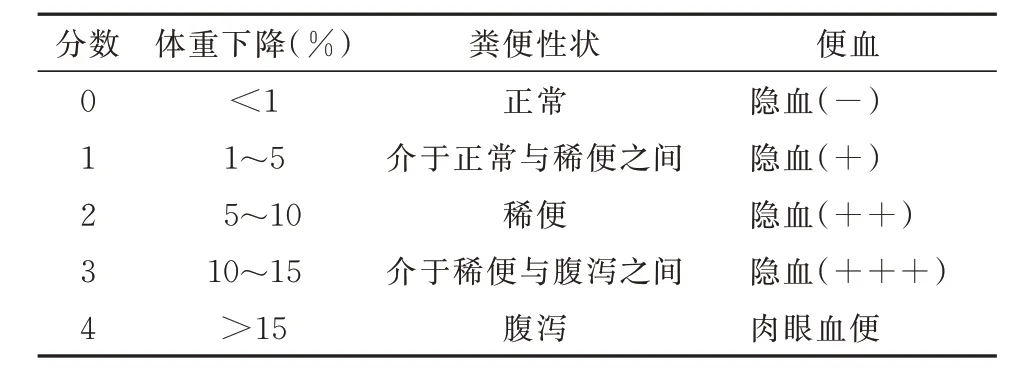
表1 疾病活动指数评分Tab 1 Disease activity index score
1.7 样本采集与处理
各组大鼠处死后,随即解剖将大鼠肛门2 cm 以上的结肠肠段完整的从腹腔中取出。结肠肠段铺平测量结肠长度;将结肠沿纵轴剖开,用预冷生理盐水冲洗,清理结肠内容物,置于滤纸上吸干,测量结肠质量/长度(weight/length,W/L)比=结肠质量(g)/结肠长度(cm)[7],并评估结肠黏膜损伤指数(colonic mucosal damage index,CMDI)[8],评分标准见表2。

表2 结肠黏膜损伤指数评分Tab 2 Colonic mucosal injury index score
切取结肠组织,部分结肠组织用4%多聚甲醛固定于EP 管内;其余结肠组织置于EP 管中剪碎,加入5 倍体积生理盐水进行匀浆,静置2 h 后在4 ℃以10 000 r/min 离 心10 min,取 上 清 液,-80 ℃保存。
1.8 结肠组织病理形态学观察
将固定后的结肠组织流水冲洗过夜,梯度酒精脱水、二甲苯透明、石蜡包埋,制成5 μm 厚切片,常规苏木精-伊红(HE)染色,在光学显微镜下观察病理切片,并进行结肠组织学(histological score,HS)评分[9]。结肠组织学损伤评分标准见表3。
1.9 大鼠结肠组织氧化应激指标水平测定
将各组结肠组织从-80 ℃冰箱中取出,称取100 mg 放入冰盒内,用冰生理盐水将组织制成10%的组织匀浆,然后取出1/4 稀释成体积分数1%的组织匀浆,于4 ℃离心机中以14 000 r/min,离心15 min,取上清,按照试剂盒说明书所描述的方法,测定ROS、MDA、MPO、SOD、GSH-Px 活性。
1.10 统计学处理
所有数据均以(±s)表示,采用SPSS22 进行统计学分析,多组间数据比较采用单因素ANOVA方法检验,多组间两两比较,方差齐,采用LSD/SNK 法,方差不齐,采用Tamhane's T2 法检验;P<0.05 为差异具有统计学意义。
2 结果
2.1 WSP 改善DSS 诱导的UC 大鼠结肠炎症
本研究采用WSP 和Sulfa 处理大鼠16 d,于第8天自由饮用5% DSS 溶液建立UC 模型,DSS 连续处理7 d,再停止饮用DSS 溶液2 d,模拟UC 期间活动性疾病和缓解期交替出现。表4 结果显示,与N组相比,C 组大鼠饮用DSS 第2 天,即出现明显体重下降(F=4.323,P<0.01),进行低、中、高浓度的蜂胶进行干预,与C 组比较,在饮用DSS 溶液第2 天,H 组能显著抑制DSS 导致的体重下降(F=4.323,P<0.05),在饮用DSS 溶液第4 天和第6 天,M 组(F=106.134,P<0.05)和L 组(F=28.156,P<0.01),DSS 导致的体重下降显著抑制。
表4 WSP 对各组大鼠体重变化的影响(±s)Tab 4 Effects of WSP on body weight change in each group of rats(±s)

表4 WSP 对各组大鼠体重变化的影响(±s)Tab 4 Effects of WSP on body weight change in each group of rats(±s)
注:与N 组比较,*P<0.05, **P<0.01;与C 组比较,#P<0.05,##P<0.01;与P 组比较,△P<0.05,△△P<0.01。
组别N 组C 组P 组H 组M 组L 组F第9 天12.47±0.23-18.53±0.28**10.23±0.16 7.67±0.15##△△1.39±0.27##△△-6.45±0.19##△△784.789第2 天0.36±0.02 0.30±0.08**0.37±0.04 0.34±0.01#0.32±0.03△△0.31±0.05△△4.323第3 天2.16±0.11-4.31±0.11**-4.07±0.19-4.17±0.12#-4.25±0.13△△-4.31±0.03△△98.26第4 天3.34±0.20-4.51±0.21**-4.12±0.11-4.25±0.24#-4.28±0.06#-4.49±0.26△△106.134第5 天5.03±0.43-6.34±0.37**-2.27±0.35-2.65±0.40##△-4.33±0.25##△△-6.18±0.28△△127.870第6 天7.69±0.10-9.89±0.09**0.39±0.03 0.25±0.04##△-4.14±0.12##△△-9.01±0.17##△△28.156第7 天9.11±0.11-13.63±0.31**3.23±0.12 2.58±0.28##△△-3.52±0.24##△△-8.39±0.19##△△352.798第8 天10.56±0.19-16.78±0.15**7.80±0.17 5.40±0.26##△△-1.74±0.25##△△-7.80±0.08##△△765.68
表5 结 果 显 示,C 组 大 鼠 饮 用DSS 第2 天,其DAI(0.88±0.35)明显高于N 组(0.25±0.46)(F=1.909,P<0.05),而与C 组比较,M 组(0.38±0.52)和H 组(0.38±0.52)大鼠DAI 评分降低(F=1.909,P<0.05);在 饮 用DSS 溶 液 第8 天,与C 组DAI(7.38±0.52)相比,L 组DAI(6.75±0.46)明显降低(F=249.503,P<0.01)。
表5 WSP 对各组大鼠DAI 的影响(±s)Tab 5 Effects of WSP on DAI in each group of rats(±s)
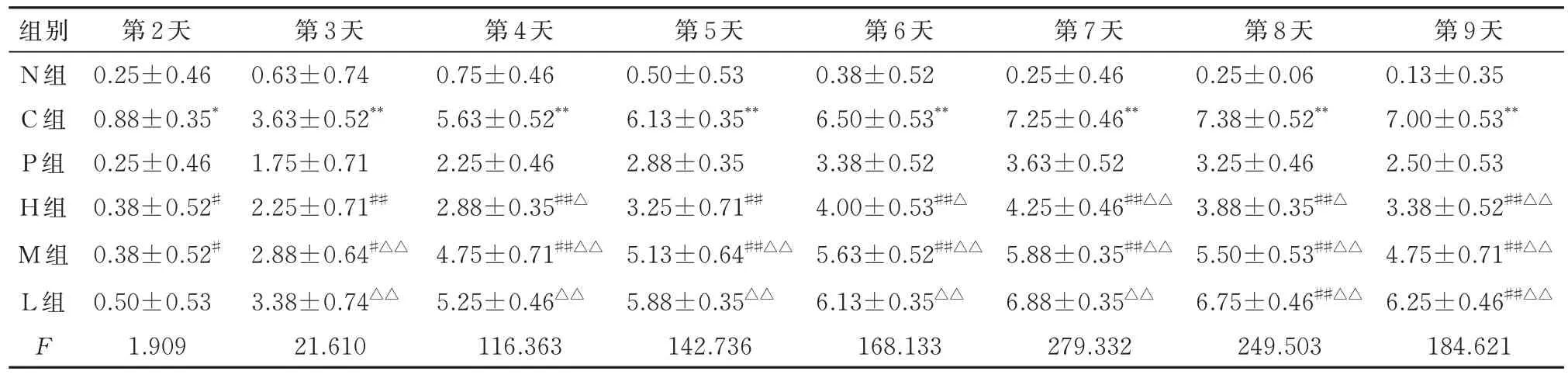
表5 WSP 对各组大鼠DAI 的影响(±s)Tab 5 Effects of WSP on DAI in each group of rats(±s)
注:与N 组比较,*P<0.05, **P<0.01;与C 组比较,#P<0.05,##P<0.01;与P 组比较,△P<0.05,△△P<0.01。
组别N 组C 组P 组H 组M 组L 组F第9 天0.13±0.35 7.00±0.53**2.50±0.53 3.38±0.52##△△4.75±0.71##△△6.25±0.46##△△184.621第2 天0.25±0.46 0.88±0.35*0.25±0.46 0.38±0.52#0.38±0.52#0.50±0.53 1.909第3 天0.63±0.74 3.63±0.52**1.75±0.71 2.25±0.71##2.88±0.64#△△3.38±0.74△△21.610第4 天0.75±0.46 5.63±0.52**2.25±0.46 2.88±0.35##△4.75±0.71##△△5.25±0.46△△116.363第5 天0.50±0.53 6.13±0.35**2.88±0.35 3.25±0.71##5.13±0.64##△△5.88±0.35△△142.736第6 天0.38±0.52 6.50±0.53**3.38±0.52 4.00±0.53##△5.63±0.52##△△6.13±0.35△△168.133第7 天0.25±0.46 7.25±0.46**3.63±0.52 4.25±0.46##△△5.88±0.35##△△6.88±0.35△△279.332第8 天0.25±0.06 7.38±0.52**3.25±0.46 3.88±0.35##△5.50±0.53##△△6.75±0.46##△△249.503
结肠的长度与实验性结肠炎的严重程度呈负相关,结肠缩短是结肠炎严重程度的标志,图2AB结果显示,与N 组(21.03±0.79)比较,C 组大鼠结肠长 度(17.71±0.44)显 著 缩 短(F=73.312,P<0.01)。与C 组 相 比,M 组(18.49±0.29)和H 组(20.89±0.52)大鼠结肠长度显著延长(F=75.350,P<0.01),但L 组与C 组比较差异无统计学意义(P>0.05)(图2AB)。与P 组相 比,L 组、M 组和H 组均有显著差异(P<0.01)。
与N 组(0.07±0.00)比较,C 组结肠W/L 比值(0.08±0.01)明 显 升 高(F=5.716,P<0.05)(图2D)。与C 组比较,L 组、M 组和H 组结肠W/L 比值呈增高趋势,但差异无统计学差异(P>0.05)。与P组 对 比,L 组、M 组 和H 组 结 肠W/L 比 值 无 统 计 学差异(P>0.05)。
2.2 WSP 减轻UC 大鼠结肠组织病变程度
观察HE 染色的病理切片,如图3A 所示,N 组结肠黏膜层、黏膜下层结构,隐窝结构正常,无炎性细胞浸润;C 组见结肠黏膜层、黏膜下层结构破坏,隐窝结构消失,并伴随大量炎性细胞浸润;与N 组(0.25±0.46)相比,C 组HS 评分(4.63±0.52)显著升高(F=84.082,P<0.01)(图3B)。H 组结肠黏膜层、黏膜下层结构,隐窝结构基本完整,未见炎性细胞浸润,损伤程度得到明显缓解;M 组仍可见炎性细胞浸润,而L 组仍见黏膜层、黏膜下层结构破坏,炎性细胞浸润(图3A)。图3B 中可见,与C 组相比,H 组HS 评 分(2.75±0.46)降 低(F=84.082,P<0.01),M 组HS 评分(4.00±0.53)降低(F=84.082,P<0.01)(图3B),L 组HS 评分无显著统计学差异(P>0.05)。与P 组相比,L 组(P<0.01)、M 组(P<0.01)和H 组(P<0.05)HS 评分均有统计学差异。
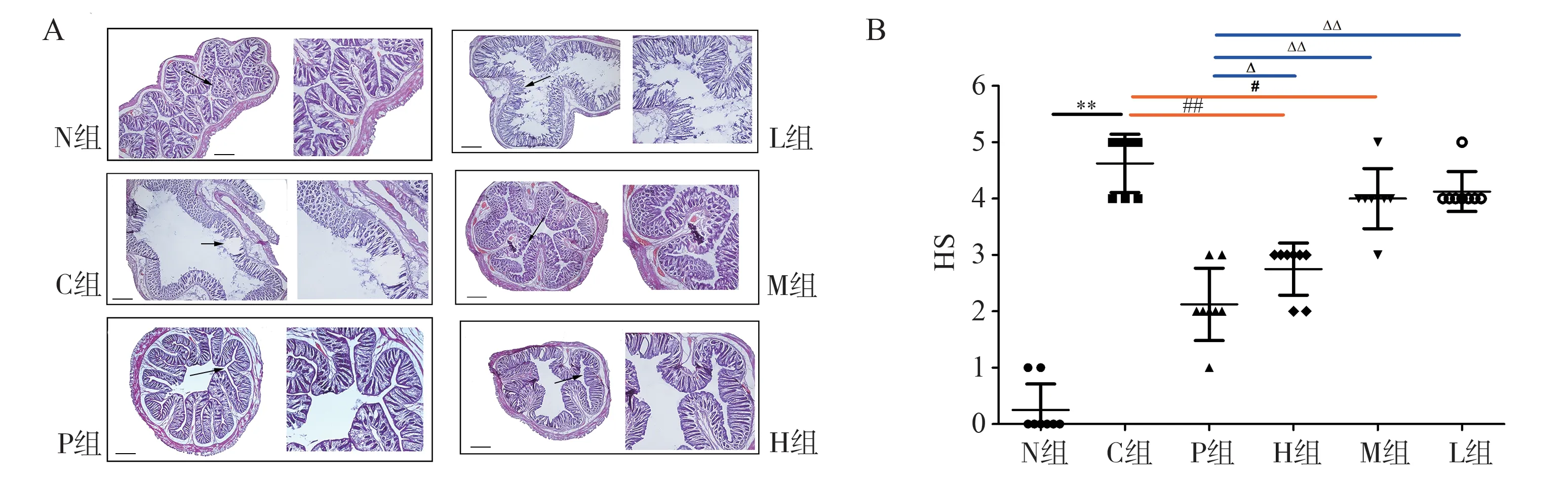
图3 WSP 对各组大鼠结肠病理变化的影响(HE 染色,×40)Fig 3 Effect of WSP on pathological changes of colon in rats(HE staining,×40)
2.3 WSP 减轻UC 大鼠结肠组织氧化应激损伤
如图4A 所示,与N 组结肠组织匀浆中SOD 含量(44.82±2.80)比较,C 组(22.77±3.18)明显下降(F=121.178,P<0.01)。与C 组结肠组织匀浆中SOD 含 量(22.77±3.18)比 较,H 组(33.41±1.34)(P<0.01)、M 组(25.28±1.65)(P<0.05)明 显 升高,而L 组改变无统计学意义(P>0.05)。与P 组结肠组织匀浆中SOD 含量(38.66±0.80)比较,H 组、M 组、L 组均显著降低(P<0.01)。

图4 WSP 对各组大鼠结肠组织SOD、GHS-Px、MDA、ROS 和MPO 水平的影响Fig 4 Effect of WSP on the levels of SOD, GHS-Px, MDA, ROS and MPO in colon tissue of rats in each group
如图4B 所示,与N 组大鼠结肠组织匀浆中GSH-Px 含 量(44.78±2.39)比 较,C 组(20.88±1.98)明显下降(F=262.132,P<0.01)。与C 组大鼠结肠组织匀浆中GSH-Px 含量(20.88±1.98)比较,H 组(36.42±2.33)(P<0.01),M 组(23.32±1.25)(P<0.05)明显升高,而L 组改变无统计学意义(P>0.05)。与P 组结肠组织匀浆中GSH-Px 含量(10.66±1.56)比较,H 组、M 组、L 组均有显著统计学差异(P<0.01)。
如图4D 所示,与N 组大鼠结肠组织匀浆中ROS 含量(138.07±2.59)比较,C 组(259.57±5.81)明显升高(F=192.140,P<0.01)。与C 组结肠组织匀 浆 中ROS 含 量(259.57±5.81)比 较,H 组(235.93±2.77)(P<0.01)、M 组(254.86±2.91)(P<0.05)明显降低,而L 组改变无统计学意义(P>0.05)。与P 组结肠组织匀浆中ROS 含量(146.85±3.58)比较,H 组、M 组、L 组差异均有显著统计学差异(P<0.01)。
如图4E 所示,与N 组大鼠结肠组织匀浆中MDA 含量(2.53±0.09)比较,C 组(6.96±0.10)明显升高(F=176.712,P<0.01)。与C 组结肠组织匀浆 中MDA 含 量(6.96±0.10)比 较,H 组(4.46±0.20)(P<0.01)明显降低,而M 组(6.88±0.14),L组(6.91±0.10)无明显统计学差异(P>0.05)。与P组结肠组织匀浆中MDA 含量(146.85±3.58)比较,H 组、M 组、L 组改变均有显著统计学差异(P<0.01)。说明DSS 诱导结肠炎时,结肠组织的的氧化应激水平显著升高。而中、高浓度蜂胶可能通过抗氧化功能,以浓度依赖的方式发挥对结肠黏膜的保护作用。
MPO 是一种几乎只存在于中性粒细胞中的酶,是促氧化和促炎的酶,是急性炎症反应的标志物。如图4C 所示,与N 组大鼠中结肠组织匀浆中MPO水平(169.37±12.49)相比,C 组(240.61±5.28)明显上调(F=591.267,P<0.01),说明UC 期间有大量中性粒细胞迁移到炎症结肠黏膜,而中性粒细胞的浸润,活化,导致免疫反应的异常激活,破坏肠黏膜结构和功能。与C 组大鼠结肠组织匀浆中MPO水平(240.61±5.28)相比,H 组(191.99±1.89)(P<0.01)、M 组(230.64±4.48)明显降低(P<0.01),而L 组改变无明显统计学意义(P>0.05)。与P 组相比,L 组、M 组和H 组改变均有显著统计学意义(P<0.01)。
上官婉虽不是才女,嫁个老公却堪称小城的才子。上官婉儿地下有知,亦或略感欣慰。上官婉的老公名叫包东坡,名字就透着才气。是本市重点中学的特级语文教师,又写得一手好字,画一手好画,在小城书画界也算是一号人物。
3 讨论
UC 是一种常见于消化系统的复发性和长期炎症性疾病,对受影响患者的身心健康有害,并可能增加结直肠癌的风险。临床上常使用的药物不能成功诱导炎症缓解和防止复发,且有副作用,目前对UC 的治疗主要是通过降低症状,降低发病率,提高生活质量,故UC 的治疗仍然是具有重大的医疗需求的领域,因此,人们对确定这种疾病的替代疗法和更可耐受的治疗方法越来越感兴趣。
天然产物及其衍生物,由于其广泛的治疗效果和副作用减少,被认为是新药研究和开发的来源。越来越多的证据证实[10],酚类,尤其是黄酮类化合物,在体外和体内都表现出有效的抗炎和抗氧化活性,是治疗UC 很有前途的药物。研究表明,饮食中富含多酚的食物[11],在诱导炎症性肠病缓解方面发挥重要作用。蜂胶是自然界中天然的抗生素,是蜜蜂从多种植物中采集的富含多种生物活性物质(如,黄酮类以及萜稀类等)的树脂物质,具有很好的抗氧化,作用可以清除体内的自由基,保护细胞膜、增强细胞活力,调节组织器官的功能[12]。在过去的十年里,人们对蜂胶在肠道健康方面的有益潜力进行了研究,证明了其对炎症性肠病的治疗价值。
3.1 WSP 对炎症结肠损伤的保护作用
DSS 诱导的结肠炎模型,由于其产生促炎因子和ROS 方面与人类UC 高度相似,是筛选抗炎和抗氧化作用的有用模型[13]。本研究利用5% DSS 诱导的大鼠UC 模型,并选择Sulfa 作为实验的阳性对照,为更好的评价WSP 对UC 的疗效。
在实验性UC 动物模型中,DAI 通常被用作测量结肠炎进展的独立量表,是根据疾病体征和症状进行评分,被认为是判断疾病程度和预后的主要指标。研究结果显示,UC 模型组大鼠DAI 明显升高,给予一定浓度WSP、Sulfa 灌胃的大鼠,DAI 均降低,差异均有统计学意义。说明WSP 在肠道炎症过程中的保护作用。结肠长度,是结肠炎症的另一个决定因素。UC 模型组大鼠,结肠长度明显缩短;给予中、高浓度WSP、Sulfa 灌胃的大鼠,离体结肠长度明显增长,再次说明WSP 限制结肠损伤的能力。
组织病理学分析证实,结肠组织暴露于DSS后,大鼠出现以结肠组织结构改变为特征的严重结肠炎症,观察到的结果与其他研究成果一致[14]。相比之下,给予中、高浓度WSP、Sulfa 灌胃的大鼠,结肠黏膜层、黏膜下层、隐窝结构得到保护,炎性细胞浸润减少,限制DSS 对肠黏膜的损害,说明一定浓度WSP 可保护结肠黏膜,缓解结肠炎症状。
结肠的主要功能是吸收水和电解质,促进粪便形成,利用蠕动促进排便,结肠的吸收功能障碍会引发腹泻[15]。本实验对各组结肠W/L 比值也进行了检测。我们发现,与UC 模型组大鼠比较,各蜂胶组结肠W/L 比值虽无显著的统计学意义,但呈增高趋势,说明结肠组织再生时,新血管发生,成纤维细胞生长,导致结肠更厚,结肠的W/L 比值反映了组织修复的程度[16]。研究结果提示,WSP 可促进结肠黏膜溃疡面的修复,并恢复结肠的吸收功能。
3.2 WSP 对炎症结肠保护作用的机制
肠黏膜屏障,通常被认为是宿主的主要防御系统,它对各种感染性或非感染性刺激形成了一个强大的屏障,以维持肠道黏膜稳态。结肠炎发生的关键事件即肠黏膜屏障破坏[17],肠黏膜屏障功能的病变与结肠黏膜上皮细胞通透性的改变以及更易受细菌侵袭和易位有关,这些事件可以触发炎症和氧化介质的释放,从而放大结肠损伤。结肠炎的严重程度可以通过影响中性粒细胞浸润、ROS 产生和促炎细胞因子产生的药物来改变治疗效果。本研究旨在探讨WSP 在DSS 诱导的结肠炎中的作用及其机制。
胃肠道中的细胞因子和氧化应激在时间和空间上协调了各种肠道炎症性疾病中炎症过程的起始、发展、加重和复发。通常结肠组织中MPO 的活性用于测定UC 大鼠免疫反应的大小,MPO 是炎症性胃肠道组织中中性粒细胞计数的间接标记物。文献报道,UC 严重程度与MPO 活性有关,MPO 的活性与被招募到炎症结肠的中性粒细胞数量成正比,可反映中性粒细胞浸润的程度[18]。中性粒细胞浸润促进UC 病理进展,并导致促炎细胞因子和ROS 的产生。MPO 是一种几乎只存在于中性粒细胞中的酶,中性粒细胞活化后,MPO 被释放到细胞外或吞噬小体内,导致肠道黏膜功能障碍和结肠组织损伤,加快肠道局部炎症的发展。本实验中,通过监测各组大鼠结肠组织匀浆中MPO 活性,发现UC 模型组大鼠结肠组织MPO 活性明显升高,而灌胃中、高浓度的WSP 和Sulfa 后,MPO 含量明显降低,说明WSP 可通过抑制中性粒细胞积聚,抑制肠黏膜异常免疫反应,保护肠黏膜屏障,缓解肠道炎症。中性粒细胞迁移到炎症结肠黏膜,导致促炎细胞因子水平增加,促炎细胞因子和抗炎细胞因子之间的失衡,可显著导致结肠组织损伤和结肠黏膜功能障碍。我们先前的研究已证明,UC 的严重程度与促炎细胞因子的产生密切相关[19,20]。
活化的中性粒细胞在肠黏膜内产生过量ROS。ROS 过量产生或其低效率的清除会导致组织氧化应激,从而导致脂质过氧化反应和下游炎症反应,在UC 的发病机制中起重要的作用[21]。氧化应激及其由此引起的脂质过氧化可加重自由基链式反应,破坏肠黏膜屏障的完整性,激活促炎反应。当细胞暴露于过量ROS 时,细胞凋亡成为细胞死亡的主要模式。正常生理情况下,结肠黏膜中含有相对较低水平的内源性抗氧化剂(如SOD,GSH-Px)。它们负责直接清除自由基,从而提供对生物组织中的氧化损伤的保护。当体内ROS 积聚增多时,体内内源性抗氧防御机制无法进行及时清除时,会引起氧化应激、细胞性疾病,如脂质过氧化反应增加和细胞死亡等。SOD 活性间接说明机体清除氧自由基的能力[22]。GSH-Px 是一种非酶的抗氧化剂,被认为是对抗自由基的第一道氧化防御系统。当细胞膜中的脂质含量被自由基攻击,激活脂质过氧化过程,从而导致细胞损伤。GSH-Px 可通过清除脂质过氧化产物MDA 起保护膜组织结构和功能的作用[23]。MDA 是氧化应激反应的产物,MDA 的水平可以表现出功能失调性氧化应激的严重程度[24],可反映细胞受损程度,MDA 水平是脂质过氧化和氧化应激的常用指标。本研究中,我们发现UC 模型组大鼠结肠组织中ROS、MDA 含量明显升高,说明结肠组织暴露于DSS 中,损害了结肠组织的抗氧化能力,产生大量ROS,导致氧化应激,炎性细胞浸润,引起脂质过氧化,导致MDA 含量升高,导致结肠炎的产生,而使用中、高浓度WSP 和Sulfa 干预后可明显抑制结肠组织中ROS、MDA 的含量。另外,UC 模型组大鼠结肠组织中非酶和酶防御系统水平显著下降,表明结肠上皮细胞存在氧化损伤,使用中、高浓度WSP 和Sulfa 干预后,大鼠结肠组织中SOD 和GSH-Px 水平升高,具有显著统计学差异。结果表明,WSP 可通过增强机体抗氧化能力和抑制脂质过氧化缓解DSS 诱导的结肠炎大鼠模型中结肠氧化损伤。
膳食中给予一定浓度的WSP 对DSS 诱导的大鼠结肠炎有有益作用,可通过防止结肠组织中SOD、GSH-Px 等内源性抗氧化酶活性的恶化,降低脂质过氧化损伤及其最终产物,如MDA,降低UC期间氧化应激;抑制中性粒细胞异常激活的免疫反应,发挥保护肠黏膜屏障的作用,在实验性UC 大鼠模型中缓解肠道炎症。WSP 是一种很有前途的治疗UC 的天然产物。
作者贡献度说明:
周华:实验设计,指标检测,文献查阅,数据统计,撰写论文;张敏:实验造模,实验数据审核;姜文涛:实验造模,指标检测。
所有作者声明不存在利益冲突关系。

