实验观察脱胶蚕丝的纳米图案化修饰对干细胞黏附和增殖的影响
欧阳秦君 刘晓娇 蔡国龙 姚响 张耀鹏
脱胶蚕丝因具有来源广泛、生物相容性和力学性能优异、低免疫原性和可生物降解等特性,在临床手术缝合线、传统的化妆品和个人护理等领域已有数百年的应用历史[1-3]。近年来,基于其优异的综合性能,亦逐渐探索其在肌腱、韧带等组织工程领域中的应用。但众多研究还体现出丝素蛋白材料的生物活性和生物功能性有待进一步提升的空间[4-5]。为了进一步提升脱胶蚕丝等类似纤维材料的生物功能性,当前大多数研究采用负载生物活性成分(抗菌剂、活性生物因子等)的方法[6-9]。相较而言,如何通过类似纤维材料的表界面图案化改性提升脱胶蚕丝的细胞黏附和增殖等生物功能性则未见研究报道。在其他类型的材料领域,尤其是二维膜材表面,已有大量研究证实材料表面的适宜纳米拓扑结构形貌能显著调控细胞行为[10-12],比如增强细胞的黏附、增殖和诱导定向分化的潜力。本研究旨在探索利用便捷的空气等离子体刻蚀技术对脱胶蚕丝表面进行有效的纳米图案化修饰,并借助扫描电子显微镜、高灵敏度动态力学疲劳试验机综合表征相关脱胶蚕丝表面的纳米图案特征及单丝力学性能变化,以期进一步选用大鼠骨髓间充质干细胞(bone mesenchymal stem cells, BMSCs)为模型细胞,深入研究纳米图案化修饰对干细胞黏附和增殖的影响。
资料与方法
一、资料
1. 材料和器材:主要材料包括桑蚕茧(浙江桐乡);聚二甲基硅氧烷(PDMS)试剂盒(Dow chemical,美国);环氧树脂AB 胶(得力集团有限公司);α-MEM 培养基、胎牛血清、青-链霉素、胰蛋白酶、磷酸盐缓冲液(PBS)(Gibco,美国);Cell counting kit-8(CCK-8)试剂盒(MCE,美国);碳酸氢钠(NaHCO3)、无水乙醇、叔丁醇、二甲基亚砜(DMSO)(国药集团化学试剂有限公司,中国);多聚甲醛(安徽白鲨生物科技有限公司);大鼠骨髓间充质干细胞(BMSCs)(上海赛箔生物科技有限公司)。主要仪器包括等离子体处理仪(SY-DT01,奥普斯等离子体科技有限公司)、扫描电镜(SEM,S-4800,日本Hitachi 公司)、动态力学疲劳试验机(Electro Force 3230,美国TA 仪器公司)、酶标仪(Multiskan FC,美国Thermo Fisher Scientific公司)。
2. 脱胶蚕丝的制备:先将桑蚕茧置于95 ℃的去离子水中煮1 min,后转移至室温的去离子水中泡1 min,重复3 次,使蚕丝舒展开来。再将舒展开的蚕茧置于87 ℃的 NaHCO3溶液中煮15 min(溶液浓度为0.02 M),使其进一步脱胶和舒展。最后理出头丝,将其均匀地缠绕在定制的聚四氟乙烯(polytetrafluoroethylene,PTFE)架子上。架子长26 mm、宽22 mm、高6 mm,中间镂空。脱胶蚕丝连续缠绕于架子上,丝的开始端和收尾端均用具有良好生物相容性的PDMS 进行粘接固定,纤维整体上接近平行排布特征。其中每个架子(样本)上缠绕的脱胶丝总长相当(均缠绕250圈)。将此步骤制备好的样本命名为non-etched silk(NE silk)。
二、方法
1. 脱胶蚕丝的纳米图案化修饰分析:将所制得的脱胶蚕丝样本(缠绕于PTFE 架子上的脱胶丝)置于等离子体处理仪中刻蚀进行纳米图案化修饰。处理功率为150 W,气氛为空气,压强维持在30 Pa。探索的刻蚀时间分别为10、30、50 min,并将其制备获得的纳米图案化修饰脱胶蚕丝依次命名为10 min-etched silk(10E silk)、30 min-etched silk(30E silk)、50 min-etched silk (50E silk)。
2. 各类脱胶蚕丝的微观形貌表征分析:采用扫描电镜观察各类脱胶蚕丝表面的微观形貌。测试之前,将未刻蚀处理和刻蚀10、30、50 min 的脱胶丝用导电胶粘贴于测试所用样品台上,并在脱胶丝表面喷镀铂金,喷镀电流为10 mA,时间为50 s。SEM测试电压为5 kV。
3. 纳米图案化脱胶蚕丝的图案特征分析:基于典型的SEM 图片,进一步采用Image J 软件进行图案化脱胶蚕丝表面的纳米图案特征分析。鉴于纤维表面有一定弧度,为尽可能降低相关误差范围,统计时仅选取纤维靠中间的区域(纤维直径约为10 μm,选取范围为纤维轴心线上 ± 2 μm 区域)。使用Photoshop 软件及Image J 软件,调整适宜的阈值以有效区分纳米图案区域与其他基底区域,进一步统计纳米图案的面积占比情况,即纳米图案的面积与整个基底面积的比例。
4. 等离子体刻蚀前后单根脱胶蚕丝的力学性能表征:采用带有高灵敏度传感器(250 g 载荷传感器)的动态力学疲劳试验机测试未刻蚀处理和刻蚀10、30、50 min 的各类单根脱胶丝的断裂强度和断裂伸长率。测试之前,将各类脱胶蚕丝裁剪为长30 mm 的短丝,各组蚕丝数量至少为7。测试时夹距设为18 mm,拉伸速率为30 mm/min。其中,各类脱胶蚕丝的截面积通过SEM 表征以及Image J 软件测量所得。首先将脱胶蚕丝用环氧树脂AB 胶包埋,待AB 胶固化后,用液氮将其脆断,进一步用此断面样品进行SEM 表征获得脱胶蚕丝的截面图片。最后通过Image J 软件测量出脱胶蚕丝截面积以用于计算对应纤维的断裂强度。
5. 骨髓间充质干细胞的复苏、培养与传代:细胞培养液按α-MEM 培养基、胎牛血清、青-链霉素体积比为90∶10∶1 的比例配置。将含BMSCs 的冻存管置于37 ℃、75 vol%的乙醇溶液中,摇晃快速解冻。之后转移至培养瓶中,置于37 ℃、5% CO2条件的培养箱内培养。细胞孵育培养24 h左右更换1次新的培养液以去除冻存液中的DMSO。之后每3 天更换一次培养液。当细胞铺满培养瓶底80% ~ 90%时,用胰蛋白酶将细胞消化。再经离心和重悬后重新制得细胞悬液,最后传代培养于3个培养瓶中。后续用于材料接种的干细胞均为P3 ~ P5代干细胞。
6. 干细胞在不同脱胶蚕丝样本上的接种与培养:将未刻蚀处理和刻蚀10、30、50 min 的脱胶蚕丝样本(缠绕于PTFE 架子上的脱胶丝)置于超低黏附6 孔板中,加入75 vol%乙醇没过样本,浸泡2 h 灭菌。移去乙醇,加入PBS 缓冲液浸泡洗涤样本3次,每次10 min,除去残留乙醇。最后加入细胞悬液接种于脱胶蚕丝样本上,接种密度为105/孔,所加细胞培养液为4 ml。随后每3 天更换1 次新鲜培养液进行材料上的细胞培养。
7. 干细胞在不同脱胶蚕丝样本上的黏附状态评估:由于脱胶丝的自发荧光特征导致较难通过荧光染色清晰观察其表面的细胞黏附状态。选用SEM 观察各脱胶蚕丝上的细胞黏附情况,测试电压为5 kV。供测试用的细胞样品制备流程为:待细胞接种培养1 d 和4 d 后,弃去细胞培养液,加入2.5%多聚甲醛于4 ℃下固定2 h。弃去固定液,用PBS 缓冲液漂洗3 次,每次5 min。随后依次加入体积分数为30、50、70、75、80、90、100 vol%的乙醇进行梯度脱水;每种浓度的乙醇处理10 min。再加入叔丁醇没过样品,置于-80 ℃冰箱冷冻过夜。最后取出样品进行冷冻干燥。干燥好后将样品粘贴于样品台上,进行铂金喷镀处理(电流为10 mA,时间为50 s)。
8. 干细胞在不同脱胶蚕丝样本上的增殖情况评估:细胞增殖检测采用CCK-8 试剂盒。参照说明书将α-MEM 培养基、胎牛血清、CCK-8试剂按8∶1∶1的体积比配置成CCK-8 工作液。分别检测细胞在不同脱胶蚕丝样本上培养1 d 和4 d 后的细胞活力情况,进一步依据吸光度变化率对比反映相关细胞增殖情况。具体操作步骤为:把附着细胞的脱胶蚕丝样本转移至新的培养板中,每孔加入4 ml CCK-8工作液,置于37 ℃、5% CO2条件的培养箱中孵育2 h。孵育完后每孔吸取200 μL工作液加入96孔培养板内,在波长为450 nm处用酶标仪检测吸光度。
9. 统计学处理:为提高实验的准确性和可信度,各项测试的样品数量不少于3 个,实验结果用±s表示。数据差异采用Origin 软件中的One-way ANOVA 进行统计学分析。P< 0.05 为差异有统计学意义。
结 果
1. 不同脱胶蚕丝表面的结构特征比较:未刻蚀处理的脱胶蚕丝(NE silk)表面较为光滑,而经等离子体刻蚀(10、30、50E silk)的脱胶蚕丝表面均呈现出明显的纳米图案结构,且纳米结构特征在不同处理时间组间也存在较大的差异(图1)。

图1 不同时间等离子体刻蚀后脱胶蚕丝的典型表面SEM照片及其阈值化处理后的照片
为了更清楚地观察对应的纳米图案特征,进一步采用Image J 软件对不同图案化脱胶蚕丝表面的典型SEM 照片进行适宜的阈值调整处理(图1 第2行;其中红色区域代表纳米图案区域)。10E silk 上的纳米图案呈现出弯曲的蠕虫状结构;而30E silk和50E silk 上的纳米图案则呈现出明显的连续分支状结构;分支之间还通过一些更为细小的纳米结构所连接。随着刻蚀时间的延长,连续分支状纳米图案的横向尺寸有进一步增大的趋势。基于图案特征,统计对应纳米图案的面积占比显示,10E silk 的纳米图案面积占比均值约为34%,30E silk 约为30%,50E silk 约为28%。表现出随着刻蚀时间的延长,图案面积占比逐渐减小的趋势。
2. 不同脱胶蚕丝的单丝力学性能比较:NE silk的断裂强度以及断裂伸长率分别为(500 ± 46)MPa(16.3% ± 2.9%)。10E silk 的对应参数分别为(451 ± 52)MPa(14.9% ± 1.9%)。30E silk 的对应参数分别为(362 ± 68)MPa(10.7% ± 2.2%)。50E silk 的对应参数分别为(321 ± 76)MPa(6.9% ±2.4%)(图2)。相比于NE silk,10、30、50E silk 分别保留有原材料90%、72%、64%的断裂强度,以及92%、65%、42%的断裂伸长率(表1)。
表1 不同时间等离子体刻蚀后单根脱胶蚕丝的断裂强度、断裂伸长率保持率(%, ± s)

表1 不同时间等离子体刻蚀后单根脱胶蚕丝的断裂强度、断裂伸长率保持率(%, ± s)
组别NE silk 10E silk 30E silk 50E silk断裂强度保持率100 ± 9 90 ± 10 72 ± 13 64 ± 15断裂伸长率保持率100 ± 17 92 ± 11 65 ± 13 42 ± 14

图2 不同时间等离子体刻蚀后单根脱胶蚕丝的力学性能比较 A应力-应变曲线 B用于计算断裂强度的脱胶蚕丝截面SEM照片
3. 不同脱胶蚕丝的干细胞黏附和增殖情况比较:第1天时,各脱胶丝表面的大部分细胞均呈现出拉长的黏附形态。对比显示,NE silk 上的细胞黏附数量相对较少,铺展状态也较差。图案化脱胶蚕丝上的细胞铺展相对更好,且细胞数量也有所增多。第4 天时,各脱胶蚕丝上的细胞数量较第1 天时均有明显增加,且大部分细胞仍然呈现出沿纤维轴向拉长的黏附形态。但横向对比各组仍然可以看到图案化脱胶蚕丝上的细胞数量更多,其中以50E silk组为最优(图3)。
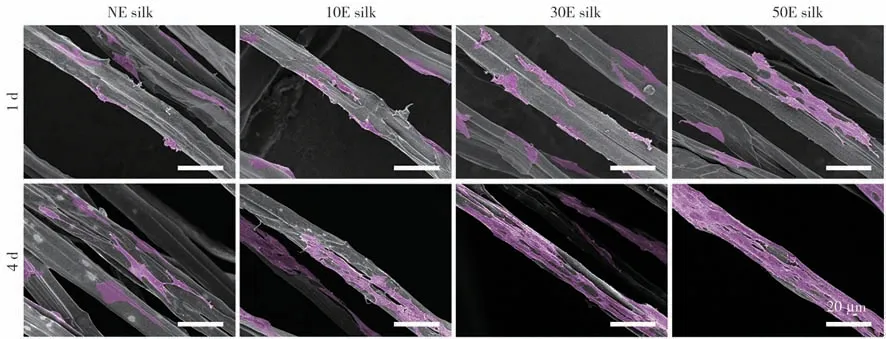
图3 干细胞在不同时间等离子体刻蚀后脱胶蚕丝上培养1 d和4 d后的黏附情况。细胞被标记为粉红色伪彩
细胞接种第1天后,图案化脱胶蚕丝的OD值均比NE silk 高;其中以50E silk 为最高。这与细胞初始黏附图片(图3首行)得到的细胞黏附规律趋势较为一致。当培养至第4天后,每个组别的OD值均有明显升高;其中NE silk、10E silk、30E silk、50E silk分别为(0.80 ± 0.04)、(2.21 ± 0.02)、(2.35 ± 0.27)、(2.73 ± 0.28)。图案化脱胶蚕丝与NE silk 相比均存在明显不同(P< 0.001);且50E silk组别最高,与其余所有组别对比差异均有统计学意义(P<0.05)。通过进一步的比较计算获得其上细胞的吸光 度 变 化 率(OD4d/ OD1d)分 别 为2.2、5.5、5.9 和6.1(表2);其中50E silk 组别的吸光度变化率显著高于其余3 组(P< 0.05)。相关定量结果进一步证实图案化脱胶蚕丝上的细胞增殖速度更快;其中以50E silk为最优。
表2 干细胞在不同时间等离子体刻蚀后脱胶蚕丝上培养1、4 d后的CCK-8检测结果( ± s)
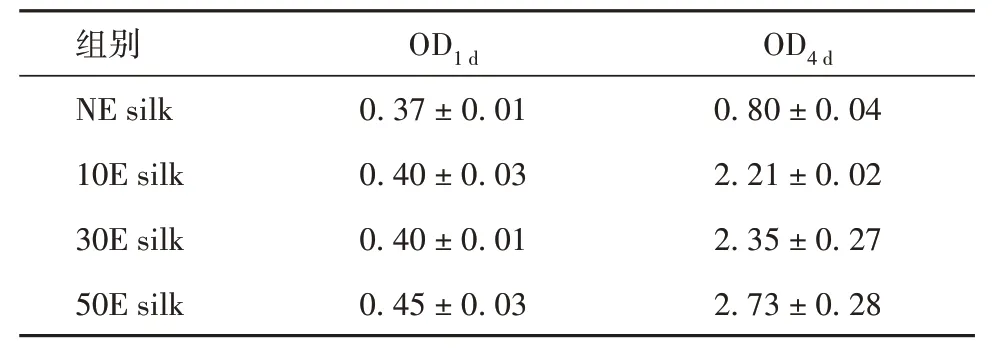
表2 干细胞在不同时间等离子体刻蚀后脱胶蚕丝上培养1、4 d后的CCK-8检测结果( ± s)
组别NE silk 10E silk 30E silk 50E silk OD1 d 0.37 ± 0.01 0.40 ± 0.03 0.40 ± 0.01 0.45 ± 0.03 OD4 d 0.80 ± 0.04 2.21 ± 0.02 2.35 ± 0.27 2.73 ± 0.28
讨 论
等离子体刻蚀作为一种干性刻蚀技术已在微纳图案加工中有广泛应用。除了微电子领域外,近年来在生物材料表面的微纳图案制备和修饰中也有较多应用。Jeon 等[13]采用多孔阳极氧化铝模板结合O2等离子体刻蚀在聚己内酯(polycaprolactone,PCL)无纺布表面上刻蚀出了较为规整的纳米图案。该图案修饰能有效促进MG63成骨细胞的初始黏附和增殖,有望应用于骨组织工程。本研究借助便捷、便于大规模制备的空气等离子体刻蚀技术在脱胶蚕丝表面制备出纳米图案,免去模板和特殊气体的使用,操作便捷。在刻蚀过程中,脱胶丝表面的纳米图案很可能是其自身结构中不稳定的软性区域(无定形结构含量高的区域)逐渐被刻蚀去除[14-15],而更为稳定的硬性区域(β-折叠结构含量更高的区域)逐渐显露或进一步融合所致。天然蚕丝中丝素蛋白的结晶结构是在其自然状态的温和纺丝过程中形成的,其结晶结构部分可能相较连续,因而10E silk 呈现出弯曲的蠕虫状纳米图案结构。随着刻蚀时间的延长。软性区域将被完全刻蚀去除;硬性区域则可能会逐渐发生融合,因而逐渐转变为连续分支状结构的纳米图案,且图案间相互有所连通。刻蚀50 min 时,硬性区域进一步融合导致纳米图案的尺寸有所增大。
本研究中,脱胶蚕丝经过空气等离子体刻蚀后力学强度有不同程度的下降。其中10E silk 的力学性能下降相对较小,还保留有原始材料90%以上的力学性能。但随着刻蚀时间的延长,脱胶丝力学强度下降越明显。相关影响趋势与等离子刻蚀对其他高分子材料的影响类似[16-18],主要是由于脱胶蚕丝等高分子材料的表面结构在等离子体刻蚀时受到了不同程度的破坏所致。进一步接种细胞培养后发现,脱胶蚕丝上细胞均呈现出拉长的黏附形态;其主要原因可能在于脱胶丝的直径尺寸约在10 ~ 15 μm;而已有研究报道证实宽度约为10 μm的条纹图案和直径约为10 μm的单根PCL纤维均具有显著的细胞接触诱导现象,即细胞倾向于沿条纹或纤维的伸展方向进行拉伸生长[19-20]。另外,相比于对照组,图案化脱胶蚕丝上细胞黏附铺展相对更好且数量也更多,这可能与此类较为连续的纳米级图案有效增加了材料表面的粗糙度,进而提升了细胞的黏附能力有关[21-23]。对比不同处理时间的脱胶丝可以发现,处理时间较长组别上细胞黏附的数量更多。其原因可能在于随着刻蚀时间的延长,其纤维表面连续纳米图案的横向尺寸均在逐渐增大。对于纳米尺度的蠕虫状或连续分支状结构,由于细胞焦点黏附,尤其是稳定焦点黏附的形成需要一定的临界尺寸(大约在几百纳米到几微米级别)[24-25],图案横向尺度的增加预计会更利于稳定焦点黏附的形成,进而更利于细胞的黏附和铺展。体内植入材料的细胞活性亦是成功实现组织修复的关键指标,具有更优的促细胞黏附和增殖的材料通常更容易募集周围细胞开展骨组织或其他组织缺损的修复。与对照组相比,脱胶蚕丝的纳米图案化修饰可以显著促进干细胞的黏附和增殖行为,刻蚀时间为50 min 的组别(50E silk)具有最优的促细胞黏附和增殖能力。50E silk 对细胞增殖能力的提升约为未修饰对照组的2.8 倍,明显高于其他研究中的一些常用图案化修饰策略[26-27]。相关影响可能是图案化脱胶蚕丝表面粗糙度的增加以及各类纳米图案固有特征结构综合作用所导致的。
综上所述,采用空气等离子体刻蚀技术可实现脱胶丝表面较为规整的纳米图案化修饰,且相关纳米图案的特征可通过调节等离子体刻蚀时间等参数有效调控。相比于无修饰的脱胶丝材料,纳米图案化修饰后的脱胶丝可以显著促进干细胞的黏附和增殖,且大体呈现出处理时间越长、效果越优的趋势。进一步考察单根脱胶丝的力学性能变化,预计刻蚀时间为10 min 的脱胶蚕丝(10E silk)在手术缝合线或机体骨组织等取向受力组织修复领域具有更优的应用前景;其原因在于此类纳米图案化修饰既显著提升了干细胞的黏附和增殖能力,又保有原材料90%以上的断裂强度和断裂伸长率。
利益竞争声明所有作者声明,无已知的可能影响本文所述工作的相互竞争的经济利益或个人关系。

