甘薯羽状斑驳病毒和甘薯褪绿矮化病毒检测方法的建立
陈涛 薛婷 杨志坚 陈选阳 陈由强 陈建楠









摘 要:為了建立甘薯羽状斑驳病毒(Sweet potato feathery mottle virus,SPFMV)和甘薯矮化褪绿病毒(Sweet potato chlorotic stunt virus,SPCSV)的逆转录环介导等温扩增(RT-LAMP)检测方法,提高检测灵敏度,实现结果的可视化。根据SPFMV外壳蛋白基因(CP)的核苷酸序列和SPCSV的热休克蛋白基因(Hsp 70)的核苷酸序列设计4条RT-LAMP特异性引物,采取单因素优化试验,对RT-LAMP反应体系中的多个因素包括时间、温度、BST聚合酶、Mg2+、RNase抑制剂、dNTPs和Betaine浓度优化,恒温扩增60 min。经琼脂糖凝胶电泳分析,SYBR Green I可视化显色,结果表明:SPFMV的优化反应体系为:FIP/BIP
2 μL、F3/B3 0.5 μL、BST聚合酶1.0 μL、dNTPs 0.6 μL、MgSO4 1.5 μL、RNase抑制剂1.0 μL、Betaine 7 μL,62℃ 60 min。SPCSV的优化反应体系为:FIP/BIP 2 μL、F3/B3 0.5 μL、BST聚合酶 1.0 μL、dNTPs 0.6 μL、MgSO4 1.5 μL、RNase抑制剂1.2 μL、Betaine 7 μL,64℃ 60 min。进一步利用SPFMV全基因组的4个片段(SPFMV-1、SPFMV-2、SPFMV-3、SPFMV-4)、SPCSV-Hsp 70和RGNNV进行特异性检验,分别建立了SPFMV和SPCSV的特异性RT-LAMP检测方法,扩增出了具有RT-LAMP的典型瀑布状条带,与凝胶电泳和SYBR Green I显色结果一致,SPFMV和SPCSV的灵敏度检测下限分别为:1×10-6、1×10-3 ng·μL-1,该方法检测灵敏度高,实现了结果的可视化。对田间甘薯苗和离体组织培养甘薯苗进行检测验证,SPFMV-RT-LAMP检测方法成功率为100%,SPCSV-RT-LAMP检测方法的成功率为95%,表明研发的SPFMV和SPCSV的RT-LAMP检测方法适用于SPFMV和SPCSV的快速检测。
关键词:甘薯;甘薯羽状斑驳病毒(SPFMV);甘薯矮化褪绿病毒(SPCSV);环介导等温扩增技术(RT-LAMP);建立
中图分类号:S 435.31 文献标志码:A 文章编号:0253-2301(2023)06-0011-11
DOI: 10.13651/j.cnki.fjnykj.2023.06.002
Establishment of the Detection Methods for Sweet Potato Feathery Mottle Virusand Sweet Potato Chlorotic Stunt Virus
CHEN Tao1,2,3, XUE Ting1,2,3*, YANG Zhi-jian4, CHEN Xuan-yang4, CHEN You-qiang1,2,3, CHEN Jian-nan1,2,3*
(1. College of Life Science, Fujian Normal University, Fuzhou, Fujian 350117, China; 2. Public Service
Platform for Industrialization Development Technology of Marine Biological Medicine and Products of the
State Oceanic Administration Fuzhou, Fujian 350117, China; 3. Fujian Key Laboratory of Special Marine
Bioresource Sustainable Utilization, Fuzhou, Fujian 350117, China; 4. Fujian Key Laboratory of Crop
Biotechnology, Fujian Agriculture and Forestry University, Fuzhou, Fujian 350002, China)
Abstract: In order to establish a reverse transcription loop-mediated isothermal amplification (RT-LAMP) method to detect the sweet potato feathery mottle virus (SPFMV)and sweet potato chlorotic stunt virus (SPCSV), improve the detection sensitivity and realize the visualization of the results, four RT-LAMP specific primers were designed according to the nucleotide sequences of SPFMV coat protein gene (CP) and SPCSV heat shock protein gene (Hsp 70) in this study, and then the single factor optimization experiment was used to optimize the multiple factors in the RT-LAMP reaction system including time, temperature, BST polymerase, Mg2+, RNase inhibitor, dNTPs and Betaine concentration, with the constant temperature amplification for 60 min. Through the agarose gel electrophoresis analysis, and the SYBR Green I visual color development, the results showed that: the optimal reaction system of SPFMV was as follows: FIP/BIP 2 μL, F3/B3 0.5 μL, BST polymerase 1.0 μL, dNTPs 0.6 μL, MgSO4 1.5 μL, RNase inhibitor 1.0 μL, Betaine 7 μL, at 62℃ for 60 min. The optimal reaction system of SPCSV was as follows: FIP/BIP 2 μL, F3/B3 0.5 μL, BST polymerase 1.0 μL, dNTPs 0.6 μL, MgSO4 1.5 μL, RNase inhibitor
1.2 μL, Betaine 7 μL, at 64℃ for 60 min. The four fragments of the whole genome of SPFMV (SPFMV-1, SPFMV-2, SPFMV-3, and SPFMV-4), SPCSV-Hsp 70 and RGNNV were used to test the specificity. Then ,the specific RT-LAMP detection methods of SPFMV and SPCSV were established respectively, and the typical waterfall-like bands with RT-LAMP were amplified, which were consistent with the results of gel electrophoresis and SYBR Green I coloration. The lower limits of sensitivity detection of SPFMV and SPCSV were as follows: 1×10-6 and 1×10-3 ng·μL-1. The detection sensitivity of this method was high, and the results could be visualized. Field sweet potato seedlings and in vitro tissue culture sweet potato seedlings were tested, and the success rate of SPFMV-RT-LAMP detection method was 100%. The success rate of SPCSV-RT-LAMP detection method was 95%, indicating that the developed RT-LAMP detection method of SPFMV and SPCSV was suitable for the rapid detection of SPFMV and SPCSV.
Key words: Sweet potato; Sweet potato feathery mottle virus (SPFMV); Sweet potato chlorotic stunt virus (SPCSV); Reverse transcription loop-mediated isothermal amplification (RT-LAMP); Establishment
甘薯Ipomoea batatas (Linnaeus) Lamarc隸属于旋花科Convolvulaceae是世界上仅次于马铃薯Solanum tuberosum L和木薯Manihot esculenta Crantz的第三大根系作物,对减缓世界饥饿有巨大作用[1]。我国甘薯种植面积达670万hm2,产量稳居世界第1,是主要的经济和粮食作物之一[2]。甘薯为营养繁殖,容易感染和积累病毒,据报道世界各地有15种病毒影响甘薯产量和品质。甘薯病毒病(SPVD)是甘薯中最常见、造成经济损失最严重的病毒病,由甘薯羽状斑驳病毒(SPFMV)和甘薯褪绿矮化病毒(SPCSV)共同侵染形成[3-5]。白粉虱传播的SPCSV和蚜虫传播的SPFMV共同侵染甘薯,将给甘薯产量带来50%的损失,甚至是绝收[6-7]。甘薯种植区一旦爆发甘薯病毒病,将对甘薯产业带来毁灭性的打击,因此急需建立一种快速、便捷、灵敏的甘薯病毒检测方法,以防治甘薯病毒的危害,减少甘薯产量损失。
SPFMV属于马铃薯Y病毒科(Potyviridae)马铃薯Y病毒属(Potyvirus)病毒,是侵染甘薯最常见的病毒之一,可能发生在种植甘薯的任何地方[2]。SPFMV病毒RNA基因组全长为10 820个核苷酸,含有1个开放阅读框(ORF),起始于核苷酸118 bp,终止于10 599 bp,可能编码由3 493个氨基酸组成的多蛋白(Mr 393 800)[8]。SPCSV属于长线形病毒科(Closteroviridae)毛形状病毒属(Crinivirus),世界各地都有该病毒的出现,如:卢旺达、乌干达、坦桑尼亚、美国、巴西等地[9]。SPCSV病毒粒子呈弯曲线状,其长度为850~950 nm,主要依靠半持久方式传播,SPCSV主要存在于寄主韧皮部细胞内,并在维管束内堆积[6]。目前,部分学者开展了甘薯病毒检测研究,许永清[10]等利用RT-PCR和ELISA方法相结合的方式检测福建地区的甘薯病毒;卢会翔等[11]利用血清检测法和qPCR相结合的方法实现了对甘薯病毒病的检测;张春雨等[12]利用RNA沉默(RNAi)病毒防御机制,通过高通量测序,利用病毒来源的小RNA鉴定植物病毒,但都存在一定的缺点。逆转录环介导等温技术(RT-LAMP)通过设计四条特异性引物(两条内引物、两条外引物),识别模板基因的不同区域,实现对少量RNA的快速扩增,且RT-LAMP可在水浴锅中进行,结果可通过琼脂糖凝胶电泳分析,而加入SYBR Green I后可在试管中通过颜色变化进行肉眼简单的观察,逆转录环介导等温扩增(RT-LAMP)是RT-PCR技术的一种高效、稳定、便捷的替代方法,其具有灵敏度高、对实验环境要求简单和检测时间短等优点[13-14]。RT-LAMP技术被广泛运用于各种病毒的检测,其检测下限低,灵敏度高,是RT-PCR的100倍。如Veronica等[15]利用RT-LAMP技术检测新冠病毒,其最低检测下限为1×10-3 ng·μL-1,王莹等[16]在马铃薯中检测出马铃薯Y病毒,其最低检测下限为2×10-3 ng·μL-1、Jantana Kampeera等[17]在罗非鱼中检测出TiLV病毒、高彦萍等[18]在马铃薯中检测出马铃薯卷叶病毒,其最低检测下限为5×10-3 ng·μL-1、李晋玉[19]利用RT-LAMP检测黄瓜绿斑驳花叶病毒其检测下限为7.2×10-3 ng·μL-1。本研究根据SPFMV外壳蛋白基因(CP)的核苷酸序列和SPCSV的热休克蛋白基因(Hsp 70)的核苷酸序列分别设计4条引物,建立和优化SPFMV、SPCSV的RT-LAMP检测方法,提高检测灵敏度,实现结果的可视化,为甘薯病毒病检测和防治提供了有效的检测技术和手段。
1 材料与方法
1.1 生物材料
感染甘薯病毒病的甘薯苗、无毒甘薯苗(经离体组织培养)均由福建农林大学作物生物技术福建省高校重点实验室陈选阳老师提供。
1.2 主要试剂
TransZol Up Plus RNA Kit(ER501)、EasyScript One-Step gDNA Removal and cDNA Synthesis Super Mix(AT311)、Super Mix、TransScript Uni Reverse Transcriptase(AU101)和RNase抑制剂(Ribonuclease inhibitor)均购自北京全式金生物公司,BstDNA Polymerase3.0(M0374S)、High Pure dNTPs、10×Buffer、Betaine、MgSO4和SYBR Green I(SR4110)均购自北京索莱宝科技有限公司,TAE电泳缓冲液和琼脂糖等其他生化试剂及普通化学试剂均为进口或国产分析纯。
1.3 试验方法
1.3.1 引物设计和合成 根据NCBI数据库中SPFMV外壳蛋白基因(CP)的核苷酸序列和SPCSV的热休克蛋白基因(Hsp 70)的核苷酸序列,使用LAMP引物在线设计网站(http://primerexplorer.jp/lampv5e/index.html)分别设计4条特异性引物(内引物:F3、B3外引物:FIP、BIP)以此来识别病毒的特定区域。引物均由福州尚亚公司合成。
1.3.2 总RNA的提取与检测 利用高纯度RNA提取试剂盒(TransZol Up Plus RNA Kit)提取感染SPVD的甘薯叶片总RNA和脱毒甘薯叶片总RNA。提取步骤严格按照试剂盒提取说明书操作。提取完成后用超微量紫外分光光度计检测RNA浓度和完整性。
1.3.3 基本反应体系 根据相关文献初步设定RT-LAMP基本反应体系[20-27]:Bst DNA Polymerase3.0 1 μL(8 000 U·mL-1)、dNTPs 0.3 μL(10 mmol·L-1)、M-MLV 0.2 μL(200 U·μL-1)、10×Buffer 2.5 μL、Betaine 5 μL(5 mol·L-1)、RNase抑制剂1 μL(50 U·μL-1)、MgSO4 2 μL(8
mmol·L-1)、FIP/BIP 2μL(10 mmol·L-1)、F3/B3 0.5 μL(10 mmol·L-1)、RNA模板1 μL(100 ng·μL-1)、ddH2O 7 μL。62℃水浴加热60 min,80℃ 10 min。
1.3.4 反应体系的优化 通过单一变量法,对RT-LAMP反应体系设置不同的反应条件,进行单因素优化试验。设置不同的反应时间(80、70、60、50、40、30 min)、反应温度(65、64、63、62、61、60℃)、BST聚合酶加入量(1.0、0.8、0.6、0.4、0.2 μL)、MgSO4加入量(3.5、3.0、2.5、2.0、1.5 μL)、RNase抑制剂加入量(1.4、1.2、1.0、0.8、0.6 μL)、dNTPs加入量(1.5、1.2、0.9、0.6、0.3 μL)和Betaine加入量(7.0、6.0、5.0、4.0、3.0 μL)进行优化。反应结束后,经琼脂糖凝胶電泳分析和SYBR Green I观察结果。RT-LAMP扩增产物加入SYBR Green I后,阳性样品呈绿色,阴性对照颜色不发生变化呈黄色。
1.3.5 灵敏度检测 RNA浓度的起始浓度为100 ng·μL-1,按照10倍稀释梯度进行稀释,一共稀释11个梯度。RNA加入量为1 μL,根据优化后的反应体系为基础。反应结束后,取2 μL产物经琼脂糖凝胶电泳分析和取适量产物进行SYBR Green I结果判定,为防止试验偶然性,进行3次重复性试验。
1.3.6 RT-LAMP特异性验证 SPFMV-CP、SPCSV-Hsp具有高度保守性的特点,以SPFMV全基因组4个片段(SPFMV-1、SPFMV-2、SPFMV-3、SPFMV-4、其中SPFMV-4包含SPFMV-CP完整序列)、SPCSV-Hsp70的cNDA以及Red-spotted Grouper Nervous Necrosis Virus(RGNNV)赤点石斑神经坏死病毒RNA为模板,利用优化好的RT-LAMP反应体系进行特异性验证,扩增产物经琼脂糖凝胶电泳检测。
2 结果与分析
2.1 RNA完整度的检测
本试验最终测得RNA浓度为:807.55 ng·μL-1,OD260/280值:1.937,并利用2%的琼脂糖凝胶电泳检测其完整度,结果表明提取的RNA浓度和完整性都满足试验的要求。
2.2 甘薯苗携带病毒检测结果
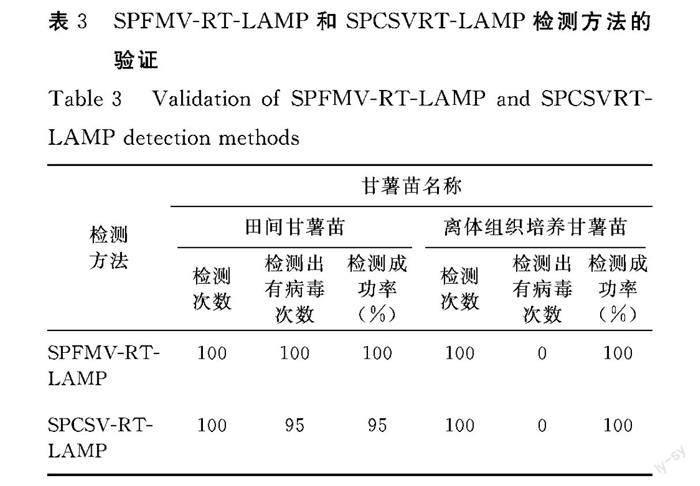
利用RT-PCR技术验证田间甘薯苗和离体组织培养甘薯苗是否携带SPFMV和SPCSV两种病毒。田间甘薯苗和离体组织培养甘薯苗检测100次,田间甘薯苗共检测100次,检测出有病毒次数100次,离体组织培养甘薯苗共检测100次,检测出有病毒次数0次,表明田间甘薯苗携带SPFMV和SPCSV两种病毒,离体组织培养甘薯苗不携带SPFMV和SPCSV两种病毒,即离体组织培养甘薯苗为无毒苗(表2)。
2.3 RT-LAMP检测方法的优化
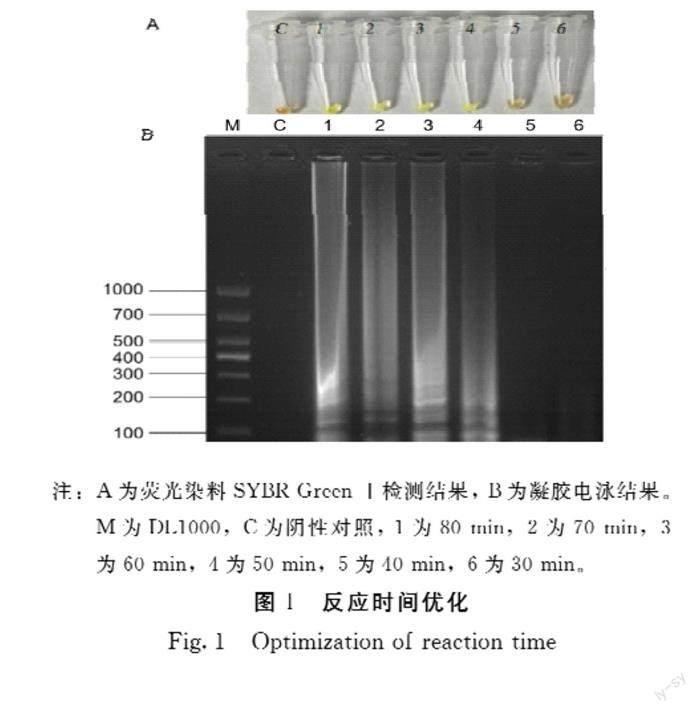
2.2.1 SPFMV RT-LAMP检测方法的优化 为建立SPFMV RT-LAMP的最优检测方法,对反应时间、温度、BST聚合酶、MgSO4、RNase抑制剂、dNTPs和Betaine浓度进行优化。(1)对反应时间进行优化:反应时间为30、40 min时无条带产生,反应时间为50 min,可看到明亮的条带,60 min扩增条带最为清晰明亮(图1-B),加入SYBR Green I后,1~4号管为绿色,5~6号管为黄色(图1-A),与凝胶电泳结果一致。(2)对反应温度进行优化:60℃~65℃时,均有瀑布状条带产生,在62℃时最为清晰明亮,对照组无明显条带(图2-B),加入SYBR Green I后,1~6号管为绿色,对照组(c)为黄色与凝胶电泳分析一致(图2-A)。(3)对BST聚合酶加入量进行优化:1~4号泳道均有瀑布状条带产生,1.0 μL时条带最为清晰,对照组无明显条带(图3-B),加入SYBR Green I后,1~4号管均为绿色,5号管为黄色,表明在加入量为0.3 μL时无法检测到甘薯病毒(图3-A),与凝胶电泳分析一致。(4)对MgSO4加入量进行优化:加入量为1.5~3.5 μL时,均有条带产生(图4-B),加入SYBR Green I后1~5号管为绿色与凝胶电泳结果一致(图4-A),从经济的角度出发,其加入量应为1.5 μL。(5)对RNase抑制剂加入量进行优化:加入量为0.8~1.2 μL时有条带产生,加入量为1.0 μL时有最为明亮的瀑布状条带(图5-B),加入SYBR Green I后,1~3号管为绿色,4~5号管为黄色(图5-A)与凝胶电泳结果一致。(6)对dNTPs加入量进行优化:加入量为0.6~1.5 μL时,有典型的瀑布状条带(图6-B),加入SYBR Green I后,1~4号管为绿色,5号管为黄色(图6-A)与凝胶电泳分析一致,且从节约成本的角度出发其加入量应为0.6 μL。(7)对Betaine加入量进行优化:加入量为7 μL时,条带最为清晰明亮(图7-B),加入SYBR Green I后,1~5号管均为绿色(图7-A),与凝胶电泳结果一致。综上所述,SPFMV的RT-LAMP反应体系为:FIP/BIP 2 μL、F3/B3 0.5 μL、BST聚合酶1.0 μL、dNTPs 0.6 μL、MgSO4 1.5 μL、RNase抑制剂1.0 μL、Betaine 7 μL,62℃60 min,80℃10 min使酶失活,结束反应。
2.3.2 SPCSV RT-LAMP检测方法的优化 为建立最优检测方法,对反应温度、BST聚合酶、MgSO4、RNase抑制剂、dNTPs和Betaine浓度进行优化,经琼脂糖凝胶电泳分析和SYBR Green I进行验证。(1)对反应温度进行优化:4~6号泳道无明显无典型的条带产生,1~3号泳道有条带产生,即63℃~65℃时,可扩增出明亮的条带,在64℃时有最为清晰明亮(图8-B),加入SYBR Green I后,1~3号管为绿色,3~6号管为黄色(图8-A)与凝胶电泳结果一致。(2)对BST聚合酶加入量优化,1~5号泳道有条带,加入量为1.0 μL时条带最为清晰明亮(图9-B),加入SYBR Green I后,1~5号管均为绿色(图9-A)与凝胶电泳结果一致。(3)对MgSO4加入量进行优化:1~5号泳道均有条带,即加入量为1.5~3.5 μL时,均能扩增出产物(图10-B),加入SYBR Green I后,1~5号管均为绿色(图10-A),与凝胶电泳结果一致,从经济的角度出发,其加入量应为1.5 μL。(4)对RNase抑制剂加入量进行优化:1~5号泳道均有条带,即其加入量为0.4~1.2 μL时有条带产生,当加入量为1.2 μL时条带最为明亮(图11-B),加入SYBR Green I后,1~5号管均为绿色(图11-A),与凝胶电泳结果一致。(5)对dNTPs加入量优化:2~5号泳道有明亮条带,加入量为0.6~1.5 μL时,可扩增出典型的瀑布状条带(图12-B),加入SYBR Green I后,1~5号管均为绿色(图12-A)与凝胶电泳结果一致,从节约成本的角度出发,dNTPs加入量应为0.6 μL。(6)对Betaine加入量进行优化:1、3号泳道有瀑布状条带,2、4、5号泳道无条带,即加入量为5或7 μL时能扩增出典型的瀑布状条带,且7 μL时条带最为清晰明亮(图13-B),加入SYBR Green I后,1、3号管为绿色,2、4、5号管为黄色(图13-A),与凝胶电泳结果一致。综上所述,SPCSV的RT-LAMP反应体系为:FIP/BIP 2 μL、F3/B3 0.5 μL、BST聚合酶1.0 μL、dNTPs 0.6 μL、MgSO4 1.5 μL、RNase抑制剂1.2 μL、Betaine 7 μL,64℃ 60 min,80℃ 10 min使酶失活,结束反应。
2.4 RT-LAMP灵敏度检测
2.4.1 SPFMV RT-LAMP灵敏度检测 提取感染SPFMV的甘薯叶片总RNA为模板,按照10倍稀释梯度进行稀释,一共稀释11个梯度,分别进行RT-LAMP扩增。结果显示:1~9号泳道有清晰明亮的瀑布状条带产生,10~11号泳道无清晰明亮的瀑布状条带产生(图14-B),即10-6~102稀释液为模板的情况下可扩增出典型的瀑布状条带,取适量的扩增产物加入核酸染料SYBR Green Ⅰ,1~9号管呈绿色、10~11管呈黄色且阴性对照(C)和空白对照(O)管均为黄色(图14-A),与琼脂糖凝胶结果一致,表明SPFMV的检测下限为1.0×10-6 ng·μL-1。按照最优体系进行3次重复性实验,结果均一致。
2.4.2 SPCSV RT-LAMP灵敏度的检测 提取感染SPCSV的甘薯叶片总RNA为模板,按照10倍稀释梯度进行稀释,一共稀释11个梯度。分别进行RT-LAMP扩增。结果显示:1~6号泳道有清晰明亮的瀑布状条带产生,7~11号泳道无条带产生,即10-3~102稀释液为模板的情况下可扩增出典型的瀑布状条带(图15-B),取适量的扩增产物加入核酸染料SYBR Green Ⅰ,1~6号管呈绿色、7~11管呈淡黄色且阴性对照(C)和空白对照(O)管都呈黄色(图15-A),与琼脂糖凝胶电泳结果一致,表明SPCSV的检测下限为1.0×10-3 ng ·μL-1。按照最优体系进行3次重复性试验,结果均一致。
2.5 RT-LAMP特异性检测
2.5.1 SPFMV 特异性检测 SPFMV侵染的甘薯总RNA、RGNNV总RNA、SPFMV全基因组的4个片段SPFMV-4(SPFMV的CP蛋白保守序列在SPFMV-4中)、
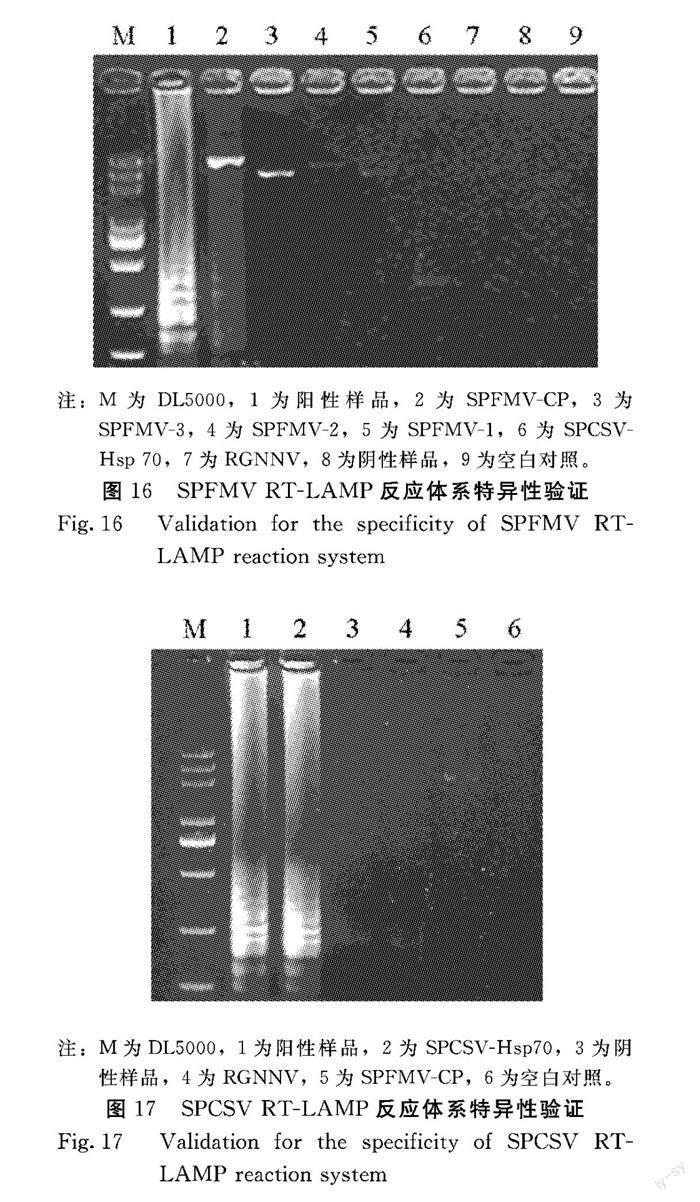
SPFMV-3、SPFMV-2、SPFMV-1、SPCSV-Hsp 70为模板,进行特异性验证。产物经琼脂糖凝胶电泳分析,结果可以看出:1、2泳道有明显的瀑布状条带,2号泳道最亮的一条带为SPFMV-4、3~5泳道无LAMP产物的明显特征,都有略微明亮的条带,为SPFMV全基因组的其他3个片段,分别为SPFMV-3、SPFMV-2、SPFMV-1、6号泳道为SPCVS-Hsp 70,7~9泳道无典型瀑布状条带的产生(图16),表明建立的SPFMV RT-LAMP檢测方法只能特异性扩增出SPFMV病毒,不能扩增出其他病毒,具有良好的特异性,可利用该检测方法实现对SPFMV的快速检测。
2.5.2 SPCSV RT-LAMP特异性验证 SPCSV侵染的甘薯总RNA、RGNNV总RNA、SPFMV-4、SPCSV-Hsp 70为模板,进行特异性验证。产物经琼脂糖凝胶电泳分析,结果可以看出:1、2泳道有明显的瀑布状条带产生,而阴性对照3号泳道未扩增出条带,4~6泳道无RT-LAMP产物的明显特征,其中5号泳道有略微明亮的条带,为SPFMV-4(图17),表明建立的SPCSV RT-LAMP检测方法只能检测出SPCSV病毒,不能检测出其他病毒,具有良好的特异性,可利用该检测方法实现对SPCSV的快速检测。
2.6 SPFMV-RT-LAMP和SPCSVRT-LAMP检测方法的验证
利用SPFMV-RT-LAMP检测方法,分别对田间甘薯苗和离体组织培养甘薯苗进行验证,各检测100次,其中100次检测出田间甘薯苗携带甘薯病毒,成功率为100 %,与RT-PCR检测结果一致,表明本试验设计的SPFMV的RT-LAMP检测方法适用于SPFMV的快速检测(表3)。
利用SPCSV-RT-LAMP檢测方法,分别对田间甘薯苗和离体组织培养甘薯苗进行验证,各检测100次,其中95次检测出田间甘薯苗携带甘薯病毒,成功率为95%,与RT-PCR检测结果一致,表明本试验设计的SPCSV的RT-LAMP检测方法适用于SPCSV的快速检测(表3)。
3 结论与讨论
本研究针对SPFMV的外壳蛋白(CP)和SPCSV的热激蛋白(Hsp 70)分别设计引物,和单一变量法进行反应体系的优化,在64℃、62℃的恒温条件下扩增60 min,琼脂糖凝胶电泳分析和SYBR Green I可视化检验,结果显示被病毒侵染的甘薯样品琼脂糖凝胶电泳具有典型的瀑布状条带,加入SYBR Green I后呈现绿色,对照呈黄色,与琼脂糖凝胶电泳结果一致,实现了结果的可视化;通过SPFMV和SPCSV的RT-LAMP灵敏度检测,3次重复性试验,反应体系的特异性验证,结果显示SPFMV的最低检测RNA浓度为1.0×10-6 ng·μL-1,SPCSV的最低检测RNA浓度为1.0×10-3 ng·μL-1,说明该方法具有检测灵敏度高,重复性好和高特异性好等优点,适用于SPFMV和SPCSV的快速检测。对田间甘薯苗和离体组织培养甘薯苗进行检测验证,SPFMV-RT-LAMP检测方法成功率为100%;SPCSV-RT-LAMP检测方法的成功率为95%,表明本试验研发的SPFMV和SPCSV的RT-LAMP检测方法适用于SPFMV和SPCSV的快速检测。
LAMP呈典型的瀑布状条带,为具有不同茎长的茎-环DNA和具有多个环的花椰菜状结构的混合物,这些茎环通过在同一链中目标序列的交替反向重复之间退火形成[24],加入SYBR Green I可直接用肉眼观察,即阳性样品呈绿色,阴性对照颜色无变化为黄色。在同一地方长时间试验,容易导致气溶胶的出现[22]。为防止试验结果的假阳性,应提前将SYBR Green I加入到干净的PCR试管顶部,盖住保持分离状态直至测试结果的完成。
基于RT-LAMP的简单性、检测灵敏度高和结果的可视化的优点,乔奇等[28]利用RT-LAMP检测技术实现对SPCSV-WA株系的检测,其方法可特异对SPCSV-WA 进行检测其最低检测下限为:1.0×10-1 ng·μL-1,姜珊珊等[29]在甘薯中检测SPFMV的最低检测下限为1.26×10-4 ng·μL-1。本试验建立的检测方法相对于乔奇等[28]、姜珊珊等[29]的研究具有更高的灵敏度,可为SPFMV和SPCSV的发生进行早期预警,可有效减少甘薯病毒病害造成的产量损失,同时也为甘薯病毒田间检测提供了一种简便可行的方案。
参考文献:
[1]ROBERT O M M, SARAH M, JOLIEN S,et al.Development of a food product profile for boiled and steamed etpotato in Uganda for effective breeding[J].International Journal of Food Science
& Technology,2021,56(3): 1385-1398.
[2]孙钟毓, 龚莺, 赵琳,等.甘薯病毒病害(SPVD)的分子生物学研究进展[J].核农学报,2020,34(1): 71-77.
[3] R F KARYEIJA, J F KREUZE, R W GIBSON, et al.Synergistic interactions of a Potyvirus and a em-limited Crinivirus in sweet potato plants[J].Virology,2000,269(1): 26-36.
[4]NEGEVE J M, BOUWKAMP J C.Effects of Sweet Potato Virus Disease (SPVD) on the Yield of Sweet Potato otypes in Cameroon[J].Experimental Agriculture,1991,27(2): 221-225.
[5]JONES P.Viruses of Plants:Descriptions and Lists from the VIDE Database (Book)[J].Plant Pathology,1997,46(4): 612-613.
[6]MWANGA R O.M, YENCHO G C,MOYER J W.Diallel analysis of sweetpotatoes forresistance to sweetpotato virus disease[J].hytica,2002,128(2): 237-248.
[7]KARYEIJIA R F, GUBSON R W, VALKONEN J P T.The signifi-cance of sweet potato feathery mottle virus in istence sweet potato production in Africa[J].Plant Disease,1998,82(1): 4-15.
[8]SAKAI J, MORI M, MORISHITA T, et al.Complete nucleotide sequence and genome organization of sweet potato hery mottle virus (S strain) genomic RNA:the large coding region of the P1 gene[J].Archives of virology,1997,142(8): 1553-1562.
[9]JOSEPH N, REGINA K, PETER S, et al.Assessing the sweetpotato virus disease and its associated vectors in hwestern Tanzania and central Uganda[J].Advances in Agriculture and Agricultural Sciences,2018,4(8): 1-10.
[10]许泳清, 李华伟, 刘中华, 等.甘薯羽状斑驳病毒(SPFMV)ELISA鉴定及RT-PCR检测方法的建立[J].福建农业学报,2013,28(12): 1267-1272.
[11]卢会翔, 吕长文, 吴正丹, 等.甘薯羽状斑驳病毒(SPFMV)和甘薯褪绿矮化病毒(SPCSV)荧光定量RT-PCR检测方建立[J].中国农业科学,2016,49(1): 90-102.
[12]张春雨, 李小宇, 王晨,等.侵染大豆的花生斑驳病毒公主岭分离物基因组测序及分析[J].植物保护,2022,48(1): 61-65.
[13]PEDRO F-S, JAVIER G A, ALICIA S H, et al.A Loop-ediated Isothermal Amplification (LAMP) Assay for Early ction of Schistosoma mansoni in Stool Samples: A Diagnostic Approach in a Murine Model[J].PLOS Neglected Tropical ases,2014,8(9): 3126.
[14]BUDZISZEWSKA M, WIECZOREK P, OBRRPALSKA-STEPLOWSKA A.One-step reverse transcription loop-mediated isothermal amplification (RT-LAMP) for detection of tomato torrado virus[J].Archives ofVirology,2016,161(5): 1359-1364.
[15]VERONICA L F,BRYONY A,JOSE L G, et al.A highly effective reverse-transcription loop-mediated isothermal lification (RT-LAMP) assay for the rapid detection of SARS-CoV-2 infection[J].The Journal of infection,2021,82(1): 125.
[16]WANGY, CHENR, NIE X, et al.Rapid and sensitive detection of potato virus Y by isothermal reverse scription-recombinase polymerase amplification assay in potato(Article)[J].Molecular and Cellular Probes,2020,50: 101505.
[17]KAMPEERA J, DANGTIP S, SUVANNAKAD R, et al.Reverse transcription loop-mediated isothermal amplification-LAMP) combined with colorimetric gold nanoparticle (AuNP) probe assay for visual detection of tilapia lake virus V) in Nile and red hybrid tilapia[J].Journal of Fish Diseases,2021,44(10): 1595-1607.
[18]高彥萍,吕和平,张武,等.马铃薯卷叶病毒RT-LAMP检测方法的建立[J].核农学报,2020,34(9): 1943-1950.
[19]李晋玉.黄瓜绿斑驳花叶病毒的RT-LAMP检测和番茄斑萎病毒的胶体金免疫层析试纸条检测[D].南京:南京农业大学,2014.
[20]ELIK A, ERTUNC F.Reverse transcription loop-mediated isothermal amplification (RT-LAMP) of plum pox virus Turkey (PPV-T) strain[J].Journal of Plant Diseases and Protection,2021,128: 663-671.
[21]LI X, HU W, LI Y, et al.Development of an RT-LAMP assay for the detection of maize yellow mosaic virus in ze[J].Journal of virological methods,2022,300: 114384.
[22]KEIZERWEERD A T, CHANDRA A, GRISHAM M P.Development of a reverse transcription loop-mediated isothermal lification (RT-LAMP) assay for the detection of Sugarcane mosaic virus and Sorghum mosaic virus in rcane(Article)[J].Journal of Virological Methods,2015,212: 23-29.
[23]TSUGUNORI N, HIROTO O, HARUMI M, et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Research,2000, 28(12): 63.
[24]BUDZISZEWSKA M, WIECZOREK P, OBREPALSKA-STEPLOWSKA A.One-step reverse transcription-mediated isothermal amplification (RT-LAMP) for detection of tomato torrado virus[J].Archives of Virology,2016,(5):1359-1364.
[25]KREUZE JF,ANA P, MILTON U,et al.Complete viral genome sequence and discovery of novel viruses by deep sequencing of small RNAs:A generic method for diagnosis, discovery and sequencing of viruses[J].Virology,2009, 388(1): 1-7.
[26]SHAILESH P G, RAGHAVENDRA K P, DILIP M, et al.Rapid detection of Tobacco streak virus (TSV) in cotton (Gossypium hirsutum) d on Reverse Transcription Loop Mediated Isothermal Amplification (RT-LAMP)
[J].Journal Of Virological hods,2019,270: 21-25.
[27]MILTON U, SEGUNDO F, LUIS F S.Synergistic Interaction of Sweet potato chlorotic stunt virus (Crinivirus) with a-, Cucumo-, Ipomo-, and Potyviruses Infecting Sweet Potato[J].Plant disease,2007,91(6): 669-676.
[28]乔奇,张振臣,秦艳红,等.甘薯褪绿矮化病毒西非株系RT-LAMP检测方法的建立[J].中国农业科学,2013,(18): 3939-3945.
[29]姜珊珊,冯佳,张眉,等.甘薯羽状斑驳病毒RT-LAMP快速检测方法的建立[J].中国农业科学,2018,51(7): 1294-1302.
(责任编辑:柯文辉)
收稿日期:2023-05-16
作者简介:陈涛,男,1998年生,硕士,主要从事甘薯病毒的检测。
*通信作者:陈建楠,男,1991年生,硕士,实验师,主要从事甘薯种植与甘薯病毒检测(E-mail:381220681@qq.com);
薛婷,女,1989年生,博士,正高级实验师,主要从事甘薯种植与甘薯病毒检测(E-mail:xueting7872126@163.com)。
基金项目:福建省科技计划项目(2020N5013);福建省科技計划项目(2020N0003)。

