基于非靶向代谢组学的冠突散囊菌发酵代谢产物分析
林俊涵 林红梅 潘志斌 程伟青 吴伟斌 陈秉梅
優秀学者论坛
林俊涵,1981年生,博士,副教授,主要从事功能微生物选育及药食同源中药发酵等研究工作。主持福建省自然科学基金项目“冠突散囊菌发酵对黄精化学特性和降血糖作用的研究”、福建省中青年教师教育科研项目“新型桑椹复合酵素制备工艺的建立”等5项,获授权实用新型专利1项,获福建省教学成果奖二等奖1项(排名第1),指导学生获第七届福建省“互联网+”大学生创新创业大赛银奖(排名第4)。作为执笔人,修订国家高等职业院校生物制药技术专业教学标准(排名第2),主持完成福建省职业教育在线精品课程《微生物发酵技术》,以第一作者或通讯作者在《Developmental and Comparative Immunology》《Gene》《Molecules》等期刊发表学术论文11篇。现任福建生物工程职业技术学院药学系副主任。
摘 要:冠突散囊菌在降糖降脂功能性食品和天然药物的开发中具有重要的应用价值。分析冠突散囊菌整体代谢产物信息和产生的降糖降脂活性成分,可以为菌株的开发和应用提供理论基础和数据支持。以冠突散囊菌菌株Ys-Ec-01为试验材料,采用基于超高效液相色谱-四级杆静电场轨道阱质谱(UHPLC-QE-MS)技术的非靶向代谢组学,结合主成分分析(PCA)和正交偏最小二乘法-判别分析(OPLS-DA)方法,分析Ys-Ec-01发酵代谢产物谱,寻找降糖降脂活性产物。结果表明:Ys-Ec-01发酵后代谢产物谱发生显著变化。从代谢产物谱中,鉴定出365种发酵产物,进而筛选出205种差异发酵产物和151种主要发酵产物,鉴定到13种降糖降脂活性成分,分别是金圣草黄素、山奈酚、异鼠李素、表儿茶素、辣椒素酯、烟酸、葫芦巴碱、1-脱氧野尻霉素、尿囊素、原儿茶酸、亚油酸、胆碱和L肉碱。这些活性成分为Ys-Ec-01的降糖降脂功能研究和开发应用提供更多靶点和基本信息。
关键词:冠突散囊菌;超高效液相色谱-四级杆静电场轨道阱质谱;非靶向代谢组学:降糖:降脂
中图分类号:Q 939.9 文献标志码:A 文章编号:0253-2301(2023)06-0001-10
DOI: 10.13651/j.cnki.fjnykj.2023.06.001
Analysis of the Fermentation Metabolites from Eurotium cristatum Basedon the Non-targeted Metabolomics
LIN Jun-han1*, LIN Hong-mei2, PAN Zhi-bin1, CHENG Wei-qing1, WU Wei-bin1, CHEN Bing-mei1
(1. Department of Pharmacy, Fujian Vocational College of Bioengineering, Fuzhou, Fujian 350002, China;
2. College of Geography and Oceanography, Minjiang University, Fuzhou, Fujian 350002, China)
Abstract: Eurotium cristatum had important application value in the development of hypoglycemic and lipid-lowering functional foods and natural medicines. The analysis of the overall metabolite information and the hypoglycemic and lipid-lowering active ingredients produced by Eurotium cristatum could provide theoretical basis and data support for the development and application of the bacterial strain. By taking the strain Ys-Ec-01 of Eurotium cristatum as the experimental material, the non-targeted metabolomics based on the ultra performance liquid chromatography-quadrupole electrostatic field orbitrap mass spectrometry (UHPLC-QE-MS) technology was used to analyze the fermentation metabolic profile Ys-Ec-01 by combining with the principal component analysis (PCA) and the orthogonal partial least squares-discriminant analysis (OPLS-DA), in order to find the hypoglycemic and lipid-lowering active products. The results showed that the metabolite profile of Ys-Ec-01 changed significantly after the fermentation. From the metabolite profile, a total of 365 fermentation products were identified, and then 205 differential fermentation products and 151 main fermentation products were screened, thus to identify 13 hypoglycemic and lipid-lowering active ingredients, which were chrysoeriol, kaempferol, isorhamnetin, epicatechin, capsaicin, nicotinic acid, trigonelline, 1-deoxynojirimycin, allantoin, protocatechuic acid, linoleic acid, choline and L-carnitine. These active ingredients provided more targets and basic information for the research, development and application of hypoglycemic and lipid-lowering function of Ys-Ec-01.
Key words: Eurotium cristatum; UHPLC-QE-MS; Non-targeted metabolomics; Hypoglycemic;Lipid-lowering
糖尿病已成为严重影响人们健康的慢性疾病。2021年,我国糖尿病患者有1.4亿人,位居世界首位,其中90%是Ⅱ型糖尿病(Type 2 Diabetes Mellitus,T2DM)[1]。T2DM人群具有高血糖、高血脂和胰岛素抵抗的病征[2],除了采用降糖药物治疗外,健康饮食和运动是防治T2DM发生,改善T2DM人群生活质量的有效手段[3]。降糖降脂功能性食品,可以有效改善T2DM的症状[3-6]。此外,降糖天然产物的提取物,还可开发成抗糖尿病药物[3, 7]。
冠突散囊菌(Eurotiumcristatum)是茯砖茶的优势菌群,可产生多种活性成分。这些活性成分具有抗氧化[8-9]、降糖,抗糖尿病[10]、降脂[11]、调节肠道菌群[12]、调节免疫
[13]等作用。研究冠突散囊菌代谢产物的生物活性,寻找降糖降脂活性成分,将有助于分析冠突散囊菌的药理作用,在开发降糖降脂功能性食品,用于防治和改善T2DM症状,以及开发降糖降脂天然药物,拓展医药应用价值等方面,具有重要的理论研究和实践意义。当前,研究人员从冠突散囊菌中分离出黄色素[8]、生物碱[9-10,14]、洛伐他汀[11]、黄酮类[14]、伏茶素[15]、多糖
[12-13]等许多化学成分,并研究了部分成分的生物活性,其中,二酮哌嗪二聚体生物碱eurocristatine[10]有降糖作用,伏茶素A具有潜在的抗糖尿病作用[16],洛伐他汀[11]、伏茶素A和伏茶素B[17]有降脂作用。这些化学成分的研究主要是集中在特定的类别上,对于菌体复杂的整体代谢产物即代谢产物谱尚未全面了解。
研究前期,本课题组获得1株冠突散囊菌Ys-Ec-01,为了开发和应用该菌株资源,采用基于超高效液相色谱-四级杆静电场轨道阱质谱(ultra-high performance liquid chromatography q exactive mass spectrometry,UHPLC-QE-MS)的非靶向代谢组学,分析Ys-Ec-01发酵代谢产物谱,结合文献资料寻找降糖降脂活性产物,为该菌株降糖降脂功能的研究和功能性食品的开发应用提供理论基础和数据支持。
1 材料与方法
1.1 菌株
冠突散囊菌菌株Ys-Ec-01由福建师范大学生命科学学院黄钦耿博士惠赠。
1.2 主要试剂
甲醇、乙腈和氨水:CNW Technologies,LC-MS级;乙酸铵:Sigma-Aldrich,LC-MS级;超纯化水:屈臣氏;蔗糖、葡萄糖、甘油、(NH4)2HPO4、KH2PO4、K2HPO4、NaCl、MgSO4·7H2O:西陇科学股份有限公司,分析纯;酪蛋白胨:北京奥博星生物技术有限公司;琼脂粉:北京索莱宝科技有限公司。
培养基配置:(1)孢子培养基:(NH4)2HPO4 0.56%、K2HPO4 0.1%、MgSO4·7H2O 0.05%、蔗糖4%、NaCl 5%、琼脂2%,121℃高压灭菌30 min。(2)发酵培养基为改良的DG18培养基(MDG18):甘油30%、葡萄糖1.5%、酪蛋白胨0.75%、KH2PO4 0.15%、MgSO4·7H2O 0.075%,121℃高压灭菌30 min。
1.3 仪器与设备
HPX-9162MBE恒温培养箱:上海博迅实业有限公司医疗设备厂;SHK-99-II恒温摇床:北京北方同正生物技术发展有限公司;LDZX-50FBS高压蒸汽灭菌锅:上海申安医疗器械厂;Vanquish超高效液相色谱仪、Q Exactive HFX高分辨率质谱仪、Heraeus Fresco17离心机:赛默飞世尔科技公司;PS-60AL超声仪:深圳市雷德邦电子有限公司。
1.4 試验方法
1.4.1 冠突散囊菌发酵上清液的制备 将保藏的Ys-Ec-01孢子甘油菌涂布到孢子培养基平板上,28℃恒温培养箱培养5~7 d。刮取平板上孢子接种到孢子培养基茄形瓶斜面,28℃恒温培养5~7 d。刮取茄形瓶斜面孢子,重悬于20 mL含玻璃珠的无菌0.9% NaCl溶液中,28℃、200 r·min-1振荡4 h打散孢子,血球计数板计数,制成孢子悬浮液。
在MDG18培养基中接入含有4×107个孢子的悬浮液发酵,以接入同体积的无菌水作为对照,发酵液和对照各6瓶,28℃、200 r·min-1,培养12 d。发酵液呈褐色,菌丝形成颗粒状即菌丝球,对照保持原淡黄色,清澈透明,未染菌。然后,发酵液和对照4℃、12 000 r·min-1离心10 min,收集上清液,冻存于-80℃备用,发酵上清液和对照上清液分别命名为JH(编号为JH1~JH6)和CK(编号为CK1~CK6)。
1.4.2 发酵和对照上清液的非靶向代谢组学测定 发酵和对照上清液化合物的提取:取一EP管,加入100 μL发酵上清液和400 μL提取液甲醇∶乙腈=1∶1(v/v),含内标混合物(邻苯二甲酸二异丁酯-D4、L-苯丙氨酸-D5、L-亮氨酸-D3、L-苯丙氨酸-D5、L-2-氯苯丙氨酸和癸酸-D19),涡旋30 s。冰浴,超声10 min。-40℃,静置1 h。4℃、12 000 r·min-1,离心15 min,取上清液加入进样瓶。按上述方法提取对照上清液中化合物。
QC样品的制备:发酵和对照上清液的12份样品各取50 μL,混合后平分为3份作为QC样品。QC样品中用于正离子模式检测的内标为邻苯二甲酸二异丁酯-D4、L-苯丙氨酸-D5、L-亮氨酸-D3,用于负离子模式检测的内标为L-苯丙氨酸-D5、L-2-氯苯丙氨酸和癸酸-D19。
样品的UHPLC-QE-MS测定:在Vanquish超高效液相色谱仪上,通过Waters ACQUITY UPLC BEH Amide色谱柱(2.1 mm×100 mm,1.7 μm)分离所有发酵提取液、对照提取液和QC樣品中的化合物。样品盘温度为4℃,进样体积2 μL,柱温30℃。流动相A为水相,含25 mmol·L-1乙酸铵和25 mmol·L-1氨水,流动相B为乙腈,流速为0.5 mL·min-1。梯度洗脱程序为:0~0.5 min,95% B;0.5~7 min,95%~65% B;7~8 min,65%~40% B;8~9 min,40% B;9~9.1 min,40%~95% B;9.1~12 min,95% B。随后,在Q Exactive HFX质谱仪上,应用Xcalibur软件采用数据依赖型模式采集一级和二级质谱数据。电喷雾电离参数设置如下:鞘气流速为30 Arb,辅助气流速为25 Arb,毛细管温度350℃,全扫描一级质谱分辨率为60000,二级质谱分辨率为7500,碰撞能量为10/30/60,电喷雾电压为3.6 kV(正离子)或
-3.2 kV(负离子)。
测定数据的质量检验:为了检验UHPLC-QE-MS的稳定性和重复性,检测QC样品的离子图谱和内标出峰的保留时间和响应强度;计算正、负离子模式下各3个样品间的皮尔逊相关系数,以及各离子模式下3个内标响应强度的相对标准偏差RSD。
1.4.3 冠突散囊菌发酵代谢产物谱的分析 采用ProteoWizard软件将质谱原始数据转为mzXML格式后,使用R程序包(XCMS软件)进行峰识别、峰提取、峰对齐和峰积分,经过偏离值过滤、缺失值过滤、缺失值填补和数据标准化处理的预处理后,所得的特征离子与上海百趣生物医学科技有限公司自建的二级质谱数据库BiotreeDB(V2.1)比对,注释代谢物,Cutoff值设为0.3。采用SIMCA软件(V16. 0. 2)对所有代谢物半定量数据进行对数(LOG)转换,并以中心化(CTR)和UV格式化处理,分别用于主成分分析(principal component analysis,PCA)和正交偏最小二乘法-判别分析(orthogonal projections tolatent structures-discriminant analysis,OPLS-DA)建模分析。
1.4.4 冠突散囊菌发酵产物的鉴定 为了提高后续数据分析的可靠性,以二级匹配分值MS2 score≥0.9为阈值,从注释的代谢物中,筛选和鉴定发酵产物,并分析它们的分类情况。
1.4.5 冠突散囊菌主要发酵产物的筛选 对OPLS-DA模型进行200次置换检验,获取随机模型的R2和Q2值,根据Q2分析模型的稳健性。计算JH和CK中各发酵产物的OPLS-DA模型第一主成分的变量投影重要度(variable importance in the projection,VIP)和倍数变化(fold change,FC),并进行学生t-检验。以VIP>1、P<0.01且|log2FC|≥1为阈值,筛选JH和CK两组样品的差异发酵产物。根据相对定量值,采用R语言对所有样品差异发酵产物进行聚类分析。选择JH中上调的差异发酵产物,作为冠突散囊菌的主要发酵产物,分析它们的分类情况。
1.4.6 冠突散囊菌降糖降脂活性产物的分析 根据现有文献资料,分析主要发酵产物的生物活性功能,寻找具有降糖和降脂作用的活性产物,探索Ys-Ec-01潜在的降糖降脂功能。
2 结果与分析
2.1 UHPLC-QE-MS方法的验证
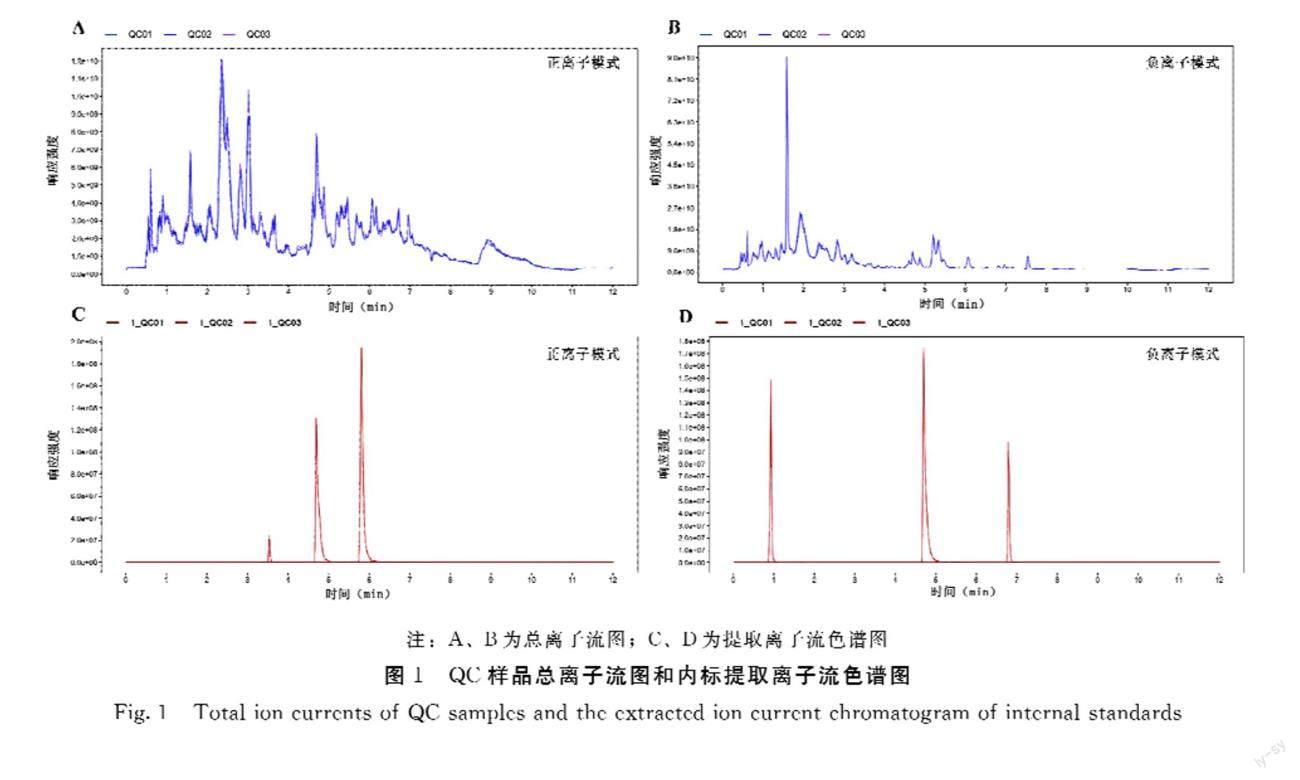
由图1可知,在正离子或负离子模式下,各自3个QC样品测定的总离子流图谱均有很高的重合性。样品间具有很高的皮尔逊相关系数,正离子模式为0.981~0.983,负离子模式为0.983~0.987,表明样品间的数据差异很小。在两种离子模式下,各QC样品中内标的保留时间和响应强度均显示良好的稳定性,正离子模式的内标响应强度的RSD分别为0.0195、0.0602和0.01,负离子模式的RSD分别为0.0145、0.0164和0.0356。检测过程穿插的2个空白样品均未检测出内标,表明样品间不产生交叉污染。上述结果表明,本研究所用检测方法稳定可靠,数据质量很高。
2.2 冠突散囊菌发酵代谢产物谱的分析
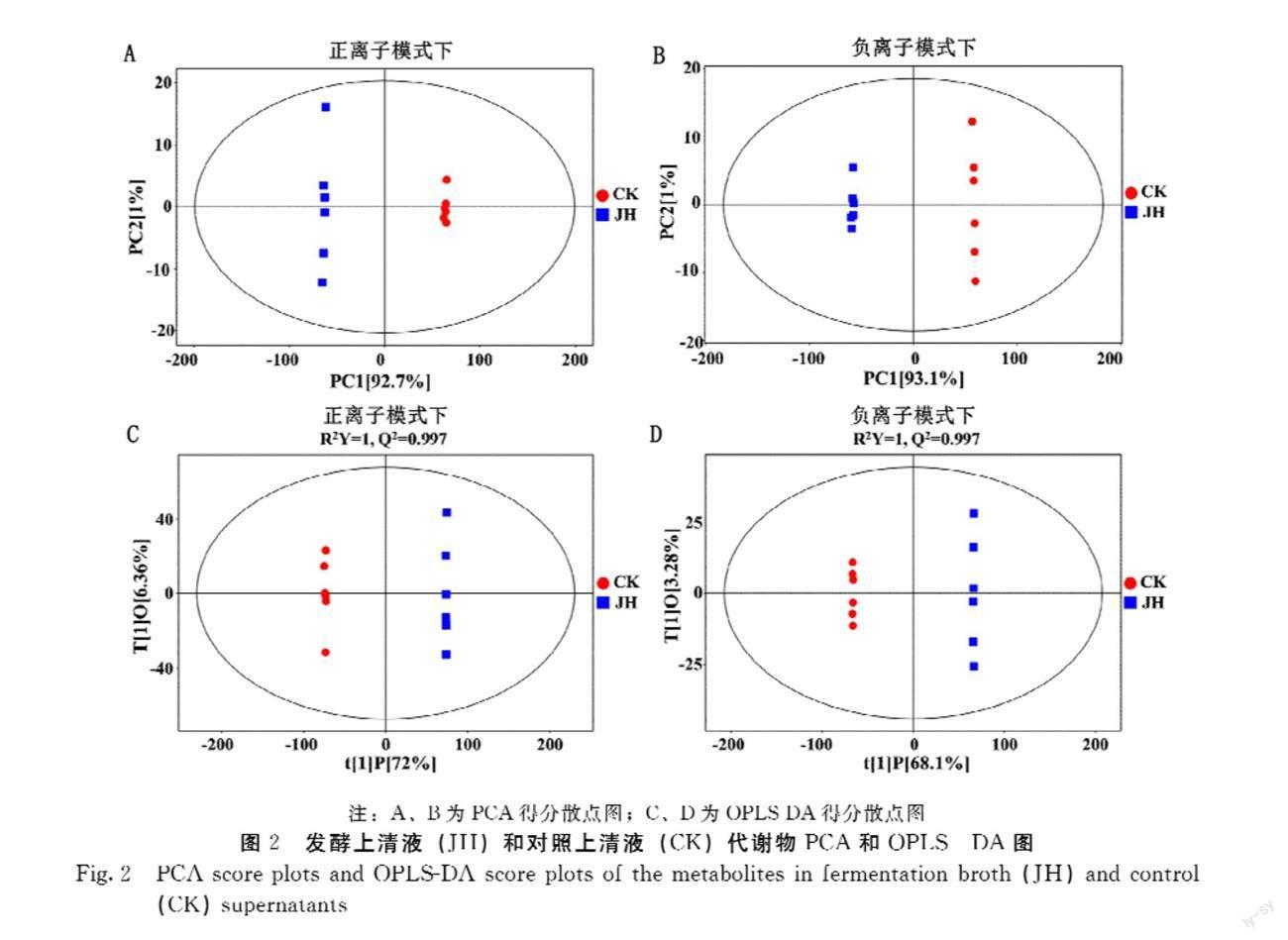
发酵和对照上清液的12个样品,共检测出8 219个正离子模式特征离子和7 057个负离子模式特征离子。对所得的全部特征离子即代谢物进行PCA(图2A和图2B)和OPLS-DA(图2C和图2D)分析,结果显示:在两种离子模式下,JH和CK两组样品明显分开,且所有样品均处于95%置信区间内,这表明Ys-Ec-01发酵后代谢产物谱发生显著改变。
2.3 冠突散囊菌发酵产物的鉴定
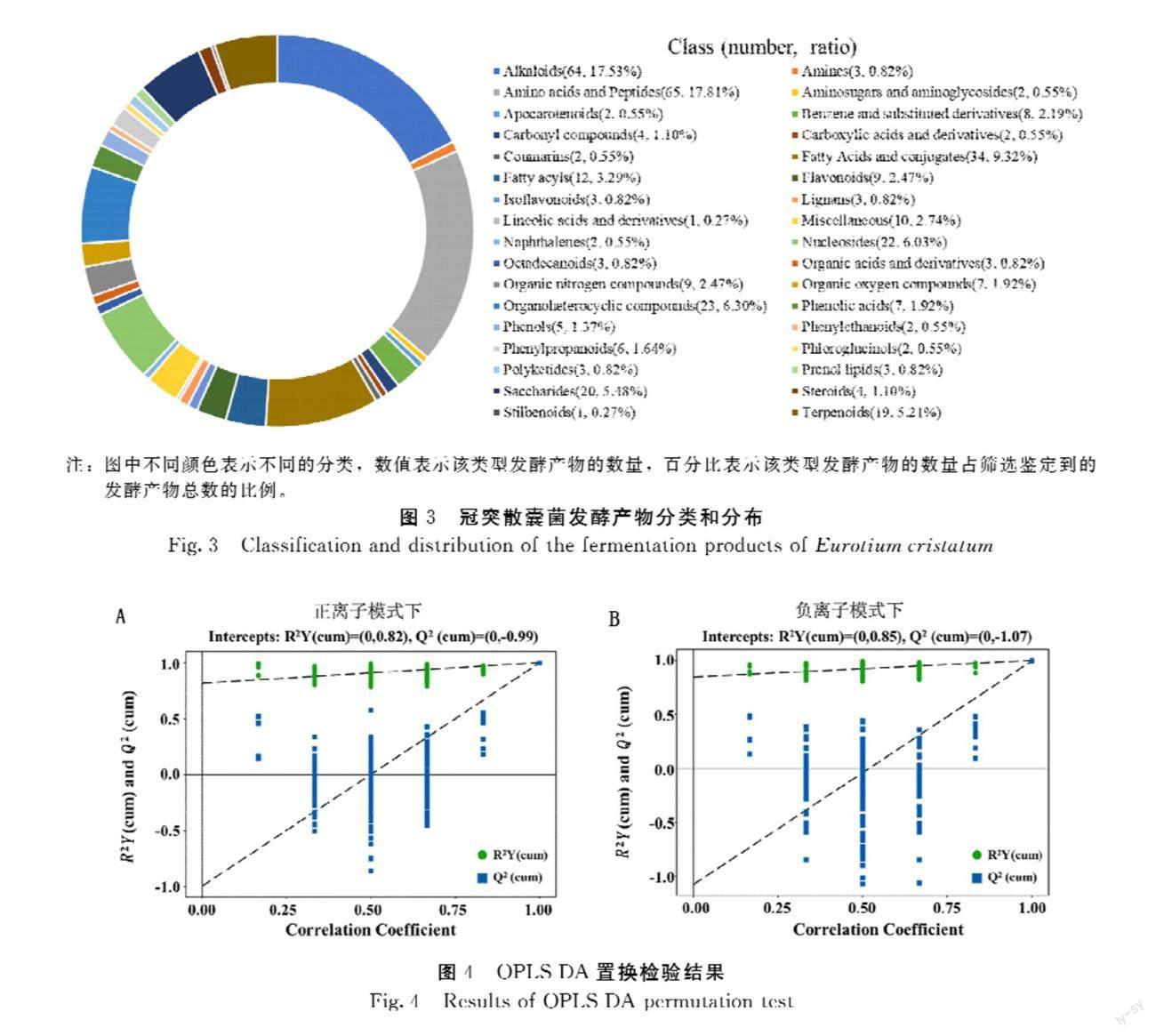
在正、负离子模式下,分别鉴定出262种和123种发酵产物,去除重复后共获得365种发酵产物,可分为35类化合物(图3),其中,数量最多的类别是氨基酸及短肽(17.81%)和生物碱(17.53%),其次为脂肪酸及衍生物(9.32%)、有机杂环化合物(6.30%)和核苷类(6.03%)。
2.4 冠突散囊菌主要发酵产物的分析
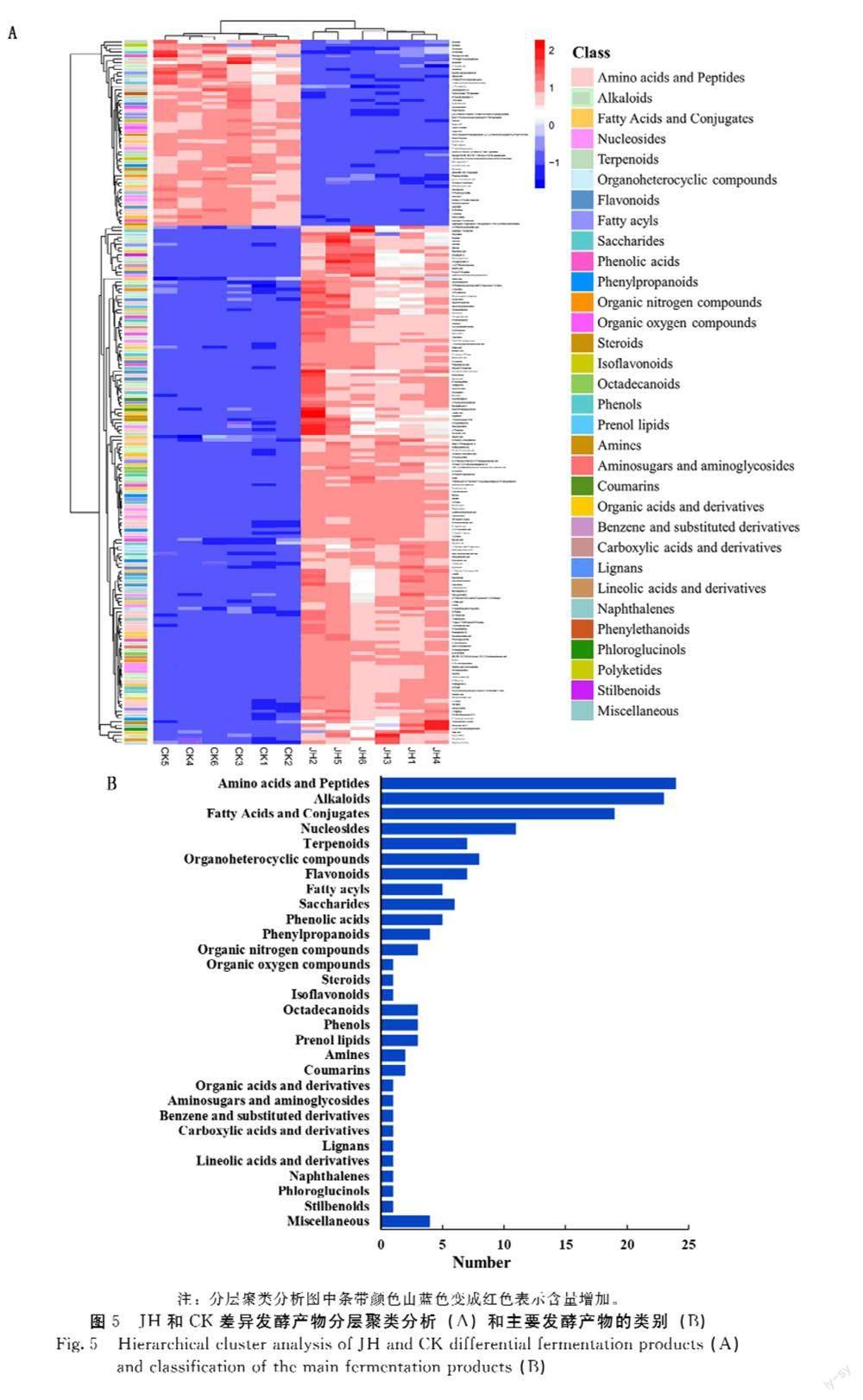
OPLS-DA的200次置换检验结果见图4,正、负离子模式下的Q2截距均小于0,表明该模型没有过拟合现象,稳健性良好,可用于筛选差异发酵产物。
JH和CK间共筛选出205种差异发酵产物,其分层聚类分析见图5A。上调的差异发酵产物有151种,结果表明Ys-Ec-01在发酵过程主要合成这151种发酵产物。这些发酵产物即为主要发酵产物,可分为30类化合物(图5B),数量排前3名的类别是氨基酸及短肽、生物碱和脂肪酸及衍生物(相对总量占比>10%),表明它们是Ys-Ec-01主要发酵产物种类中最多的3类。
2.5 冠突散囊菌降糖降脂活性产物的分析
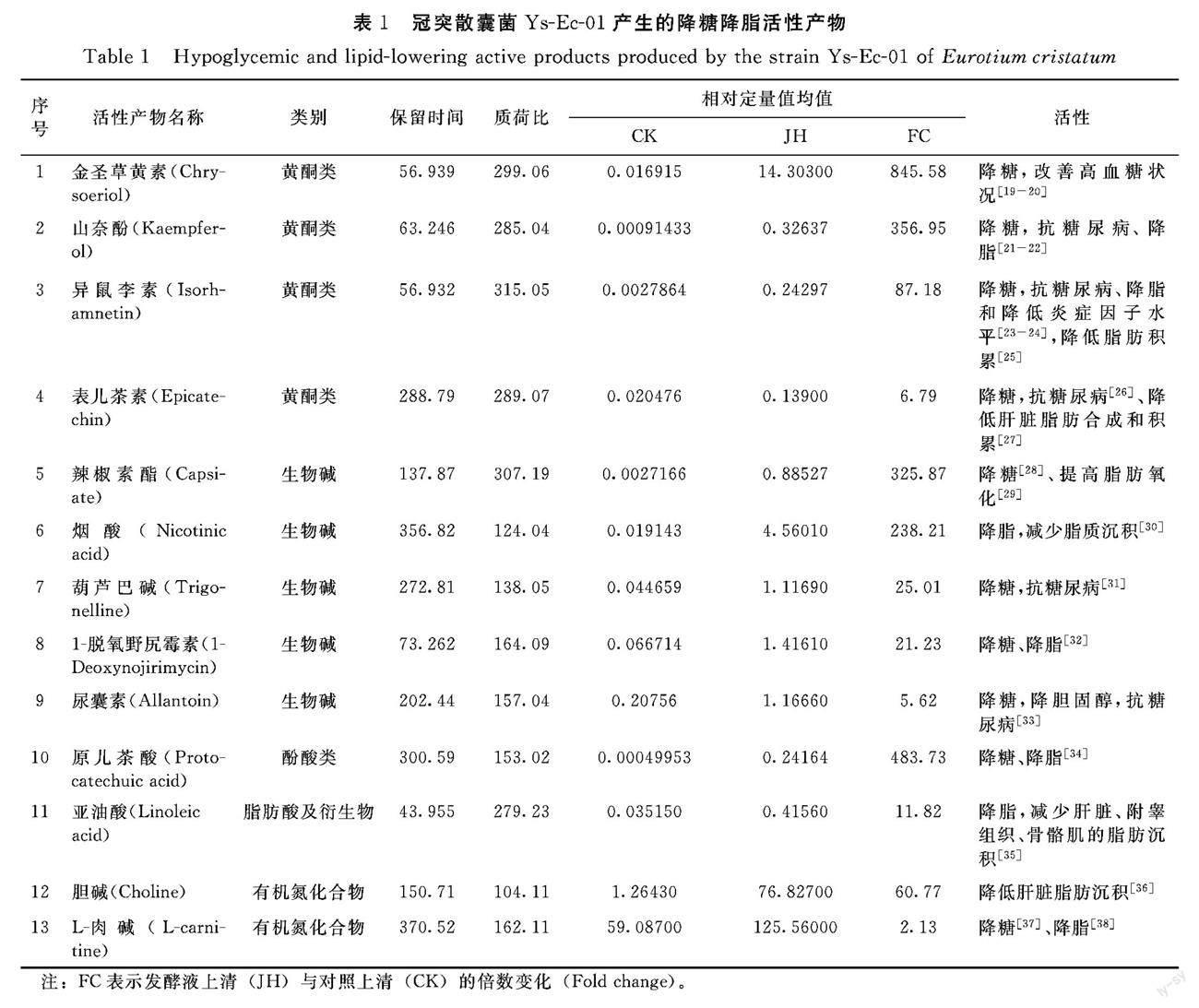
从主要发酵产物中,鉴定出13种降糖降脂活性产物(表1),包括4种黄酮类、5种生物碱类、1种酚酸类、1种脂肪酸及衍生物和2种有机氮化合物。
2.5.1 黃酮类活性产物 金圣草黄素、山奈酚和异鼠李素的发酵后含量变化极大,分别上调845.58倍、356.95倍和87.18倍,其中,金圣草黄素的变化倍数是13种活性产物中最高的。
金圣草黄素存在于许多植物中,如臭荠、旱柳、辣椒等[18]。研究表明,金圣草黄素通过调节链脲佐菌素(streptozotocin,STZ)诱导的T2DM大鼠中的糖代谢酶,修复肝脏损伤和控制β细胞的降解,以降低血糖、血红蛋白和糖化血红蛋白(glycated hemoglobin,HbA1c)水平,改善高血糖状况[19];保护STZ诱导的Wistar大鼠肝脏和肾脏[20]。山奈酚广泛存在于中药和植食性食物中[21],它可通过抑制肝脏糖异生,降低STZ诱导的糖尿病小鼠血糖浓度,发挥抗糖尿病作用[21];通过激活高脂饮食小鼠的PPARγ/LXRα/ABCA1和PPARγ/PI3K/AKT通路,分别发挥降血脂和降血糖作用[22]。异鼠李素可降低T2DM大鼠胰岛素抵抗,降低空腹血糖和血脂水平,发挥抗糖尿病作用[23];也可调整T2DM小鼠肠道菌群结构,降低血脂和炎症因子水平,改善糖尿病症状[24],还能通过依赖性NHR-49/PPARα信号通路降低秀丽线虫的脂肪积累[39]。
2.5.2 生物碱类活性产物 辣椒素酯和烟酸发酵后含量大幅度上调,分别为325.87和238.21倍。辣椒素酯可增加非肥胖T2DM大鼠β细胞数量,促进胰岛素分泌,并提高肝脏内胰岛素敏感性,增加肝脏糖原储存,以维持血糖稳定,发挥抗糖尿病作用[40];也可提高人体脂肪氧化[29]。烟酸是一种常用的降低血浆甘油三酯药物,可抑制肝脏中的PGC-1β/APOC3 通路,降低血脂[30]。1-脱氧野尻霉素是我国首个原创降血糖天然药物桑枝总生物碱片中三种成分中含量最高的成分[7, 41],可降低STZ诱导的糖尿病老鼠血糖、胆固醇(total cholesterol,TC)、 甘油三酯(triglyceride,TG)和低密度脂蛋白胆固醇(low-density lipoprotein-cholesterol,LDL-C)水平,提高高密度脂蛋白胆固醇(high-density lipoprotein-cholesterol,HDL-C)水平,改善血脂状况[32]。
2.5.3 其他类活性产物 原儿茶酸发酵后含量上调483.73倍;L-肉碱发酵后含量虽然仅上调2.13倍,但却是13种活性产物中最高的,占比达55.26%。原儿茶酸可降低糖尿病大鼠的血糖、TC、TG和LDL-C水平,提高HDL-C水平[34]。L-肉碱可有效降低T2DM患者的空腹血糖和HbA1c水平[37],以及心血管疾病患者的TC和LDL-C水平,提高HDL-C水平[38]。
3 结论与讨论
本研究通过基于UHPLC-QE-MS的非靶向代谢组学,分析了冠突散囊菌Ys-Ec-01发酵前后的代谢产物谱。在发酵后,Ys-Ec-01代谢产物谱发生显著变化。在正、负离子模式下,分别鉴定出262种和123种发酵产物,去重后共获得365种发酵产物,从中筛选出205种差异发酵产物和151种主要发酵产物,氨基酸及短肽、生物碱和脂肪酸及衍生物是主要发酵产物中最多的3类化合物。结合文献分析,鉴定到13种降糖降脂活性产物,表明Ys-Ec-01具有潜在的降糖降脂功能。
本研究所鉴定的13种降糖降脂活性产物并未包括已报道的二酮哌嗪二聚体生物碱eurocristatine[10]、洛伐他汀[11]、伏茶素A和伏茶素B[16-17],这13种活性产物丰富了冠突散囊菌降糖降脂活性成分的种类,为Ys-Ec-01的降糖降脂功能研究和开发应用提供更多的靶点和基本信息。发酵产物的合成与基因和蛋白的表达有关,后续可通过转录组学和蛋白组学分析这13种活性产物高产量的调控机制,并为Ys-Ec-01的开发应用提供理论基础和数据支持。除了降糖降脂外,这13种活性产物还存在其他生物活性,如金圣草黄素还具有抗氧化、抗菌、抗炎症、抗癌症等作用[18],对这些生物活性及其他主要发酵产物的生物活性分析,可以拓展Ys-Ec-01的应用范围。
参考文献:
[1]SUN H,SAEEDI P,KARURANGA S,et al.IDF Diabetes Atlas:Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045[J].Diabetes Research and Clinical Practice,2022,183:109119.
[2]ARORA A,BEHL T,SEHGAL A,et al.Unravelling the involvement of gut microbiota in type 2 diabetes mellitus[J].Life Sciences,2021,273:119311.
[3]张丽雯,阮梅花,刘加兰,等.糖尿病领域研发态势分析[J].遗传,2022,44(10):824-839.
[4]李鑫,朱明微,李瑞楚,等.复方桦树茸降糖片的制备及其对2型糖尿病小鼠降血糖作用研究[J].药物评价研究,2022,45(11):2239-2246.
[5]王云威,王景雪.铁皮石斛多糖对2型糖尿病小鼠降糖降脂的作用[J].食品科学,2020,41(21):127-132.
[6]刘红芹,张晓旭,赵婷婷,等.葛根、桑叶、苦瓜、苦荞配方辅助治疗Ⅱ型糖尿病 [J].中国食品学报,2018,18(8):33-41.
[7]劉率男,刘泉,刘玉玲,等.桑枝总生物碱片研发历程回顾(二):现代药理学理念诠释中药的药效特点及药理作用机制[J].中国糖尿病杂志,2020,28(8):635-640.
[8]李玉婷,吕嘉枥.金花菌黄色素的稳定性及其抗氧化活性研究[J].微生物学通报,2013,40(11):2030-2036.
[9]ZOU X,LI Y,ZHANG X,et al.A new prenylated indole diketopiperazine alkaloid from Eurotium cristatum[J].Molecules,2014,19(11):17839-17847.
[10]ZHANG H,HUI J,YANG J,et al.Eurocristatine,a plant alkaloid from Eurotium cristatum,alleviates insulin resistance in db/db diabetic mice via activation of PI3K/AKT signaling pathway[J].European Journal of Pharmacology,2020,887:173557.
[11]尹慧慧,陈育如,赵文文.冠突散囊菌利用不同原料产洛伐他汀的条件优化[J].南京师大学报(自然科学版),2018,41(2):93-98.
[12]XIE Z,BAI Y,CHEN G,et al.Modulation of gut homeostasis by exopolysaccharides from Aspergillus cristatus(MK346334),a strain of fungus isolated from Fuzhuan brick tea,contributes to immunomodulatory activity in cyclophosphamide-treated mice[J].Food and Function,2020,11(12):10397-10412.
[13]LI H,MI Y,DUAN Z,et al.Structural characterization and immunomodulatory activity of a polysaccharide from Eurotium cristatum[J].International Journal of Biological Macromolecules,2020,162:609-617.
[14]LIU G,DUAN Z,WANG P,et al.Purification,characterization,and hypoglycemic properties of eurocristatine from Eurotium cristatum spores in Fuzhuan brick tea[J].RSC Advances,2020,10(37):22234-22241.
[15]张静,周跃斌.湖南黑茶发展概况[J].湖南农业科学,2013(4):40-42.
[16]NAGASAWA T,ISHIMARU K,HIGASHIYAMA S,et al.Teadenol A in microbial fermented tea acts as a novel ligand on GPR120 to increase GLP-1 secretion[J].Food and Function,2020,11(12):10534-10541.
[17]蔡正安,刘素纯,刘杏益,等.冠突散囊菌在不同茶类及几种植物材料上“发花”的研究[J].茶叶科学,2010,30(4):263-268.
[18]ABOULAGHRAS S,SAHIB N,BAKRIM S,et al.Health benefits and pharmacological aspects of chrysoeriol[J].Pharmaceuticals,2022,15(8):973.
[19]KRISHNAN B,RAMU G A,BALASUBRAMANI R,et al.Chrysoeriol ameliorates hyperglycemia by regulating the carbohydrate metabolic enzymes in streptozotocin-induced diabetic rats[J].Food Science and Human Wellness,2020,9(4):346-354.
[20]RAUTER AP,MARTINS A,BORGES C,et al.Antihyperglycaemic and protective effects of flavonoids on streptozotocin-induced diabetic rats[J].Phytotherapy Research,2010,24(S2):S133-138.
[21]ALKHALIDY H,MOORE W,WANG Y,et al.The flavonoid kaempferol ameliorates streptozotocin-induced diabetes by suppressing hepatic glucose production[J].Molecules,2018,23(9):2338.
[22]TANG H,ZENG Q,TANG T,et al.Kaempferide improves glycolipid metabolism disorder by activating PPARγ in high-fat-diet-fed mice[J].Life Sciences,2021,270:119133.
[23]MATBOLI M,SAAD M,HASANIN A H,et al.New insight into the role of isorhamnetin as a regulator of insulin signaling pathway in type 2 diabetes mellitus rat model: Molecular and computational approach[J].Biomed Pharmacother,2021,135:111176.
[24]LI J,YUAN H,ZHAO Z,et al.The mitigative effect of isorhamnetin against type 2 diabetes via gut microbiota regulation in mice[J].Frontiers in Nutrition,2022,9:1070908.
[25]BETTAIEB A,VAZQUEZ PRIETO M A,RODRIGUEZ LANZI C,et al.(-)-Epicatechin mitigates high-fructose-associated insulin resistance by modulating redox signaling and endoplasmic reticulum stress[J].Free Radical Biology & Medicine,2014,72:247-256.
[26]QU Z,LIU A,LI P,et al.Advances in physiological functions and mechanisms of(-)-epicatechin[J].Critical Reviews in Food Science and Nutrition,2021,61(2):211-233.
[27]CREMONINI E,IGLESIAS DE,KANG J,et al.(-)-Epicatechin and the comorbidities of obesity[J].Archives of Biochemistry and Biophysics,2020,690:108505.
[28]ZHANG S,MA X,ZHANG L,et al.Capsaicin reduces blood glucose by increasing insulin levels and glycogen content better than capsiate in streptozotocin-induced diabetic rats[J].Journal of Agricultural and Food Chemistry,2017,65(11):2323-2330.
[29]ZSIBORAS C,MATICS R,HEGYI P,et al.Capsaicin and capsiate could be appropriate agents for treatment of obesity:A meta-analysis of human studies[J].Critical Reviews in Food Science and Nutrition,2018,58(9):1419-1427.
[30]HERNANDEZ C,MOLUSKY M,LI Y,et al.Regulation of hepatic ApoC3 expression by PGC-1β mediates hypolipidemic effect of nicotinic acid[J].Cell Metabolism,2010,12(4):411-419.
[31]ALDAKINAH A A A,AL-SHORBAGY M Y,ABDALLAH D M,et al.Trigonelline and vildagliptin antidiabetic effect: improvement of insulin signalling pathway[J].The Journal of Pharmacy and Pharmacology,2017,69(7):856-864.
[32]HU TG,WEN P,SHEN W Z,et al.Effect of 1-deoxynojirimycin isolated from mulberry leaves on glucose metabolism and gut microbiota in a streptozotocin-induced diabetic mouse model[J].Journal of Natural Products,2019,82(8):2189-2200.
[33]GO H K, RAHMAN M M, KIM G B,et al.Antidiabetic effects of yam (Dioscorea batatas) and its active constituent, allantoin, in a rat model of streptozotocin-induced diabetes[J].Nutrients 2015,7(10):8532-8544.
[34]ALEGBE E O,TERALI K,OLOFINSAN K A, et al.Antidiabetic activity-guided isolation of gallic and protocatechuic acids from Hibiscus sabdariffa calyxes[J].Journal of Food Biochemistry,2019,43(7):e12927.
[35]李海玲,张思晨,赵志敏,等.共轭亚油酸降脂及分子机理研究进展[J].中国油脂,2022,47(1):60-67.
[36]李博,李伟,王恬.胆碱对脂肪代谢调控及其机制的研究进展[J].中国粮油学报,2016,31(1):142-146.
[37]WANG D D,MAO Y Z,HE S M,et al.Quantitative efficacy of L-carnitine supplementation on glycemic control in type 2 diabetes mellitus patients[J].Expert Review of Clinical Pharmacology,2021,14(7):919-926.
[38]ASADI M,RAHIMLOU M,SHISHEHBOR F,et al.The effect of l-carnitine supplementation on lipid profile and glycaemic control in adults with cardiovascular risk factors:A systematic review and meta-analysis of randomized controlled clinical trials[J].Clinical Nutrition,2020,39(1):110-122.
[39]FARIAS-PEREIRA R,SAVARESE J,YUE Y,et al.Fat-lowering effects of isorhamnetin are via NHR-49-dependent pathway in Caenorhabditis elegans[J].Current Research in Food Science,2020,2:70-76.
[40]KWON D Y,KIM YS,RYU S Y,et al.Capsiate improves glucose metabolism by improving insulin sensitivity better than capsaicin in diabetic rats[J].Journal of Nutritional Biochemistry,2013,24(6):1078-1085.
[41]夏學军,汪仁芸,刘玉玲.柱前衍生化RP-HPLC法测定桑枝总生物碱的含量[J].中国新药杂志, 2008,17(23):2044-2047.
(责任编辑:柯文辉)
收稿日期:2023-05-12
作者简介:林俊涵,男,1981年生,博士,副教授,主要从事功能微生物选育及药食同源中药发酵等研究。
基金项目:福建省中青年教师教育科研项目(科技类)(JAT201225);福建省自然科学基金项目(2023J01171);国家自然科学基金青年项目(32001109);福建生物工程职业技术学院重点项目(2020ZD02)。

