参芪温肺方减轻慢性阻塞性肺疾病大鼠的肺气虚证:基于调节NLRP3/GSDMD细胞焦亡通路
吴 迪,王小乐,高雅婷,童佳兵,,杨勤军,丁焕章,张 璐,李泽庚
1安徽中医药大学中医学院,安徽 合肥 230038;2江西中医药大学附属医院,江西 南昌 330006;3安徽省中医药科学院中医呼吸病防治研究所//安徽省教育厅中医药防治肺系重大疾病重点实验室//安徽中医药大学第一附属医院,安徽 合肥230031
慢性阻塞性肺疾病(COPD)是以持续性气流阻塞为特征的一种异质性肺部状态[1],伴咳嗽、咳痰、呼吸困难等慢性呼吸道症状。气道异常导致的慢性气道炎症是COPD的重要发病机制[2],与有毒颗粒和气体暴露等危险因素密切相关,可诱导多种细胞因子并募集炎性细胞靶向肺组织,从而导致炎症反应的发生[3,4]。被细胞内外信号刺激激活的细胞焦亡作为一种程序性细胞死亡方式,常伴随一系列的炎症反应[5]。研究发现[6],NOD样受体蛋白3(NLRP3)炎症小体介导的经典细胞焦亡途径在COPD的发病机制中扮演重要角色。COPD患者外周血单个核细胞中NLRP3 mRNA及血浆中白细胞介素-18(IL-18)和IL-1β表达均显著升高[7]。香烟烟雾可刺激小鼠肺组织中NLRP3 炎症小体相关蛋白NLRP3和凋亡相关微粒蛋白(ASC)的活化,激活半胱氨酸的天冬氨酸蛋白水解酶-1(Caspase-1),促进消皮素D(GSDMD)蛋白的裂解,诱导细胞焦亡,释放IL-1β和IL-18,加重COPD小鼠肺组织的损伤和炎性细胞焦亡[8,9]。因此,抑制NLRP3炎症小体的活化,可能是抑制COPD细胞焦亡发生的关键环节。
目前,中医药改善COPD的优势显著,安全可靠[10]。针对COPD气虚病证发展规律的病机认识,第四届国医大师韩明向教授根据新安医家吴楚《补肺汤》化裁而成的参芪温肺方(SQWF,专利号ZL 2022 1 0325914.X),由人参、炙黄芪、干姜、陈皮、白术、桔梗和炙甘草七味中药组成,具有温肺化痰,益气平喘之功效。前期临床观察发现,该方可以有效改善COPD肺气虚证患者的咳嗽、咳痰等症状、减少急性加重次数,提高肺功能等。尽管疗效确切,但作用机制尚不明确。SQWF能否通过干预炎症小体介导的细胞焦亡通路影响COPD尚不清楚。
本文通过构建COPD 肺气虚证大鼠模型,拟从NLRP3炎症小体信号通路阐明SQWF对肺气虚模型大鼠细胞焦亡的影响,探索SQWF改善COPD的可能作用机制。
1 材料和方法
1.1 实验动物
SPF级雄性SD大鼠48只,体质量180±20 g,购自邳州市东方养殖有限公司,许可证号:SCXK(苏)2017-0003。按照标准适应性饲养7 d后进行实验。实验通过安徽中医药大学动物伦理委员会批准(AHUCM-rats-2021087),严格按照国家《实验动物管理条例》执行。
1.2 药品
参芪温肺方药物组成:人参(吉林)10 g、炙黄芪(甘肃)15 g、干姜(云南)6 g、陈皮(福建)10 g、白术(安徽)10 g、桔梗(安徽)6 g、炙甘草(新疆)6 g,购自安徽中医药大学第一附属医院中药房,中药饮片由该院韩燕全教授鉴定均为正品。每剂药物质量63 g。将参芪温肺方药物加入10倍药物重量的蒸馏水(630 mL)煎煮1 h后将药液过滤倒出,药渣再加入8倍重量蒸馏水(504 mL)煎煮40 min后再次过滤,混合两次药液,按临床等效剂量进行换算[11]制得高剂量生药含量1.134 g/mL,1 mL/100 g灌胃,4 ℃冰箱保存,蒸馏水稀释应用。玉屏风颗粒(国药集团广东环球制药有限公司,国药准字Z10930036,5 g/袋),用生理盐水配置成浓度为0.135 g/mL 的混悬液应用。
1.3 材料与试剂
脂多糖(LPS,Sigma);雄狮牌过滤嘴香烟(浙江中烟工业有限责任公司,84 mm烤烟型,焦油量:8 mg,烟气烟碱量:0.7 mg;烟气一氧化碳量:10 mg);苏木素伊红染色液(Biosharp);RNA快速提取试剂盒、SYBR定量试剂盒、逆转录酶mix(Sparkjade®);DAB显色试剂盒(武汉赛维尔生物科技有限公司);NLRP3抗体、ASC抗体、IL-1β抗体(Affinity);GSDMD 抗体、Caspase-1 抗体、IL-18抗体(Proteintech);大鼠TNF-α、IL-6、IL-1β酶联免疫吸附测定法(ELISA)检测试剂盒(杭州联科生物技术股份有限公司);IL-18检测试剂盒(Elabscience®)。
1.4 仪器
SH-III-50N型抓力检测仪(南京苏测计量仪器有限公司);AniRes2005型动物肺功能分析系统(北京贝兰博科技有限公司);JB-P5型包埋机(武汉俊杰电子有限公司);RM2016型病理切片机(上海徕卡仪器有限公司);CHL2FM3型倒置显微镜(Olympus);Sysmex XN-9000 型全自动血液分析仪(日本希森美康公司);EPOCH2型酶标仪(BioTek);JXFSTPRP-CLN型冷冻研磨仪(上海拓赫机电科技有限公司);Centrifuge 5418 R 型高速冷冻离心机(Eppendorf);Veriti 96-Well Thermal Cycler 型梯度 PCR 仪(ThermoFisher Scientific);LightCycler480 II型实时荧光定量PCR仪(Roche);BioSpectrometer®basic 型分光光度计(Eppendorf);NIKON DS-U3型显微成像系统(Nikon)。
1.5 COPD大鼠模型构建与给药
将大鼠随机分为空白组(Blank)、模型组(Model)、SQWF低(SQWF-L)、中(SQWF-M)、高(SQWF-H)剂量组、玉屏风组(YPF),8只/组。除正常组外,其余各组大鼠采用全身香烟烟雾暴露联合脂多糖气管滴注法构建COPD大鼠模型[12-14]:于造模第1和14 天行气道滴注脂多糖(1 mg/kg),滴注当日不烟熏。造模的第2~28 天(除第1和14 天)将大鼠置于自制烟熏箱中,烟熏1 h/d,空白组不予处理。根据“人与动物等效剂量换算法”计算[15],于造模第29 天起,SQWF低、中、高剂量组分别给予2.835、5.67、11.34 g/kg 灌胃,玉屏风组给予玉屏风颗粒混悬液1.35 g/kg灌胃,空白组和模型组给予等容积的生理盐水灌胃,各组每日给药1 次,连续给药14 d。
1.6 行为学变化
观察实验期间大鼠的行为学变化,包括活动情况、精神状态、呼吸、毛发、饮食、等,每周称量体质量,比较各组大鼠体质量变化。
1.7 抓力测试
使用抓力检测仪测量造模第0、2、4、7周末大鼠的抓力。固定抓力检测仪,使大鼠前爪抓住前部网格,抓取大鼠尾部轻轻向后拉,读取抓力值,每只大鼠测量3次取平均值,统计分析数据。
1.8 肺功能检测
末次给药结束后,禁食24 h,腹腔注射0.3%戊巴比妥钠(1 mL/100 g)麻醉,使用动物肺功能分析系统检测各组大鼠肺功能。大鼠行气管切开连接双通插管后,仰卧于密闭体积描计箱内,保证气管插管和体描箱气路相连顺畅,待气道压力波形稳定后,测定0.3 s用力肺活量(FEV0.3)、FEV0.3/用力肺活量(FVC)和用力呼气峰值流速(PEF),分析评价大鼠的肺功能。
1.9 标本制备与采集
肺功能检测完毕后,腹主动脉取血于含EDTA采血管中,轻轻摇晃,用于血细胞检测。剩余外周血于3500 r/min离心15 min,分离血清保存至-80 ℃医用低温冰箱。取血后,迅速打开胸腔,结扎右主支气管,将4 mL无菌培养基缓慢注入左肺,回抽液体,反复灌洗3次,共回收支气管肺泡灌洗液(BALF)约10 mL,用于炎症因子的检测。取右肺上叶组织,4%多聚甲醛固定,用于苏木精-伊红(HE)染色和免疫组织化学(IHC)染色,剩余肺组织用冻存管分装置于液氮快速冷冻,后转移至-80 ℃冰箱保存。
1.10 HE染色观察肺组织病理学改变
将4%多聚甲醛中固定的肺组织经脱水,常规石蜡包埋,制成5 μm切片;然后切片经脱蜡后,常规HE染色,脱水封片,显微镜观察各组大鼠肺组织结构和形态学特征。随机截取6张视野图片,在每个视野中心画“十”交叉线,计算每个视野中相交肺泡隔膜数(Ns)、肺泡数(Na)、划线总长度(L)、面积(S),计算肺泡平均截距[16](MLI,μm)=L/Ns,平均肺泡数(MAN,个/mm2)=Na/S。
1.11 外周血中炎性细胞检测
使用血液分析仪检测各组大鼠外周血中白细胞计数(WBC)、中性粒细胞百分比(NEU%)、淋巴细胞百分比(LYM%)、单核细胞细胞百分比(MON%)、嗜酸性粒细胞百分比(EOS%)的含量。
1.12 酶联免疫吸附法(ELISA)法检测BALF中TNF-α、IL-6、IL-1β、IL-18的含量
取出低温储存的BALF,严格按照ELISA试剂盒说明书进行操作。按实验设计,分别设置标准孔组、正常组、模型组、SQWF-L、SQWF-M、SQWF-H组、玉屏风组,各孔加入对应的标准品和待测样品100 μL/孔,然后于每孔加入50 μL稀释的检测抗体(1∶100 稀释)。室温孵育2 h后,丢弃掉液体,洗涤后,每孔加入100 μL酶结合物工作液,室温孵育45 min,洗涤,每孔加入100 μL显色底物TMB,避光,反应20 min后加入100 μL的终止液以终止反应。使用酶标仪检测450 nm波长下各孔的A值,计算各组TNF-α、IL-6、IL-1β、IL-18的表达水平[17]。
1.13 q-PCR 法测定肺组织焦亡关键因子转录水平的表达
使用RNA 快速提取试剂盒提取肺组织总RNA。进行逆转录合成cDNA,PCR反应,扩增,以GAPDH作为内参基因,采用2-ΔΔCt法计算mRNA的表达倍数。基因引物序列由武汉赛维尔生物科技有限公司合成(表1)。

表1 目的基因引物序列Tab.1 Sequences of primers used in this study
1.14 免疫组化(IHC)检测肺组织焦亡相关蛋白的定位和表达
将石蜡包埋的肺组织切片进行脱蜡脱水洗涤后,柠檬酸钠孵育,阻断内源性过氧化物酶,3%BSA血清封闭,NLRP3、ASC、Caspase-1、GSDMD、IL-1β、IL-18 一抗4 ℃孵育过夜。次日,二抗室温孵育,PBS洗涤后加DAB溶液显色,显微镜下观察,阳性为棕黄色。应用Image Pro Plus软件对图像进行关键蛋白的半定量分析,平均光密度值A(A=IntDen/Area)。
1.15 统计学分析
使用SPSS 23.0对数据结果进行统计分析,计量资料采用均数±标准差表示,若数据满足正态分布和方差齐性,多组间比较采用单因素方差分析,不符合正态分布者采用非参数检验,方差不齐者采用Dunnett's T3检验。P<0.05 认为差异有统计学意义。
2 结果
2.1 一般情况比较
与空白组相比,模型组大鼠呼吸急促,咳嗽、喷嚏增加,口鼻分泌物增多,可闻及明显的痰鸣音,精神倦怠,活动量减少,行动迟缓,毛发枯黄,饮食量少,大便稀溏,体型消瘦,体质量增长缓慢。造模后第2周起,各烟熏组体质量与正常组相比明显下降(P<0.01),并且持续到造模第7周。第6周起,SQWF及玉屏风组干预后大鼠的症状均有不同程度的改善,咳嗽、喘息明显缓解,饮食有所改善,各给药组体质量较模型组有所增高,给药结束后SQWF-H大鼠体质量与模型组相比显著增高(P<0.05,图1)。
2.2 抓力测试结果
造模第0~2周,空白组、模型组及各干预组之间抓力无显著性差异;第4周起,模型组大鼠抓力较正常组显著降低(P<0.01);造模结束第7周,SQWF各给药组及玉屏风组大鼠抓力较模型组显著增高(P<0.01,图2)。

图2 各组大鼠抓力比较Fig.2 Comparison of grip strength of rats in each group(g,Mean±SD;n=8).**P<0.01 vs blank group,##P<0.01 vs model group.
2.3 肺功能变化
与空白组相比,模型组大鼠FEV0.3、FEV0.3/FVC及PEF水平均显著降低(P<0.01),与模型组相比,SQWF各组和玉屏风干预后各呼吸功能指标均有不同程度好转,其中,SQWF-M和SQWF-H组FEV0.3和PEF水平显著升高(P<0.01、P<0.05),SQWF虽能提高FEV0.3/FVC水平,但差异无统计学意义;SQWF各组和玉屏风比较差异无统计学意义(P>0.05,图3)。

图3 各组大鼠肺功能比较Fig.3 Comparison of pulmonary function of rats in each group(n=8,Mean±SD).**P<0.01 vs blank group;##P<0.01 vs model group,#P<0.05 vs model group.
2.4 肺组织病理改变
与模型组相比,SQWF各组及玉屏风组肺组织病理损伤均相对减轻,其中以SQWF-H组改善最为显著。空白组大鼠肺泡结构基本完整,形态正常,黏膜及气道壁周围未见充血、水肿,仅见散在个别炎性细胞;模型组大鼠肺泡腔扩大,形态异常,肺泡壁断裂、融合,气道管腔狭窄,腔内可见渗出物,管壁及周围见大量炎症细胞聚集,管壁增厚,部分上皮细胞脱落。与模型组相比,SQWF各组及玉屏风组部分肺泡腔扩大,排列不规则,黏膜上皮细胞脱落减轻,可见少量炎性细胞浸润和水肿。与空白组相比,模型组MAN显著降低(P<0.01),MLI显著升高(P<0.01),SQWF及玉屏风干预后MAN升高,MLI降低(P<0.01),其中以SQWF-H组效果最为显著(图4)。
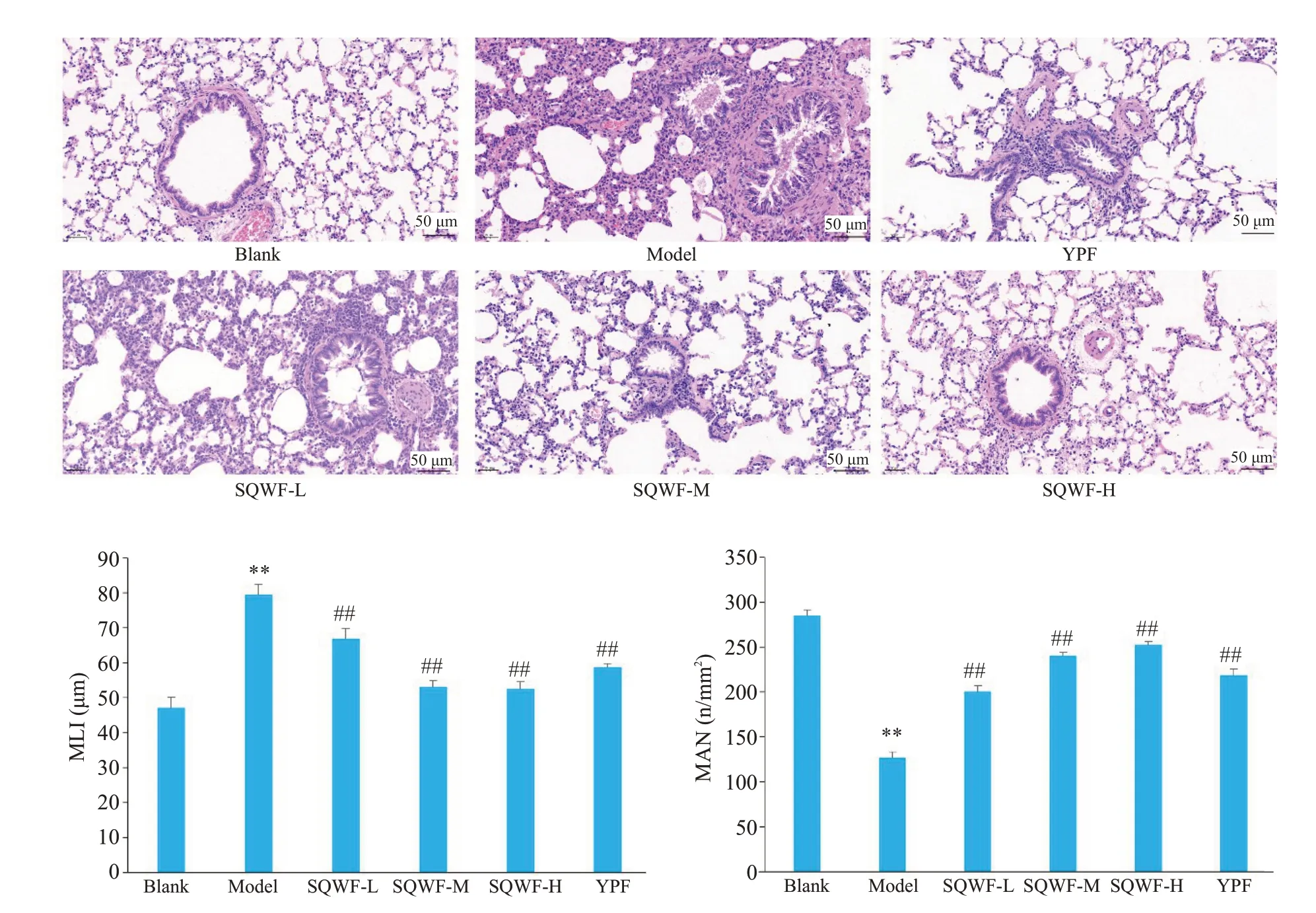
图4 各组大鼠肺组织结构和病例指标的比较Fig.4 Histopathological observation of the lung tissue and pathological indexes in each group(HE staining,original magnification:×20;n=6,Mean±SD).**P<0.01 vs blank group,##P<0.01 vs model group.
2.5 大鼠外周血中炎性细胞的水平
与空白组相比,模型组大鼠外周血中的WBC、NEU%、MON%的水平显著升高(P<0.01),LYM%显著降低(P<0.01)。与模型组相比,SQWF各组及玉屏风组上述指标均有所改善,其中SQWF-H和玉屏风组改善水平最为显著(P<0.01)。各组EOS%水平均无显著性差异(图5)。
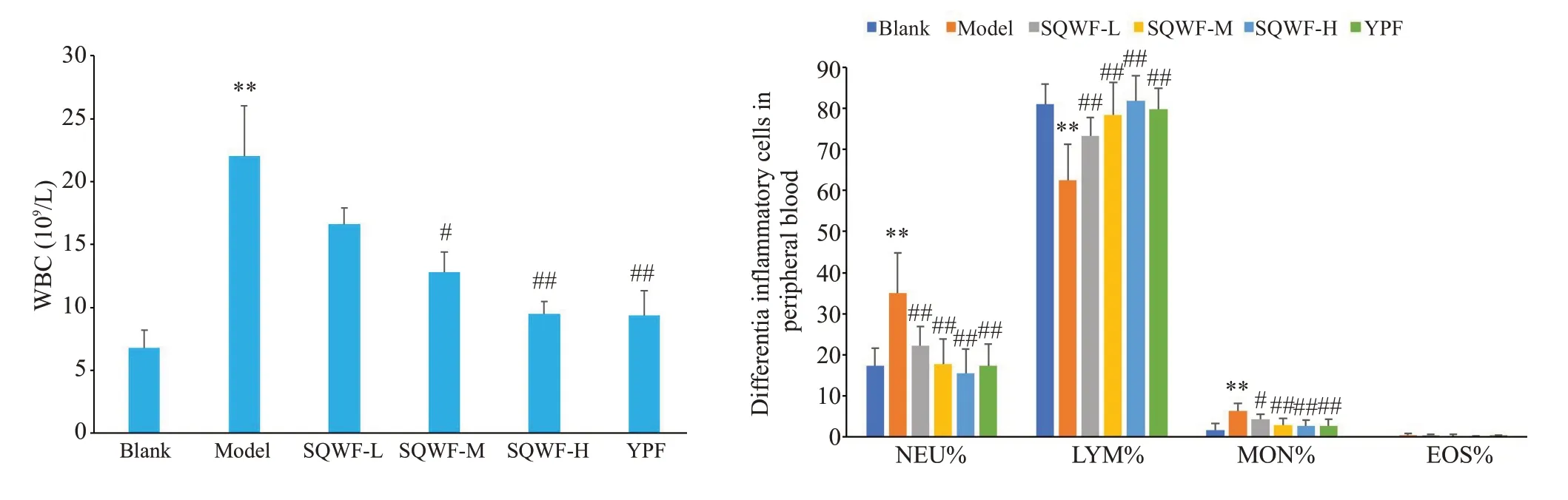
图5 各组大鼠外周血中炎性细胞比较Fig.5 Comparison of peripheral blood inflammatory cells among the groups(n=6,Mean±SD),**P<0.01 vs blank group,##P<0.01 vs model group,#P<0.05 vs model group.
2.6 大鼠BALF中炎症因子水平
与空白组相比,模型组大鼠BALF中TNF-α、IL-6、IL-1β、IL-18含量均显著升高(P<0.01),与模型组相比,各SQWF组及玉屏风组BALF中TNF-α、IL-6、IL-1β、IL-18含量明显降低(P<0.01),且下降程度随SQWF剂量增加而变化,呈剂量依赖性(图6)。
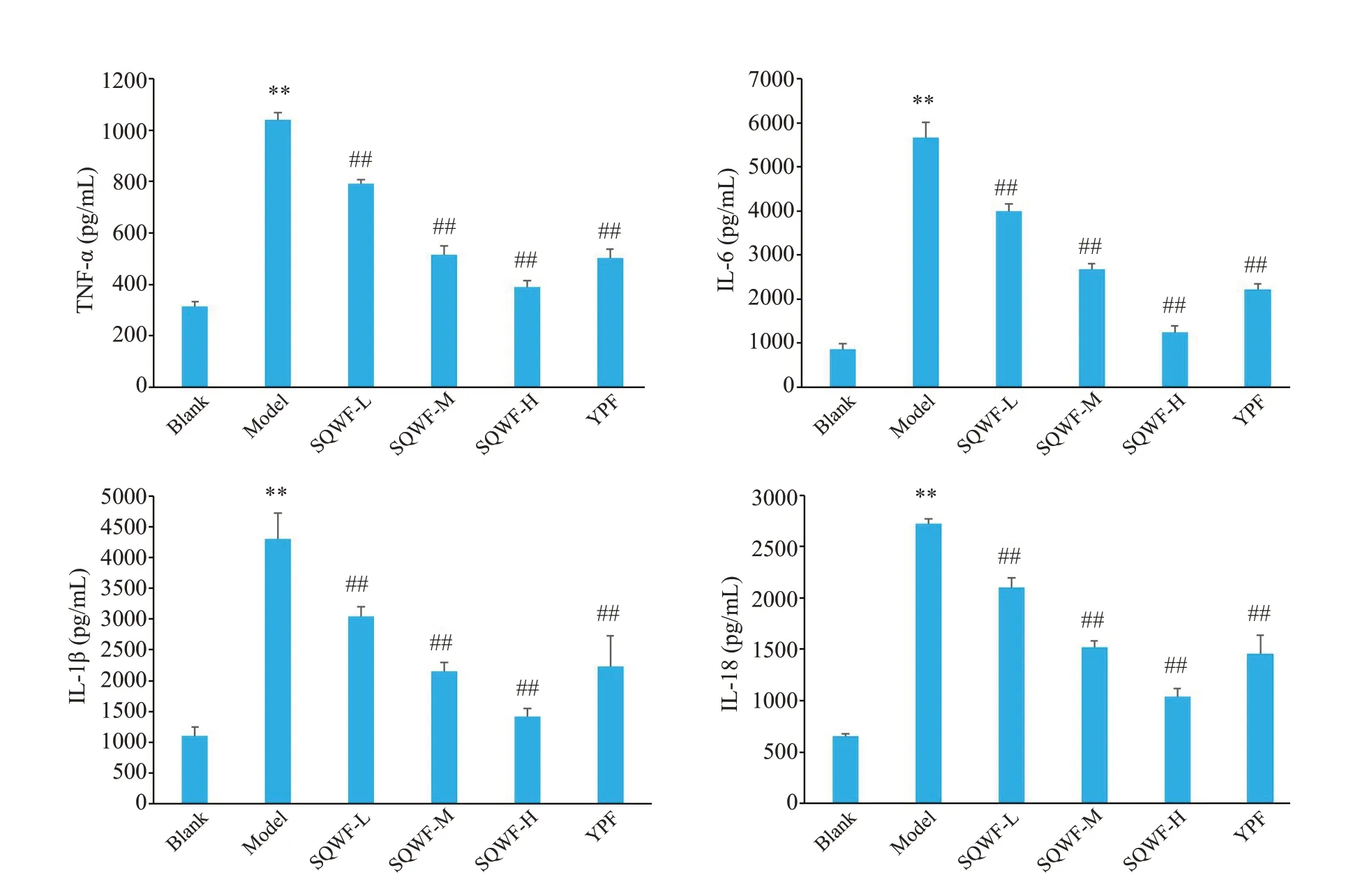
图6 各组大鼠BALF中炎症因子比较Fig.6 Comparison of inflammatory factors in the BALF among the groups(n=7,Mean±SD),**P<0.01 vs blank group,##P<0.01 vs model group.
2.7 大鼠肺组织焦亡相关因子转录表达水平
与空白组相比,模型组大鼠肺组织NLRP3、ASC、GSDMD、IL-1β mRNA 的表达显著升高(P<0.05,P<0.01),但Caspase-1和IL-18的表达上调不明显,差异无统计学意义。与模型组相比,SQWF-H组和玉屏风组可显著下调NLRP3、ASC、GSDMD及IL-1β的mRNA水平(P<0.05,P<0.01),SQWF-M 组仅可以显著下调GSDMD及IL-1β mRNA的水平(P<0.01),以SQWF-H组效果最为显著,各治疗组在改善Caspase-1和IL-18 mRNA的水平方面的差异无统计学意义(图7)。

图7 各组大鼠肺组织中焦亡相关因子mRNA的比较Fig.7 Comparison of mRNA expressions of pyroptosis-related factors in the lung tissue of the rats(n=3,Mean±SD),**P<0.01 vs blank group,*P<0.05 vs blank group;##P<0.01 vs model group,#P<0.05 vs model group.
2.8 大鼠肺组织焦亡相关蛋白定位及表达情况
与空白组相比,模型组大鼠肺组织中NLRP3、ASC、Caspase-1、GSDMD、IL-1β、IL-18蛋白表达显著上调,气道内皮及管壁周围均可见阳性细胞高表达。与模型组相比,各给药组的表达量明显下调,其中以SQWF-H组最为明显(图8,P<0.01)。
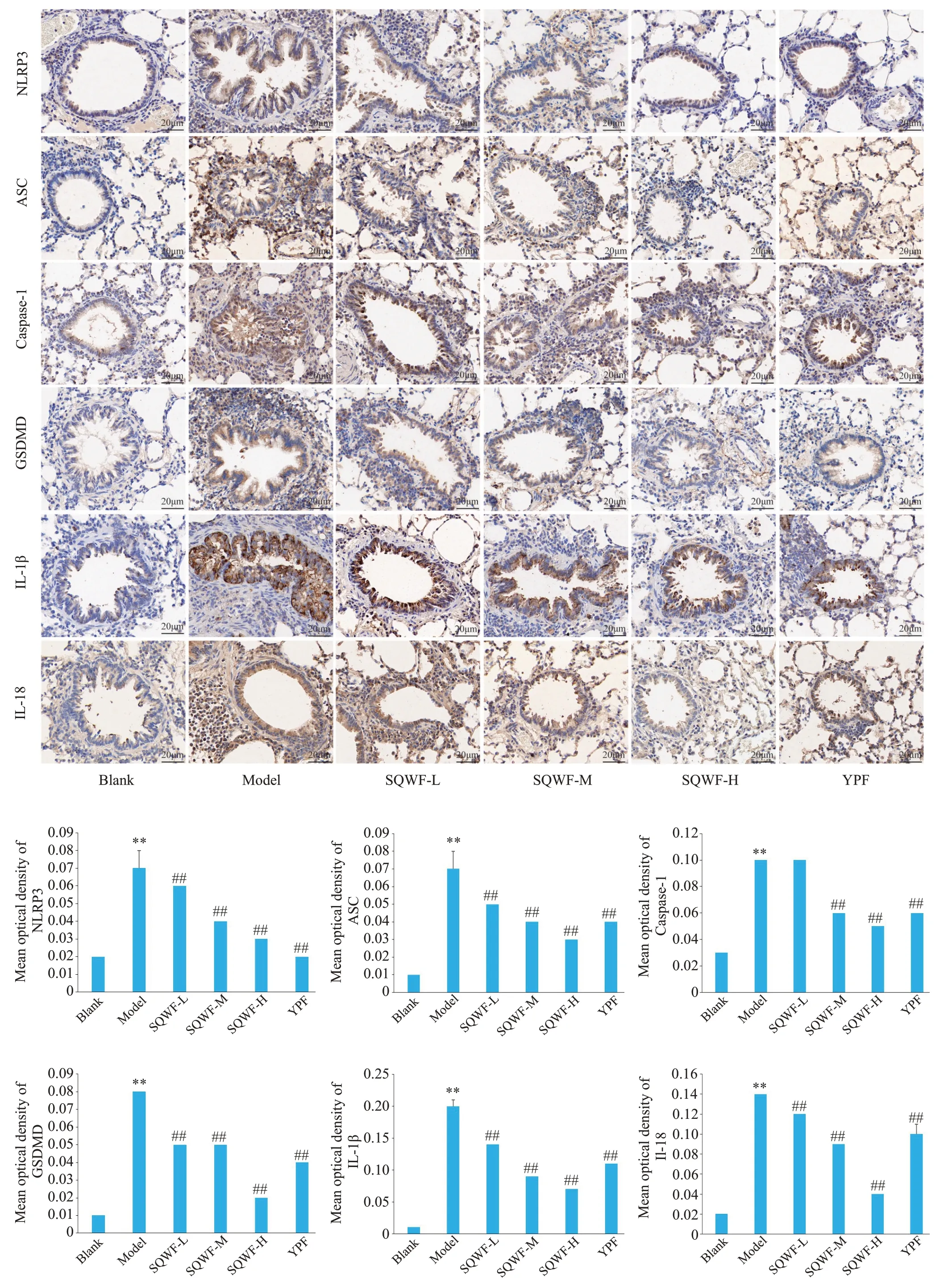
图8 各组大鼠肺组织中焦亡相关蛋白的阳性表达Fig.8 Expression of pyroptosis-related proteins in the lung tissue of the rats in each group,**P<0.01 vs blank group,##P<0.01 vs model group.
3 讨论
肺气亏虚贯穿COPD 病程始终[18-20],发病机制复杂,但与炎症反应息息相关。持续炎症刺激造成肺组织结构退行性病变,诱导不可逆的肺气肿及气道重塑,进而导致肺气虚的产生和发展,最终引起进行性呼吸困难,甚至威胁生命[21]。以NLRP3炎症小体活化介导的细胞焦亡可引发炎症级联反应[22]。
本研究通过吸烟联合脂多糖建立COPD肺气虚证大鼠模型,并给予SQWF进行干预,发现COPD模型大鼠体质量上升缓慢,抓力明显下降,气虚无力症状明显,肺功能减弱,肺气肿改变,炎症小体及焦亡相关因子激活,肺组织及全身炎症反应加重,而经SQWF治疗后,体质量和抓力明显增高,气虚症状缓解,肺功能明显提升,肺气肿有所改善,炎症小体及焦亡相关因子表达下调,炎症反应减轻。提示吸烟联合脂多糖可诱导COPD肺气虚证肺组织焦亡,引发炎症反应,而SQWF对COPD肺组织焦亡有明显的抑制作用,并能有效改善肺气虚炎症状态。
由感觉蛋白NLRP3、适应蛋白ASC 及效应蛋白Caspase-1组成的炎症小体作为细胞焦亡的上游信号[23],被触发后可促使pro-Caspase-1的成熟活化,继而切割GSDMD,并使其募集至细胞膜上形成孔隙,释放IL-1β、IL-18等炎症因子,诱导细胞焦亡[24]。已有文献报道,NLRP3炎症复合体的激活介导的细胞焦亡可能参与COPD的疾病进程[25,26]。Wang等[9]研究证实,TREM-I可以通过激活NLRP3 炎症小体介导的细胞焦亡来促进COPD 小鼠的肺组织损伤和炎症。本研究结果表明,与COPD肺气虚证模型大鼠相比,给予SQWF和玉屏风均能改善大鼠气虚无力症状,显著抑制肺组织中的炎症细胞浸润,改善肺功能,同时明显下调炎症小体及焦亡关键因子的表达、炎症细胞及因子的分泌。然而,各组Caspase-1和IL-18 mRNA的转录水平有一定趋势但无显著性差异,而在蛋白层面差异显著,考虑可能是由于两种检测方法选取的肺组织不同(qPCR右中、IHC右上),或者是在qPCR过程中实验重复次数较少导致结果误差较大。
玉屏风颗粒已被证实治疗COPD肺气虚证安全可靠,疗效确切,临床应用广泛[10,27]。本研究发现SQWF-H组效果优于玉屏风散,疗效最为显著。表明SQWF方对COPD肺气虚证炎性反应的保护作用确切可靠,其作用机制可能与抗NLRP3炎症小体介导的细胞焦亡及其下游炎症因子的释放有关。
COPD属中医“肺胀”、“喘证”、“咳嗽”范畴,本团队提出COPD的中医基本病机在于肺气亏虚,痰瘀互结,肺气虚是发病的始动和根本因素,并研制参芪温肺方,可改善COPD肺气虚证患者的临床症状,减少急性加重次数,提高呼吸功能和运动耐力。方中,人参、黄芪为君药,具有补气固表、益肺升阳之功。现代药理学研究发现黄芪的有效成分黄芪甲苷可以下调肺组织Caspase-1,IL-1β及IL-18等焦亡蛋白的表达,削弱炎症反应以拮抗肺纤维化的发展[28]。人参提取物亦可通过调节NLRP3炎症小体发挥神经保护作用[29]。臣药干姜、白术温肺止咳,化痰燥湿,使参芪补而不滞。干姜抑制Caspase家族激活,起到抗凋亡和拮抗炎症的作用[30]。白术可以通过焦亡途径降低IL-1β、IL-18和TNF-α的产生,减轻炎症反应[31]。陈皮,桔梗佐白术理气化痰、补肺畅中。川陈皮素和桔梗均可抑制NLRP3炎症小体的激活,降低IL-1β、IL-6、TNF-α的分泌,减轻炎症反应[32,33]。炙甘草化痰止咳、益气和中、调和诸药,共同起到温肺化痰平喘、抑制细胞焦亡作用。本研究进一步证明SQWF可以抑制肺组织细胞焦亡,改善COPD肺气虚的病理改变。因此,深入研究SQWF治疗COPD细胞焦亡的分子作用机制意义重大。
综上所述,SQWF可能通过阻断焦亡经典途径的激活,降低肺组织中NLRP3、ASC、Caspase-1、GSDMD的表达,控制IL-1β、IL-18炎症因子的释放,从而削弱肺气虚炎症损伤,发挥治疗COPD的效果。该结果为SQWF临床治疗COPD肺气虚证提供依据,且NLRP3炎症小体可能是中医药治疗COPD的理想靶点。