长链非编码RNA H19 促进血管钙化:基于抑制Bax 抑制因子1/视神经萎缩蛋白1通路
陈韦任,杜 辉,沙 媛,周玉杰,梁 静,陈韵岱,马 茜,吴雪萍,钱 赓
1首都医科大学附属北京安贞医院心内12病房//北京市心肺血管疾病研究所//冠心病精准治疗北京市重点实验室//首都医科大学冠心病临床诊疗与研究中心,北京 100029;2中国人民解放军总医院第二医学中心心血管内科//国家老年疾病临床研究中心,北京 100853;3中国人民解放军总医院第一医学中心心血管内科,北京 100853;4清华大学附属北京清华长庚医院心血管内科,北京102218
血管钙化很常见,根据病变位置分为中膜钙化和内膜钙化[1-3]。血管内膜的钙化是影响动脉粥样硬化、冠心病、糖尿病血管病变和慢性肾脏疾病预后的主要危险因素之一[4-6]。血管钙化的机制目前不是很清楚,可能和血管平滑肌细胞(VSMC)骨型分化、细胞凋亡、钙磷沉积、氧化应激、炎症、线粒体功能和结构的破坏等等有关[7-9]。
长链非编码RNA(lncRNA)是一种长度超过200个核苷酸的功能性RNA分子,它没有编码蛋白质的能力,但它参与各种生物过程,比如染色质修饰、mRNA转录和转录后调控[10-12]。研究表明,lncRNA不仅在正常发育中发挥关键作用,而且还参与血管的病理生理调节[13-15]。LncRNAH19最早被发现参与急性心肌梗死的病理生理过程,过表达lncRNA H19能增加心肌细胞保护作用,进而起到减轻急性心肌梗死的作用[16]。本团队之前的研究发现血管钙化后,lncRNA H19表达明显增高;敲低lncRNA H19后血管钙化减轻,lncRNA H19通过增加VSMC 骨型分化促进血管钙化[17],但是lncRNAH19下游的调节通路并不是很清楚。
Bax抑制因子1(BI-1)是一种能抑制Bax凋亡因子的调节蛋白,最近研究发现它和血管钙化密切相关[18]。视神经萎缩蛋白1(OPA1)是介导线粒体融合的重要蛋白,主要位于线粒体内膜,对线粒体的形态和功能的稳定起到非常重要作用[19,20]。本团队前期研究发现血管钙化抑制BI-1和OPA1蛋白,增加钙磷沉积、细胞骨型分化蛋白Runt相关转录因子2(Runx-2)、骨形态发生蛋白2(BMP-2)表达和细胞凋亡;而激活BI-1/OPA1蛋白通路能抑制钙磷沉积、细胞骨型分化和细胞凋亡,进而减轻血管钙化;基因敲低OPA1蛋白后血管钙化加重[21,22],而lncRNA H19是否通过BI-1/OPA1通路作用于血管钙化并不清楚。因此我们通过该研究明确lncRNA H19是否通过抑制BI-1/OPA1通路促进钙磷沉积、细胞骨型分化和细胞凋亡,进而诱导钙化。
1 材料和方法
1.1 材料
1.1.1 主要试剂 β磷酸甘油、氯化钙(Sigma);胎牛血清(Hyclone);DMEM(Gibco);茜素红S染色试剂盒(上海歌凡生物公司);von Kossa染色试剂盒(北京索莱宝公司);钙测定试剂盒(北京中生北控生物公司);凋亡试剂盒(Roche);RNA提取试剂盒(北京索莱宝公司);BI-1、OPA1、Runx-2、BMP-2、半胱氨酸天冬氨酸蛋白酶3(caspase-3)和β-肌动蛋白(β-actin)(Abcam);靶向小鼠慢病毒载体H19(si-H19)(北京赛业生物公司)。
1.1.2 实验动物 SD 雄性大鼠(4 周龄,体质量80~100 g)、ApoE-/-小鼠(8周龄,体质量20~30 g)、C57BL/6J小鼠(8周龄,体质量20~30 g)购自北京斯贝福生物技术有限公司。本研究通过中国人民解放军总医院实验伦理委员会批准(伦理审查编号:S2021-099-01)。
1.2 动物模型建立及分组
ApoE-/-小鼠空腹后连续5 d腹腔内注射链脲佐菌素(剂量50 mg/kg,频次1次/d),建立糖尿病模型,糖尿病诊断标准为小鼠连续2 d血糖≥250 mg/dL。ApoE-/-糖尿病小鼠进行高脂饲料喂养32周后,取主动脉弓进行试验[23]。实验分成3组(n=6):①对照组:C57BL/6J小鼠普通饲料喂养32周;②钙化组:ApoE-/-糖尿病小鼠进行高脂饲料喂养32周;③钙化+siH19组:ApoE-/-糖尿病小鼠在高脂喂养第20周,连续12周腹腔注射100 μLsi-H19[24]。
1.3 VSMC培养和实验分组
1.3.1 VSMC培养 使用SD大鼠提取原代VSMC,简要步骤如下:大鼠经异氟醚麻醉后迅速取胸主动脉,去除外膜后,将血管剪成1~2 mm2小碎块,然后将小碎块放入装有10%FBS和DMEM液体的培养瓶中培养,等细胞长满培养瓶后,去掉小碎块,在孵箱中继续培养。经传3~5代后,将细胞用于试验[25]。免疫组织化学法检测结果提示VSMC纯度>98%。
1.3.2 VSMC钙化模型建立和实验分组 VSMC钙化模型建立:VSMC 使用钙化培养基(含有10%FBS 的DMEM中加入10 mmol/L β磷酸甘油和7.2 mmol/L氯化钙)培养14 d[26]。实验分为5组:①对照组:含有10%FBS的DMEM培养14 d;②钙化组:钙化培养基培养14 d;③钙化+siH19组:siRNA敲低lncRNA H19表达后,钙化培养基培养14 d;④钙化+siH19+BI-1-/-组:siRNA敲低lncRNA H19和BI-1表达后,钙化培养基培养14 d;⑤钙化+siH19+OPA1-/-组:siRNA敲低lncRNA H19和OPA1表达后,钙化培养基培养14 d。每2 d更换1次培养基。
1.4 细胞转染
按照说明书配制转染液体:将125 pmoL siRNA加入到150 μL OPTI-MEM(Gibco)液体中混匀,另将6.25 μL Lipofectamine 2000(Thermo Fisher公司,美国)加入到150 μL OPTI-MEM中混匀,然后合并混匀上述两种液体,加入到VSMC 中,在培养箱中孵育6~8 h,然后将液体更换为培养基继续培养。转染效果使用qRT-PCR进行验证。
1.5 qRT-PCR实验
收集组织或细胞提取总RNA,分离纯化后使用逆转录试剂盒合成cDNA,然后使用特异性引物进行扩增,在95 ℃下初始变性5 min,然后进行95 ℃30 s、60 ℃30 s和72 ℃30 s,40个循环。使用2-ΔΔCt记录RNA的表达量,每组实验重复3次,以GAPDH来标准化结果。引物序列如下:①lncRNA H19正向:5'-TACAAC CACTGCACTACCTG-3',逆向:5'-TGACTCCTGTGT TCCTGTTA-3';②BI-1 正向:5'-CCGGGCACCTAAA GAAGGTCTATGCCTCGAGGCATAGACCTTCTTT AGGTGCTTTTTG-3',逆 向: 5'-AATTCAAAAAGCA CCTAAAGAAGGTCTATGCCTCGAGGCATAGACC TTCTTTAGGTGC-3';③OPA1 正向:5'-ACAGCAAA TTCAAGAGCACGA-3',逆向:5'-TTGCGCTTCTGT TGGGCAT-3';④GAPDH 正向:5'-ACCACAGTCCAT GCCATCAC-3',逆 向:5'-TCCACCACCCTGTTGCT GTA-3'。
1.6 Western blotting实验
使用细胞裂解液裂解VSMC,然后提取细胞总蛋白,取30 μg 加入10%SDS-PAGE 凝胶中进行蛋白电泳,然后将蛋白电转移至PVDF膜。5%BSA液体37 ℃封闭1 h,然后使用一抗4 ℃孵育过夜,1%洗膜缓冲液冲洗后,辣根过氧化物酶标记的二抗室温下反应2 h。应用化学发光试剂与膜反应后,使用软件对蛋白质的表达进行量化分析。
1.7 茜素红S染色
按照试剂说明书,VSMC使用70%酒精固定1 h,PBS 浸洗细胞3 次,然后使用1 mg/mL 茜素红S 溶液37 ℃染色30 min,PBS浸洗细胞3次,等样品干燥后使用相机拍照。
1.8 钙含量实验
按照钙含量测定试剂盒说明书,去除培养液,使用PBS浸洗细胞,先加入样品裂解液,然后加入检测工作液,室温避光孵育10 min,使用酶标仪测定吸光度,计算钙浓度。另取上清液测定总蛋白含量,以钙浓度除以总蛋白含量得出最后数值。
1.9 TUNEL实验
细胞涂片自然晾干,加入4%多聚甲醛(pH=7.4)室温下固定15 min,滴加100 μL的TdT酶反应液于37 ℃湿温盒中孵育60 min,加入终止液室温孵育15 min,PBS浸洗细胞3次,0.3%H2O2浸洗5 min,滴加100 μL辣根过氧化物酶室温反应30 min,PBS浸洗细胞3次,滴加50 μL DAB底物缓冲液,封片剂封片,显微镜下观察染色情况,凋亡细胞细胞核呈棕色。
1.10 Von Kossa染色
小鼠主动脉弓病理切片经过脱水、脱蜡处理后,使用硝酸盐溶液在光的作用下进行照射染色30 min,蒸馏水清洗干净后,置于硫代硫酸钠溶液进行定影,然后使用中性品红进行复染,蒸馏水清洗干净晾干后,使用显微镜观察钙化情况,采用Image-Pro Plus进行分析,测定结果为钙化面积/斑块面积×100%。
1.11 统计学分析
所有试验结果均重复3次,使用SPSS19.0软件进行数据分析。试验结果以均数±标准差表示,两组间比较采用t检验,多组间比较采用单因素方差分析(ANOVA)。P<0.05时认为差异具有统计学意义。
2 结果
2.1 LncRNAH19抑制BI-1/OPA1蛋白通路
β磷酸甘油和氯化钙诱导VSMC钙化后,qRT-PCR结果提示lncRNA H19表达明显上升,而siRNA能明显减少lncRNA H19表达(P<0.001)。Western blotting结果提示VSMC钙化后BI-1和OPA1表达明显下降,而siRNA敲低lncRNA H19表达后,BI-1和OPA1蛋白表达明显上升;另siRNA敲低BI-1后,OPA1蛋白表达再次下降(P<0.001,图1)。
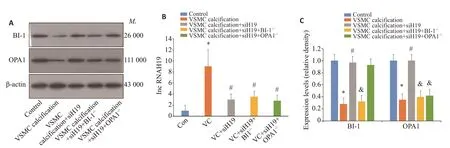
图1 LncRNAH19抑制BI-1/OPA1蛋白通路Fig.1 LncRNA H19 inhibits BI-1 and OPA1 protein expressions in VSMC calcification.A:Western blotting of BI-1 and OPA1.B: Expression level of lncRNA H19.C: Expression levels of BI-1 and OPA1.*P<0.05 vs Control,#P<0.05 vs VSMC calcification,&P<0.05 vs VSMC calcification+siH19.
2.2 LncRNAH19抑制BI-1/OPA1蛋白通路促进VSMC钙沉积
茜素红S染色结果提示VSMC钙化后形成弥漫性红色钙化结节,siRNA敲低lncRNA H19表达后红色钙化结节消失,抑制BI-1或OPA1蛋白均能诱导红色钙化结节再次生成。ELISA结果提示VSMC钙化后细胞钙浓度显著增多,siRNA敲低lncRNA H19表达后细胞钙浓度显著降低,抑制BI-1或OPA1蛋白后钙浓度再次增多(P<0.001,图2)。

图2 LncRNAH19抑制BI-1/OPA1通路促进VSMC钙沉积Fig.2 LncRNA H19 promotes calcium deposition by inhibiting the BI-1/OPA1 pathway.A:Changes in Alizarin red S staining.B:Serum calcium level.*P<0.05 vs Control,#P<0.05 vs VSMC calcification,&P<0.05 vs VSMC calcification+siH19.
2.3 LncRNAH19抑制BI-1/OPA1蛋白通路促进Runx-2和BMP-2表达
Western blotting 结果提示VSMC 钙化后Runx-2和BMP-2表达显著上升,siRNA敲低lncRNA H19表达后Runx-2和BMP-2表达显著下降,抑制BI-1或OPA1蛋白后Runx-2和BMP-2表达再次上升(P<0.001,图3)。

图3 LncRNAH19抑制BI-1/OPA1通路促进Runx-2和BMP-2表达Fig.3 LncRNA H19 increases Runx-2 and BMP-2 protein expression by inhibiting the BI-1/OPA1 pathway.*P<0.05 vs Control,#P<0.05 vs VSMC calcification,&P<0.05 vs VSMC calcification+siH19.
2.4 LncRNA H19抑制BI-1/OPA1蛋白通路促进活化caspase-3表达和细胞凋亡
Western blotting 结果提示VSMC 钙化后活化caspase-3表达显著增多,siRNA敲低lncRNA H19表达后活化caspase-3表达显著降低,抑制BI-1或OPA1蛋白后活化caspase-3表达再次增多(P<0.001,图4)。
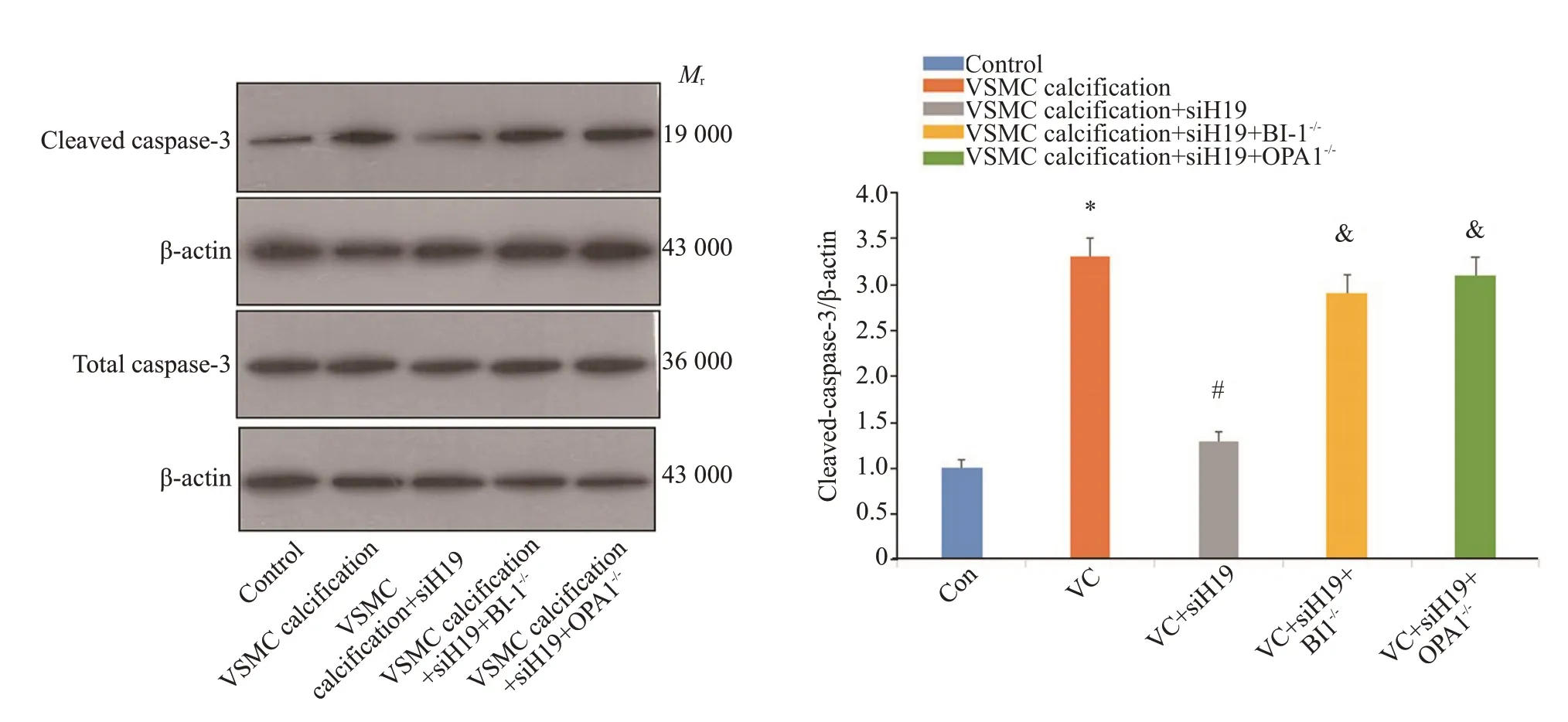
图4 LncRNAH19抑制BI-1/OPA1通路促进活化caspase-3表达Fig.4 LncRNA H19 promotes cleaved caspase-3 protein expression by inhibiting the BI-1/OPA1 pathway.*P<0.05 vs Control,#P<0.05 vs VSMC calcification,&P<0.05 vs VSMC calcification+siH19.
TUNEL染色结果提示VSMC钙化后细胞凋亡率显著上升,siRNA敲低lncRNA H19表达后细胞凋亡率显著下降,抑制BI-1或OPA1蛋白后细胞凋亡率再次上升(P<0.001,图5)。

图5 LncRNAH19抑制BI-1/OPA1通路促进细胞凋亡(红色箭头所指为凋亡细胞)Fig.5 LncRNA H19 increases cell apoptosis rate by inhibiting the BI-1/OPA1 pathway.*P<0.05 vs Control,#P<0.05 vs VSMC calcification,&P<0.05 vs VSMC calcification+siH19.
2.5 LncRNA H19抑制BI-1/OPA1蛋白通路诱导小鼠血管钙化
动物实验研究标明血管钙化后,lncRNA H19表达增加,BI-1和OPA1 mRNA表达明显减少,钙化面积呈现黑色(von Kossa染色);而敲低lncRNA H19表达后,BI-1 和OPA1 mRNA 表达明显增加,钙化面积减少(P<0.001,图6)。

图6 LncRNAH19抑制BI-1/OPA1通路诱导小鼠血管钙化(红色箭头所指为钙化结节)Fig.6 LncRNA H19 promotes vascular calcification by inhibiting BI-1 and OPA1 protein in mice.A:Von Kossa staining.B:Ratio of calcification area.C:mRNAexpression levels of lncRNAH19,BI-1 and OPA1.*P<0.05 vs Control,#P<0.05 vs vascular calcification.
3 讨论
最近研究表明,lncRNA H19 和血管钙化密切相关[27-30]。研究提示lncRNA H19通过调节丝裂原活化蛋白激酶和细胞外信号调节激酶转导通路增加Runx-2蛋白和抑制平滑肌22α和α平滑肌肌动蛋白表达,进而促进血管钙化[31]。有学者同样发现血管钙化诱导lncRNA H19表达增加,而敲低lncRNA H19后,Runx-2蛋白表达下降,VSMC骨型分化减少,血管钙化减轻[32]。本研究进一步证实lncRNA H19 促进细胞骨型分化蛋白Runx-2和BMP-2表达进而诱导血管钙化。另外我们发现lncRNA H19 增加钙沉积和细胞凋亡,促进血管钙化;敲低lncRNA H19表达后钙沉积和细胞凋亡减少,钙化减轻。该研究结果进一步丰富了lncRNA H19调节血管钙化的可能机制。
研究发现lncRNA H19能加快巨噬细胞脂质沉积,进而促进动脉粥样硬化斑块进展,基因敲除lncRNA H19能延缓斑块进展[33]。下调lncRNA H19能通过调节血管平滑肌细胞凋亡减轻动脉粥样硬化斑块损害[34]。研究证实BI-1和冠状动脉粥样硬化密切相关,过表达BI-1能维持线粒体内环境,减轻心肌缺血再灌注损伤,起到保护心脏作用[35]。另外BI-1还能抑制线粒体分裂,保护微循环,减轻再灌注损伤[36]。Yang 等[37]提出lncRNA Punisher能作用于OPA1蛋白调节线粒体内环境,进而影响动脉粥样硬化斑块VSMC凋亡:糖尿病小鼠肾组织lncRNA H19表达增加、线粒体融合蛋白2表达下降,提示lncRNA H19可能通过调节线粒体融合蛋白2影响糖尿病小鼠心肾功能的改变[38]。
而lncRNA H19 和BI-1、OPA1 的研究目前尚没有。本研究发现lncRNA H19能调节BI-1/OPA1蛋白通路:血管钙化后lncRNA H19表达增加,BI-1和OPA1表达明显下降,而siRNA敲低lncRNAH19表达后,BI-1和OPA1 蛋白表达明显上升;lncRNA H19 抑制BI-1/OPA1蛋白通路加重钙沉积、细胞骨型分化和细胞凋亡促进血管钙化:siRNA 敲低lncRNA H19 表达后钙沉积、细胞骨型分化和细胞凋亡减少,血管钙化减轻;而抑制BI-1或OPA1蛋白后钙沉积、细胞骨型分化和细胞凋亡增加,血管钙化加重。
综上所述,本研究证实lncRNAH19通过抑制BI-1/OPA1通路促进血管钙化,其机制可能和促进钙沉积、细胞骨型分化和细胞凋亡增加有关,该研究结果将为血管钙化的诊断和治疗提供新的观点和理论依据。本研究局限性在于缺乏深入生物信息学方面的研究,有待于进一步研究。