高表达CAMSAP2通过上调TGF-β信号促进胃癌细胞的侵袭和转移
左芦根,王 炼,杨 子,李骏杰,王文锋,李 静,王月月,宋 雪,张小凤,耿志军
蚌埠医学院第一附属医院1胃肠外科,3检验科,4中心实验室,安徽 蚌埠 233004;2蚌埠医学院临床医学院,安徽 蚌埠 233030;5组织移植安徽省重点实验室,安徽 蚌埠 233030;6炎症相关性疾病基础与转化研究安徽省重点实验室,安徽 蚌埠233030
胃癌在我国的发病率和死亡率均居于恶性肿瘤的第3位[1,2]。即使在肿瘤内、外科和放疗等综合治疗技术不断提升的情况下[3-5],胃癌的5年生存率仍未得到显著的提高[6,7],肿瘤复发和转移是引发该困境的主要原因之一[8,9]。深入探索胃癌侵袭和转移的分子机制,有望为临床诊疗和疾病预后提供新的靶标[10-12]。钙调蛋白调控的光谱相关蛋白2(CAMSAP2)是钙调蛋白家族成员之一,具有多种生物学功能,可通过调控非中心体微管组装和微管负极动力学来促进细胞的增殖和迁移[13,14]。新近的研究显示:CAMSAP2在肝癌中表达显著升高且与临床转移指征和不良预后有关[15];CAMSAP2在结直肠癌中表达显著上调并通过调控肿瘤细胞侵袭和转移等恶性行为影响患者预后[16]。近年来,CAMSAP2对肿瘤发生和转移的调控机理引起学者的广泛关注,但CAMSAP2在胃癌中的表达及其对预后的影响尚未见报道。本研究结合TCGA等公共数据库和本机构的临床病例进行分析,以明确CAMSAP2在胃癌中的表达和对预后的影响,通过KEGG富集分析预测CAMSAP2的可能作用途径和机制,并进一步采用细胞学实验和动物实验进行验证,以期为胃癌的诊疗提供参考。
1 资料和方法
1.1 研究对象
回顾性分析2013年10月~2017年10月期间在我院接受手术治疗的胃癌患者的临床资料。纳入标准:明确诊断为原发性胃癌;成功实施胃癌根治术(R0 切除)。排除标准:合并其他组织起源的恶性肿瘤;患者术后死于胃癌以外的其他因素;患者临床资料缺失。最终纳入符合标准的胃癌患者106例。此研究获得我院伦理委员会审核批准(伦科批字[2022]第183号)。
1.2 患者资料来源和采集
采集患者以下资料,包括:(1)临床资料:通过电子病历系统获取患者性别、年龄、病理诊断、病理分期、术前外周血癌胚抗原(CEA)和糖类抗原19-9(CA19-9)等数据;(2)生物标本:从我院病理科调取手术标本蜡块,包括癌组织和对应的癌旁组织;(3)随访数据:通过电话随访获得患者术后生存资料,包括:是否死亡,以及死亡的时间和原因,随访时间截止至2022年10月。
1.3 免疫组化检测CAMSAP2的表达
将手术标本蜡块制备成4 μm厚度的切片,再进行脱蜡和抗原修复、H2O2阻断内源性过氧化物酶、血清封闭、一抗(CAMSAP2;1∶200;Proteintech)与二抗孵育、DAB显色、苏木素复染、脱水和封片。切片经扫描后使用ImageJ软件进行目标蛋白的相对积分光密度(IOD)值计算。二抗为过氧化物酶标山羊抗兔/鼠IgG聚合物,中杉金桥。
1.4 生物信息学分析
通过Timer、GEPIA和HPA数据库分析CAMSAP2在泛癌和胃癌组织中的表达情况,UALCAN 和KMplotter数据库分析CAMSAP2对胃癌进展和预后的影响。搜索cBioPortal数据库获得CAMSAP2和胃癌的相关基因,在DAVID在线网站中进行富集分析。
1.5 体外分析CAMSAP2调控胃癌细胞的EMT和迁移侵袭及其可能的机制
1.5.1 慢病毒感染调控MGC803细胞CAMSAP2的表达 将MGC803细胞(购自国家生物医学实验细胞资源库)分为3组,包括:CAMSAP2上调组(LV-CAMSAP2)、CAMSAP2下调组(si-CAMSAP2)和空白对照组。采用慢病毒转染的方式上调或下调CAMSAP2的表达,简述为:采用RPMI 1640培养基(含10%胎牛血清)培养MGC803细胞,制备成密度为5×104/mL的细胞悬液,铺于六孔板中,分别滴加HitransG A感染液、过表达、特异性干扰(siRNA:GAGATGAGAAAGACGTTCA TTGT),37 ℃培养8 h后更换完全培养基,感染后72 h,含Puromycin(1 μg/mL)的培养液筛选细胞,获得稳定表达的细胞株,最后采用免疫印迹实验验证转染效果。
1.5.2 免疫印迹检测CAMSAP2 表达以及胃癌细胞EMT相关蛋白 采用RIPA裂解液(含有蛋白酶和磷酸酶抑制剂)裂解MGC803细胞并提蛋白,经BCA法进行蛋白定量、变性、SDS-PAGE凝胶电泳分离蛋白样本、转膜、脱脂奶粉封闭、4 ℃孵育一抗过夜、室温孵育二抗、洗膜后用ECL化学发光液显影后采集图片,使用ImageJ软件进行灰度值分析。一抗信息如下:CAMSAP2和TGF-β1(Proteintech);Vimentin、N-cadherin和E-cadherin(CST);Smad2/3、p-Smad2/3 和β-actin(Abcam);所有抗体稀释比均为1∶1000。二抗为辣根酶标记山羊抗兔/鼠IgG,中杉金桥,1:3000。
1.5.3 划痕和Transwell实验检测胃癌细胞的迁移和侵袭 划痕实验:将各组细胞接种在六孔板中,待细胞汇合到90%左右,用无菌的200 μL吸头垂直细胞板划直线,PBS洗去飘浮细胞,将细胞培养基更换为无血清培养基,分别于0和24 h用显微镜观察并采集照片。侵袭实验:Transwell小室中平铺50 μL基质胶(美国康宁),于培养箱中孵育3 h。用无血清培养基重悬各组MGC803细胞,按1×104/孔滴加到上室中,再将800 μL完全培养基加入下室,于培养箱中孵育36 h。移除小室内培养基,湿棉签擦去膜内表面残余细胞,再经4%多聚甲醛固定、0.2%结晶紫染色后,置于显微镜下观察并拍照。迁移实验:除小室中不加基质胶外,其他步骤同侵袭实验。
1.6 体内分析CAMSAP2调控胃癌EMT进程及其可能的机制
1.6.1 构建胃原位种植瘤模型 选用BALB/c-Nude裸鼠(江苏集萃药康生物科技股份有限公司;6~7周龄、雄性、体质量为20~22 g)构建胃原位种植瘤模型。在建模过程中小鼠分别接受不同CAMSAP2 表达量的MGC803细胞,并据此将小鼠分为CAMSAP2上调组(LV-CAMSAP2组)、CAMSAP2下调组(si-CAMSAP2组)和对照组(Control组),每组8只。建模操作简述为:小鼠麻醉后做左侧正中旁切口以充分暴露胃,用微量注射器抽取50 μL MGC803细胞悬液(1×108/mL),缓慢注入胃大弯侧的浆膜层,最后依次缝合小鼠的腹膜和皮肤,小鼠于清洁环境下继续饲养12周,麻醉后以颈椎脱位法处死,通过观察和病理学检测评估小鼠移植瘤的局部生长和转移情况,并取检用于后续检测分析。
1.6.2 肿瘤体积和转移评估 测量胃原位肿瘤直径并计算其体积(公式:体积=长度×宽度×深度/2),并采用宏观播散评分评估局部肿瘤浸润以及远处转移情况,具体评分标准如下[17]:(1)出现以下任一情况记1分(可累计):局部浸润至毗邻的肝脏、胰腺、肠系膜、肠袢和腹壁;(2)出现以下任一情况额外加1分(可累计):大量局部浸润超过肝脏周长的一半、多发性转移性结节(实质器官>1个;膈肌、肠系膜、腹膜后>10个)、转移性结节>50 mm3、腹水形成(体积≤5 mL)、黄疸、肠梗阻和恶病质;(3)腹水形成体积>5 mL,记2分。
1.6.3 免疫印迹检测胃癌EMT 进程及其可能的分子机制 将胃原位肿瘤组织剪碎,使用RIPA裂解液裂解并提蛋白。其余步骤和抗体同1.5.2。
1.7 统计学方法
数据分析采用SPSS 26.0软件。计数资料的组间比较用χ2检验。两组间计量资料的比较用t检验。三组间比较用单因素方差分析。相关性分析使用Spearman检验。生存曲线(K-M)用于分析术后生存率,Cox回归模型用于预测影响胃癌患者术后5年生存率的危险因素。P<0.05为差异具有统计学意义。
2 结果
2.1 CAMSAP2在胃癌组织中表达升高
分析Timer、GEPIA和HPA数据库发现CAMSAP2在胃癌等多种癌症中的表达升高(P<0.05,图1A~C)。免疫组化技术检测本机构的胃癌手术标本发现:CAMSAP2在胃癌组织中的表达水平显著高于癌旁组织(P<0.05,图1D、E)。
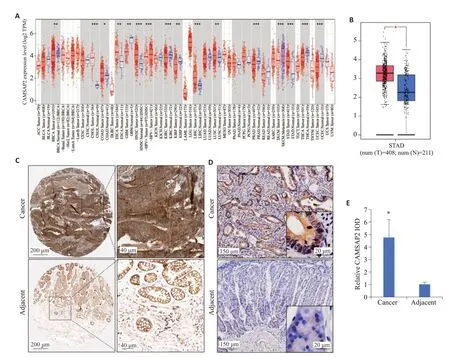
图1 CAMSAP2在胃癌组织中表达升高Fig.1 Expression of CAMSAP2 is elevated in gastric cancer tissue.A: Pan-cancer expression analysis.B,C: Expression of CAMSAP2 in gastric cancer and adjacent tissues.D,E: Immunohistochemical staining for CAMSAP2 in gastric cancer and adjacent tissues.*P<0.05 vs adjacent tissue.
2.2 CAMSAP2的表达量和胃癌恶性进展参数正相关
UALCAN 数据库显示CAMSAP2 的表达量与胃癌的癌症分期和肿瘤分级显著正相关(P<0.05,图2A、B)。以免疫组化所测得CAMSAP2相对表达量的中位数(4.93)为界,将本机构106例患者分为CAMSAP2高表达组(n=53)和低表达组(n=53)。如表1 所示,CAMSAP2高表达组患者中CEA≥5 μg/L、CA19-9≥37 kU/L、T3-T4 stage及N2-N3 stage的患者比例显著高于CAMSAP2 低表达组(P<0.05)。此外,Spearman相关分析表明CAMSAP2 的表达与患者外周血CEA 和CA19-9的水平正相关(P<0.001,图2C、D)。
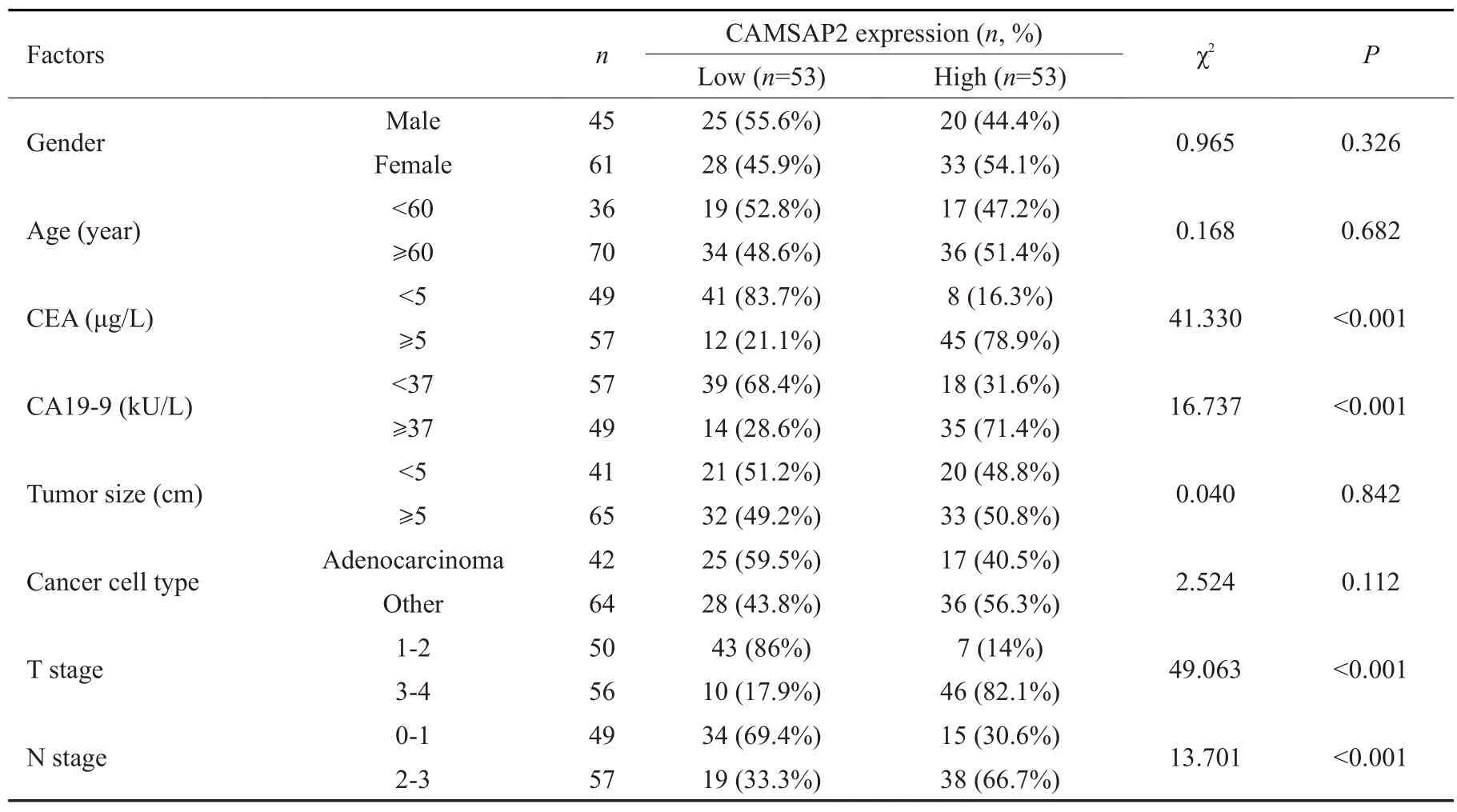
表1 CAMSAP2的表达量和胃癌恶性进展参数正相关Tab.1 CAMSAP2 expression level is positively correlated with progression of gastric cancer

图2 CAMSAP2的表达量和胃癌恶性进展参数的相关性Fig.2 Correlation between CAMSAP2 expression level and progression of gastric cancer.A,B:CAMSAP2 expression is correlated with stage and grade of gastric cancer.C,D: CAMSAP2 expression level is correlated with peripheral blood CEA and CA19-9 levels.*P<0.05 vs Normal.
2.3 CAMSAP2高表达影响术后5年生存率
KM-plotter数据库表明:胃癌组织CAMSAP2高表达的患者生存期显著缩短(P<0.05,图3A)。通过K-M曲线对本研究纳入患者的生存数据进行分析发现,CAMSAP2高表达的胃癌患者术后5年生存率显著低于CAMSAP2低表达组的患者(P<0.001,图3B)。
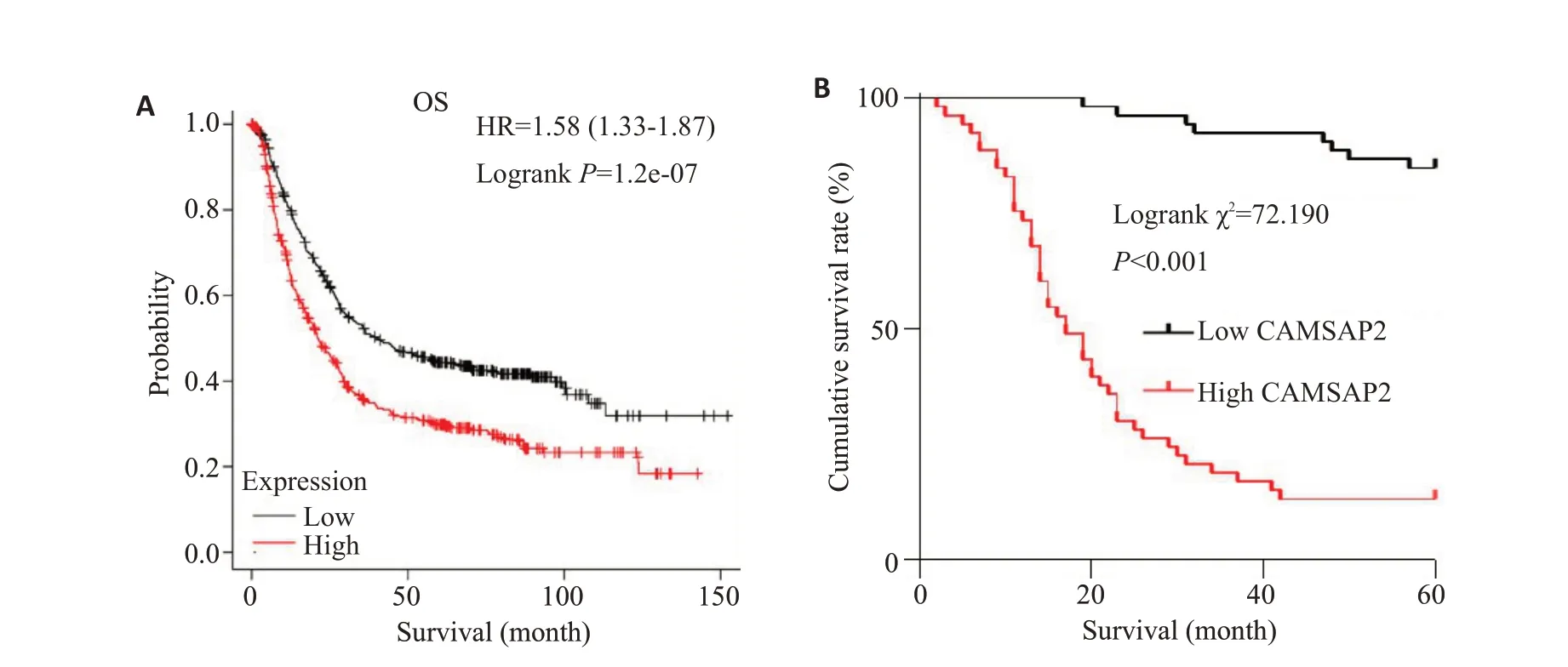
图3 CAMSAP2高表达影响术后5年生存率Fig.3 A high CAMSAP2 expression is associated with a reduced 5-year survival rate of gastric cancer patients after radical gastrectomy.A: CAMSAP2 expression level affects overall survival of gastric cancer patients.B: Kaplan-Meier survival analysis for 5-year survival rate of the patients after radical gastrectomy.
2.4 CAMSAP2高表达是影响胃癌患者术后5年生存率的独立危险因素
如表2所示,经Cox单因素和多因素生存分析发现以下因素是影响胃癌根治术后5 年生存率的独立危险因素,包括:CAMSAP2 高表达、CEA≥5 μg/L、CA19-9≥37 kU/L、T3-T4 stage及N2-N3 stage。
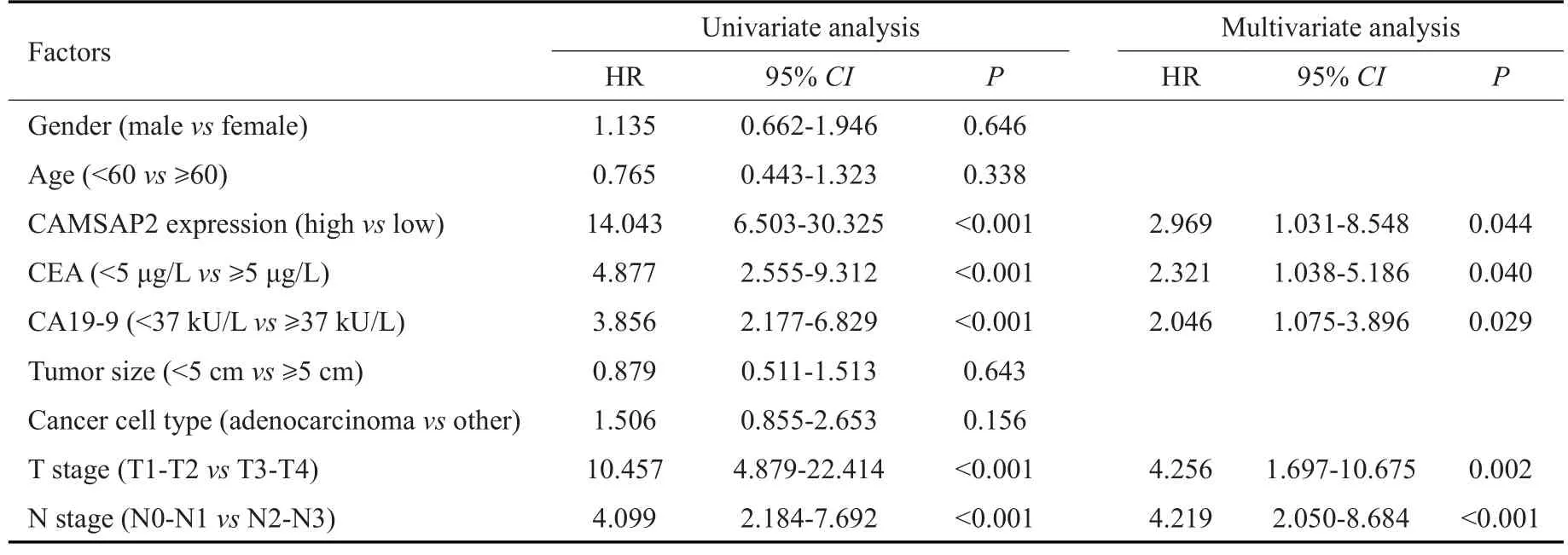
表2 影响胃癌根治术后5年生存率的危险因素分析Tab.2 Analysis of risk factors affecting 5-year survival rate of gastric cancer patients after radical gastrectomy
2.5 基因富集分析预测CAMSAP2 和EMT 过程及TGF-β信号有关
KEGG富集分析结果显示CAMSAP2的生物学功能可能和EMT及TGF-β信号有关(图4)。

图4 KEGG富集分析结果Fig.4 Results of KEGG enrichment analysis.
2.6 CAMSAP2体外促进胃癌细胞的EMT、迁移和侵袭
利用慢病毒转染技术调控胃癌细胞系中CAMSAP2的表达,分为上调、下调和对照组(P<0.05,图5A、B)。免疫印迹结果显示,上调CAMSAP2促进Vimentin和N-cadherin的表达并抑制E-cadherin的表达,下调则相反(P<0.05,图5C、D)。划痕和Transwell实验表明,CAMSAP2的上调促进MGC803细胞的迁移和侵袭,CAMSAP2的下调则反之(P<0.05,图5E~G)。
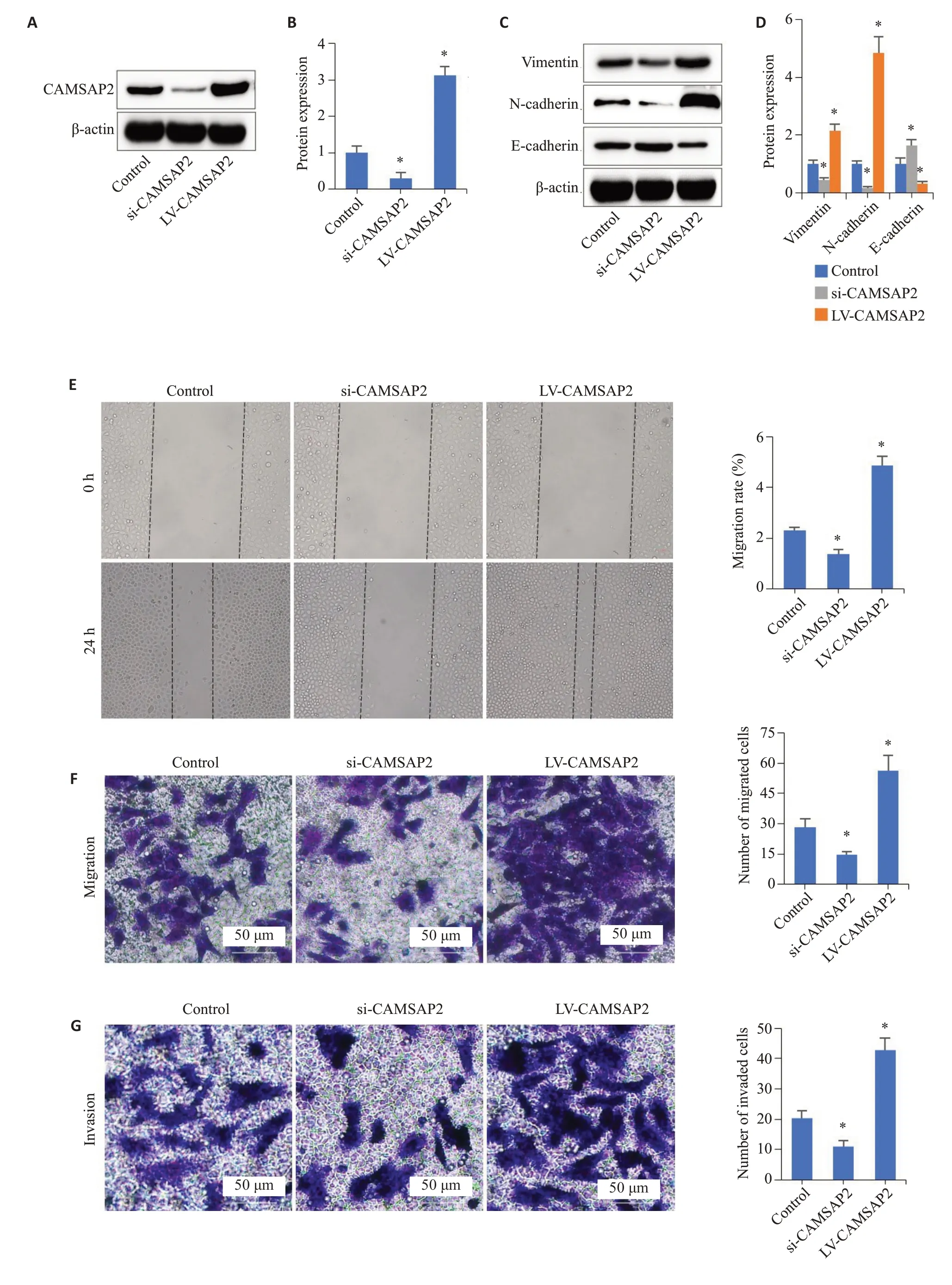
图5 CAMSAP2促进胃癌细胞的EMT、迁移和侵袭Fig.5 CAMSAP2 overexpression promotes EMT,migration and invasion of gastric cancer cells.A,B: Lentiviral transfection effect.C,D:Expression of EMT markers in MGC803 cells.E:Wound-healing assay.F,G:Cell migration and invasion of MGC803 cells.Control:normal control;si:siRNA;LV:overexpression.*P<0.05 vs Control.
2.7 CAMSAP2在体内促进胃癌的进展
各组小鼠胃原位肿瘤和肿瘤腹腔脏器转移情况如图6A,CAMSAP2上调组原位肿瘤体积明显高于对照组,而下调组则明显低于对照组(P<0.05,图6B)。同时,CAMSAP2上调组裸鼠肿瘤的宏观播散评分明显高于对照组,而下调组则相反(P<0.05,图6C)。此外,免疫印迹结果显示:下调CAMSAP2可降低Vimentin和N-cadherin的表达并增加E-cadherin的表达,上调则结果相反(P<0.05,图6D、E)。
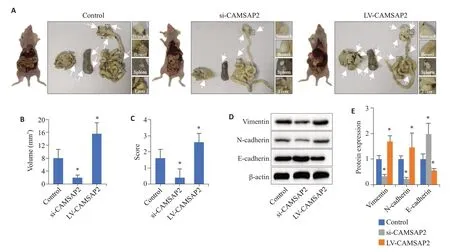
图6 CAMSAP2在体内促进胃癌的进展Fig.6 CAMSAP2 overexpression promotes gastric cancer progression in nude mice.A: Representative pictures of orthotopic transplantation models.B: Comparison of tumor volume among the groups.C: Dissemination score.D,E:Expression of EMT markers in the tumor tissue.Control:normal control;si:siRNA;LV:overexpression.*P<0.05 vs Control.
2.8 CAMSAP2可能通过上调TGF-β信号促进胃癌细胞的EMT进程
体外实验数据显示,CAMSAP2上调组胃癌细胞中TGF-β和p-Smad2/3 的水平显著高于对照组,而CAMSAP2下调组则显著低于对照组(P<0.05,图7A、B)。同时,体内研究数据与体外研究数据一致(P<0.05,图7C、D)。
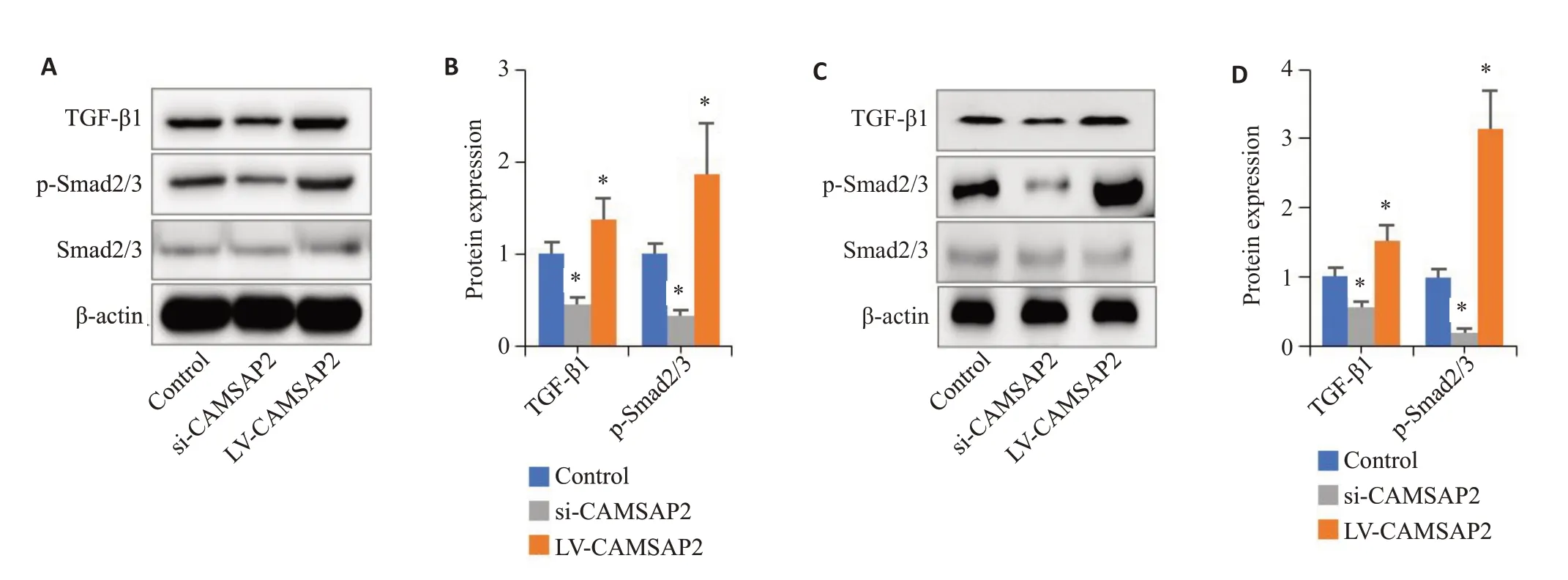
图7 CAMSAP2可能通过TGF-β信号促进胃癌EMT进程Fig.7 CAMSAP2 overexpression promotes gastric cancer EMT possibly via TGF-β signaling.A,B:Expression of TGF-β1,p-Smad2/3 and Smad2/3 in MGC803 cells.C,D: Expression of TGF-β1,p-Smad2/3 and Smad2/3 in the tumor tissue.Control:normal control;si:siRNA;LV:overexpression.*P<0.05 vs Control.
3 讨论
本研究中,我们通过生物信息学和本机构临床病例的联合分析发现:CAMSAP2在胃癌组织中高表达,且与疾病恶性进展和患者预后不良相关;在此基础上,开展细胞和动物实验进一步验证,CAMSAP2在体内外环境下均可上调TGF-β信号,从而促进胃癌细胞的EMT进程以及侵袭迁移等恶性行为。
既往报道显示,CAMSAP2在肝癌和结直肠癌中的表达均显著增高,但在胃癌中未见相关报道[15,16]。我们通过对公共肿瘤数据库和本机构的临床病理标本进行分析,发现CAMSAP2在胃癌组织中的表达水平显著高于癌旁组织;通过分析CAMSAP2表达与胃癌临床病理参数间的关系,发现CAMSAP2高表达和外周血CEA和CA19-9水平,以及T stage和N stage呈正相关。进一步采用Cox 回归模型联合TCGA 数据库分析发现CAMSAP2高表达是影响胃癌患者术后5年生存率的独立危险因素。以上数据显示CAMSAP2在胃癌中高表达且影响肿瘤恶性进展和预后,但其作用途径和机制并不明确。
新近的研究发现CAMSAP2是一种微管负极靶向蛋白,其可通过促进肿瘤细胞的高效运动,参与肿瘤细胞迁移和侵袭等恶性行为的调控[18-20]。我们采用KEGG富集分析发现CAMSAP2在胃癌中的作用可能和调控EMT进程有关。EMT是上皮细胞在形态学上趋向间质细胞表型[21,22],细胞间粘附性减弱并获得迁移侵袭能力的过程[23,24],可参与肿瘤细胞的转移[25,26]。然而,CAMSAP2是否参与了胃癌细胞EMT进程尚不明确。我们首先采用慢病毒感染调控CAMSAP2在胃癌细胞系中的表达,免疫印迹检测发现上调CAMSAP2可促进胃癌细胞的EMT进程,同时划痕和Transwell实验结果证实上调CAMSAP2可促进胃癌细胞迁移和侵袭。此外,我们进一步构建裸鼠原位癌移植模型进行在体验证,结果发现上调CAMSAP2对胃癌细胞EMT进程和肿瘤转移均有促进作用。以上结果表明CAMSAP2可促进胃癌细胞EMT进程以及迁移、侵袭等恶性行为,但具体的机制尚不清楚。
既往研究表明,TGF-β是调控恶性肿瘤EMT的关键信号[27,28],其中TGF-β/Smad信号的激活在启动EMT进程中发挥重要作用[29-31],而我们的生信富集分析发现CAMSAP2的作用可能和TGF-β信号有关。为进一步验证CAMSAP2调控胃癌细胞的分子机制,我们采用免疫印迹技术于体内和体外研究中发现,上调CAMSAP2可促进TGF-β/Smad2/3信号传导,而下调CAMSAP2可抑制TGF-β/Smad2/3 信号传导。以上结果提示CAMSAP2对胃癌细胞EMT进程的促进作用可能和TGF-β/Smad信号的激活有关。
我们研究具有如下潜在临床意义:首先,我们通过对HPA和KM-plotter等数据库以及本机构收治的胃癌患者数据进行了深入分析,证实CAMSAP2在胃癌组织中高表达且和疾病进展及患者预后相关,这一结果有望为胃癌的临床进展评估以及预后判断提供新的参考指标;此外,我们通过体内和体外研究发现CAMSAP2通过上调TGF-β/Smad信号,从而参与了胃癌细胞的EMT过程,这些分子信号领域的研究有望对开发胃癌的治疗方案革新思路。
我们研究仍存在以下不足:本研究的纳入患者数量有限,所得临床研究结果有待更大样本量的研究加以验正;此外,我们发现CAMSAP2可能通过激活TGF-β信号促进胃癌EMT进程,但也可能忽略了CAMSAP2其他调控机制和途径。
综上,本研究发现CAMSAP2在胃癌中高表达且和肿瘤进展、预后不良相关,其可能通过上调TGF-β信号参与了胃癌EMT和侵袭迁移的调控。