长链非编码RNA ABHD11-AS1 促进胃癌细胞糖酵解并加速肿瘤恶性进展
冯 雯,赖跃兴,王静,徐萍
上海交通大学医学院附属松江医院(筹)消化内科,上海 松江201600
胃癌是消化道最常见的恶性肿瘤之一,全世界每年有超过100 万人被诊断出胃癌[1],总体5 年生存率约36%,晚期胃癌5年生存率则不足10%[2],所以,迫切需要了解胃癌增殖和转移的潜在机制,为胃癌靶向治疗提供理论依据,以此延长胃癌患者的生存时间。
能量代谢重新编程是癌症增殖与转移的关键标志之一[3]。为满足肿瘤的快速增殖对营养物质的需求增加,在有氧条件下,快速增长的癌细胞并没有利用线粒体中的三羧酸循环去“燃烧”葡萄糖来产生ATP,反而像酵母一样通过发酵葡萄糖,因而消耗葡萄糖的效率更高,ATP 形成更快,从而为快速分裂的癌细胞提供生物能量需求。此外,异常增多的乳酸(糖酵解的终点)可降低肿瘤微环境的pH 值,有助于降解肿瘤细胞间质,促进肿瘤细胞的迁移、侵袭[4,5]。因此,肿瘤细胞的有氧糖酵解[6],为肿瘤细胞提供了生长和生存优势,是肿瘤细胞最具代表的代谢表型[7]。多项研究证实,胃癌的发生和发展与活跃的有氧糖酵解有关。研究表明胃癌组织中葡萄糖的含量降低,而乳酸和糖酵解中间体的含量升高[8];使用F-氟脱氧葡萄糖(FDG)-PET 测量胃癌患者的葡萄糖摄取量,大多数胃癌患者的葡萄糖摄取量明显增加[9],所以,胃癌细胞表现出明显的有氧糖酵解特征。因此,鉴定与有氧糖酵解相关的新型分子标记物可以通过靶向新陈代谢通路阻止胃癌发展。
长链非编码RNA(lncRNA)是近年来新发现的长度超过200 nt的功能性RNA分子,它在肿瘤的发生发展中扮演重要作用[10]。ABHD11-AS1是近年来新发现的lncRNA,其促进了甲状腺肿瘤[11]、卵巢癌[12]等肿瘤的恶性进展。已有研究表明ABHD11-AS1在胃癌患者组织[13]及胃液[14]中明显上调,并且与胃癌的存活率相关,可用于预示癌症的预后。目前仅有文献报道它可以与miR-361-3p协同调节PDPK1促进胃癌细胞细胞增殖,抑制凋亡[15]。关于ABHD11-AS1影响胃癌发生发展的分子机制的研究内容较少,其是否通过影响肿瘤细胞糖酵解从而调控了胃癌的增殖与转移,仍然未知,值得进一步探究。本研究拟通过构建ABHD11-AS1过表达质粒感染胃癌细胞株,探讨上调ABHD11-AS1对胃癌细胞糖酵解及增殖、转移的影响及潜在的分子机制。
1 材料和方法
1.1 材料
人正常胃GES-1 细胞,人胃癌MGC803 细胞、MKN45 细胞、SGC7901 细胞由本实验室保存。pcDNA-Vector、pcDNA-ABHD11-AS1 由捷诺生物公司构建合成。胎牛血清(FBS,Gibco);DMEM培养基(HyClone);转染试剂Lipo-fectamine 2000 及Trizol RNA 提取试剂(Invitrogen);逆转录试剂盒(TAKARA);鼠抗人β-tubulin抗体(Bioworld);CCK-8溶液(南京诺唯赞生物科技有限公司);Transwell小室(Corning);dsDNAoligos(金斯瑞生物科技公司)。
1.2 方法
1.2.1 荧光定量PCR检测3种胃癌细胞ABHD11-AS1 mRNA水平 利用Trizol试剂抽提胃癌细胞总RNA,纯化后用紫外分光光度仪检测RNA浓度。用逆转录试剂盒将RNA逆转录成cDNA。利用SYBR Green将反应体系置于荧光定量PCR系统进行定量PCR分析,5s-RNA作为内参。本实验引物序列见表1。

表1 qRT-PCR检测差异表达基因的引物序列Tab.1 Primer sequences for qRT-PCR for differentially expressed genes
1.2.2 细胞转染 分别将对数生长期的MGC803细胞、MKN45细胞以4×105/孔铺于6孔板上,24 h内转染质粒pcDNA-Vector和pcDNA-ABHD11-AS1,转染前1 h更换无血清培养基,每孔转质粒2.5 μg,质粒与Lipofectamine2000质量体积比为1∶2.5,溶于DMEM中,转染6 h后更换含有血清的完全培养基。
1.2.3 荧光定量PCR方法检测ABHD11-AS1过表达效率将转染48 h后的细胞用Trizol提取细胞总RNA并逆转录成cDNA,Real-time PCR检测细胞内ABHD11-AS1的mRNA水平。
1.2.4 CCK-8法检测细胞增殖能力 将转染12 h后的胃癌细胞用0.25%胰蛋白酶消化后,以2.5×103/孔的细胞密度接种于96孔板中,分两组,每组设5个复孔。同时设空白对照组(不加细胞),分别于1、2、3、4、5 d移去培养基,每孔加入含10%CCK-8无血清培养基,避光孵育2 h 后在酶联免疫检测仪A490nm处测量各孔的吸光度值。重复3次取平均值,绘制生长曲线。
1.2.5 克隆形成实验检测克隆形成能力 将转染24 h后的胃癌细胞,消化后按2.5×103/孔的细胞密度接种于6孔板中,每组设3个平行样品,静置培养10 d,当孔板中出现肉眼可见的克隆时终止培养。采用4%多聚甲醛溶液固定细胞,30 min后弃去溶液,PBS漂洗3次,结晶紫染色。
1.2.6 Transwell实验检测细胞迁移能力 细胞转染48 h后,消化细胞后用无血清DMEM重悬,细胞计数,将4×105细胞种入不含基质胶的侵袭小室(Tran-swell)上层(100 μL/孔),下层加入含有10%FBS的DMEM溶液,24 h后用4%多聚甲醛溶液固定,结晶紫染色并于显微镜下观察、拍照。
1.2.7 Transwell实验检测细胞侵袭能力 在细胞超净台中进行,首先用DMEM湿润24孔板,然后在无菌EP管中加100 μL不含血清的DMEM,再加入4 μL BD胶,混合轻弹后置于冰上,取102 μL混合液滴在Transwell小室中央,注意不要有气泡,等BD胶完全凝固后使用。余操作步骤同上。
1.2.8 葡萄糖摄取、乳酸生成实验检测细胞糖酵解水平胃癌细胞进行过表达及转染后,将细胞接种到6孔板中,6 h后,将培养基替换为完全培养基,并孵育24 h。按照葡萄糖含量检测表配制溶液,随后根据试剂盒说明书,取2 μL培养基上清,加入葡萄糖试剂盒工作液中,37 ℃水浴10 min,利用酶标仪检测吸光度值(A505nm),根据说明书计算出葡萄糖摄取情况。利用乳酸检测试剂盒检测乳酸含量,步骤同前,酶标仪检测吸光度值(A530nm),根据说明书计算出乳酸含量。
1.2.9 Western blotting检测c-Myc蛋白质水平 细胞转染48 h后加入细胞裂解液,提取蛋白质,4 ℃12 000×g离心15 min,取上清,测蛋白质浓度,加入上样缓冲液,100 ℃加热变性10 min,SDS-PAGE,湿转法转至PVDF膜。5%脱脂奶粉的TBST室温封闭1 h,加入一抗,于4 ℃孵育过夜,加入二抗,于室温孵育1 h,TBST洗膜后,ECL 化学发光检测显影,在凝胶成像系统上拍照并分析。
1.3 统计学处理
采用SPSS19.0统计软件分析。实验结果用均数±标准差表示,组间均数比较采用t检验,P<0.05为差异具有统计学意义。所有实验都是独立重复3次。
2 结果
2.1 ABHD11-AS1在正常胃细胞和3种胃癌细胞中的表达量
荧光定量PCR结果均显示,相比正常细胞,胃癌细胞中ABHD11-AS1的表达量明显升高;而3种胃癌细胞株中,ABHD11-AS1 在MKN45 与MGC803 细胞中表达量明显低于SGC7901 细胞,差异有统计学意义(P<0.05,图1)。
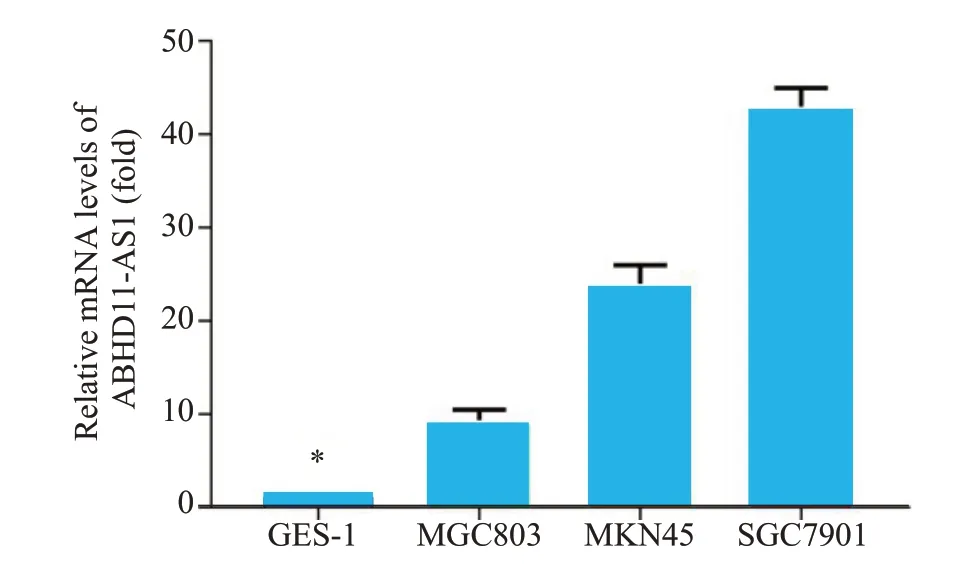
图1 ABHD11-AS1在正常胃细胞及3种胃癌细胞中的相对表达量Fig.1 Relative expression of ABHD11-AS1 mRNA in normal gastric cells and 3 gastric cancer cell lines detected by real-time PCR.*P<0.05 vs MGC803,MKN45 and SGC790 cells.
2.2 检测pcDNA-ABHD11-AS1质粒的过表达效果
选择相对低表达ABHD11-AS1 的MGC803 和MKN45细胞进行基因过表达实验,将过表达质粒转染以上两种胃癌细胞72 h后,荧光定量PCR检测结果显示,与对照组(pcDNA-Vector)相比,实验组(pcDNAABHD11-AS1)中ABHD11-AS1的mRNA水平明显上升,差异有统计学意义(P<0.05,图2)。由此证实,过表达质粒pcDNA-ABHD11-AS1 能有效促进胃癌细胞MGC803和MKN45中ABHD11-AS1基因的表达。
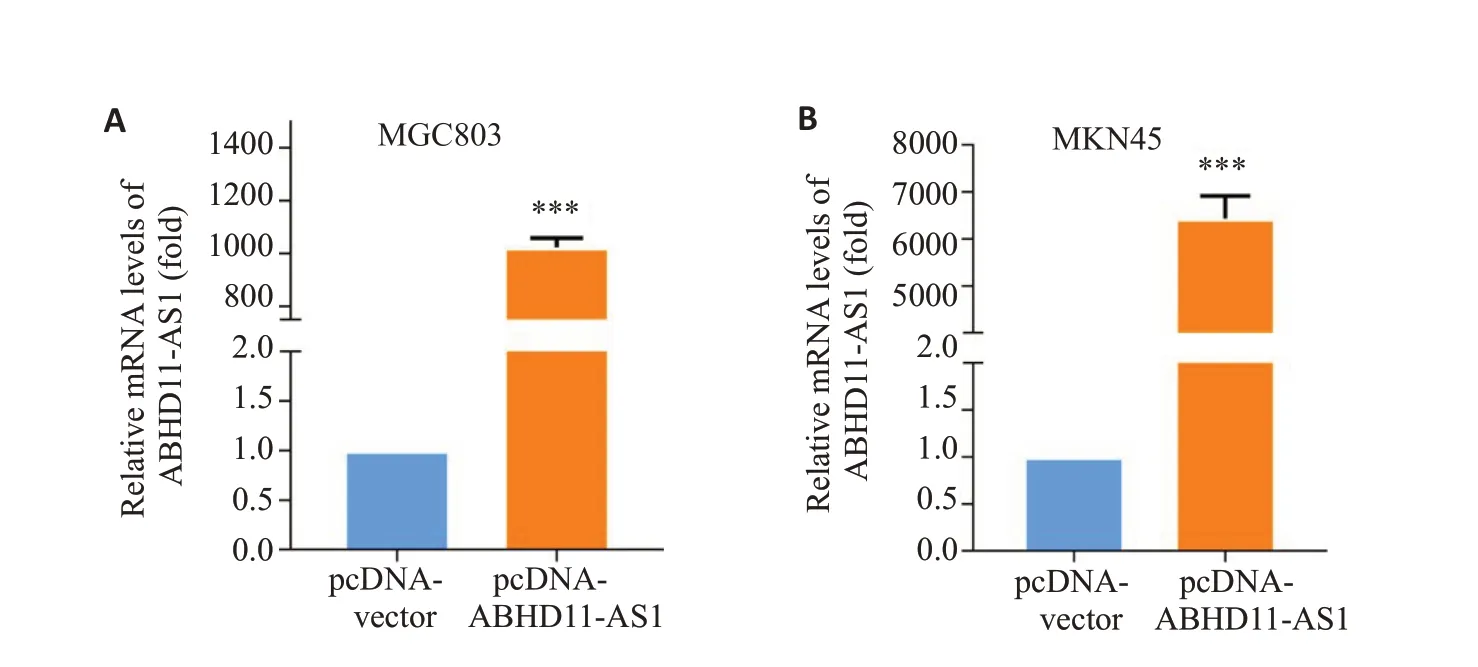
图2 pcDNA-ABHD11-AS1质粒的过表达效果Fig.2 Transfection efficiency of pcDNA-ABHD11-AS1 plasmid in MGC803 cells(A)and MKN45 cells(B).***P<0.001 vs pcDNA-vector.
2.3 上调ABHD11-AS1基因对MGC803和MKN45细胞增殖的影响
2.3.1 上调ABHD11-AS1对细胞克隆形成能力的影响克隆形成实验结果显示,MKN45和MGC803细胞中,对照组(pcDNA-Vector)细胞克隆形成能力明显弱于实验组(pcDNA-ABHD11-AS1)(图3A),过表达ABHD11-AS1增强了胃癌细胞的克隆形成能力。
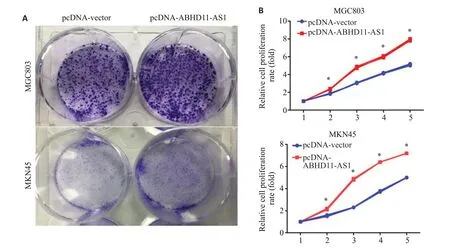
图3 上调ABHD11-AS1对胃癌细胞增殖的影响Fig.3 ABHD11-AS1 overexpression enhances proliferation of gastric cancer cells.A: Colony-forming ability of the two gastric cancer cell lines (Crystalline violet staining).B: ABHD11-AS1 overexpression promotes proliferation of MGC803 or MKN45 cells.*P<0.05 vs pcDNA-vector.
2.3.2 上调ABHD11-AS1 对细胞生长能力的影响CCK-8实验结果显示,与对照组相比,实验组胃癌细胞的生长能力提高,并且随着时间的延长,促进作用越明显,差异有统计学意义(P<0.05,图3B)。
2.4 上调ABHD11-AS1基因对MGC803和MKN45细胞迁移和侵袭的影响
2.4.1 Transwell实验结果显示 在MGC803细胞中,对照组与实验组穿膜细胞数差异有统计学意义(P<0.01);在MKN45细胞中,实验组与对照组穿膜细胞数差异有统计学意义(P<0.01,图4)。
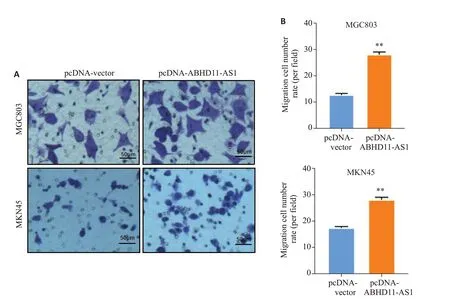
图4 上调ABHD11-AS1对胃癌细胞迁移的影响Fig.4 ABHD11-AS1 overexpression promotes migration of gastric cancer cells.A: Transwell assay of MGC803 and MKN45 cells transfected with pcDNA-Vector or pcDNA-ABHD11-AS1 plasmids(Crystalline violet staining,×200).B:Average number of migrated cells per field.**P<0.01 vs pcDNAvector.
2.4.2 Transwell实验结果显示 在MGC803细胞中,实验组与对照组侵袭的细胞数差异有统计学意义(P<0.01);在MKN45细胞中,实验组与对照组侵袭细胞数差异有统计学意义(P<0.01,图5)。
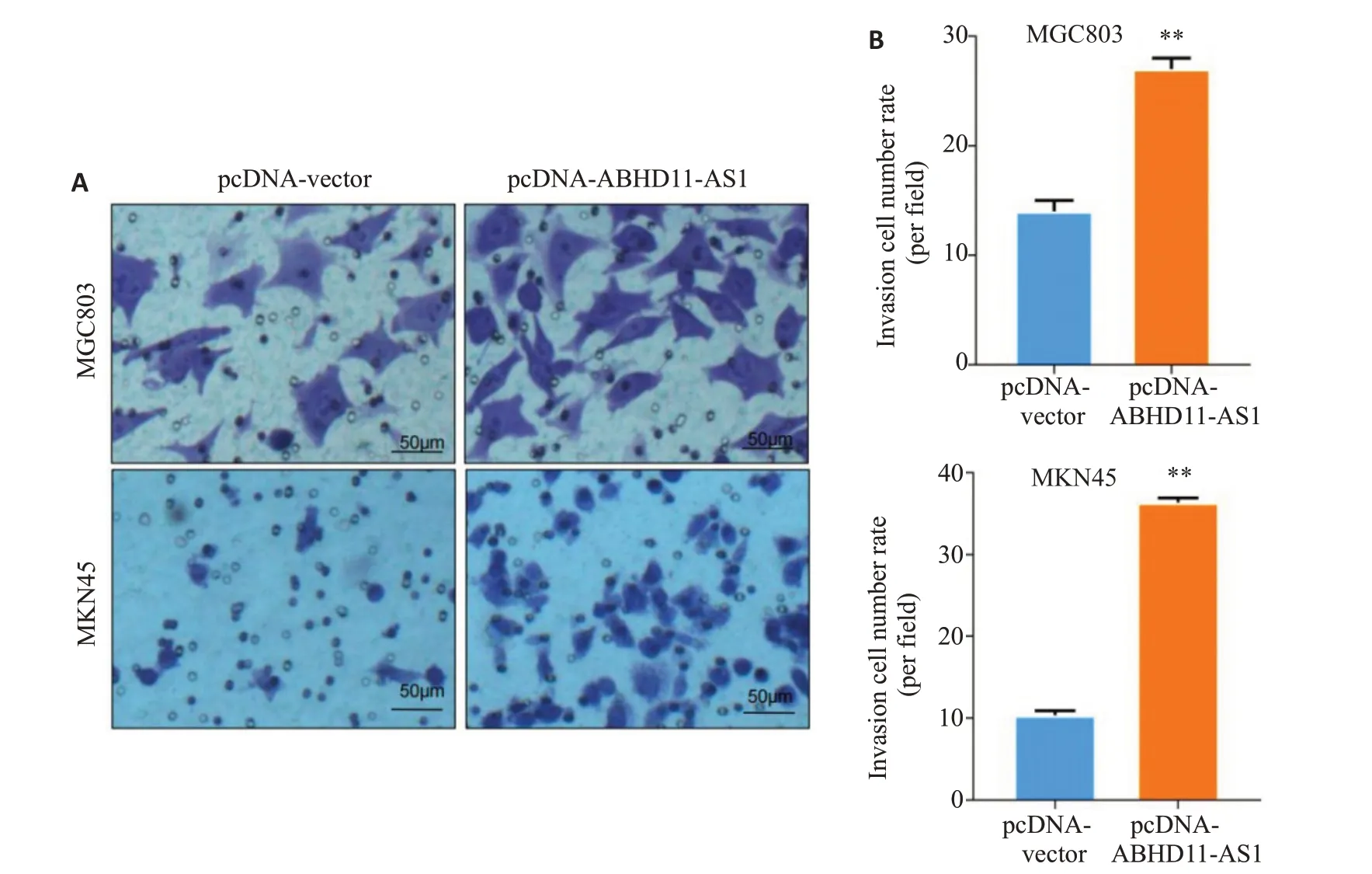
图5 上调ABHD11-AS1对胃癌细胞侵袭的影响Fig.5 ABHD11-AS1 overexpression promotes invasion of gastric cancer cells.A:Transwell assay of MGC803 and MKN45 cells transfected with pcDNA-Vector or pcDNA-ABHD11-AS1 plasmids(Crystalline violet staining,×200).B:Average number of migrated cells per field.**P<0.01 vs pcDNAvector.
2.5 ABHD11-AS1促进了胃癌细胞MGC803和MKN45的糖酵解
在MGC803和MKN45细胞中,过表达ABHD11-AS1后,进行葡萄糖浓度测量,结果显示,相比对照组,实验组细胞的葡萄糖摄取含量升高,乳酸的含量也升高,两组差异有统计学意义(P<0.05,图6)。
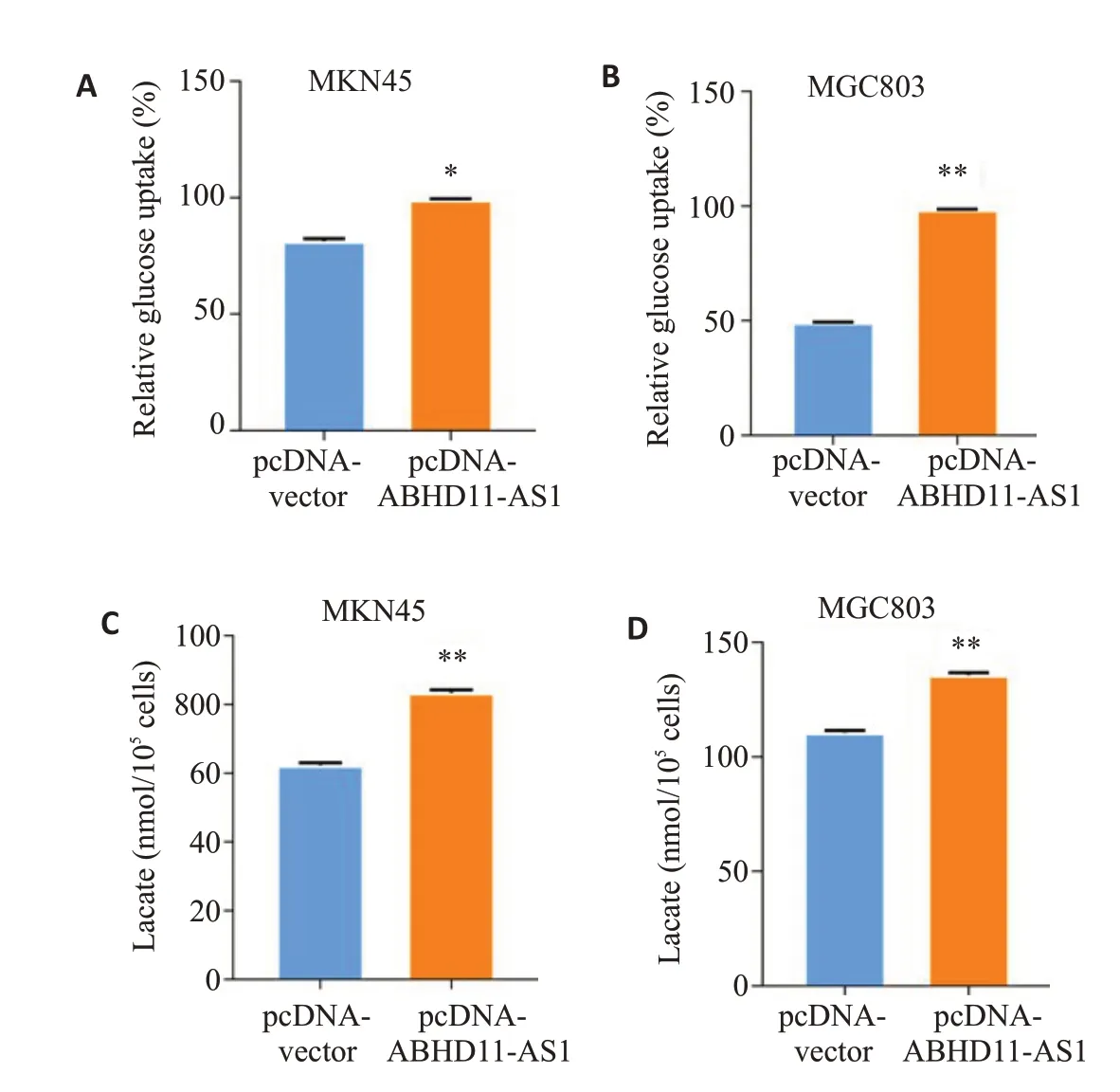
图6 上调ABHD11-AS1对胃癌细胞糖酵解的影响Fig.6 Effect of ABHD11-AS1 overexpression on glycolysis of gastric cancer cells.A,B:Transfection with pcDNA-ABHD11-AS1 increases glucose uptake in the gastric cancer cells.C,D:Transfection with pcDNA-ABHD11-AS1 increases lactic acid production in the gastric cancer cells.*P<0.05,**P<0.01 vs control group.
2.6 数据库预测RNAABHD11-AS1的转录因子
通过LncMAP 数据库(http://bio-bigdata.hrbmu.edu.cn/LncMAP)对ABHD11-AS1可能结合的转录因子进行查找分析。通过对预测的结果分析,发现转录因子Myc,其定位于8号染色体的c-Myc,是已知的糖酵解相关基因,可能参与了长链非编码RNAABHD11-AS1调控胃癌细胞糖酵解的途径(图7)。
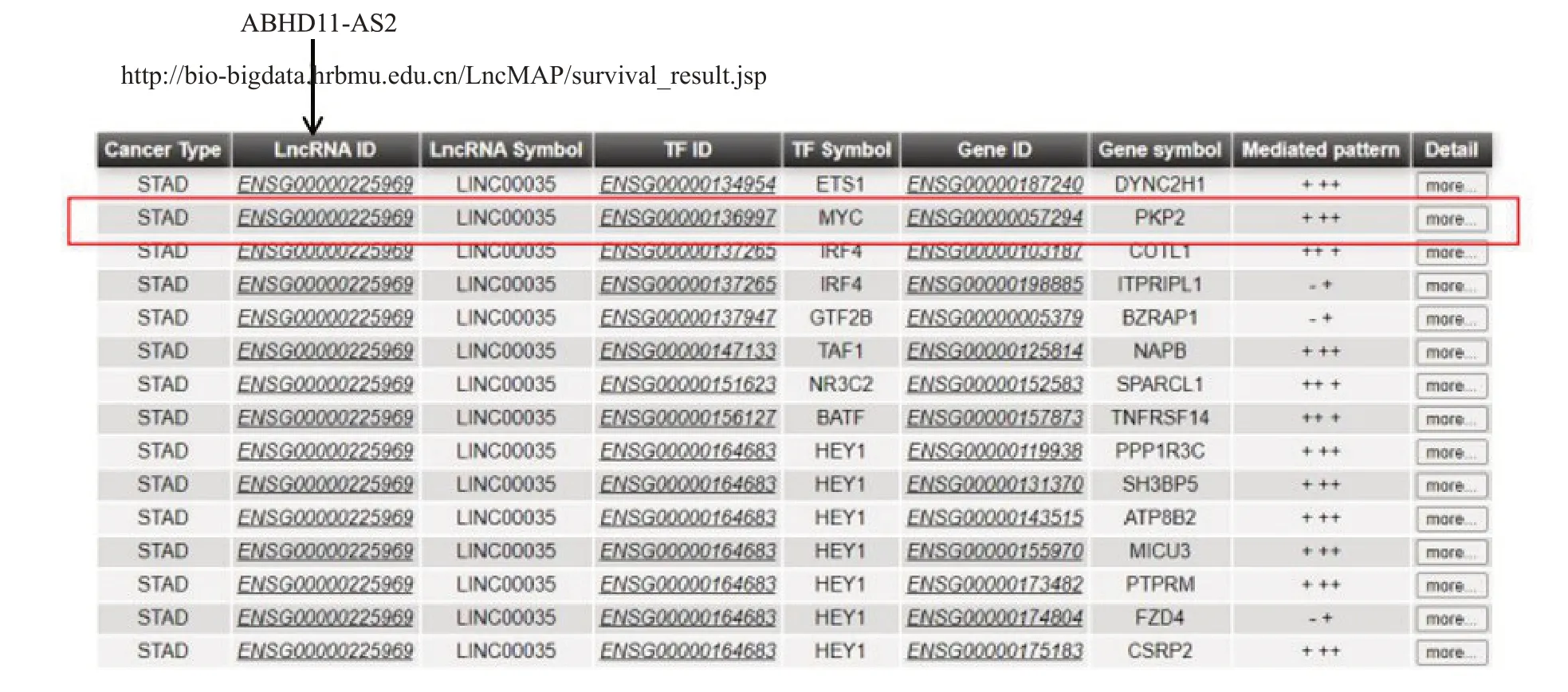
图7 数据库预测RNAABHD11-AS1的转录因子Fig.7 Database prediction of transcription factors ofABHD11-AS1.
2.7 上调ABHD11-AS1促进了c-Myc的表达
在MGC803和MKN45细胞中,对照组和实验组分别转染空载质粒(pcDNA-Vector)和过表达质粒(pcDNA-ABHD11-AS1),荧光定量PCR 鉴定结果显示,过表达质粒可以有效提升c-Myc mRNA表达量。Western blot检测对照组和实验组中c-Myc蛋白表达量,结果显示,相比对照组,实验组中过表达ABHD11-AS1后,MGC803和MKN45细胞中c-Myc表达量升高。
3 讨论
癌症的主要标志之一是癌细胞代谢的重新编程[7],这提高了肿瘤细胞的生存、增殖和生长机会。其中一种重要的重编程就是以糖酵解为主的代谢表型,称为Warburg效应[6],也就是肿瘤细胞的有氧糖酵解。研究表明其与癌基因激活有关,如Ras、c-Myc和Akt[16-18],伴随抑癌基因缺陷,导致乳酸的异常产生,最终进入细胞外空间的乳酸等酸可以降低肿瘤微环境的pH值,促进肿瘤侵袭[19]。越来越多的证据证实了糖酵解在肿瘤发生中的关键作用。LncRNA它们本身不具有蛋白质编码的功能,但可以依赖其序列特异性靶基因的表达进行多方面、多层次的调控[20],进而参与到各个关键的生物进程中。近年来,大量的研究数据表明,lncRNA可以调控肿瘤细胞的多个生物学过程,其在糖类代谢及脂质代谢中发挥重要的角色[21]。近期研究发现,有核梭杆菌靶向lncRNA ENO1-IT1 促进结肠癌细胞糖酵解过程[22]。HULC直接结合两种糖酵解酶,乳酸脱氢酶A和丙酮酸激酶M2,促进以上两种酶的水平升高,从而促进肿瘤的糖酵解进程[23]。在本研究中,我们着重于新型lncRNA ABHD11-AS1对胃癌细胞糖酵解和恶性行为的影响及其作用的可能机制。实验结果表明,相比正常胃细胞,lncRNAABHD11-AS1 在胃癌细胞中相对高表达,在3种胃癌细胞中表达量也存在差异,在MKN45 和MGC803中表达量相对较低,故选择这两个胃癌细胞株进行过表达实验,确定过表达质粒pcDNA-ABHD11-AS1的转染效率。在功能测定中,上调ABHD11-AS1促进了胃癌细胞的增殖及克隆形成能力,增强了MKN45和MGC803细胞的迁移及侵袭能力,进一步检测葡萄糖及乳酸发现,上调ABHD11-AS1促进了肿瘤对葡萄糖摄取,增加了乳酸的代谢产生,以上研究结果表明lncRNAABHD11-AS1可以促进胃癌细胞的增殖、转移、侵袭和糖酵解过程。通过分析数据库发现,lncRNA ABHD11-AS1可能通过已知的癌基因Myc发挥作用。Myc基因包括c-Myc,n-Myc,l-Myc,分别定位于8号染色体,2号染色体和1号染色体,其中c-Myc作为广为人知的癌基因,在增强癌细胞糖酵解代谢方面发挥了重要作用[24]。作为转录因子,c-Myc 参与各种细胞过程,包括葡萄糖代谢过程,尤其是糖酵解[25],癌细胞中c-Myc的激活是促进Warburg现象的关键。在许多类型的癌症中,c-Myc总是被激活并通过进一步激活其靶基因(如葡萄糖转运蛋白1、己糖激酶2、丙酮酸激酶同工酶2和乳酸脱氢酶A),然后导致癌细胞增殖、迁移和转移[36-28]。在结肠癌细胞中,lncRNA GLCC1 直接与HSP90 相互作用以保护c-Myc免于泛素化,并进一步影响c-Myc靶基因(乳酸脱氢酶A)的转录修饰模式,从而重新编程细胞的糖酵解[23]。在胶质母细胞瘤中,mTOR复合物2上调c-Myc水平并通过增加FoxO1和FoxO3的乙酰化水平激活c-Myc,然后促进糖酵解[29]。在许多类型的癌症中,c-Myc 可以直接转录激活糖酵解基因,从而促进糖酵解活性,增加葡萄糖摄取并快速将葡萄糖转化为乳酸[26],此外c-Myc可促进葡萄糖转运蛋白,己糖激酶及磷酸果糖激酶的转录,增加细胞对葡萄糖的摄取和丙酮酸的生成,抑制丙酮酸的有氧氧化[30]。在本研究中,我们发现ABHD11-AS1 在胃癌细胞中表达量较高,ABHD11-AS1在胃癌细胞中的高表达可以上调c-Myc的表达水平,通过增加c-Myc的表达量,可能会募集到更多的c-Myc 下游糖酵解靶基因,如GLUT1、HK2、ENO1、PKM2和LDHA,从而促进有氧糖酵解过程,并影响肿瘤恶性进展,ABHD11-AS1具体如何通过c-Myc发挥作用,值得我们进一步探究。总体而言,这些数据表明lncRNAABHD11-AS1 作为胃癌发生中的致癌基因影响糖酵解途径,同时促进胃癌细胞增殖、迁移、侵袭,以上结果为进一步研究ABHD11-AS1促进胃癌细胞恶性进展的作用机制奠定了基础,为将来胃癌的诊断及靶向治疗提供坚实的理论基础。