缺血性脑卒中患者血清LncRNA SNHG8的表达及临床意义
高继英,石代乐,王 刚
(河北北方学院附属第一医院 a.神经外科高压氧舱室;b.神经外科;c.神经内科,河北张家口 075000)
缺血性脑卒中(ischemic stroke,IS)约占脑卒中病例总数的70%,具有极高的发病率及致残率,严重威胁人类生命健康,早期诊断并评估IS病情,给予及时有效干预,具有重要意义[1-2]。长链非编码RNA(long non-coding RNA,LncRNA)可参与调节脑缺血损伤、神经发育和神经可塑性等多种病理生理过程[3]。LncRNA小核仁RNA宿主基因8(long non-coding RNA small nucleolar RNA host gene 8,LncRNA SNHG8)为LncRNA之一,可通过调控靶基因表达参与细胞增殖、分化、上皮间质转化、血管生成等多种生物学过程[4]。研究显示,LncRNA SNHG8在大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)大鼠脑组织和氧-葡萄糖剥夺(oxygen-glucose deprivation,OGD)的原代小胶质细胞中低表达,上调LncRNA SNHG8表达可通过调控miRNA-425-5p/沉默信息调节因子(silent information regulator,SIRT)1/核因子-κB轴抑制脑缺血性诱导小胶质细胞炎症和保护血脑屏障损伤[5]。以上研究表明,LncRNA SNHG8在脑损伤中发挥保护作用,但LncRNA SNHG8在IS中的临床价值尚不清楚。因此,本研究拟探讨IS患者血清LncRNA SNHG8表达情况及其诊断价值,为IS的诊疗提供理论参考。
1 材料与方法
1.1 研究对象 选择2019年5月~2021年12月在河北北方学院附属第一医院神经内科住院的IS患者115例作为研究对象(IS组),其中男性70例,女性45例,年龄46~78(61.20±10.50)岁;吸烟35例,饮酒41例,高血压58例,糖尿病27例,冠心病12例。另选取同期在本院体检人员120例作为对照组,同时排除既往有脑卒中史、头部外伤史等系统疾病者,其中男性64例,女性56例,年龄46~80(60.70±11.80)岁;吸烟28例,饮酒33例,高血压46例,糖尿病23例,冠心病15例。两组性别、年龄及吸烟、饮酒、高血压、糖尿病、冠心病比例比较,差异均无统计学意义(χ2=1.361,t=0.343,χ2=1.509,1.809,3.486,0.652,0.246,均P>0.05)。所有研究对象或其直系亲属签署知情同意书,且经河北北方学院附属第一医院伦理委员会审核、批准后实施。
IS组纳入标准:①符合中国缺血性脑卒中诊治指南(2018)中诊断标准[7];②首次发病且在发病24h内入院就诊;③经头颅CT或3.0 MRI检查确诊且排除其他脑部病变。排除标准:①短暂性脑缺血发作、出血性脑梗死、脑外伤、高血压脑病及脑膜炎者;②并发肝肾功能障碍者;③有恶性肿瘤者;④临床资料不全者。根据入院时国立卫生研究院卒中量表评分(national institute of health stroke scale,NIHSS)[6]对IS组患者进行神经功能损伤评分,将患者分为轻度组(NIHSS评分≤4分,n=39)、中度组(4分<NIHSS评分≤20分,n=35)和重度组(NIHSS评分>20分,n=41)。
1.2 仪器与试剂 ABI 7300 PCR仪(美国Applied Biosystem公司),总RNA提取试剂(Trizol)(美国Invitrogen公司,货号15596018),反转录试剂盒(Reverse Transcriptase M-MLV)(货号H2640A,日本Takara)及TaqMan探针法荧光定量PCR试剂盒(2×Probe qPCR Mix)(货号HS0616,日本Takara),LncRNA SNHG8及内参GAPDH的引物(上海生物工程有限公司)。
1.3 方法
1.3.1 样品采集及保存:采集IS组患者入院24h内、治疗1周、治疗2周后及对照组人员体检当天肘静脉血5 ml,常温3 000×g离心10 min后收集血清,置于-80℃保存待检。
1.3.2 实时荧光定量PCR(real time fluorescent quantitative PCR,qRT-PCR)法检测血清LncRNA SNHG8表达水平:采用Trizol试剂提取血清中总RNA,取1μg RNA使用反转录试剂盒合成cDNA。反应条件:95 ℃ 10 min;然后95 ℃ 10 s,60℃60 s,共40个循环。LncRNA SNHG8上游引物:5’-CCC GAGAACCGTCAGTTTGA-3’,下游引物:5’-ACAC CCGTTTCCCCAACTAC-3’;GAPDH上游引物:5’-AATCCCATCACCATCTTC-3’,下游引物:5’-AG GCTGTTGTCATACTTC-3’。反应结束后,以GAPDH为内参,采用2-∆∆Ct法计算LncRNA SNHG8的相对表达量。
1.3.3 临床资料收集:收集入选人员性别、年龄、疾病史、血脂指标,血脂指标包括总胆固醇(total cholesterol,TC)、三酰甘油(triglyceride,TG)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)与高密度脂蛋白胆固醇(highdensity lipoprotein cholesterol,HDL-C)。
1.4 统计学分析 采用SPSS 22.0统计学分析,计量资料均符合正态分布检验,以均数±标准差(±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。计数资料采用n(%)表示,组间比较采用χ2检验。Spearman相关性分析IS患者血清LncRNA SNHG8与NIHSS评分的相关性;采用受试者工作特征(receiver operating characteristic curve,ROC)曲线分析血清LncRNA SNHG8对IS的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 两组血脂及血清LncRNA SNHG8表达水平比较 见表1。IS组血清TC,LDL-C水平高于对照组,而 HDL-C及LncRNA SNHG8表达水平低于对照组,差异均有统计学意义(均P<0.001);对照组与IS组患者血清TG水平比较,差异无统计学意义(P>0.05)。
表1 两组血脂及血清LncRNA SNHG8表达水平比较(±s)
项目IS组(n=115)对照组(n=120)t值P值TG(mmol/L)1.59±0.671.65±0.810.6170.538 TC(mmol/L)5.26±1.214.35±1.435.255<0.001 HDL-C(mmol/L)1.39±0.411.72±0.366.564<0.001 LDL-C(mmol/L)2.23±0.531.51±0.659.284<0.001 LncRNA SNHG80.78±0.111.05±0.1515.680<0.001
2.2 不同病情严重程度IS患者血清LncRNA SNHG8表达水平比较 轻度组、中度组和重度组患者血清中LncRNA SNHG8表达水平分别为0.85±0.10,0.77±0.09和0.71±0.08,三组比较差异有统计学意义(F=24.173,P<0.001);与轻度组比较,中度与重度组患者血清中LncRNA SNHG8表达水平降低,差异有统计学意义(t=3.601,6.931,均P<0.05),与中度组比较,重度组患者血清中LncRNA SNHG8表达水平降低,差异有统计学意义(t=3.077,P=0.003)。
2.3 IS患者血清LncRNA SNHG8表达与临床病理参数的关系 见表2。不同年龄、性别、梗死分型的IS患者血清LncRNA SNHG8表达水平比较差异均无统计学意义(均P>0.05)。
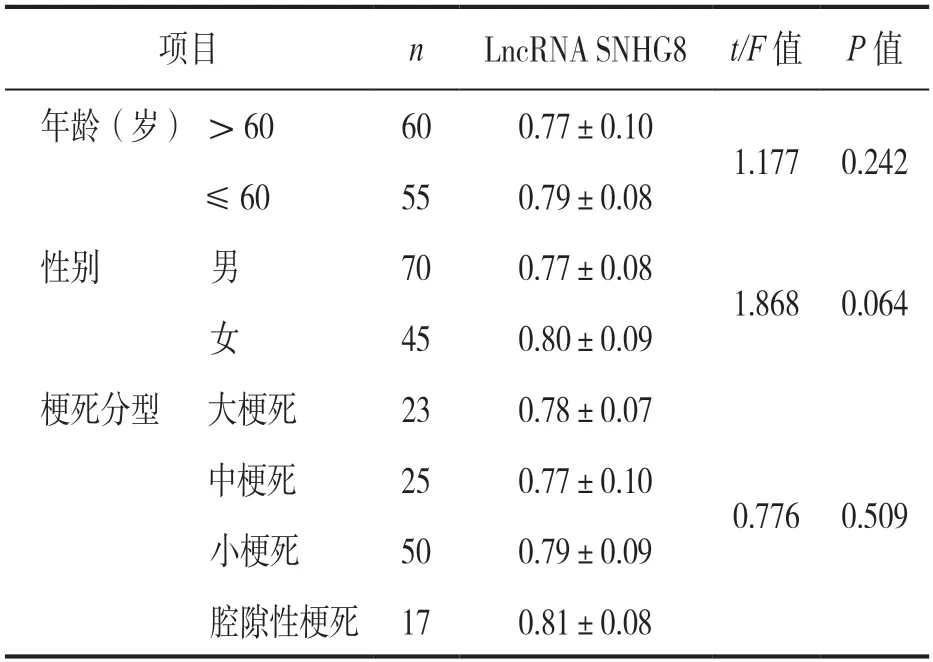
表2 IS患者血清LncRNA SNHG8表达与临床病理参数的关系
2.4 IS患者血清LncRNA SNHG8与NIHSS评分的相关性 相关性分析显示,IS患者血清LncRNA SNHG8与NIHSS评分呈负相关性(r=-0.501,P<0.001)。
2.5 血清LncRNA SNHG8对IS的诊断价值 血清LncRNA SNHG8表达水平评估IS患者的ROC曲线下面积为0.873(95%CI为:0.823~0.913),最佳截断值为0.89,敏感度和特异度分别为85.22%,73.33%。
2.6 IS患者治疗前、后血清LncRNA SNHG8表达水平变化 IS患者在入院24 h内、治疗1周后、治疗2周后血清LncRNA SNHG8表达水平分别为0.78±0.11,0.85±0.09和0.93±0.08,表达水平依次升高,差异有统计学意义(F=73.064,P<0.001)。
3 讨论
IS是临床最常见的脑血管疾病之一,IS的发病机制复杂,其中脑缺血再灌注损伤及其炎症反应引起神经损伤,涉及多基因、多信号转导途径参与的过程[8]。
LncRNA在脑组织中表达广泛,通过调控其靶基因表达来发挥调控细胞生物学功能,在帕金森病、阿尔兹海默症、中风等中枢神经系统疾病发生发展中起着重要作用[9-10]。研究显示,LncRNA可通过调控氧化应激、神经炎症反应、凋亡与自噬、血管生成等过程参与IS的发生发展[11]。报道显示,IS患者脑组织与血清中LncRNA异常表达,可能成为诊断IS的潜在标志物,如LncRNA H19,LncRNA GAS5,LncRNA RNF5P1等[12-13]。LncRNA SNHG8是LncRNA之一,在多种病变组织、肿瘤中均异常表达,参与调控肿瘤细胞增殖、迁移与耐药性、心肌缺血再灌注引起的心肌损伤等多种生理病理过程[14-15]。研究显示[16],过表达LncRNA SNHG8可改善MCAO大鼠神经功能缺陷,降低脑含水量、血脑屏障通透性及脑组织损伤和炎症,在OGD诱导的小胶质细胞中,过表达LncRNA SNHG8或可增加细胞活力并降低乳酸脱氢酶活性,其作用机制与调控miRNA-449c-5p/SIRT1/叉头框转录因子O1通路有关。另有研究显示[17],在慢性脑缺血诱导的神经细胞中过表达LncRNA SNHG8可通过miRNA-384/同源盒基因A13/序列相似性家族3A轴抑制慢性脑缺血诱导的神经元凋亡。以上研究结果表明,LncRNA SNHG8在脑损伤过程中发挥保护作用。本研究结果表明,LncRNA SNHG8在IS患者血清中表达水平降低,并随着患者病情加重而降低,提示LncRNA SNHG8与IS发病及患者疾病的严重程度有一定相关性,IS患者由于脑缺血造成脑局部缺氧,致使氧化损伤、兴奋性毒性及神经元凋亡,进而破坏血脑屏障,而炎症反应及神经元坏死产生的细胞因子可加重脑损伤,LncRNA SNHG8可能通过调节神经炎症反应与神经元凋亡参与IS的发展,而上调LncRNA SNHG8表达可抑制神经炎症反应与神经元凋亡[5],提示LncRNA SNHG8在脑损伤过程中发挥神经保护作用,可能成为IS治疗的靶向标志物。
NIHSS评分可用于评估IS患者病情的严重程度,评分越高,表示患者病情越严重,有研究显示[18],LncRNA与IS患者的NIHSS评分相关,推测LncRNA可能对IS的病情严重程度产生影响。本研究相关性分析显示,IS患者血清LncRNA SNHG8与NIHSS评分呈负相关,进一步提示LncRNA SNHG8表达水平与IS患者的疾病严重程度相关。一般认为外周血中的LncRNA来源于体内凋亡或坏死的细胞,LncRNA可以通过血脑屏障,脑组织LncRNA水平与血清中LncRNA水平一致,LncRNA SNHG8可能来源于受损的脑组织,在脑损伤组织中表达水平降低,可能通过参与调节神经炎症与神经元凋亡,促进IS疾病进展,有望通过检测血清中LncRNA SNHG8表达水平预测IS的疾病发生与进展。进一步研究发现,血清LncRNA SNHG8对评估IS患者发生有一定指导价值,可能成为诊断IS的分子标志物。本研究还显示,IS患者在治疗后血清LncRNA SNHG8表达水平升高,表明LncRNA SNHG8在IS患者中起到神经保护作用,这可能与其参与调节小胶质细胞炎症反应与神经元凋亡有关。
综上所述,LncRNA SNHG8在IS患者血清中表达水平降低,与IS患者疾病严重程度有关,对IS有一定诊断价值,可能成为诊断IS的分子标志物。但由于本研究纳入的临床资料及样本量相对较少,且LncRNA SNHG8与IS发生发展的具体作用机制尚未明确,后续将收集更多的临床资料并扩大样本,增加基础研究内容,以深入探讨LncRNA SNHG8在IS中的作用。

