基于生物学信息分析筛选晚期肝细胞癌患者接受PD-1抑制剂治疗后糖酵解相关基因差异表达并构建生存获益模型与验证
吴翠婷,周雪辉,张婉馨(南方医科大学珠江医院药剂科,广州 510280)
肝细胞癌(hepatocellular carcinoma,HCC)是最常见的原发性肝癌类型,对人类健康有着严重威胁[1]。作为一种免疫检查点分子,程序性细胞死亡蛋白-1 (programmed cell death protein 1,PD-1)在加强耐受性以及降低免疫系统功能方面发挥着重要作用[2],为HCC患者带来希望。但肿瘤细胞为了满足自身生长需要,会改变代谢途径,包括糖酵解以及脂肪酸代谢等[3]。因而,尽管肝癌治疗不断取得进展,但肝癌患者的长期生存率仍然较低[4]。近几年的研究显示,糖酵解相关风险评分在预测各种实体瘤的预后方面表现出色。如LIU等[5]人开发了一种与糖酵解相关的四基因特征以预测肺腺癌患者的预后,结果显示出较好的准确性;同样,CHEN等[6]人建立了包含7个糖酵解相关基因的预测模型,在他们最近的研究中表明可以有效预测结肠腺癌的预后。由此可见,糖酵解在癌症的增殖、生长、侵袭和治疗中起着重要作用,深入了解HCC中的糖酵解有助于揭示HCC的发病机制和潜在治疗途径以及耐药机制。因此,这篇研究将基于生物学信息分析筛选糖酵解相关基因,以此探讨PD-1抑制剂治疗晚期肝细胞癌患者后的生存获益,分析其指导预后和治疗的意义。
1 材料与方法
1.1 资料来源 于癌症基因组图谱 (the cancer genome Atlas,TCGA)数据库获取369例HCC患者和50例正常肝组织的临床数据和高通量测序数据,患者年龄53~72(69.23 ± 6.61)岁。这篇研究经南方医科大学珠江医院伦理委员会批准(1564HF26)。数据集的纳入标准:①均接受了PD-1抑制剂治疗;②经病理检查均证实为HCC晚期;③临床病理特征完整(肿瘤分期、治疗模式等)。排除标准:①数据库样本数据无效或不足;②除PD-1抑制剂外还进行其他联合治疗的患者。
1.2 研究方法 利用TCGA数据库提取糖酵解相关基因的表达水平并进行相关性检验。使用“limma” R包对369个肿瘤组织和50个正常肝组织的基因数据进行差异分析。筛选出肝细胞癌组织中异常表达的糖酵解相关基因[错误发现率<0.05,log2fold change(log2FC)>1)]。
1.3 统计学分析
1.3.1 通过 LASSO分析筛选关键预测因子:结合R语言的‘glmnet’包,采用Lasso COX回归进一步降维。模型的惩罚参数(λ)选取最低标准。接着使用“survival”和“survminer”包对关键预测因子进行生存分析,以此验证不同糖酵解相关基因是否与生存获益相关。
1.3.2 风险评分模型的构建和验证:将符合条件的因子重新计算系数以获得预后模型,每个患者的风险评分均由回归系数(β)加权后得出。以数据库的中值风险评分作为阈值,将患者分为高风险组和低风险组。接着使用“survminer”包进行最佳分离统计,将基因表达量分为高组和低组,最后利用Kaplan-Meier法绘制生存曲线,评估基因特征对总体生存情况的预测价值。
1.3.3 糖酵解相关基因列线图的建立与验证:构建列线图模型来预测患者生存获益情况,绘制随时间变化的受试者工作特征(receiver operating characteristic,ROC)曲线,并计算ROC曲线下的面积,以此验证列线图的准确度;利用校准曲线比较列线图模型预测和观察结果,以验证列线图的校准度;采用临床决策曲线分析法验证模型的预测可靠度。
2 结果
2.1 鉴定HCC中差异表达的糖酵解相关基因 基于糖酵解评分的HCC样本基因表达模式,确定了前10个上调和前10个下调的糖酵解相关差异表达基因,见表1。与正常肝组织相比,前10个上调基因中S100P和SPP1在HCC组织中高表达,而PLA2G2A和APOA4在HCC中表达下调;在前10个下调基因中,SPP2,LECT2,SLC10A1,CYP2A6,CYP3A4,HSD17B13,CYP2A7和IYD表达显著下调,而CYP7A1表达在肿瘤组织中相对于正常肝组织明显上调。

表1 HCC中差异表达的糖酵解相关基因
2.2 多因素COX分析以及预测因子的筛选 多因素分析结果显示高表达的SPP1,TMEM92和EGLN3预示着 HCC患者的不良预后,而SPP2,LECT2,SLC10A1,CYP3A4,HSD17B13和IYD的高表达预测 HCC患者的预后更佳(均P<0.05),见表2。利用 LASSO进一步筛选,确定了与 HCC糖酵解相关的6个差异表达基因(SPP2,LECT2,SLC10A1,CYP3A4,HSD17B13 和 IYD)。
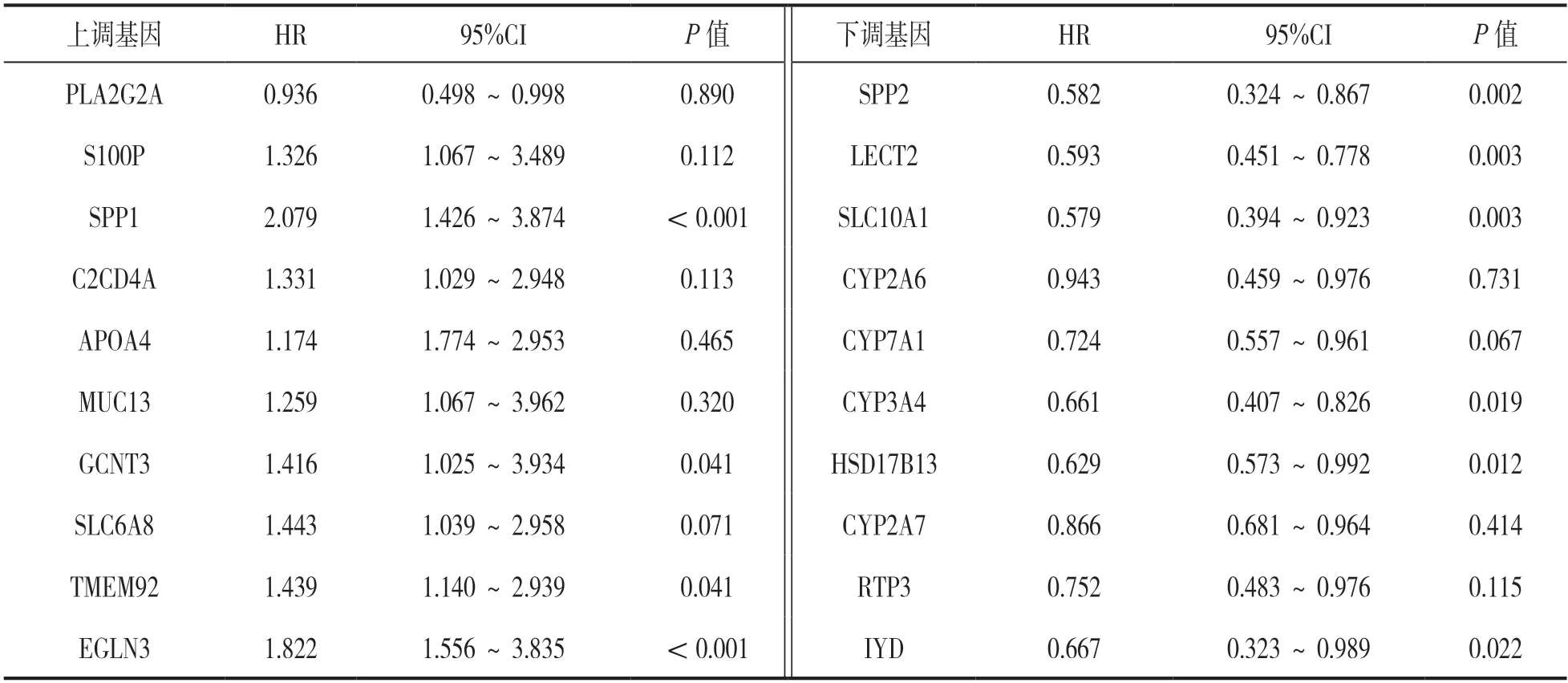
表2 多因素分析结果
2.3 构建基于糖酵解相关基因的风险评分模型 根据个体预后风险评分以中位数为临界值分为高风险组和低风险组,见图1A;患者的生存状况被标记为点图,见图1B;随着风险评分的升高,患者生存时间呈逐渐下降趋势,随访结果为死亡的患者比例逐渐升高;图1C基因热图显示,两组患者基因的表达水平存在显著差异,表明它们与风险评分密切相关,是预后模型中的关键因素。

图1 基于糖酵解相关基因的风险模型
2.4 风险评分模型的评价 根据中位风险评分,将患者分为高危组和低危组,利用Kaplan-Meier法绘制生存曲线,结果显示低危组患者总生存时间显著高于高危组患者(Log-Rankχ2=4.933,P<0.001),表明风险评分模型可以有效预测HCC患者的预后,见图2。

图2 高危组和低危组患者的生存曲线
2.5 列线图模型的构建 基于上述分析结果,构建列线图预测模型。图3结果显示,以下六种基因预测总分430分,对应生存获益概率为73.98%。
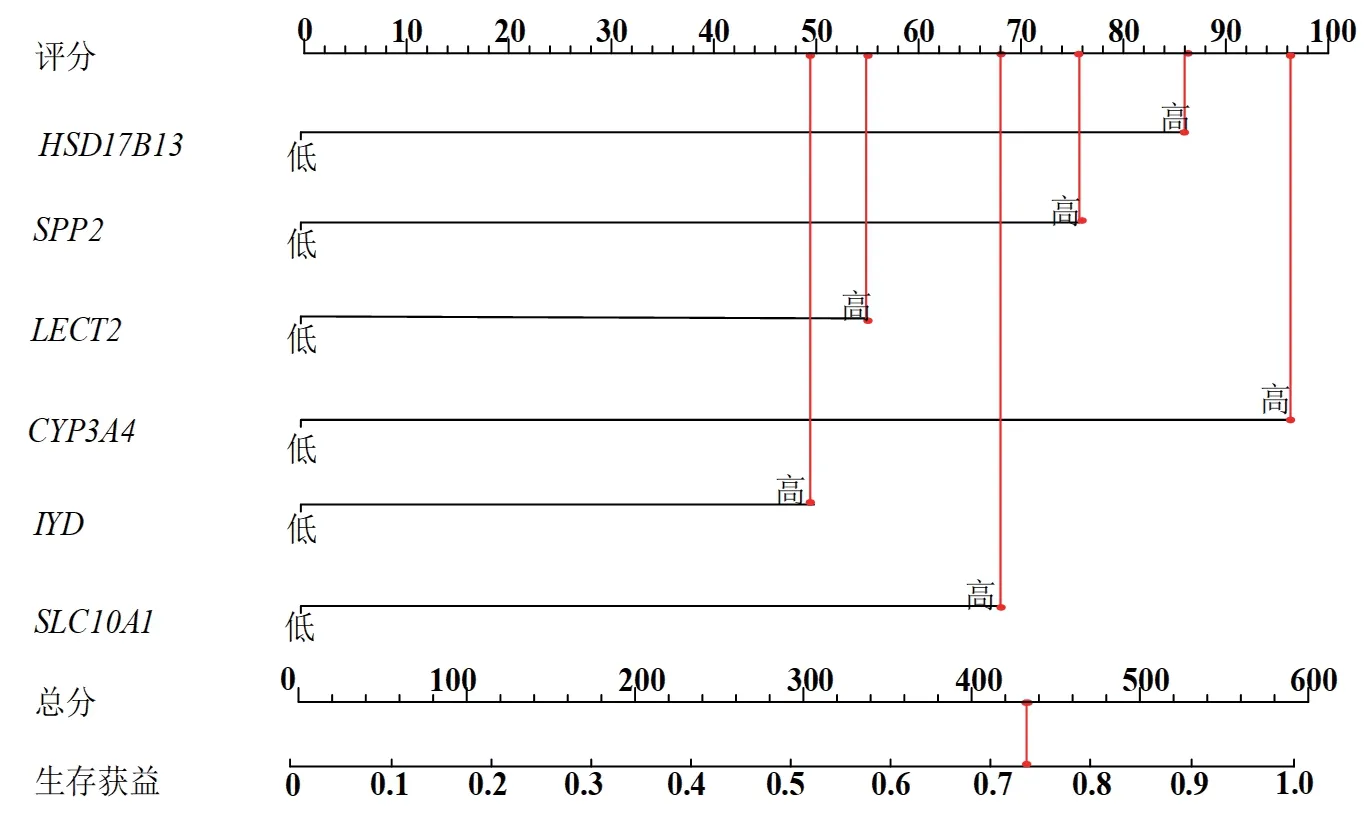
图3 基于糖酵解相关基因预测生存获益的列线图模型
2.6 列线图模型的验证 通过ROC曲线的绘制对模型区分度进行评价,AUC为0.740(95%CI:0.687~0.792,P<0.001),C-index为0.814,大于0.75,模型区分度较高,见图4A;对预测模型的校准曲线进行检验:χ2=5.035,P=0.442,见图4B;通过绘制临床决策曲线可以看出,预测模型距极端曲线较远,当阈概率在13%~85%时使用列线图模型预测生存获益的净获益率较高,由此可见模型安全可靠,实用性强,见图4C。
图4 预测模型验证
3 讨论
肝细胞癌(HCC)是最常见的原发性肝癌,是全球癌症负担的主要原因。晚期HCC仍然是一种致命疾病,部分原因是数十年来治疗选择有限[7]。尽管通过手术(包括切除和肝移植)以及消融技术在某些早期疾病病例中是可以治愈的,但复发率仍然很高[8]。最近,随着更好地了解这些肿瘤的生物学特性,HCC的治疗前景发生了重大转变。在HCC患者的治疗中除了分子靶向药物外,免疫检查点抑制剂显示出较为突出的治疗效果,并在晚期阶段获得批准。例如,PD-1抑制剂被证明作为二线治疗具有生存获益[9]。
此外,HCC的治疗面临诸多挑战的原因之一就是患者的预后难以预测,给临床管理和临床决策带来困难。最近的数据表明,葡萄糖代谢重编程,尤其是有氧糖酵解,在低氧环境下HCC的发生和发展中具有重要意义,基因富集分析比较的结果表明,糖酵解在HCC中更为活跃,可以促进肿瘤的恶性行为[10]。这是由于糖酵解增强可促进癌细胞快速利用葡萄糖产生丰富的ATP,为癌细胞提供了丰富的细胞结构,有益于癌细胞增殖以及存活所必需的生物合成。因此,发现HCC糖酵解的关键调节剂非常重要。在这项研究中,发现具有高糖酵解基因特征的肿瘤样本在HCC中的总生存时间显著缩短,利用TCGA 数据,确定了与HCC糖酵解相关的6个差异表达基因(SPP2,LECT2,SLC10A1,CYP3A4,HSD17B13 和 IYD),而且这些基因的高表达与HCC患者的生存获益密切相关。
LECT2是一种主要由肝细胞产生的分泌蛋白,通常在血管细胞、内皮细胞中表达。大量研究表明,LECT2与多种癌症的进展有关。例如,LECT2 被认为是结肠腺癌的潜在预后风险生物标志物之一[11]。其可通过多种机制在HCC中发挥抑癌作用,如LECT2通过抑制血管生成进而抑制 HCC中的肿瘤生长,此外还可控制炎性单核细胞,因此低表达的LECT2的HCC患者具有更高的分级和炎症浸润[12]。然而,目前还没有关于LECT2在HCC中的作用系统和全面的研究。因此,有必要进一步探讨LECT2在HCC中的潜在机制。
由基因SLC10A1编码的牛磺胆酸钠协同转运多肽(sodium taurocholate cotransport polypeptide,NTCP)是乙型肝炎病毒的受体,相关报道显示[13],肿瘤组织中较低水平的NTCP表达与HCC患者较差的术后存活率相关。此外,NTCP在HCC中的异位表达会抑制肿瘤细胞的增殖和生长。与这篇研究结果一致,即SLC10A1在HCC肿瘤组织中的表达降低。
根据以往研究结果显示,CYP3A4主要表达于肝脏和肠道,其酶类参与约50%药物的代谢以及多种前致癌物质的代谢活化[14]。CYP3A4 的下调与前致癌物的代谢降低有关,从而导致前致癌物的暴露增加。因此,CYP3A4基因的下调参与了侵袭性肿瘤行为,从而导致更高的早期复发率和更差的生存期[15],这也从侧面证实CYP3A4较高表达水平更容易使HCC患者生存获益。在肝脏中高度表达的基因HSD17B13编码视黄醇脱氢酶,虽然这种蛋白质的生理作用尚未完全阐明,但它似乎参与脂质生物合成以及性激素、胆汁酸和脂肪酸氧化还原过程的调节[16]。据报道,肿瘤周边组织中HSD17B13的表达与HCC患者的总生存期较差相关,酒精性肝病患者中HSD17B13 rs72613567功能缺失突变体对HCC发展具有一定的保护作用[17-18]。根据以上研究,对于基因HSD17B13在HCC中的潜在机制还需进一步探讨。
有证据表明,SPP2与剪接体和染色质的稳定性相关,其表达失调可能影响细胞增殖和凋亡的进程,这可能导致疾病进展,进而影响HCC患者的总生存期[19];而IYD在癌症中的表达模式和功能作用尚不清楚,有待进一步深入研究。基于6个已识别的基因,建立并验证了HCC的新风险预后特征,并已证明对于风险估计和生存预测是有效的。此外,已有多项研究表明,由特征计算的风险评分是总生存期的独立预后因素,并且与晚期肿瘤阶段的HCC的生物学活性、较大的肿瘤大小和较高的组织学分级有关。风险评分较高的患者可能更容易死亡且复发风险较高。结合基于六个基因预后特征的列线图提高了预测模型的精度和可靠性,与组成因素相比获得了更大的净收益。但这项研究有几个局限性。首先,结果缺乏实验数据的验证;其次,糖酵解途径中六种基因的分子机制还需要在未来的研究中进一步探索。
综上所述,这篇研究证实了HCC肿瘤样本中的六种糖酵解基因可以通过抑制Warburg效应抑制肝癌肿瘤生长,虽然这些基因调控糖酵解的详细机制值得进一步研究,但可以基于糖酵解基因的表达水平预测晚期HCC患者治疗后的生存获益情况,以此为依据制定更有效的治疗方案。

