梅毒血清固定患者外周血单个核淋巴细胞中miR-31和miR-192水平表达及其诊断价值研究
赵 萍,吴红霞,高海珍(江阴市人民医院.皮肤科;.检验科,江苏江阴 214400)
梅毒是由梅毒螺旋体感染引起的慢性、系统性的性传播疾病[1]。有些患者经驱梅治疗后仍然达不到血清学转阴结局,被称为血清固定[2]。由于梅毒螺旋体在体外极难培养,血清固定的发病机制尚不清楚,因此急迫需要开发新的生物标志物用于诊断梅毒血清固定。目前有不少微小核糖核酸(miR-223,miR-589,miR-1204)在早期梅毒及血清固定患者外周血单个核淋巴细胞中表达异常,参与梅毒血清固定的免疫机制调节[3-4]。微小核糖核酸(micro RNA,miR)-31属于高度保守的miRNA,可促进免疫调节因子的产生,从而参与疾病免疫调节过程[5-6]。miR-192可调节T细胞免疫活化参与细胞免疫过程[7]。尽管有不少研究表明梅毒发病机制与免疫调节密切相关,但是对于miR-31和miR-192在梅毒血清固定患者体内水平尚不清楚。因此本研究从免疫应答方面入手,通过检测梅毒血清固定患者外周血miR-31和miR-192水平,分析二者表达情况及对血清固定的诊断价值,旨在为梅毒血清固定早期诊疗提供理论基础。
1 材料与方法
1.1 研究对象 选取2020年11月~2022年11月期间江阴市人民医院收治的梅毒患者81例,根据患者进行驱梅治疗后的血清转变情况分为血清固定组(n=37)和转阴组(n=44)。血清固定组:男性20例,女性17例,年龄18~50(31.35±5.36)岁,病程1~3(2.11±0.44)年;转阴组:男性23例,女性21例,年龄18~48(30.44±5.41)岁,病程1~3(1.98±0.31)年。根据临床病理分期分为Ⅰ期梅毒患者(n=45)和Ⅱ期梅毒患者(n=36)。根据梅毒快速血浆反应素试验(rapid plasma reaction test,RPR)分为反应素初始滴度<1∶8梅毒患者(n=31)、1∶8~1∶32梅毒患者(n=26)和>1∶32梅毒患者(n=24)。另选取同期在本院进行健康体检的50例志愿者为健康对照组,其中男性27例,女性23例,年龄18~50(30.67±5.52)岁。纳入标准:①所有患者均符合梅毒相关诊断要求[8];②滴度在1∶2以上;③患者及家属知情同意。排除标准:①并发其它传染性、自身免疫性疾病;②未经驱梅治疗者;③近期使用免疫调节剂或抗生素;④患有恶性肿瘤者。该研究通过本院医学伦理委员会批准。
1.2 仪器与试剂 Trizol试剂(上海康朗生物科技有限公司,货号KL-0016),逆转录试剂盒(上海玉博生物科技有限公司,货号205111),SYBR Green Master Mix(2×)试剂(北京索莱宝科技有限公司,货号:SR1110);Ficoll-Paque细胞分离液(广州亿宁生物科技有限公司,货号:17-1440-02),10g/dl FBS 1640培养液(武汉普诺赛生命科技有限公司,货号:PM150110B),梅毒快速血浆反应素诊断试剂盒(上海科华生物工程股份有限公司,货号S10950038),qRT-PCR仪(美国ABI公司,型号ABI 7500)。
1.3 方法
1.3.1 外周血miR-31,miR-192水平检测:所有研究对象抽取外周静脉血于抗凝管中,离心后,弃去上层血浆,加入等量生理盐水稀释混匀,将其加入含有Ficoll-Paque细胞分离液的15 ml离心管中,离心30 min,吸取环状乳白色单个核细胞层,用10 g/dl FBS 1640培养液反复洗涤三次,保存备用。用qRT-PCR法检测miR-31,miR-192表达水平。按照Trizol试剂操作步骤分离提取外周血总RNA,测其浓度、纯度。严格按照逆转录试剂盒操作步骤将RNA逆转录合成cDNA,采用qRTPCR仪检测外周血miR-31和miR-192相对表达水平。内参为U6,U6上游引物为5’-GCTCGCTTCGG CAGCACA-3’,下游引物为5’-AACGCTTCACGAA TTTGCGT-3’;miR-31上游引物为5’-ACGCGGCAA GATGCTGGCA-3’,下游引物为5’-CAGTGCTGG GTCCGAG-TGA-3’;miR-192上游引物为5’-CTGAC CTATGAATTGACAGCC-3’,下游引物为5’-CAGTG CGCGCACCTATT-3’。引物由上海生工生物工程有限公司合成。qRT-PCR反应体系共25µl:SYBR Green Master Mix(2×)12.5µl,cDNA(50 ng/µl)2 µl,PCR上下游引物(10 µmol/L)各0.5 µl,加ddH2O至25 µl。反应条件:95℃ 3min,95℃ 30s,60℃ 30s,72℃ 30s,39个循环。各样品均重复三次,使用2-∆∆Ct方法(Ct为循环阈值)计算目的基因miR-31和miR-192的相对表达量。
1.3.2 梅毒血清反应素滴度检测:所有患者入院后第二日清晨空腹抽取外周静脉血,经离心后取血清,将血清按比例稀释为1∶1,1∶2,1∶4,1∶8,1∶16,1∶32,1∶64和1∶128。采用梅毒快速血浆反应素诊断试剂盒检测血清中的梅毒血清反应素滴度,按照说明书进行结果判读:圆圈内出现絮状物且液体浑浊(产生凝集反应)为阳性,圆圈内颗粒均匀分散(未产生凝集反应)为阴性。
1.3.3 梅毒相关判断标准: 梅毒血清固定:梅毒患者经过规范驱梅治疗后,非梅毒螺旋体抗体滴度下降到一定程度不再下降,长期维持在低滴度的现象;梅毒转阴:梅毒患者经过规范驱梅治疗后,非梅毒螺旋体血清学试验转阴。Ⅰ期梅毒:临床表现为硬下疳,梅毒血清学试验检测为阳性。Ⅱ期梅毒:临床表现为Ⅱ期梅毒疹,可有Ⅰ期病毒史,病期在二年以内,血清学检测为阳性。
1.4 统计学分析 数据用SPSS25.0软件进行统计学分析,计数资料以n表示,采用χ2检验;计量资料以均数±标准差(±s)表示,两组比较采用t检验,多组比较采用单因素方差分析(进一步两两比较用SNK-Q检验);Logistic回归分析梅毒患者发生血清固定的影响因素;受试者工作特征(ROC)曲线分析外周血miR-31和miR-192水平对梅毒患者发生血清固定的诊断价值。P<0.05为差异有统计学意义。
2 结果
2.1 三组外周血miR-31,miR-192水平比较 见表1。血清固定组、转阴组外周血miR-31,miR-192水平低于健康对照组(q=25.789,13.736; 25.907,15.680,均P<0.05),血清固定组外周血miR-31,miR-192水平低于转阴组(q=12.343,10.656,均P<0.05),差异具有统计学意义(均P<0.05)。
表1 三组外周血miR-31,miR-192水平比较(±s)

表1 三组外周血miR-31,miR-192水平比较(±s)
项目血清固定组(n=37)转阴组(n=44)健康对照组(n=50)F值P值miR-310.36±0.100.68±0.131.01±0.22167.815<0.001 miR-1920.51±0.120.73±0.191.03±0.05173.090<0.001
2.2 不同临床病理分期梅毒患者外周血miR-31,miR-192水平比较 病理分期为Ⅰ期患者组外周血miR-31(0.56±0.13),miR-192(0.76±0.14)水平高于Ⅱ期患者组(0.38±0.10,0.47±0.08),差异具有统计学意义(t=6.842,11.059,均P<0.05)。
2.3 不同反应素初始滴度梅毒患者外周血miR-31,miR-192水平比较 见表2。反应素初始滴度<1∶8、反应素初始滴度为1∶8~1∶32的梅毒患者血清miR-31,miR-192水平高于反应素初始滴度>1∶32梅毒患者(q=6.338,3.223; 10.188,4.735,均P<0.05),反应素初始滴度<1∶8梅毒患者血清miR-31,miR-192水平高于反应素初始滴度为1∶8~1∶32的梅毒患者(q=3.049,5.376,均P<0.05),差异具有统计学意义(均P<0.05)。
表2 不同反应素初始滴度梅毒患者外周血miR-31,miR-192水平比较(±s)

表2 不同反应素初始滴度梅毒患者外周血miR-31,miR-192水平比较(±s)
项目<1∶8梅毒患者组(n=31)1∶8~1∶32梅毒患者组(n=26)>1∶32梅毒患者组(n=24)F值P值miR-310.56±0.180.48±0.120.39±0.0910.057<0.001 miR-1920.80±0.200.64±0.130.49±0.1226.166<0.001
2.4 Logistic回归分析梅毒患者发生血清固定的影响因素 见表3。以梅毒患者是否发生血清固定为因变量(发生=1,未发生=0),miR-31(实测值)、miR-192(实测值)为自变量,行Logistic回归分析,结果显示,miR-31,miR-192均是梅毒患者发生血清固定的保护因素(均P<0.05)。
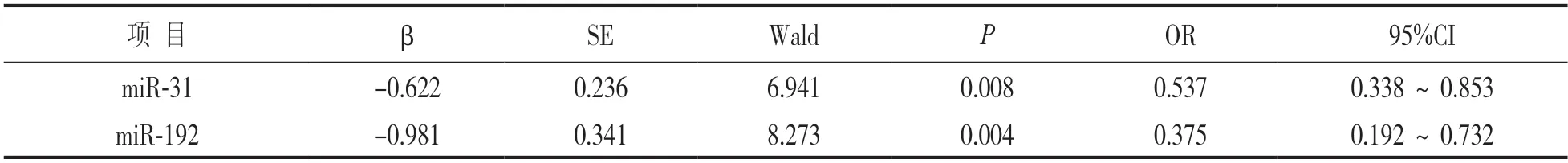
表3 Logistic回归分析梅毒患者发生血清固定的影响因素
2.5 外周血miR 31,miR-192水平对梅毒患者发生血清固定的诊断价值 见图1。外周血miR-31诊断梅毒患者发生血清固定的最佳截断值为0.51,AUC为0.729(95%CI:0.618~0.821),敏感度和特异度分别为75.68%和61.36%,约登(Youden)指数为0.370;miR-192诊断梅毒患者发生血清固定的最佳截断值为0.58,AUC为0.821(95%CI:0.720~0.898),敏感度和特异度分别为86.49%和72.73%,Youden指数为0.592;血清miR-31,miR-192联合检测梅毒患者发生血清固定的AUC为0.927(95%CI:0.847~0.973),敏感度和特异度分别为83.78%和84.09%,Youden指数为0.679。二者联合检测优于外周血miR-31,miR-192各自单独诊断,差异具有统计学意义(Z=3.836,2.563,均P<0.05)。

图1 外周血miR-31,miR-192水平诊断梅毒患者发生血清固定的ROC曲线
3 讨论
早期梅毒症状主要以皮肤黏膜受损为主,具有传染性,经过抗感染治疗后多数症状得到缓解。晚期梅毒可发展为全身性多种脏器不可逆损伤,病情严重者可危及生命[9]。临床治疗时发现部分梅毒患者经过驱梅治疗后仍然会出现阳性,关于这种血清固定状态的具体发生机制尚不清晰,有研究认为梅毒发展影响自身免疫机制[10]。因此从免疫应答方面入手寻找可靠指标为梅毒血清固定诊断提供线索。
miRNA在抗感染免疫调节过程中通过不同的方式调节下游炎症相关靶基因,从而影响病情发展。近期有不少研究者发现,miRNA参与梅毒血清固定的免疫机制调节。韩雪梅等[4]人发现,miR-195,miR-223和miR-589在血清固定患者体内上调,通过调节免疫反应介导梅毒患者血清固定过程。温晶等[11]人发现,梅毒血清固定患者同时存在Th1/Th2,调节性T细胞(Treg)/Th17失衡现象,影响梅毒血清固定患者体内免疫应答水平。章婧等[12]人研究发现,梅毒血清固定患者体内与免疫相关Th17/Treg平衡发生失调,参与血清固定的过程。
miR-192在机体体液中含量丰富,除了参与多种癌症疾病外,对消化道、呼吸道等感染性疾病具有重要的免疫调节作用,可以有效诊断感染性疾病及其预后[7]。BULFONI等[13]人发现,miR-192在丙型肝炎病毒(hepatitis C virus,HCV)/人类免疫缺陷病毒(human immunodeficiency virus,HIV)并发感染的患者中表达下调,可减弱病毒翻译和基因组稳定性。HIV晚期患者体内CD4+细胞数量下降,miR-192下调可抑制CD4+细胞的表达[14]。CD4+是一种特殊类型的淋巴细胞,是CD4阳性的T淋巴细胞,是一种辅助淋巴细胞,在免疫反应当中,起到重要的作用。本研究结果显示,梅毒血清固定患者外周血miR-192水平低于转阴患者、健康体检者,是梅毒患者发生血清固定的保护因素,与BULFONI等[13]人研究结果类似。提示miR-192对梅毒血清固定具有重要调控作用,可作为早期诊断梅毒患者发生血清固定的生物标志物。分析原因,可能是机体感染梅毒后,miR-192下调抑制T细胞增殖与分化,使体内免疫相关平衡失调,参与血清固定调节过程。
miR-31通过直接靶向上游STAT1转录因子抑制T细胞转录因子(T cell transcription factors,T-bet)的表达参与HIV感染的调控,T-bet是调控IFN-γ产生和CD4+T细胞活化的关键因子,因此miR-31可抑制CD4+T细胞活化[15]。吕俊楠等[16]人研究发现,miR-31在HIV感染患者体内呈低表达水平,miR-31可通过影响T细胞活化时的信号通路,调节CD4+T细胞活化,对HIV感染早期免疫损伤机制有重要意义。由此可见,miR-31通过对CD4+T细胞的调控作用参与免疫应答反应。本研究结果显示,梅毒血清固定患者外周血miR-31水平低于健康体检者、转阴患者,是影响梅毒发生血清固定的保护因素。提示,miR-31对梅毒血清固定具有重要调控作用,有望成为生物标志物用来诊断梅毒患者发生血清固定。分析原因,可能由于梅毒侵入人体后,miR-31下调通过抑制CD4+T细胞活化,使体内免疫相关平衡失调,降低免疫系统功能,参与血清固定发生过程。
早期梅毒临床症状较轻,对机体损害程度较小,但是对于进展期梅毒来说,其可随着血液循环系统移行,导致全身性感染,这也是梅毒患者死亡的主要原因之一[4]。梅毒血清固定发生与多种因素有关,例如是否进行规范治疗、梅毒分期、反应素初始滴度等。患者一旦进入血清固定后,重复治疗对降低滴度影响不大[17]。本研究发现,一期患者外周血miR-31,miR-192水平显著高于二期患者,结合上述miR-31,miR-192血清固定的影响可推测,二期患者易发生血清固定现象。本研究进一步发现,随着反应素初始滴度比的增加梅毒患者外周血miR-31,miR-192水平逐渐降低。由于反应素初始滴度>1:8患者发生血清固定概率较高[18],结合上述结果分析,高水平miR-31,miR-192可降低梅毒患者发生血清固定的概率。另外,本研究通过ROC曲线分析显示,外周血miR-31,miR-192联合诊断梅毒患者发生血清固定优于各自单独诊断。提示,miR-31,miR-192联合诊断梅毒血清固定具有较高效能。综上所述,外周血miR-31,miR-192在梅毒血清固定患者体内水平下调,二者联合诊断梅毒血清固定具有较高效能,为诊断梅毒血清固定的方法提供了一定的参考,在临床上具有一定的可推广价值。由于研究样本量较少,存在不足,后续将加大样本量继续挖掘梅毒血清固定的具体发病机制。

