老年HIV感染患者HAART治疗后CD4+T淋巴细胞水平和病毒载量变化及其影响因素
门娅玲 何伶俐 赵春蓉 王嘉川
(成都医学院第二附属医院·核工业四一六医院感染科,四川 成都 610051)
人免疫缺陷病毒(HIV)是一种以攻击人体辅助T淋巴系统为主的逆转录病毒,HIV感染后可广泛存在于患者体液中,具有长期传染性,若无有效控制,HIV可引起免疫功能进行性破坏,增加机会性感染、恶性肿瘤风险,因此需积极抗病毒治疗〔1〕。高效抗逆转录病毒联合疗法(HAART)指采用3种或以上抗病毒药物联合治疗HIV感染的方式,目的在于使病毒载量下降至检测下线、减少传播风险、促进免疫功能重建、降低获得性免疫缺陷综合征(艾滋病)发病及死亡率、提高生存质量等,因此其疗效直接影响患者自身生存及临床艾滋病防控质量〔2〕。HIV感染可直接攻击CD4+T淋巴细胞,导致其水平降低,使机体免疫功能下降;HIV病毒载量是直观反映HIV病毒复制水平的指标,与疾病进展速率及预后关联密切,因此CD4+T淋巴细胞、HIV病毒载量常用于感染者病情及HAART治疗效果评估〔3〕。老年HIV感染一般指50岁及以上的HIV感染人群,数据显示〔4〕,全球老年HIV感染人数超过400万,占HIV感染者总数的10%左右。本研究探讨老年HIV感染患者HAART治疗后CD4+T淋巴细胞水平和病毒载量变化及影响因素。
1 资料与方法
1.1一般资料 回顾性分析成都医学院第二附属医院·核工业四一六医院2018年3月至2021年3月接受HAART治疗的135例老年HIV感染患者的临床资料,其中男116例,女19例,年龄60~81岁,平均(70.8±5.5)岁。本研究符合赫尔辛基宣言,患者及家属知情并同意配合本研究。纳入标准:①均为新确证的HIV-1抗体阳性病例;②年龄≥60岁;③入组前无抗病毒治疗;④开启HAART治疗后可取得随访配合,且治疗态度、积极性良好;⑤治疗前均有CD4+T淋巴细胞及病毒载量检测数据;⑥临床及随访资料(随访时间≥1年)完善。排除标准:①于本中心治疗前已有抗HIV治疗史;②处于艾滋病期,或合并严重、未控制的机会性感染者;③合并恶性肿瘤、肝肾功能不全、严重代谢性疾病;④伴精神疾病、认知障碍者;⑤治疗中断或缺乏完整随访资料者。
样本量估算:参照广义多因素分析设计样本例数估算的一般规则〔5〕,样本量至少为变量数目的5~10倍,本研究涉及变量(性别、年龄、感染途径、受教育程度、婚姻状态、确证至治疗间隔、HAART初始治疗方案、换药情况、基线CD4+T淋巴细胞、基线病毒载量、合并病毒感染情况、免疫学疗效、病毒学疗效)共13个,样本量(5~10)×13=65~130,考虑到数据缺失,增加10%样本量,最终确定样本量(5~10)×13×(1+10%)=72~143例。
1.2方法
1.2.1HAART治疗方案 参考《中国艾滋病诊疗指南(2018版)》〔6〕(以下简称“指南”)推荐治疗方案,本次研究初始治疗主要分为2类HAART治疗方案,一类是含依非韦伦(EFV)方案,包括拉米夫定(3TC)+替诺福韦(TDF)+EFV,3TC+齐多夫定(AZT)+EFV,3TC+阿巴卡韦(ABC)+EFV;另一类是单片复方制剂方案,包括ABC/3TC/多替拉韦(DTG),丙酚替诺福韦(TAF)/恩曲他滨(FTC)/埃替格韦(EVG);具体药物用法、用量与指南保持一致,HAART启动后,需终身治疗,治疗期间,每3~6个月检测1次CD4+T淋巴细胞及病毒载量,评估药物不良反应、病毒耐药性等情况,必要时更换药物。
1.2.2临床资料收集 自制《临床资料调查表》,结合患者病历系统,记录性别、年龄、感染途径、受教育程度、婚姻状态、确证至治疗间隔、HAART初始治疗方案、换药情况、基线CD4+T淋巴细胞、基线病毒载量、合并乙肝病毒(HBV)或丙肝病毒(HCV)感染情况等信息。
1.2.3CD4+T淋巴细胞及病毒载量检测 采用流式细胞仪(美国BD公司FC500型)检测外周血CD4+T淋巴细胞及计数;采用荧光定量-聚合酶链反应(PCR)〔7〕检测血浆HIV载量,检测仪器为美国雅培公司Abbott m2000rt荧光定量PCR仪,检测步骤均严格按试剂盒要求及实验室标准程序进行。
1.3治疗结局定义 参照指南中相关标准拟定治疗结局定义,免疫重建:启动HAART持续治疗后1年,CD4+T淋巴细胞较治疗前升高≥100个/μl视为免疫重建良好,<100个/μl视为免疫重建不良。病毒学失败:启动HAART持续治疗48 w后,血浆HIV-RNA持续≥200 拷贝/ml,或先实现病毒学完全抑制,后又见HIV-RNA≥200 拷贝/ml状态。
1.4统计学分析 采用SPSS24.0软件进行t检验、Z检验、χ2检验、多因素Logistic回归分析。
2 结 果
2.1治疗前后CD4+T淋巴细胞水平变化 治疗前,135例患者CD4+T淋巴细胞计数24~644个/μl,平均(152.64±88.76)个/μl;治疗后1年,患者CD4+T淋巴细胞计数82~951个/μl,平均(286.72±104.48)个/μl;治疗前后比较差异有统计学意义(t=9.220,P<0.001)。
治疗前,患者CD4+T淋巴细胞计数<200个/μl 87例(64.44%),200~349个/μl 26例(19.26%),≥350个/μl 22例(16.29%);治疗后1年,<200个/μl 41例(30.37%),200~349个/μl 56例(41.48%),≥350个/μl 38例(28.15%);治疗前后差异有统计学意义(χ2=31.744,P<0.001)。根据患者治疗前后CD4+T淋巴细胞计数变化,可分为免疫重建良好组(增幅≥100个/μl)93例,免疫重建不良组(增幅<100个/μl)42例。
2.2治疗前后血浆病毒载量变化 治疗前,135例患者病毒载量200~1 000万〔32 005(426,74 828)〕拷贝/ml;治疗后1年,病毒载量40~10 048〔135(50,264)〕拷贝/ml;治疗前后差异有统计学意义(Z=4.952,P<0.001)。治疗前,病毒载量<1 000拷贝/ml 10例(7.41%),1 000~9 999拷贝/ml 42例(31.11%),1万~10万拷贝/ml 49例(36.30%),>10万且≤100万拷贝/ml 21例(15.56%),>100万拷贝/ml 13例(9.62%);治疗后,病毒载量<200拷贝/ml 98例(72.59%),200~999拷贝/ml 28例(20.74%),1 000~9 999拷贝/ml 9例(6.67%),≥1万拷贝/ml 0例(0.00%);治疗前后差异有统计学意义(χ2=210.879,P<0.001)。根据患者治疗前后血浆病毒载量控制情况,可分为病毒学成功组(病毒载量<200拷贝/ml)98例(72.59%),失败组(病毒载量≥200拷贝/ml)37例(27.41%)。
2.3影响患者免疫重建不良的单因素分析 年龄、确证至治疗间隔、HAART初始治疗方案、换药情况、基线CD4+T淋巴细胞、基线病毒载量、合并HBV或HCV感染与患者免疫重建不良有关(P<0.05);性别、感染途径、受教育程度、婚姻状态与患者免疫重建不良无关(P>0.05)。见表1。
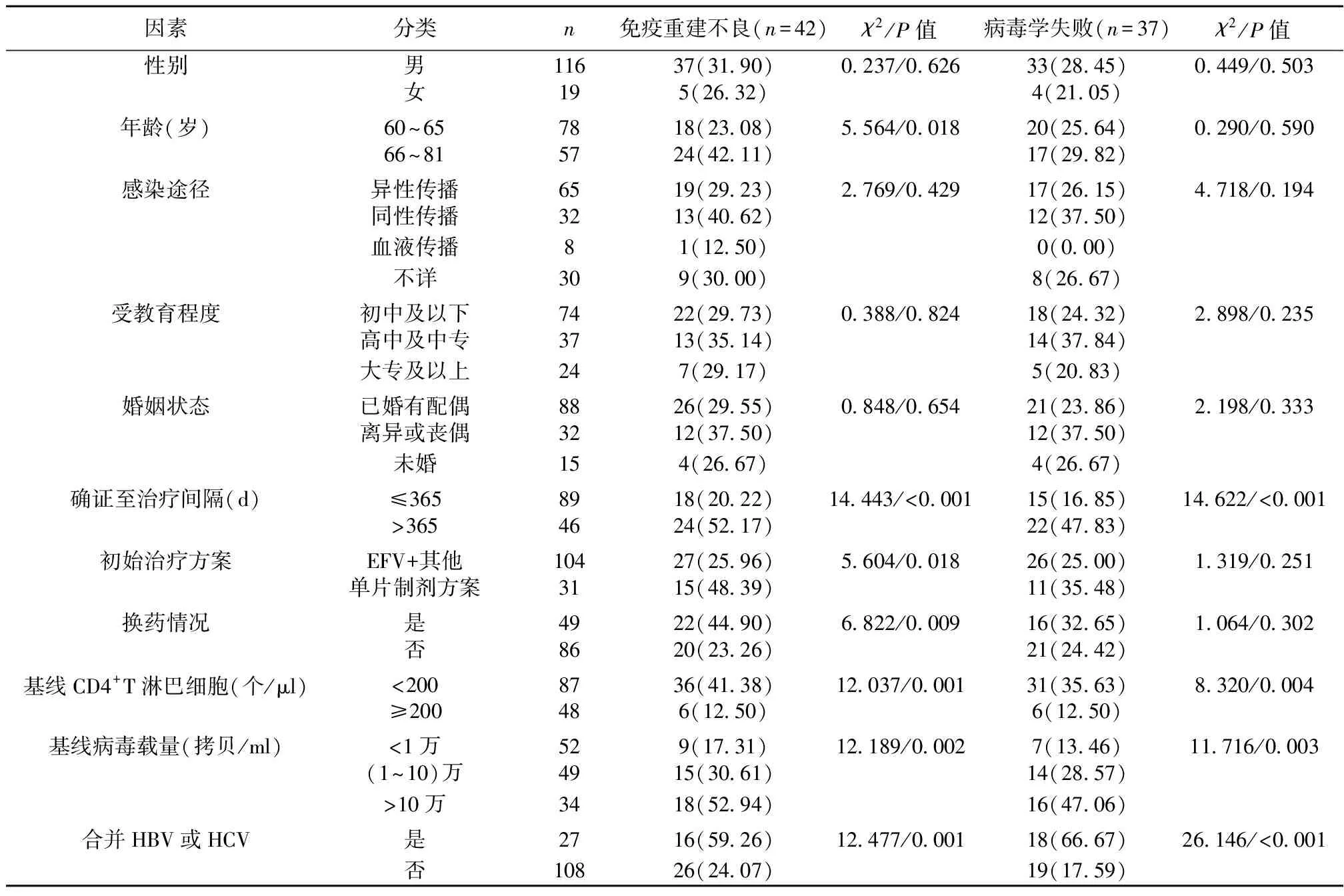
表1 影响患者免疫重建不良和病毒学失败的单因素分析
2.4影响患者病毒学失败的单因素分析 单因素分析显示,确证至治疗间隔、基线CD4+T淋巴细胞、基线病毒载量、合并HBV或HCV感染与患者病毒学失败有关(P<0.05);性别、年龄、感染途径、受教育程度、婚姻状态、初始治疗方案、换药情况与患者病毒学失败无关(P>0.05)。见表1。
2.5影响患者免疫重建不良的多因素Logistic回归分析 变量赋值为:因变量:免疫重建良好=0,免疫重建不良=1;多因素Logistic回归分析显示,确证至治疗间隔>365 d、基线病毒载量>10万拷贝/ml、合并HBV或HCV是患者免疫重建不良的危险因素(P<0.05),基线CD4+T淋巴细胞≥200个/μl是其保护因素(P<0.05)。见表2。
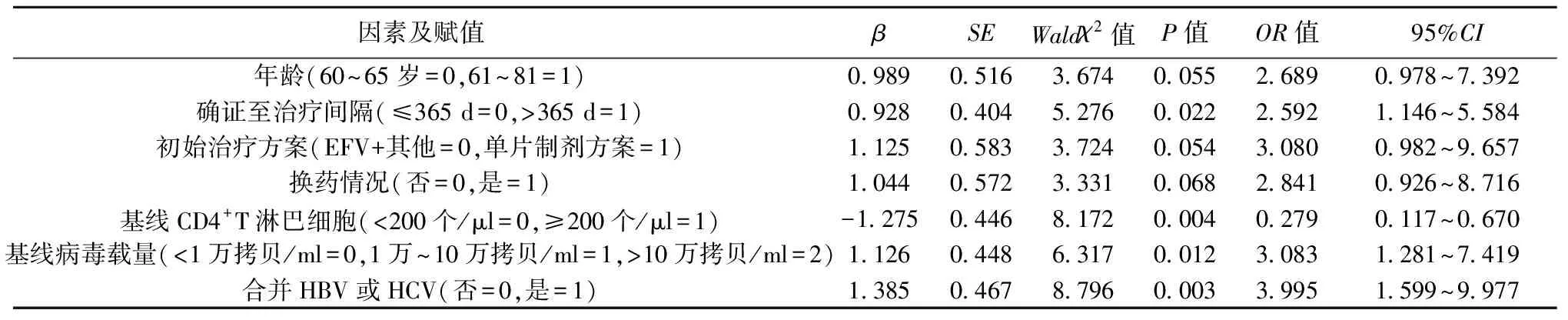
表2 影响患者免疫重建不良的多因素Logistic回归分析
2.6影响患者病毒学失败的多因素Logistic回归分析 多因素Logistic回归分析显示,确证至治疗间隔>365 d、基线病毒载量>10万拷贝/ml、合并HBV或HCV是患者病毒学失败的危险因素(P<0.05),基线CD4+T淋巴细胞≥200个/μl是其保护因素(P<0.05)。见表3。
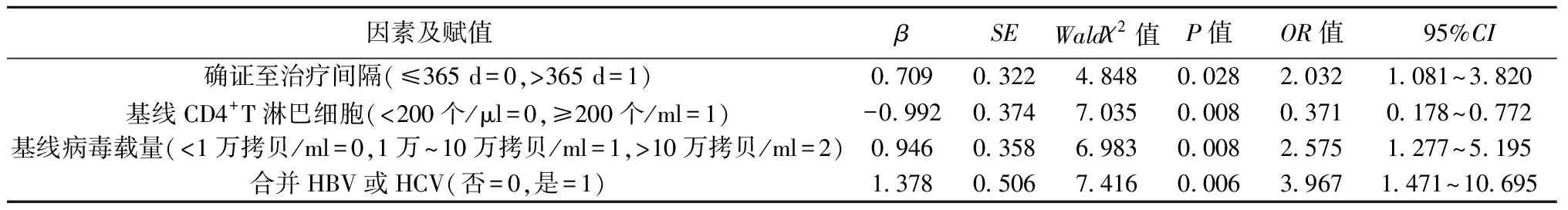
表3 影响患者病毒学失败的多因素Logistic回归分析
3 讨 论
既往关于HIV感染研究多集中于18~49岁性活跃期人群,而老年人一般不作为HIV感染高危人群进行研究,但随着人口老龄化加剧,老年HIV感染报道越来越多,关于其研究也逐步引起临床重视〔8〕。对老年HIV感染者而言,其本身存在生理功能下降、免疫衰老现象,可表现为胸腺组织萎缩明显、骨髓造血干细胞数量少,故其T/B淋巴细胞增殖、分化能力较低,不利于免疫功能恢复,加之受社会观念、经济状态等影响,HIV感染后可能对老年患者身心健康影响更为强烈〔9〕;另外,老年HIV感染患者因基础疾病多、药物清除率下降、多重用药等情况,在行HAART治疗时,药物不良反应问题也较为突出,可能直接导致治疗不耐受、治疗方案不断变化〔10〕。由此可见,老年HIV感染者为脆弱群体,但这类人群HIV感染防控容易被忽视,可能增加HIV传播风险,因此对于临床确证的老年HIV感染患者,有必要分析其HAART治疗效果及影响因素。
CD4+T淋巴细胞是HIV主要靶细胞,其破坏可直接导致机体细胞免疫缺陷,增加患者机会性感染及恶性肿瘤风险,CD4+T淋巴细胞水平被认为是判断免疫状态的最好指标〔11〕。本文结果提示,HAART治疗能有效提升患者CD4+T淋巴细胞,与既往报道一致〔12〕。但根据指南标准,本研究提示,仍有较高比例的患者经HAART治疗后免疫状态不能得到较好恢复。抑制病毒复制,尽可能降低血浆病毒载量甚至到不可检出水平,对降低HIV传播风险、延缓HIV进展至关重要,因此临床应重视HIV感染者HAART治疗后病毒载量检测〔13〕。本文结果提示抗病毒失败。
本研究发现,确证至治疗间隔>365 d、基线病毒载量>10万拷贝/ml、处于症状期、合并HBV或HCV是均老年HIV感染者免疫重建不良、病毒学失败的危险因素,而基线CD4+T淋巴细胞≥200个/μl是保护因素。分析原因:①确证至治疗间隔:HIV感染后,病毒可持续增殖,同时机体免疫功能会呈进行性破坏,故确证到治疗间隔越久,越不利于患者CD4+T淋巴细胞数量回升和病毒载量抑制〔14〕。目前建议患者不管基线CD4+T淋巴细胞如何,一旦确诊HIV感染,均应立即开始治疗,但在实际情况中,受各种因素影响,如慢性病发作状态、机会性感染控制情况、经济条件、病毒耐药变异等,不同患者确证至治疗间隔差异较大〔15〕。结合本研究结果,如何保障患者治疗及时性值得临床重视。②基线CD4+T淋巴细胞:基线CD4+T淋巴细胞水平越低,意味着免疫功能破坏越严重,患者免疫重建恢复所需时间也越差;反之,较高的基线CD4+T淋巴细胞水平更利于HAART治疗后免疫功能恢复,对抑制病毒有积极作用〔16〕。俞海亮等〔17〕报道指出,基线CD4+T淋巴细胞较高水平时行抗病毒治疗更利于CD4+T淋巴细胞恢复,支持本研究结果。③基线病毒载量:基线病毒载量越高,说明HIV-RNA在机体复制越强,人体免疫系统受损速度也越快;而且病毒载量越高,可能与HIV耐药突变更快有关〔18〕,故基线病毒载量可影响免疫重建。也有研究指出〔19〕,HIV感染者基线病毒载量>10万拷贝/ml者,其病毒反弹风险明显高于≤10万拷贝/ml者,支持本研究结果。④合并HBV或HCV感染:HIV感染者中HBV或HCV感染率较普通人群更高,合并HBV或HCV感染在HIV感染者中不容忽视〔20〕。有研究指出〔21〕,HBV或HCV感染可能通过影响肝功能来影响患者免疫重建。还有报道显示〔22〕,HBV或HCV感染可能对HIV复制有促进作用,从而加速了T淋巴细胞亚群损害,降低其对病毒清除作用,故合并HBV或HCV不利于患者治疗后CD4+T淋巴细胞恢复及病毒抑制。针对上述危险因素,临床对应尽早开启老年HIV感染者HAART治疗,重视患者HBV、HCV共病情况及肝功能筛查,并针对性制定诊疗方案,治疗期间应加强CD4+T淋巴细胞及病毒载量监测,必要时可在HAART治疗基础上,联合其他治疗方式如中医药治疗、细胞因子制剂使用等帮助患者进行免疫重建,提高病毒抑制效果。
综上,老年HIV感染者经HAART治疗后CD4+T淋巴细胞计数可明显升高,病毒载量可明显下降,但仍有部分患者免疫重建不良、病毒学治疗失败,这与患者确证至治疗间隔、基线CD4+、基线病毒载量、合并HBV或HCV感染情况关联密切,临床应重视相关危险因素,并积极采取针对性干预措施。本研究创新点在于聚集老年HIV感染者HAART治疗效果,从免疫学、病毒学不同角度分析影响疗效因素;本研究不足之处在于,实际影响HAART治疗的因素可能更多,比如抗病毒药物耐药性、用药依从性等,后期可扩大样本进一步探究;对其他可能造成结果偏倚的因素,积极采取措施规范管理。

