紫苏醛抑制黄曲霉生长机理研究
仝文君 张玉申 陈晓璐 雷瑶 周云静 都立辉



摘要:研究分析了紫苏醛对黄曲霉细胞壁的作用机理。通过对麦角固醇含量、扫描电镜菌丝形态观察、胞内物质外泄等指标的测定以及胞壁相关基因表达量的变化,确定紫苏醛通过抑制黄曲霉细胞膜组分合成而破坏细胞膜完整性。结果表明:紫苏醛对黄曲霉最小抑菌浓度为0.125 μL/mL;霉菌质膜中的麦角固醇含量由582.75 μg/g下降到281.85 μg/g;紫苏醛处理后的黄曲霉菌体受损严重,孔洞与凹陷明显,菌体变形;胞内物质大量外泄,霉菌细胞膜完整性降低。以上结果表明紫苏醛通过抑制CYP51B、CHSB、CHSC等胞壁相关基因,抑制麦角甾醇合成,破坏质膜完整性,进而致使细胞膜渗透性被破坏,胞内物质外泄。
关键词:紫苏醛;黄曲霉;胞壁基因;抑菌机理
中图分类号:Q939 文献标志码:A DOI:10.16465/j.gste.cn431252ts.20230426
基金项目:江苏省研究生科研与实践创新计划(KYCX21_1531)。
Study on mechanism of perillaldehyde inhibiting the growth of Aspergillus flavus
Tong Wenjun, Zhang Yushen, Chen Xiaolu, Lei Yao, Zhou Yunjing, Du Lihui
(College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing, Jiangsu 210023)
Abstract: In this study, we analyzed the mechanism of perillaldehyde in Aspergillus flavus cell walls. By observing the contents of ergosterol, the morphology of mycelia under scanning electron microscope, the determination of intracellular substance leakage, and the changes of cell wall related gene expression, perillaldehyde was determined to inhibit A. flavus fine synthesis of membrane components destroying membrane integrity. The results showed that the minimum inhibitory concentration of perillaldehyde against A. flavus was 0.125 μL/mL. The ergosterol content in mycoplasma plasma membrane decreased from 582.75 μg/g to 281.85 μg/g. After perillaldehyde treatment, A. flavus was seriously damaged, with obvious holes and depressions, and the bacteria were deformed. A large amount of intracellular substances leaked out and the integrity of mold cell membrane was reduced. These results indicated that perillaldehyde inhibited ergosterol synthesis and damaged plasma membrane integrity by inhibiting CYP51B, CHSB, CHSC and other cell wall related genes, thus resulting in the destruction of membrane permeability and the leakage of intracellular substances.
Key words: perillaldehyde, Aspergillus flavus, cell wall gene, bacteriostasis mechanism
黄曲霉(Aspergillus flavus)作为在大量淀粉基质上生长的杂草状霉菌[1],污染了坚果、玉米、大豆、花生、稻谷等经济作物。在粮食的生长、收获、仓储、加工、运输等环节中,也会产生大量的致癌性剧毒化合物黄曲霉毒素(aflatoxin, AFT)[2]。该毒素除了降低粮食本身的营养价值,造成较大经济损失以外,对动物和人体的健康也造成极大威胁[3]。黄曲霉毒素具有很强的诱导异常性、免疫抑制性和致癌性,肝脏损害是其致病性的主要表现[4]。机体的免疫受抑制,进而致使抗病力降低[5-6]。因此,控制黄曲霉的生长繁殖以及毒素的代谢累积,对保障储粮安全与质量控制具有重要的社会意义。令人唏嘘的是,尽管各种抑菌物质被广泛用于抑制此类真菌的生长[7-8],但耐药菌株层出不穷,在毒性、高残留、难降解和高成本等各方面仍然存在巨大的缺点[9-10]。因此,介于合成抗真菌剂的多重潜在耐药性和副作用[11],人们越来越关注天然抗真菌剂。植物來源的天然抗真菌剂以其广谱抗菌性、生物可降解性、高挥发性和低残留等特点已被认为是传统化学抑菌剂的理想替代品[12-13]。
紫苏醛作为紫苏中提取的一种天然的单萜物质[14],具有多种生物学特性,包括抗炎、抗真菌、抗感染、抗氧化、抗癌、抗过敏及降脂等生物学作用[15]。有研究[14,16]指出,紫苏醛对丝状真菌如黄曲霉菌、黑曲霉菌和白色念珠菌具有显著的杀菌作用。故紫苏醛在抑菌方面有广阔的应用前景。近年来,真菌细胞壁因其在真菌胞壁完整性中的重要作用,其胞壁组分关键合成酶常被作为开发新型杀菌药物的靶点被认为是开发新抗真菌治疗的可能靶点[17]。石程仁等[18]发现0.2 mg/mL的紫苏醛可抑制黄曲霉生长,并具有较高的抑制黄曲霉产毒能力。Tian等[19]发现紫苏醛能够通过抑制黑曲霉菌细胞壁麦角甾醇的合成发挥杀菌作用。因此有必要对紫苏醛作用于黄曲霉的抑菌机理做进一步研究。
本实验主要测定与黄曲霉细胞壁表型相关的麦角固醇、菌丝形态观察、电导率等指标,并对与胞壁合成相关的葡聚糖合成酶、4种几丁质合成酶等进行荧光定量,逐层递进地研究紫苏精油对黄曲霉菌细胞壁的作用机理,以期为进一步阐述紫苏醛抑菌机理提供理论依据和新的研究思路。
1 材料与方法
1.1 材料与仪器
马铃薯葡萄糖琼脂培养基(PDA):北京陆桥技术有限责任公司;马铃薯葡萄糖肉汤(PDB):上海博微生物科技有限公司。
乙醇(分析纯):国药集团化学试剂有限公司;血球计数板:上海求精生化试剂仪器有限公司;紫苏醛:上海源叶生物科技有限公司;戊二醛(分析纯)、乙醇(分析纯)、氢氧化钾(分析纯)、正庚烷(分析纯):阿拉丁试剂有限公司;钾离子试剂盒:南京建成生物有限公司;反转录试剂盒、荧光定量试剂盒:诺唯赞生物科技有限公司。
AB104-N型电子天平:上海第二天平仪器厂;FE38型电导率仪:上海梅特勒-托利多仪器有限公司;THZ-D型台式恒温振荡器:上海百典仪器设备有限公司;GI54DP型立式高温高压灭菌锅:致微公司;日立SU8020型扫描电镜:日本日立公司;CJ-2D型超净工作台:上海三发科学仪器有限公司;Synergy H1型酶標仪:美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 黄曲霉菌孢子液制备
取纯化后的野生型(WT)黄曲霉菌株接种在PDA培养基上,在30 ℃黑暗培养4~6 d后,使用灭菌后的孢子洗脱液进行洗脱收集,用血球计数板对孢子进行计数,终浓度调至1×106个/mL后备用。
1.2.2 最小抑菌浓度(MIC)
根据Rodriguez-Tudela等[20]的方法,采用二倍稀释法测定紫苏醛的MIC。以不出现肉眼可见菌落的最低抑菌浓度定义为MIC。
1.2.3 麦角固醇含量测定
1.2.4 扫描电镜观察
参考Ju等[22]的方法略作修改。2%孢子液接种至含有不同浓度(0、1/2 MIC、1 MIC、2 MIC)紫苏醛的PDB培养基,30 ℃,160 r/min培养48 h,取适量菌丝体,用0.1 mol/L磷酸盐缓冲盐(PBS,pH 7.2)洗涤并收集菌丝体。2.5%戊二醛固定2 h,0.1 mol/L磷酸盐缓冲液冲洗3次,梯度乙醇系列脱水干燥后,进行喷金镀膜处理,10.0 kV下用扫描电镜观察菌丝体形态特征。
1.2.5 细胞膜渗透性测定
根据Bomfin等[23]的测定方法稍加修改,采用电导率来表示渗透率的变化。2%孢子液接种至PDB,30 ℃、160 r/min培养48 h,抽滤得菌丝体。配制含有1/2 MIC、1 MIC、2 MIC紫苏醛的无菌水,对照组为不添加紫苏醛的无菌水。取1 g菌丝置于30 ℃、120 r/min培养12 h,间隔2 h取样。用电导率仪测定黄曲霉的电导率。
1.2.6 紫苏醛对黄曲霉菌丝K+泄露的影响
2%孢子液接种至PDB,30 ℃、160 r/min培养48 h,抽滤得菌丝体。配制含有1/2 MIC、1 MIC、2 MIC紫苏醛的无菌水,对照组为不添加紫苏醛的无菌水。取1 g菌丝置于30 ℃、120 r/min培养12 h,间隔3 h取样。用钾离子试剂盒测定K+ 的含量。
1.2.7 RNA提取与荧光定量PCR(qRT-PCR)
取不同紫苏醛浓度处理的菌株(1/4 MIC、1/2 MIC和3/4 MIC)培养48 h,以不添加紫苏醛培养24 h的黄曲霉作为对照组。取液氮研磨后的菌体100 mg,加1 mL Trizol,匀浆处理,提取菌株RNA,超微量分光光度计测定提取RNA的纯度和质量。用反转录试剂盒反转录成cDNA。用荧光定量PCR仪检测相关基因相对表达量。
1.3 数据处理
每组实验重复3次,实验结果以平均值±标准差表示,采用SPSS 17.0进行数据处理与分析,通过邓肯检验进行单因素方差分析,显著性差异P<0.05。
2 结果与分析
2.1 最小抑菌浓度
如图1所示,不添加紫苏醛的野生型对照组,孢子正常萌发,芽管延伸,基本生长成菌丝体状;紫苏醛浓度较低(0.031 25~0.125 μL/mL)时,随紫苏醛浓度的升高,黄曲霉孢子芽管长度逐渐变短,交联不再致密,萌发被抑制;苏醛浓度为0.25、0.5 μL/mL时,孢子不再萌发。表明黄曲霉的MIC为0.125 μL/mL。
2.2 麦角固醇含量测定
黄曲霉经0、0.031 25、0.062 5、0.125 μL/mL的紫苏醛处理后,其麦角固醇含量如图2所示,处理组麦角固醇含量较对照组的显著降低(P <0.05),且随着紫苏醛浓度的增加,菌体麦角固醇含量逐渐降低。麦角固醇是霉菌细胞壁的主要成分,是评价细胞膜完整性的重要指标。麦角固醇的合成受阻将会导致细胞膜功能的显著障碍,使胞内物质泄露。Ferreira等[24]研究表明,麦角甾醇大多具有抑制麦角甾醇生物合成的作用,会损害蛋白质的完整性和功能,导致渗透紊乱,从而影响真菌生长和增殖。李汶玥等[25]研究发现,二氧化氯及丁香肉桂精油均会影响禾谷镰刀菌细胞膜的完整性,麦角固醇含量同样出现了被抑制的现象,导致细胞膜渗透性增强,从而抑制菌丝生长。由此可知,紫苏醛通过破坏霉菌细胞壁的主要成分麦角固醇抑制黄曲霉生长,且这种抑制具有浓度依赖性。

2.3 扫描电镜观察
由图3可知,未经紫苏醛处理的菌丝形态完整,菌丝整齐、均匀、表面光滑。而用0.031 25 μL/mL紫苏醛处理的菌丝,表面变得不平整,部分产生褶皱与变形,0.062 5 μL/mL紫苏醛处理的菌丝体,出现大量孔洞与凹陷,当浓度增加到0.125 μL/mL时,菌丝体损伤更严重,甚至出现断裂。吕好新等[26]研究了肉桂-山苍子复合精油对黑曲霉的影响,证实精油处理的黑曲霉BQM菌丝体损伤严重,发生皱缩、干瘪、凹陷等变形现象。陈可欣等[27]研究表明,香樟精油处理后的灰绿曲霉细胞变形严重,霉菌表面明显受损,精油处理会改变灰绿曲霉细胞的完整性与膜渗透性。由此推测,随着紫苏精油处理浓度的增加,菌丝体形态被严重破坏,细胞膜完整性丧失引起细胞膜结构严重受损,菌丝体内含物流出导致黄曲霉菌生长受阻。
2.4 细胞膜渗透性测定
在0~10 时内,对照组未检测到明显变化,而经不同浓度紫苏醛处理的黄曲霉,電导率表现出了不同的增加趋势(图4(a)),电导率随着时间的推移,逐渐升高,呈正相关性。暴露12 h后,0.031 25、0.062 5、0.125 μL/mL紫苏醛处理组的电导率分别升至(170.6±6.53)、(238.6±6.01)、(269.1±9.98) μS/cm,显著高于对照组。此现象与Hu等[28]的研究结果一致。这表明高浓度的紫苏醛会导致细胞内成分泄漏和电解质流出,使电导率显著升高。
在0~12时,不同浓度紫苏醛处理后的菌体的K+外泄浓度与对照组相比,均表现出明显差异(图4(b)),尤以1 MIC和2 MIC最为显著。其中菌体在紫苏醛处理后的3~9 h,K+含量上升趋势最为明显。刘欢等[29]研究发现复配精油破坏菌丝细胞膜结构,内部的K+、Na+等离子流出,且随着精油浓度增加,细胞溶出物的释放量和细胞膜渗透性明显增加。蒋梦曦等[30]发现,Iturin A处理能使缓冲液中K+离子浓度显著增加,表明Iturin A对匍枝根霉菌丝的细胞膜造成一定破坏,使得细胞膜上形成孔洞,胞内物质外泄。这表明高浓度的紫苏醛能在更短时间内对黄曲霉菌丝细胞膜造成破坏,且破坏程度剧烈,致使K+浓度急剧增加。其菌体细胞膜受到了不可逆的损伤。
本研究中电导率和电解液泄漏的增加证实菌体自身保护屏障被打破,紫苏醛通过破坏细胞膜完整性对黄曲霉造成不利影响。
2.5 荧光定量PCR
经紫苏醛处理的黄曲霉的麦角固醇(CYP51B)和4种几丁质酶(CHSB、CHSC、CHSE、CHSG)表达下调,较对照组(CK)均显著降低(图5)。CYP51B基因的差异表达证实了紫苏醛处理降低了黄曲霉细胞膜中甾醇的生物量,4种几丁质酶的差异表达也证明了紫苏醛处理破坏了黄曲霉细胞壁的完整性。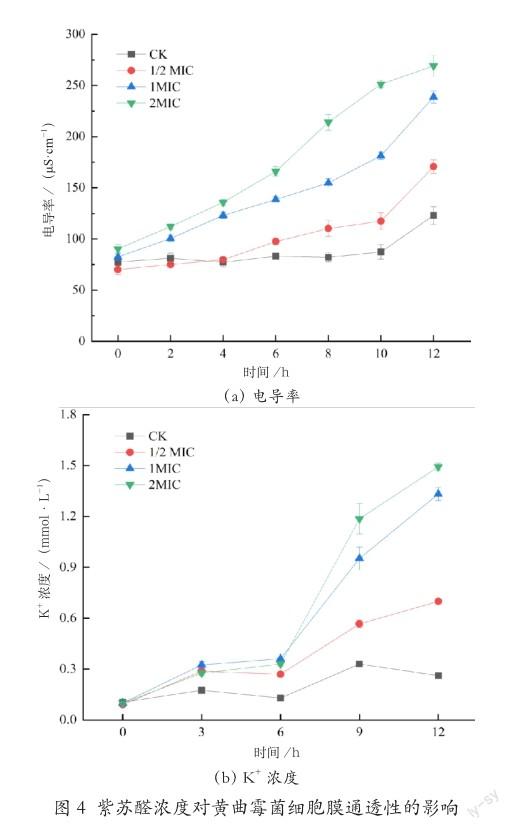

3 结 论
本研究通过对麦角固醇含量、扫描电镜菌丝形态观察、胞内物质外泄等指标的测定以及胞壁相关基因表达量的变化,确定紫苏醛通过抑制黄曲霉细胞膜组分合成而破坏细胞膜完整性。采用二倍稀释法,测定了紫苏醛对黄曲霉的最小抑菌浓度为0.125 μL/mL;紫苏醛处理能够抑制菌丝麦角固醇的合成,导致黄曲霉菌丝内部电解液以及K+的外泄,细胞膜渗透性增强,从而抑制菌丝生长;扫描电镜观察表明,紫苏醛处理使黄曲霉菌体损伤严重,形成大量孔洞与凹陷。紫苏醛处理后的CYP51B以及4种几丁质酶基因表达量显著降低,与上述表型结果具有一致性。
本研究发现,紫苏醛通过调节黄曲霉胞壁相关基因的表达进而影响麦角甾醇的合成,破坏质膜完整性,进而致使细胞膜渗透性被破坏,胞内物质外泄,影响多种酶进行正常的合成和代谢,使菌体代谢受阻。
参 考 文 献
[1] GONG Q W, ZHANG C, LU F X, et al. Identification of bacillomycin D from Bacillus subtilis fmbJ and its inhibition effects against Aspergillus flavus[J]. Food Control,2014,36(1):8-14.
[2]张少波,邓常继,张海涛,等.时间分辨荧光免疫层析法测定粮食中的黄曲霉毒素B1[J].粮食科技与经济,2021,46(6):80-82+110.
[3]戴煌,黄周梅,李占明,等.免疫法在食品黄曲霉毒素检测中的应用[J].中国食品报,2021,21(10):287-304.
[4]高晓芳,胡婷婷,洪冰,等.超高效液相色谱-串联质谱法快速测定小麦中黄曲霉毒素B1[J].粮食科技与经济,2022,47(1):85-87+91.
[5]李敬玺,欧阳素贞,王学平.黄曲霉毒素对机体的损害与硒的保护作用[J].河南职业技术师范学院学报,2003(2):50-54.
[6]白海娜.食品中黄曲霉毒素研究进展[J].食品安全导刊, 2020(33):154.
[7]胡春红,李俐俐,刘坤,等.食品防腐剂对产毒黄曲霉孢子萌发及菌丝生长的抑制作用研究[J].食品工业科技,2014,35(15):282-285.
[8]林日高,林捷,周爱梅,等.对羟基苯甲酸酯类钠盐的抑菌作用及其稳定性研究[J].中国食品添加剂,2002(3):19-23.
[9]翟秀超,冯文旭,吴殿辉,等.植物精油对真菌微生物抑制作用的研究进展[J].食品与发酵工业,2021,47(6):259-266+279.
[10]郭东起.拮抗酵母菌在果蔬采后保鲜中的应用[J].食品研究与开发,2016,37(8):4.
[11]王龑,林威,俞根荣,等.植物精油在食品防霉保质中应用的研究进展[J].核农学报,2021,35(5):1170-1177.
[12]邓业成,宁蕾.4种植物精油的抑菌活性及应用[J].广西师范大学学报(自然科学版),2012,30(3):288-294.
[13] JULIANY R C, PHILIP G C, CORLISS A O, et al. Essential oils as antimicrobials in food systems – a review[J]. Food Control,2015,54:111-119.
[14] TIAN H, QU S, WANG Y Z, et al. Calcium and oxidative stress mediate perillaldehyde-induced apoptosis in Candida albicans[J]. Applied Microbiology and Biotechnology,2017,101(8):3335-3345.
[15] QU S, CHEN L, TIAN H, et al. Effect of perillaldehyde on prophylaxis and treatment of vaginal candidiasis in a murine model[J]. Frontiers in Microbiology,2019,10:1466.
[16] TIAN J, WANG Y Z, LU Z Q, et al. Perillaldehyde, a promising antifungal agent used in food preservation, triggers apoptosis through a metacaspase-dependent pathway in Aspergillus flavus[J]. Journal of Agricultural and Food Chemistry,2016,64(39):7404-7413.
[17] CORTéS J C G, CURTO M A, CARVALHO V S D, et al. The fungal cell wall as a target for the development of new antifungal therapies[J]. Biotechnology Advances,2019,37(6):107352.
[18] 石程仁,张初署,杜咏梅,等.不同植物抑制剂对黄曲霉菌生长和产毒的影响[J].食品安全质量检测学报,2017,8(8): 2892-2897.
[19] TIAN J, WANG Y Z, ZENG H, et al. Efficacy and possible mechanisms of perillaldehyde in control of Aspergillus niger causing grape decay[J]. International Journal of Food Microbiology,2015,202:27-34.
[20] RODRíGUEZ-TUDELA J L, BARCHIESI F, BILLE J, et al. Method for the determination of minimum inhibitory concentration (MIC) by broth dilution of fermentative yeasts[J]. Clinical Microbiology and Infection,2003,9(8):i-viii.
[21] AVAN?O G B, FERREIRA F D, BOMFIM N S, et al. Curcuma longa L. essential oil composition, antioxidant effect, and effect on Fusarium verticillioides and fumonisin production[J]. Food Control,2017,73:806-813.
[22] JU J, XU X M, XIE Y F, et al. Inhibitory effects of cinnamon and clove essential oils on mold growth on baked foods[J]. Food Chemistry,2018,240:850-855.
[23] BOMFIM N D S, NAKASSUGI L P, OLIVEIRA J F P, et al. Antifungal activity and inhibition of fumonisin production by Rosmarinus officinalis L. essential oil in Fusarium verticillioides (Sacc.) Nirenberg[J]. Food Chemistry,2015,166:330-336.
[24] FERREIRA F M D, HIROOKA E Y, FERREIRA F D, et al. Effect of Zingiber officinale roscoe essential oil in fungus control and deoxynivalenol production of Fusarium graminearum Schwabe in vitro[J]. Food Additives & Contaminants: Part A, Chemistry, Analysis, Control, Exposure & Risk Assessment,2018,35(11):2168-2174.
[25] 李汶玥,陳虹宏,袁永俊,等.二氧化氯及丁香、肉桂精油对禾谷镰刀菌生长和孢子萌发的抑制研究[J].粮油食品科技,2022,30(2):197-206.
[26] 吕好新,赵玲丽,霍珊珊,等.肉桂-山苍子复合植物精油对发霉花生黑曲霉BQM菌的抑菌效果[J].中国食品学报, 2021,21(12):222-229.
[27] 陈可欣,骆郑航,李玲,等.香樟精油抑制灰绿曲霉的活性与机理研究[J].中国粮油学报,2021,36(3):71-78.
[28] HU Z Y, YUAN K, ZHOU Q, et al. Mechanism of antifungal activity of Perilla frutescens essential oil against Aspergillus flavus by transcriptomic analysis[J]. Food Control,2021,123:10773.
[29] 刘欢,夏光辉,温春野.复配精油对采后葡萄灰霉菌抑制作用的研究[J].食品工业科技,2014,35(21):115-118+122.
[30] 蒋梦曦,林福兴,别小妹,等.Iturin A与肉桂精油复配提升樱桃番茄贮藏品质[J].食品与发酵工业,2019,45(19):206-212.

