初治肺腺癌患者EGFR基因突变和C-MET基因扩增共存的临床病理及预后分析
王婉玲 许存宝 杨金玲 张宏图 陈一峰

摘要:目的 探讨初治肺腺癌患者驱动基因EGFR突变和C-MET扩增共存的临床病理特征、预后。方法 复阅病理切片,应用扩增阻遏突变系统—实时荧光定量聚合酶链反应检测EGFR基因突变,应用荧光原位杂交检测C-MET扩增,回顾性分析EGFR突变和C-MET扩增共存初治肺腺癌的临床病理及随访资料。结果 11例EGFR突变合并C-MET扩增的送检组织中除1例难以评估组织结构的细胞块,其他10例均出现复杂腺体和实性的高级别成分。临床Ⅳ期的EGFR突变合并C-MET擴增组患病率显著高于EGFR突变组和C-MET扩增组,差异有统计学意义(P均<0.001);而EGFR突变组和C-MET扩增组在各临床分期的患病率差异均无统计学意义(P均>0.05)。EGFR基因和C-MET扩增组间的生存率变化差异无统计学意义(χ2=0.042,P=0.838),而EGFR突变合并C-MET扩增组患者的生存状况显著差于EGFR突变组(χ2=246.72,P<0.001)和C-MET扩增组(χ2=236.41,P<0.001)。结论 EGFR突变叠加C-MET扩增的初治肺腺癌组织学分化较差、进展快、预后差,首诊时往往已经是癌症晚期,临床需重视这种并发的不良驱动分子事件,随着C-MET靶向抑制剂的可及性增加,这部分叠加分子事件的肺腺癌患者将可能从EGFR与C-MET双靶用药中获益。
关键词:肺腺癌;EGFR基因;C-MET扩增
中图分类号: R734.2文献标志码: A文章编号:1000-503X(2023)04-0627-07
DOI:10.3881/j.issn.1000-503X.15416
Clinicopathological Features and Prognosis of Patients Newly Diagnosed With Lung
Adenocarcinoma With Both EGFR Mutation and C-MET Amplification
WANG Wanling1,XU Cunbao1,YANG Jinling1,ZHANG Hongtu2,CHEN Yifeng1
1Department of Pathology,Quanzhou First Hospital Affiliated to Fujian Medical
University,Quanzhou,Fujian 362000,China
2Department of Pathology,National Cancer Center,National Clinical Research Center for Cancer,
Cancer Hospital,CAMS and PUMC,Beijing 100021,China
Corresponding author:CHEN Yifeng Tel:0595-22229842,E-mail:chenyifeng716@qq.com
ABSTRACT:Objective To explore the clinicopathological features and prognosis of the patients newly diagnosed with lung adenocarcinoma with both EGFR mutation and C-MET amplification.Methods The pathological sections were reviewed.EGFR mutation was detected by amplification refractory mutation system-quantitative real-time polymerase chain reaction,and C-MET amplification by fluorescence in situ hybridization.The clinicopathological features and survival data of the patients newly diagnosed with lung adenocarcinoma with both EGFR mutation and C-MET amplification were analyzed retrospectively.Results In 11 cases of EGFR mutation combined with C-MET amplification,complex glands and solid high-grade components were observed under a microscope in 10 cases except for one case with a cell block,the tissue structure of which was difficult to be evaluated.The incidence of lung adenocarcinoma in the patients with EGFR mutation combined with C-MET amplification at clinical stage Ⅳ was higher than that in the EGFR mutation or C-MET amplification group (all P<0.001),whereas the difference was not statistically significant between the EGFR mutation group and C-MET amplification group at each clinical stage (all P>0.05).There was no significant difference in the trend of survival rate between EGFR gene group and C-MET amplification group (χ2=0.042,P=0.838),while the survival of the patients with EGFR mutation combined with C-MET amplification was worse than that of the patients with EGFR mutation (χ2=246.72,P<0.001) or C-MET amplification (χ2=236.41,P<0.001).Conclusions The patients newly diagnosed with lung adenocarcinoma with EGFR mutation plus C-MET amplification demonstrate poor histological differentiation,rapid progress,and poor prognosis.The patients are often in the advanced stage when being diagnosed with cancer.Attention should be paid to this concurrent adverse driving molecular event in clinical work.With increasing availability,the inhibitors targeting C-MET may serve as an option to benefit these patients in the near future.
Key words:lung adenocarcinoma;EGFR gene;C-MET amplification
Acta Acad Med Sin,2023,45(4):627-633
我国肺癌发病率和死亡率在恶性肿瘤中均位居首位[1-2],肺腺癌是肺癌中最常见的组织学亚型,约占所有类型的50%,而且发病率持续增长[3],肺腺癌异质性大,受不同基因的驱动和调控,即使体积小的癌灶,肺腺癌细胞也可表现出高转移潜能等。针对肺腺癌的多基因联合检测越来越成为临床精准诊疗的常态化工作,虽然单个驱动基因的突变常见,但是不同基因的并存不能被忽视。本研究收集11例EGFR基因突变叠加C-MET基因扩增的肺腺癌病例,分析、总结其临床病理特征、治疗、随访情况,旨在阐明这两种分子事件并发的结局,从而引起更多的关注,为临床合理、适时选择靶向用药方案提供依据。
资料和方法
资料来源 收集2019年1月1日至2021年12月31日于福建医科大学附属泉州第一医院经病理证实的298例原发性肺腺癌初治患者资料,活检或手术切除癌组织均行驱动基因EGFR、KRAS、BRAF、HER2、NRAS、PIK3CA突变,ALK、ROS1、RET融合检测,C-MET扩增检测,由两名高级职称的病理医师重新镜检病理组织切片,利用医院电子病历系统查阅患者年龄、性别、主要症状及体征、影像学检查、治疗情况等相关临床资料,电话随访患者或其家属的生存状况,截止日期为2022年4月1日。该研究经福建医科大学附属泉州第一医院伦理委员会批准(伦理审查编号:泉一伦〔2021〕197号)。
免疫组织化学染色 标本经10%中性福尔马林固定,在自动免疫组织化学染色仪(罗氏 BenchMark ULTRA)上选择双染程序,先滴加一抗甲状腺转录因子1(thyroid transcription factor-1,TTF-1)(克隆号:8G7G3/1,福建迈新生物技术有限公司),Ultra view 二氨基联苯胺显色,再滴加天冬氨酸蛋白酶A抗体(克隆号:MX015,福建迈新生物技术有限公司),Ultra view 固红显色,按照既定流程完成酶标双染色。
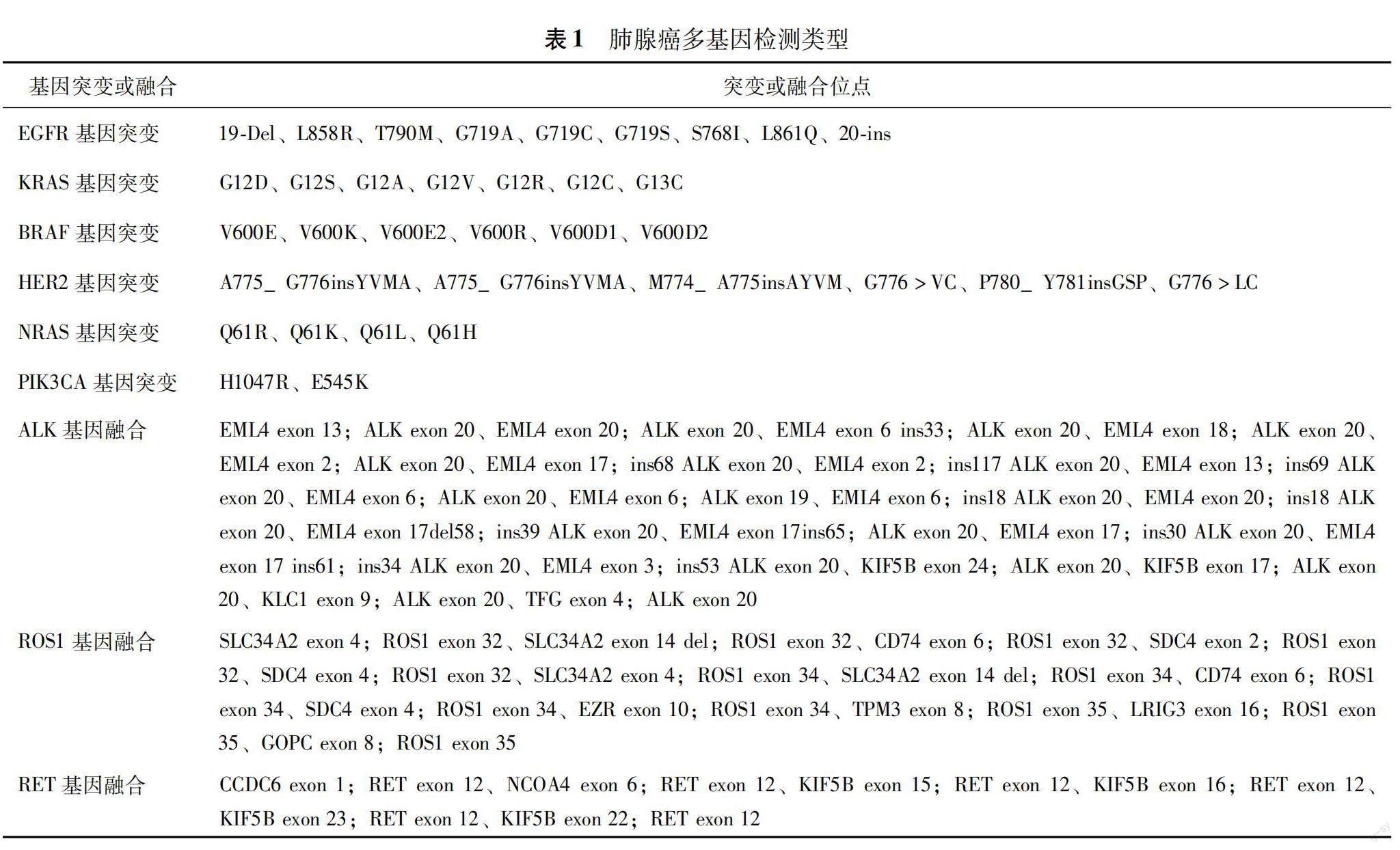
扩增阻遏突变系统—实时荧光定量聚合酶链反应 按照石蜡包埋组织 DNA/RNA核酸提取试剂盒和Amoydx5种突变基因检测试剂盒(厦门艾德生物医药科技股份有限公司)的说明书,提取石蜡包埋组织DNA和总RNA,使用Nanodrop 2000微量分光光度计(美国赛默飞科学公司)测定DNA和RNA的浓度,确保DNA和RNA的A260/A280比值在1.8~2.1,然后在LightCycler480Ⅱ實时荧光定量聚合酶链反应仪(德国罗氏公司)进行扩增,检测EGFR、KRAS、BRAF、HER2、NRAS、PIK3CA基因突变和ALK、ROS1、RET基因融合,涵盖的变异类型见表1。
荧光原位杂交技术检测C-MET基因扩增情况 按照C-MET基因探针试剂盒(武汉康录生物技术股份有限公司)的说明书预处理石蜡组织切片,暗室里在原位杂交仪(美国雅培Abbott StatSpin ThermoBrite S500)上开启切片自动化变性杂交进程,历经洗涤、复染,而后用荧光显微镜观察至少30个癌细胞,计算红色C-MET探针信号与绿色第7号染色体着丝粒信号的比值,当比值≥2.0或C-MET平均拷贝数≥5.0时,即认定为C-MET基因扩增[4-6]。
统计学处理 应用SPSS 20.0软件进行统计分析,采用Fisher精确概率法比较组间临床分期的差异;以患者死亡为结局事件,采用Kaplan-Meier法绘制生存曲线,采用Log-rank检验法比较组间生存率,双侧P<0.05为差异有统计学意义。
结果
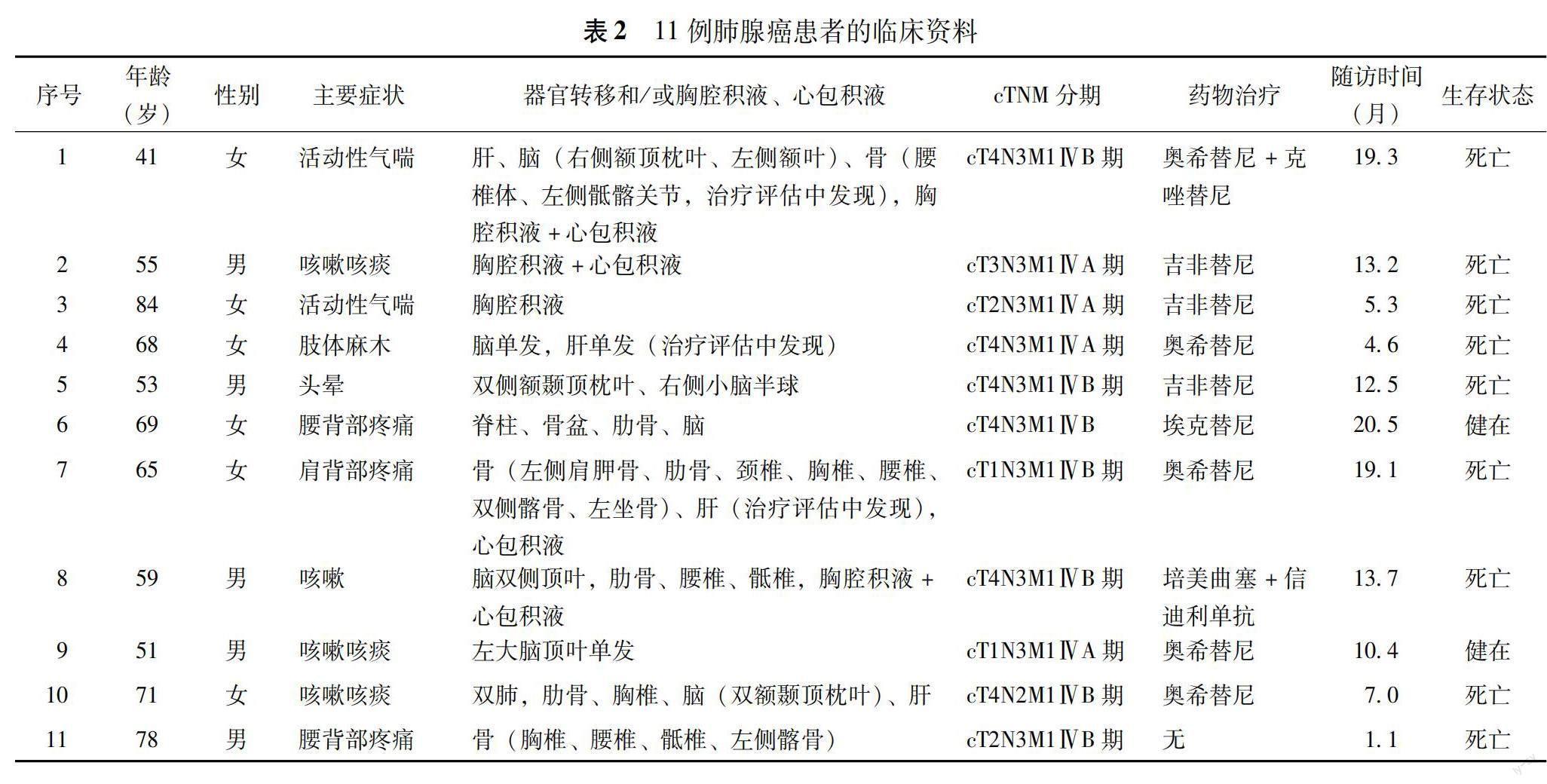
临床及影像学检查特征 298例原发性肺腺癌患者,男141例、女157例,年龄28~84岁,中位年龄61(53,69)岁。入院患者分别行头颅MRI平扫及增强、全腹CT平扫及增强、颈胸腰椎MRI平扫及增强、全身骨发射型计算机断层扫描检查,首诊发现脑转移癌7例,其中5例有多发癌灶、2例有单发癌灶;发现骨转移癌6例,均为多发癌灶,首诊发现5例,另1例在治疗评估中发现;发现肝转移癌4例,首诊发现2例,另2例在治疗评估中发现;首诊发现胸水和/或心包积液5例。根据肺癌TNM分期(第8版)标准,发生远处转移的11例列入临床Ⅳ期,包括男5例、女6例,年龄41~84岁,中位年龄65(54,70)岁,这11例首诊的主要症状表现为活动性气喘2例,咳嗽和/或咳痰4例,腰和/或肩背部疼痛3例,肢体麻木1例,头晕1例(表2)。
病理检查结果 11例临床Ⅳ期确诊病例送检物为活检标本及胸水,其中肺穿刺活检6例,胸膜活检1例,淋巴结穿刺1例,淋巴结穿刺、肝肿物穿刺1例,骨组织活检1例,胸水制成细胞块1例。细胞块由于可供诊断的腺样癌性成分少,难以客观评价镜下结构,10例活检组织均可见高级别成分相互混杂,包括复杂腺体结构8例(筛状结构5例,不规则或融合腺体5例,单个、小细胞团或条索状3例,丝状微乳头2例)(图1A~1C),实性2例(图1D)。11例免疫组织化学双染色均显示TTF-1(黄褐色)、天冬氨酸蛋白酶A(红色)阳性(图1E)。
基因检测结果 EGFR突变肺腺癌组共176例(176/298,59.1%):临床Ⅰ期99例、Ⅱ期48例、Ⅲ期29例;C-MET扩增组共7例(7/298,2.3%):临床Ⅰ期2例、Ⅱ期3例、Ⅲ期2例;EGFR突变和C-MET扩增共存者11例(11/298,3.7%),均为临床Ⅳ期,经荧光原位杂交检测均有C-MET扩增(图1F),经扩增阻遏突变系统—实时荧光定量聚合酶链反应检测显示4例EGFR基因外显子19缺失,7例外显子21L858R突变,未发现ALK、ROS1基因融合,未发现KRAS、BRAF、HER2、RET、NRAS、PIK3CA基因突变。临床Ⅳ期的EGFR突变合并C-MET扩增组患者比率显著高于EGFR突变组和C-MET扩增组,差异均有统计学意义(P均<0.001);而EGFR突变组和C-MET扩增组在各临床分期的患病比率差异均无统计学意义(P均>0.05)。
A.肺腺癌的丝状微乳头结构(HE);B.肝转移性肺腺癌的复杂腺体结构(HE);C.肺腺癌的复杂腺体结构(HE);D.淋巴结转移性肺腺癌的实性结构(HE);E.甲状腺转录因子1(细胞核黄褐色)、天冬氨酸蛋白酶A(细胞质红色)阳性表达(免疫组织化学双染);F.肺腺癌细胞肝细胞生长因子受体红色探针信号呈簇状扩增(箭头)(荧光原位杂交法)治疗及随访 截至2022年4月1日,具有EGFR突变和C-MET扩增的肺腺癌组中9例死亡,平均生存时间为(11.52±1.96)个月,中位生存时间为12.50(6.15,16.40)个月;2例存活,随访时长分别为20.5、10.4个月。例11治疗前死亡,总生存期最短,仅1.1个月;例1行奥希替尼联合克唑替尼治疗,总生存期达19.3个月;例8行培美曲塞化疗及信迪利单抗免疫治疗;其余的用药情况是奥希替尼靶向治疗(含1例联合克唑替尼治疗)5例、吉非替尼3例、埃克替尼1例(表2)。7例C-MET基因扩增的病例和176例EGFR基因突变的病例中死亡人数分别为0和3,随访时间最长为37.8个月,最短为10.9个月。经Log-rank法对EGFR突变组、C-MET扩增组及EGFR突变合并C-MET扩增肺腺癌患者的生存时间进行比较,结果显示EGFR突变和C-MET扩增组间生存率变化差异无统计学意义(χ2=0.042,P=0.838),而EGFR突变合并C-MET扩增组患者的生存率曲线下降速度显著快于EGFR突变组(χ2=246.72,P<0.001)和C-MET扩增组(χ2=236.41,P<0.001)(图2)。
讨论
EGFR、ALK、ROS1已成为肺非小细胞癌国内外靶向用药前分子检测的常规一线基因[7],MET基因扩增在肺非小细胞癌中的发生率为3%~19%,主要发生在肺腺癌[8],常是引起EGFR酪氨酸酶抑制剂(EGFR-tyrosine kinase inhibitors,EGFR-TKI)继发耐药的主要分子机制之一,而原发性MET扩增在肺非小细胞癌中约占4%[5],已被列入肺非小细胞癌靶向分子检测的扩展基因,它很少与EGFR等基因突变共存[9],本研究显示约3.7%肺腺癌首诊患者(11/298)同时具有EGFR基因突变和C-MET基因扩增,其中5例主要表现为呼吸系统外的症状,如腰和/或肩背部疼痛、肢体麻木、头晕,經过详细查体、影像学及病理学检查等,考虑属肺癌晚期器官转移的表现。另外6例出现咳嗽、咳痰、气喘症状,其中2例同时出现胸水和/或心包积液,4例同时出现肝、脑或骨远处器官的转移。这11例肺腺癌患者临床评估均为Ⅳ期,明显高于EGFR突变组或C-MET扩增组处于Ⅳ期的患病率,而EGFR突变组和C-MET扩增组在各临床分期的患病率差异无统计学意义,表明EGFR突变和C-MET扩增共存的腺癌进展快,首诊时已经是癌症晚期。C-MET基因位于7q21-q31,是编码肝细胞生长因子的酪氨酸激酶受体,生理状态下C-MET基因编码蛋白特异性结合肝细胞生长因子,激活磷脂酰肌醇3-激酶/丝氨酸苏氨酸蛋白激酶/哺乳动物雷帕霉素靶蛋白、细胞外信号调节激酶/丝裂原活化蛋白激酶、信号转导及转录激活蛋白3、Wnt/β-连环蛋白等下游通路[4,10],促进组织的生长发育,MET扩增则能异常激活相关分子通路,促进肿瘤增殖、侵袭及迁移等,从而导致癌的演进。本研究除1例送检组织为难以评估组织结构的细胞块,其他10例在显微镜下均出现复杂腺体和实性的高级别成分,虽然是活检组织,不能全面判断其占整个腺癌的比例,但是从另一侧面反映了双重基因变异与腺癌的分化不良可能存在因果关系,Chen等[11]指出原发MET扩增在低分化肺腺癌中更频繁发生。1项肺癌突变联盟的三机构队列研究显示转移性腺癌患者MET免疫组织化学阳性表达率约为39.2%(71/181);而MET扩增率约为1.7%(3/181),提示免疫组织化学染色方法并不能替代性筛查MET扩增[12]。
东亚肺腺癌EGFR基因突变率达40%~60%[13],大约90%的EGFR突变发生在外显子19缺失突变和外显子21(L858R)[14-15],应用EGFR-TKI针对性靶向治疗,有效率高达80%[16],总生存期延长至20~30个月[17],本研究叠加C-MET扩增的EGFR外显子19缺失4例、外显子21L858R突变7例,未发现ALK、ROS1基因融合,未发现KRAS、BRAF、HER2、RET、NRAS、PIK3CA基因突变。截至2022年4月1日,研究对象中无失访病例,7例C-MET基因扩增的病例和176例EGFR基因突变的病例经10.9~37.8个月的随访,死亡人数分别为0和3。EGFR突变合并C-MET扩增组中9例患者死亡,2例存活,经Log-rank法检验显示,EGFR突变合并C-MET扩增组的生存状况差于EGFR突变组和C-MET扩增组,而EGFR突变组和C-MET扩增组间的总体生存率差异无统计学意义,表明EGFR突变合并C-MET扩增患者生存期短、预后差,EGFR突变合并C-MET扩增患者中仅1例曾接受联合克唑替尼治疗,鉴于是个案发现,需要后续积累大宗病例进一步了解双靶向治疗EGFR突变合并C-MET扩增肺腺癌患者的利弊。以埃万妥单抗为代表的EGFR和C-MET双特异性抗体新型药物能同时阻断磷脂酰肌醇3-激酶/丝氨酸苏氨酸蛋白激酶/哺乳动物雷帕霉素靶蛋白途径和Ras/Raf/Mek途径,在肺癌临床研究中展现出良好的前景,此类药物有望给EGFR突变合并C-MET扩增肺腺癌患者带来更多的治疗机会[18]。
C-MET扩增更常继发于EGFR基因突变后的次生分子事件,但也可在EGFR-TKI治疗前作为始发驱动分子事件,与EGFR突变并存于肺腺癌中,本研究11例患者组织学均可见到高级别腺癌成分,易发生脑、骨、肝等多器官、多灶性转移,肿瘤临床分期晚,患者总生存期短,有报道MET扩增可额外增强EGFR非依赖性表皮生长因子磷酸化等下游信号转导,引起EGFR-TKI原发性耐药,降低癌细胞对EGFR-TKI的反应性[19]。因此,临床上需警惕在EGFR-TKI治疗前EGFR突变与C-MET扩增共存现象的发生,联合应用MET抑制剂很有可能在增强抗癌效果上使这部分患者获益。
参 考 文 献
[1]Xia C,Dong X,Li H,et al.Cancer statistics in China and United States,2022:profiles,trends,and determinants[J].Chin Med J (Engl),2022,135(5):584-590.DOI:10.1097/CM9.0000000000002108.
[2]中华医学会肿瘤学分会,中华医学会杂志社.中华医学会肿瘤学分会肺癌临床诊疗指南(2021版)[J].中华医学杂志,2021,101(23):1725-1757.DOI:10.3760/cma.j.cn112137-20210207-00377.
[3]Succony L,Rassl DM,Barker AP,et al.Adenocarcinoma spectrum lesions of the lung:detection,pathology and treatment strategies[J].Cancer Treat Rev,2021,99:102237.DOI:10.1016/j.ctrv.2021.102237.
[4]Saigi M,McLeer-Florin A,Pros E,et al.Genetic screening and molecular characterization of MET alterations in non-small cell lung cancer[J].Clin Transl Oncol,2018,20(7):881-888.DOI:10.1007/s12094-017-1799-7.
[5]Friedlaender A,Drilon A,Banna GL,et al.The METeoric rise of MET in lung cancer[J].Cancer,2020,126(22):4826-4837.DOI:10.1002/cncr.33159.
[6]Tang Z,Zhang J,Lu X,et al.Coexistent genetic alterations involving ALK,RET,ROS1 or MET in 15 cases of lung adenocarcinoma[J].Mod Pathol,2018,31(2):307-312.DOI:10.1038/modpathol.2017.109.
[7]Kalemkerian GP,Narula N,Kennedy EB,et al.Molecular testing guideline for the selection of patients with lung cancer for treatment with targeted tyrosine kinase inhibitors:American society of clinical oncology endorsement of the college of american pathologists/international association for the study of lung cancer/association for molecular pathology clinical practice guideline update[J].J Clin Oncol,2018,36(9):911-919.DOI:10.1200/JCO.2017.76.7293.
[8]中華医学会病理学分会,国家病理质量控制与指导中心,中华医学会肿瘤学分会肺癌学组,等.非小细胞肺癌分子病理检测临床实践指南(2021版)[J].中华病理学杂志,2021,50(4):323-332.DOI:10.3760/cma.j.cn112151-20201220-00945.
[9]Lung J,Hung MS,Lin YC,et al.MET exon 14 skipping mutations and gene amplification in a Taiwanese lung cancer population[J].PLoS One,2019,14(8):e0220670.DOI:10.1371/journal.pone.0220670.
[10]陈恒屹,何勇.肝细胞生长因子/间质上皮转化因子信号通路与非小细胞肺癌靶向治疗耐药的关系及机制研究进展[J].中国医学科学院学报,2021,43(2):259-264.DOI:10.3881/j.issn.1000-503x.11968.
[11]Chen Y,Jiang B,He Y,et al.A lung adenocarcinoma patient with co-mutations of MET and EGFR exon20 insertion responded to crizotinib[J].BMC Med Genomics,2022,15(1):141.DOI:10.1186/s12920-022-01291-z.
[12]Guo R,Berry LD,Aisner DL,et al.MET IHC is a poor screen for MET amplification or MET exon 14 mutations in lung adenocarcinomas:data from a tri-institutional cohort of the lung cancer mutation consortium[J].J Thorac Oncol,2019,14(9):1666-1671.DOI:10.1016/j.jtho.2019.06.009.
[13]Zhang X,Jiang Y,Yu H,et al.A comprehensive study on the oncogenic mutation and molecular pathology in Chinese lung adenocarcinoma patients[J].World J Surg Oncol,2020,18(1):172.DOI:10.1186/s12957-020-01947-z.
[14]Van Der Steen N,Zwaenepoel K,Mazzaschi G,et al.The role of c-Met as a biomarker and player in innate and acquired resistance in non-small-cell lung cancer:two new mutations warrant further studies[J].Molecules,2019,24(24):4443.DOI:10.3390/molecules24244443.
[15]Hu M,Zhang T,Yang Y,et al.Driver gene alterations in lung adenocarcinoma:demographic features of 2544 Chinese cases[J].Int J Biol Markers,2020,35(4):44-50.DOI:10.1177/1724600820967015.
[16]王宇,于麗艳,方楠,等.中国人群非小细胞肺癌的基因突变情况及其靶向药物的应用[J].中华医学遗传学杂志,2019,36(5):424-428.DOI:10.3760/cma.j.issn.1003-9406.2019.05.003.
[17]王梦瑶,任敦强,郭彩宏,等.EGFR双突变非小细胞肺癌患者临床特征分析[J].中国肺癌杂志,2018,21(8):594-599.DOI:10.3779/j.issn.1009-3419.2018.08.05.
[18]王静静,迟雨佳,陈含笑,等.Amivantamab治疗EGFR/MET基因异常非小细胞肺癌的单中心经验[J].中国肺癌杂志,2022,25(7):493-500.DOI:10.3779/j.issn.1009-3419.2022.102.26.
[19]Wang Q,Yang S,Wang K,et al.MET inhibitors for targeted therapy of EGFR TKI-resistant lung cancer[J].J Hematol Oncol,2019,12(1):63.DOI:10.1186/s13045-019-0759-9.
(收稿日期:2022-12-05)

