中药微调3号合剂对晚期胃癌免疫治疗临床疗效及肠道菌群的影响
黄箫娜 朱晨阳 李雨真 金春晖

摘要:目的 探討中药微调3号(WD-3)合剂对晚期胃癌免疫治疗患者的临床疗效及其对肠道菌群的影响。方法 选取2020年1月至2021年12月无锡市中医医院肿瘤科收治的51例晚期胃癌免疫治疗患者,按入院时间顺序采用随机数字表法将患者分为WD-3组[免疫治疗+口服WD-3合剂(每日1剂)](n=25)和观察组(仅免疫治疗)(n=26),另设10例健康体检者作为健康对照组。治疗前后进行体力状况Karnofsky评分、临床常见症状改善情况比较,治疗后比较客观疗效;治疗后收集受试者粪便,对患者粪便进行基于16SrRNA基因高通量测序粪便菌群及靶向代谢组学检测,比较分析肠道菌群的α、β多样性,菌落结构组成及短链脂肪酸含量。结果 两组患者生活质量评分治疗后均优于治疗前,治疗后WD-3组优于观察组,差异有统计学意义(P=0.035)。WD-3组治疗后口干(P=0.038)及味觉改变(P=0.008)症状较治疗前改善,观察组治疗后反流症状(P=0.001)及口干症状(P=0.022)较治疗前好转;与观察组相比,治疗后WD-3组吞咽困难(P=0.047)、口干(P=0.045)有改善,差异有统计学意义。WD-3组客观缓解率及疾病控制率均优于观察组,WD-3组中位无进展生存期、中位总生存期较观察组显著延长(P=0.039,P=0.043)。WD-3组、观察组肠道菌群的α多样性指数,包括辛普森指数(P=0.014,P=0.021)、香农指数(P=0.007,P=0.024)、物种均一度(P=0.009,P=0.027)、观察到的物种数(P=0.032,P=0.012)均显著低于健康对照组。观察组和WD-3组之间肠道菌群α、β多样性差异无统计学意义(P 均>0.05)。在门水平上,与健康对照组相比,WD-3组和观察组的厚壁菌门丰度降低(P=0.038,P=0.042),变形杆菌门丰度升高(P=0.016,P=0.015),观察组放线菌门丰度低于健康对照组(P=0.035),WD-3组的放线菌门则高于观察组(P=0.046),差异有统计学意义;在属水平上,观察组双歧杆菌属和粪球菌属细菌丰度显著低于健康对照组,而WD-3组这两种菌属的丰度高于观察组,差异有统计学意义(P均<0.001)。对WD-3组和观察组进行LEfSe分析显示,有6种肠菌丰度存在差异,在属水平上,WD-3组与健康对照组相比,糖多孢菌属丰度升高且仅存在于WD-3组。对粪便中短链脂肪酸进行分析显示,WD-3组异丁酸和异戊酸含量较健康对照组均显著升高(P=0.037,P=0.004)。结论 WD-3合剂可能通过增加胃癌患者双歧杆菌属、粪球菌属细菌丰度,提高异丁酸和异戊酸含量,改变肠道微生态,进而实现对胃癌免疫治疗的增效作用。
关键词:晚期胃癌;中药;微调3号合剂;肠道菌群;生活质量
中图分类号: R735.2;R273文献标志码: A文章编号:1000-503X(2023)04-0581-10
DOI:10.3881/j.issn.1000-503X.15496
Weidiao-3 Mixture Improves the Clinical Efficacy of Immunotherapy for
Advanced Gastric Cancer by Regulating Intestinal Flora
HUANG Xiaona,ZHU Chenyang,LI Yuzhen,JIN Chunhui
Department of Oncology,Wuxi Traditional Chinese Medicine Hospital Affiliated to Nanjing University of
Chinese Medicine,Wuxi,Jiangsu 214000,China
Corresponding author:JIN Chunhui Tel:0510-88859999,E-mail:wxzy013@njucm.edu.cn
ABSTRACT:Objective To investigate the effects of Weidiao-3(WD-3)Mixture on the clinical efficacy of immunotherapy for advanced gastric cancer and the intestinal flora.Methods Fifty-one patients with advanced gastric cancer treated in Wuxi Traditional Chinese Medicine Hospital from January 2020 to December 2021 were randomized into a WD-3 group(immunotherapy + WD-3 Mixture,one dose per day)(n=25)and a gastric cancer(GC) group(only immunotherapy)(n=26)according to the admission time.Ten healthy volunteers were included as the healthy control group.The Karnofsky score and the Quality of Life Questionnare-Core score were evaluated before and after treatment,and the clinical efficacy was compared after treatment.After treatment,the stool samples were collected for 16SrRNA gene high-throughput sequencing and targeted metabolomics.The α and β diversity and structure of the intestinal flora and the content of short-chain fatty acids were compared between groups.Results The quality of life in both groups improved after treatment and was better in the WD-3 group than in the GC group(P=0.035).The dry mouth(P=0.038)and altered taste(P=0.008)were mitigated in the WD-3 group after treatment,and the reflux(P=0.001)and dry mouth(P=0.022)were mitigated in the GC group after treatment.After treatment,the WD-3 group outperformed the GC group in terms of dysphagia(P=0.047)and dry mouth(P=0.045).The WD-3 group was superior to the GC group in terms of objective remission rate and disease control rate,with prolonged median progression-free survival and median overall survival(P=0.039,P=0.043).The α and β diversity indexes of the intestinal flora showed no significant differences between WD-3 and GC groups(all P>0.05).At the phylum level,WD-3 and GC groups had lower relative abundance of Firmicutes(P=0.038,P=0.042)and higher relative abundance of Proteobacteria(P=0.016,P=0.015)than the healthy control group.The relative abundance of Actinomycetes in the GC group was lower than that in the healthy control group(P=0.035)and the WD-3 group(P=0.046).At the genus level,the GC group had lower relative abundance of Bifidobacteria and Coprococcus than the healthy control group and the WD-3 group(all P<0.001).LEfSe revealed the differences in the relative abundance of 6 intestinal bacterial taxa between the WD-3 group and the GC group.At the genus level,Saccharopolyspora had higher relative abundance in the WD-3 group than in the healthy control group and only existed in the WD-3 group.The content of isobutyric acid and isovaleric acid in the WD-3 group was higher than that in the healthy control group(P=0.037,P=0.004).Conclusion WD-3 Mixture may increase the relative abundance of Bifidobacteria and Coprococcus and the content of isobutyric acid and isovaleric acid to alter the intestinal microecology,thereby improving the efficacy of immunotherapy for gastric cancer.
Key words:advanced gastric cancer;Chinese medicine;Weidiao-3 Mixture;intestinal flora;quality of life
Acta Acad Med Sin,2023,45(4):581-590
胃癌在全球范围内所有恶性肿瘤中发病率位居第5位,病死率位居第4位[1]。中国国家癌症中心最新癌症统计数据显示,我国胃癌的发病率和死亡率位居所有恶性肿瘤的第3位[2]。晚期胃癌的5年生存率仅为10.4%[3]。作为高发病率、高死亡率的恶性肿瘤,胃癌仍缺乏有效的治疗手段。目前,晚期或复发性胃癌的治疗方案主要有化疗、放疗、分子靶向治疗及免疫治疗,而免疫治疗已经成为晚期胃癌的一线、二线治疗推荐药物,尽管总体生存期有所延长,但仍有大部分晚期胃癌患者无法从免疫治疗中获益[4]。越来越多证据表明肿瘤的发生、发展与肠道微生态变化有关。通过改变肠道微生态或可调控机体免疫状态,影响抗肿瘤治疗疗效。有研究显示肠道菌群与中医理论中“脾”的生理功能密切相关[5]。中药微调3号(Weidiao-3,WD-3)合剂是全国老中医药专家学术经验继承工作指导老师赵景芳基于“脾为后天之本”理论而创立的,以六君子汤化裁而成,主方健脾益气、化湿和胃[6]。既往回顾性研究显示WD-3联合化疗能提高中晚期胃癌患者生活质量[7],但其是否通过调节患者肠道菌群提高胃癌患者免疫治疗疗效尚不清楚。因此,本研究旨在通过观察WD-3合剂对晚期胃癌患者肠道菌群的影响,以期验证中药WD-3合剂提高晚期胃癌患者免疫治疗疗效的可能机制。
对象和方法
对象 选取2020年1月至2021年12月在无锡市中医医院肿瘤科招募的符合纳排标准的晚期胃癌患者51例和健康体检者10例。诊断标准:胃癌诊断标准参照胃癌诊疗规范(2011版)[8]。纳入标准:(1)经临床病理确诊的晚期胃癌患者;(2)预计生存期3个月以上,Karnofsky评分≥60分;(3)患者签署知情同意书。健康体检者匹配标准:与胃癌患者按年龄进行频数匹配,其中年龄相差≤5岁。排除标准:(1)合并严重心、肝、肾和造血系统损害者;(2)精神病患者;(3)正在服用补充及调节肠道菌群药物者;(4)Her-2阳性患者。健康体检者排除标准:血清肿瘤标志物异常。按入院时间顺序采用随机数字表和随机隐藏(序列编码的、密闭的、不透光的信封)将纳入的受试者分为2组,不存在跨组现象。将患者随机分成WD-3组和观察组,其中WD-3组25例、观察组26例。两组患者均为微卫星稳定(microsatellite stabillity,MSS)、细胞程序性死亡配体1(programmed celldeath ligand 1,PD-L1)低表达患者,经历过奥沙利铂/紫杉醇类/伊立替康联合氟尿嘧啶二线及以上化疗方案治疗。WD-3组与观察组均完成至少2疗程免疫治疗,同时,WD-3组至少完成2疗程WD-3合剂治疗。本研究经无锡市中医医院伦理委员会批准(伦理审查编号:SWJWZYY2020011704-01)。
治疗方法 WD-3组:根据2020版中国临床肿瘤学会胃癌诊疗指南[9],在单药免疫治疗的基础上,给予WD-3合剂口服,3周为1疗程,2个疗程结束后全面评价疗效。WD-3 合剂组成:党参10 g,白术10 g,制半夏6 g,茯苓10 g,茯神 10 g,陈皮6 g,生薏仁30 g,猪苓30 g,山药15 g,焦谷、麦芽各15 g,枇杷叶10 g,炙甘草3 g。每日1剂。每剂中药由无锡市中医院药剂科浓煎,取药液共400 ml,于9∶00、15∶00各口服1次,每次200 ml。观察组:仅给予依据指南规范化单药免疫治疗,3周为1疗程,每 2个疗程结束后评价疗效。以上免疫治疗药物为:信迪利单抗(信达生物制药有限公司,批号:DP2212008),用药剂量200 mg,每3周1次;纳武利尤单抗(美国百时施贵宝有限公司,批号:ACE4088),3 mg/kg,每2周1次。根据患者经济条件,充分沟通后选择使用。所有患者未使用血管靶向药物。
观察指标
体力状况评分:采用体力状况评分表(Karnofsky评分),总分0~100分,得分越高,健康状况越好,生活质量越高。治疗前后对WD-3组和观察组进行体力状况评分比较。
生命質量评分:采用肿瘤患者生命质量评分表(EORTC QLQ-STO22问卷表)[10],包括进食受限、吞咽困难、反流、疼痛、口干、焦虑、味觉改变等条目,每个条目设定4个等级,得分0(没有)~4分(非常),患者评分越高提示生活质量越低。治疗前后对WD-3组和观察组进行生命质量评分比较。
客观疗效评价:按 Recist v1.1 标准[11]、iRECIST 标准[12]评价客观疗效,观察患者客观缓解率、疾病控制率、中位无进展生存期(progression-free survival,PFS)和中位总生存期(overall survival,OS)。
16SrRNA高通量测序检测肠道菌群:WD-3组和观察组治疗2个疗程后收集胃癌患者粪便,同期收集健康对照组粪便,-80 ℃保存。肠道菌群:利用土壤DNA提取试剂盒(美国奥美嘉生物技术公司,批号:D5625-01)提取粪便DNA,用赛默飞公司的Nano Drop2000仪器对DNA进行定量,并通过1%琼脂糖凝胶电泳检测DNA提取质量。利用细菌16SrRNA基因可变区V3~V4通用引物338F(5-ACTCCTACGGGAGGCAGCA-3)和806R(5-GGACTACHVGGGTWTCTAAT-3),PCR仪(GeneAmp2720型,美国应用生物系统公司)扩增,2%琼脂糖凝胶电泳检测PCR产物,0.8倍磁珠(诺唯赞生物科技公司)DNA纯化磁珠纯化回收PCR产物,使用Quant-iTPicoGreen dsDNA荧光试剂盒在宝特 FLx800荧光分析仪下进行荧光定量。采用Illumina公司的TruSeq建库试剂盒制备测序文库,利用Illumina HiSeq平台进行高通量测序。比较分析各组肠道菌群的α、β多样性,菌落结构组成及短链脂肪酸。
气相色谱-质谱联用仪测定短链脂肪酸:检测指标包括乙酸、丙酸、丁酸、异丁酸、戊酸、异戊酸、己酸。取适量粪便样本于2 ml离心管中,加50 μl 15%磷酸,再加125 μg/ml异己酸(内标)溶液100 μl和乙醚400 μl匀浆1 min,于4 ℃ 12 000 r/min(r=180 mm)离心10 min,取上清上机测试。检测平台:TRACE 1310气相色谱仪、ISQ7000质谱仪(均为美国赛默飞公司产品)。
生物信息学 对高通量测序获得的序列进行质控和过滤,建立菌群可操作单元[扩增子序列变异(amplicon sequence variants,ASV)/操作分类单元(operational taxonomic units,OTU)],对于16SrRNA基因选用Greengenes数据库(Release 13.8,http://greengenes.secondgenome.com)(DeSantis et al.,2006)进行比对,对ASV/OTU进行注释,分类单元包括门、纲、目、科、属、种,采用QIIME2(2019.4)软件进行菌群生物信息学分析。
统计学处理 采用SPSS 26.0 软件进行统计分析。计量资料符合正态分布的以均数±标准差表示,两组间比较采用独立样本t检验,组内前后比较采用配对t检验,多组间比较采用单因素方差分析;对于不符合正态分布的计量资料以M(P25,P75)表示,采用Mann-Whitney U 检验进行两组间比较,多组间比较采用Kruskal-Wallis H 检验;计数资料以频数(百分比)表示,采用χ2检验。生存曲线采用Kaplan-Meier法估计并作图,PFS和OS采用log-rank检验进行组间比较。P<0.05为差异有统计学意义。
结果
一般资料 WD-3组男22例、女3例,年龄(69.44±11.78)岁,有手术史14例、未手术11例。观察组男23例、女3例,年龄(69.92±9.81)岁,有手术史11例、未手术15例。两组患者一般资料比较差异均无统计学意义(P均>0.05)。10例健康对照组男4例、女6例,年龄(67.40±13.53)岁,与WD-3组、观察组比较,年龄差异均无统计学意义(P均>0.05)。
体力状况评分 两组患者治疗前体力状况评分差异无统计学意义(P=0.966),治疗后WD-3组显著高于观察组(P=0.035)。观察组(P=0.013)和WD-3组(P=0.001)患者治疗后与治疗前比较,差异均有统计学意义(表1)。
生命质量评分 两组患者治疗前生命质量评分差异无统计学意义(P>0.05)。WD-3组治疗后口干(P=0.038)及味觉改变(P=0.008)症状较治疗前改善,观察组治疗后反流症状(P=0.001)、口干(P=0.022)较治疗前好转。治疗后WD-3组吞咽困难(P=0.047)、口干症状(P=0.045)较观察组有改善,差异有统计学意义(表2)。
客观疗效评价 使用Recist v1.1、iRECIST标准评价客观疗效,两种评价标准结果一致。两组患者治疗后客观疗效评价显示,WD-3组客观缓解率(P=0.026)、疾病控制率(P=0.025)优于观察组(表3);WD-3组中位PFS时间(7.90个月比5.33个月,P=0.039)和中位OS时间(12.97个月比9.57个月,P=0.043)较观察组均显著延长(图1、2)。
肠道菌群分析 治疗后收集所有受试者的粪便样本进行高通量测序。对于具有可用高通量测序菌群数据的29例患者(WD-3组12例、观察组17例,占总人数的56.86%)以及10例健康人群进行肠道菌群分析,最终得到2 953 421个有效序列,99.99%的序列长度分布在 403~433 bp,序列平均长度为 417.76 bp。对检测的肠道微生物物种进行分类注释,抽平,获得各水平微生物分类单元数,3组在门、属、种水平微生物分类单元数均比较均一(图3)。
肠道菌群α多样性指数比较:WD-3组、观察组、健康对照组肠道菌群检测覆盖率及基于进化的多样性差异均无统计学意义(P均>0.05)。WD-3组、观察组肠道菌群α多样性指数,包括辛普森指数(P=0.014,P=0.021)、香農指数(P=0.007,P=0.024)、物种均一度(P=0.009,P=0.027)、观察到的物种数(P=0.032,P=0.012)均显著低于健康对照组(图4)。物种累积曲线提示随着样本量的增加,ASV/OTU总数增加稍趋于平缓(图5A),丰度等级曲线折线趋于平缓,提示本研究人群能够表征肠道菌群的结构状态(图5B)。
肠道菌群组间比较分析(β多样性分析):3组样本点之间距离分开不明显,表明该3组样本间的肠道菌群整体结构相似(图6)。
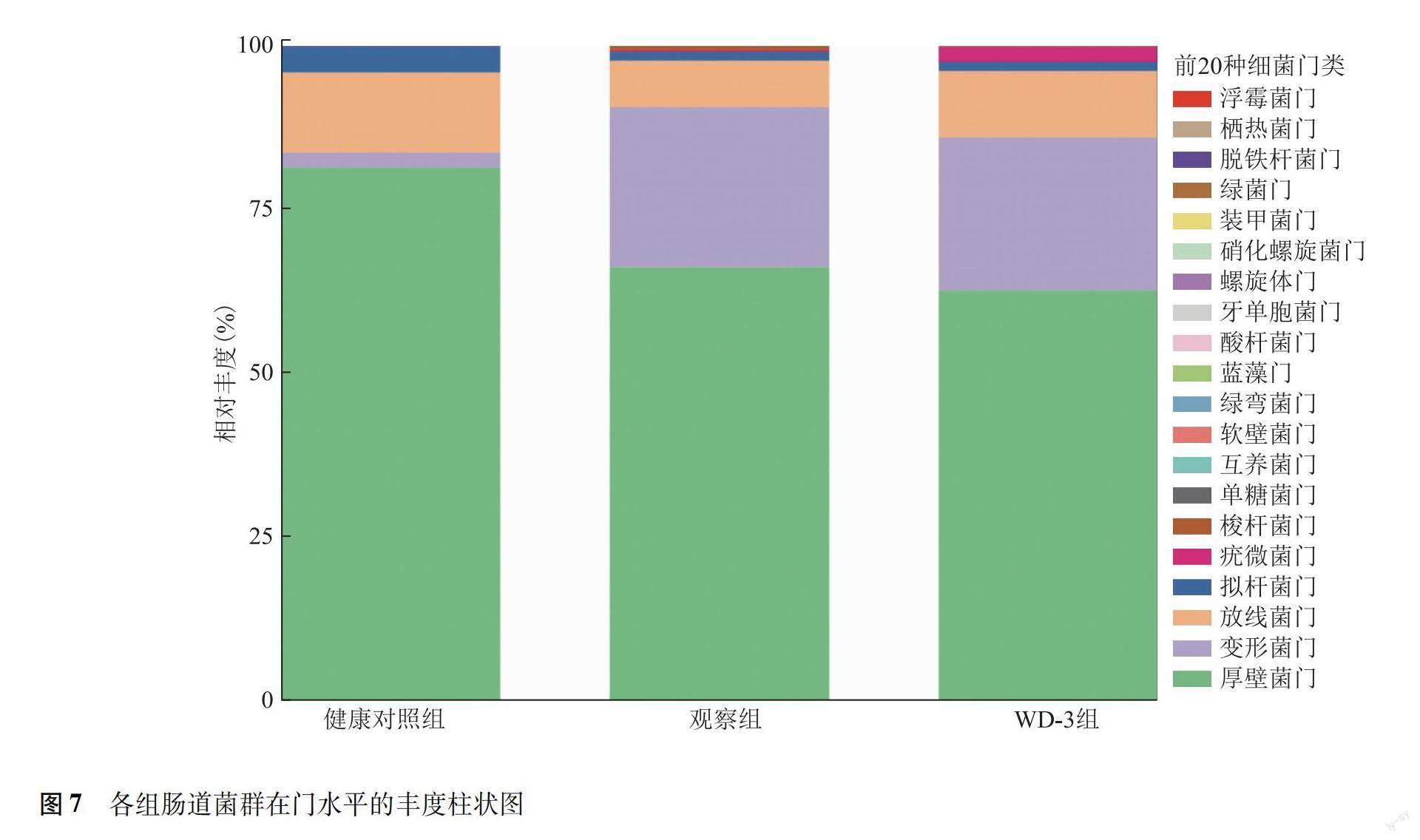
群落分析及物种组成分析:3组粪便微生物群落组成分析显示,粪便菌群在门水平上主要分属于厚壁菌门、变形菌门、拟杆菌门和放线菌门,其中各组以厚壁菌门所占比例最大(图7)。与健康对照组比较,WD-3组和观察组的厚壁菌门丰度均显著降低(P=0.038,P=0.042),变形杆菌门丰度显著升高(P=0.016,P=0.015);观察组放线菌门丰度显著低于健康对照组(P=0.035),WD-3组则显著高于观察组(P=0.046)。
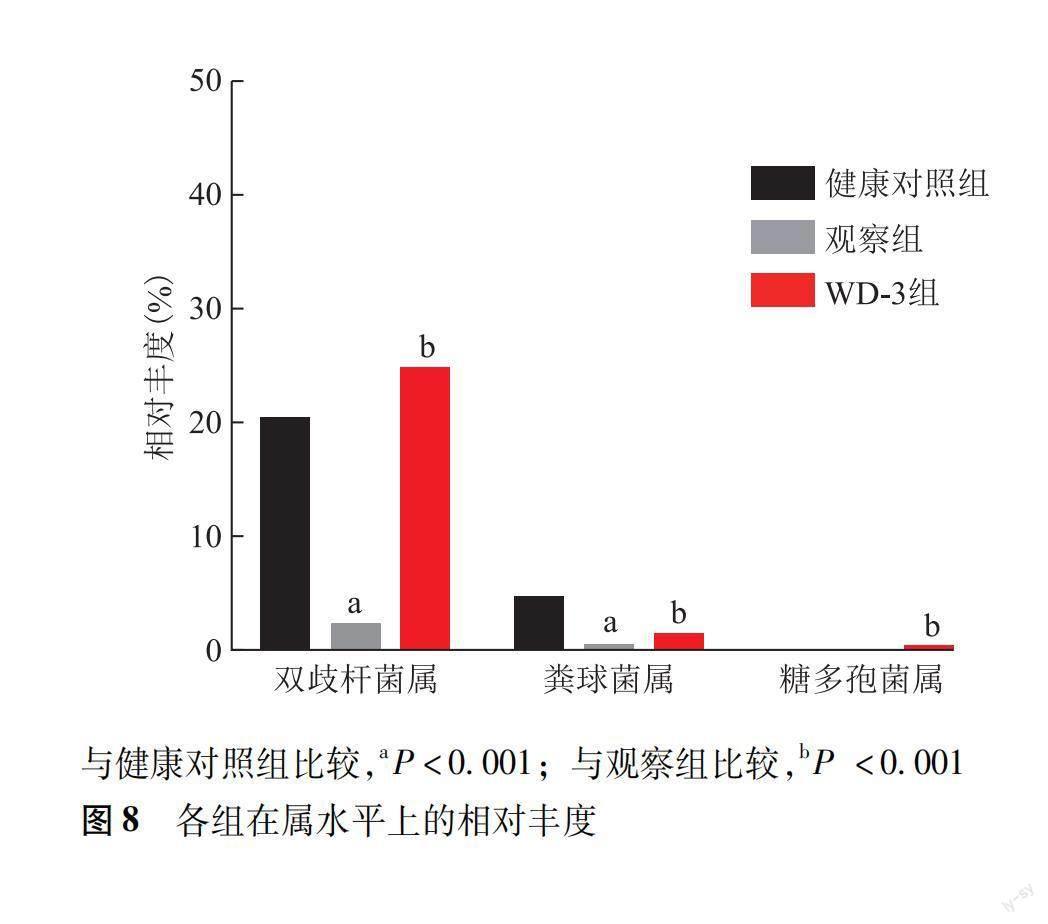
在属水平,观察组双歧杆菌属和粪球菌属细菌丰度均显著低于健康对照组(P均<0.001),而WD-3组这两种菌属的丰度均高于观察组(P均<0.001);另外,糖多孢菌属细菌丰度只在WD-3组发现(图8)。
LEfSe分析WD-3与观察组微生物群落特异菌:LEfSe进化分支图及线性判断分析图显示,WD-3组有5种细菌类群明显偏高(LDA>2),分别为丁酸菌属、糖多孢菌属、孪生菌科、孪生菌目、假诺卡氏菌科,较观察组偏高;观察组有1种细菌类群明显偏高(LDA>2),为丛毛单胞菌科,较WD-3组偏高。在属水平上,WD-3组与健康对照组相比,糖多孢菌属丰度升高(LDA>2)(图9、10)。
短链脂肪酸含量 通过气相色谱-质谱联用仪对健康对照组、观察组和WD-3组粪便中短链脂肪酸进行分析,结果显示WD-3组异丁酸和异戊酸含量较健康对照组显著升高(P=0.037,P=0.004),但与观察组比较,差异无统计学意义(P=0.388,P=0.319)(图11)。
讨论
人类肠道微生物的数量庞大、种类繁多,其不仅参与食物的消化与吸收,也通过短链脂肪酸(乙酸、丙酸、丁酸等)等代谢参与机体的整体生理调节。肠道菌群在人类健康和疾病中发挥着重要的功能。中医认为,“脾为后天之本”,胃主受纳,脾主运化,脾胃协同完成消化吸收和精微物质的全身输布功能,参与整体的生理代谢调节。若脾胃运化失司、水谷不化、津液失运,脾胃功能受损,则会出现一系列消化道症候。临床研究显示,脾虚与肠道菌群的失调密切相关[13],胃癌患者都会有不同程度不同类型的脾虚、脾胃不和,可出现肠道菌群失调。本研究通过16SrRNA基因高通量测序检测肠道菌群,结果显示胃癌患者在肿瘤的发生发展过程中肠道菌群的多样性和菌群结构发生了显著的变化,胃癌组患者(WD-3组和观察组)菌群α、β多样性均显著低于健康对照组,厚壁菌门丰度显著低于健康对照组。Sarhadi等[14]研究显示胃癌患者肠道菌群的Shannon多样性和Chao1指数均低于健康对照组,胃癌患者菌群结构与健康人群存在一定差异。本研究结果与Sarhadi等[14]研究一致。
中药WD-3合剂是基于无锡市中医医院著名中医肿瘤专家赵景芳教授微调平衡理论创立的。WD-3合剂由党参、炒白术、茯苓、薏苡仁、姜半夏、陈皮、猪苓、淮山药、谷芽、麦芽、茯神、枇杷叶、灸甘草组成,该合剂主方由健脾中药组成,临床用于治疗脾胃虚弱证型胃癌患者,本研究提示,WD-3合剂联合免疫治疗可提高患者客观缓解率及中位PFS和OS,并在改善口干、吞咽困难等消化道症状方面较观察组明显。
进一步研究显示,虽然WD-3组和观察组肠道菌群的α、β多样性差异无统计学意义,但在门、属水平上,服用WD-3合剂患者放线菌门、双歧杆菌属、粪球菌属细菌丰度显著高于观察组;另外,糖多孢菌属细菌丰度只在WD-3组发现。有研究显示双歧杆菌是人类肠道中重要的生理菌群,是构成肠道黏膜菌群的主要成分,它不仅能拮抗多种肿瘤的生长,还能预防多种肿瘤的发生发展[15]。Sivan等[16]研究显示双歧杆菌可促进DC细胞、CD8+T细胞活化而增强PD-L1的抗肿瘤疗效。粪球菌具有维持正常肠道菌群结构的重要作用,它能产生天然抗生素,还能通过分泌细菌素抑制大肠杆菌和沙门氏菌等病原菌的生长、调节肠道微环境[17]。Sayed等[18]报道糖多孢菌产生的次生代谢产物具有多种生物学作用,如抗微生物、抗癌等。Riquelme等[19]在胰腺癌长期生存患者的腫瘤微生物群中发现了较高的α多样性,并发现糖多孢菌、假黄单胞菌和链霉菌的存在和丰度可以影响和预测胰腺癌患者术后的长期生存。本研究WD-3组患者放线菌门、双歧杆菌属、粪球菌属细菌丰度显著增加,并在WD-3组中检测到糖多孢菌属。因此,推测WD-3合剂可能通过调节肠道菌群改善晚期胃癌免疫治疗疗效。
短链脂肪酸是肠道微生物重要的代谢物之一,主要包含乙酸、丙酸、丁酸和戊酸等[20]。短链脂肪酸不仅可作为肠黏膜的主要能量来源,维持肠黏膜屏障通透性,还有抗炎、抗肿瘤等作用[21-22]。本研究对粪便中短链脂肪酸进行分析显示,WD-3组异丁酸和异戊酸含量较健康组明显升高。另有研究显示,结肠丁酸盐低比例增加了结肠肿瘤的风险[23]。丁酸可以抑制促炎信号通路 核因子-κB,同时诱导调节性T细胞分化和抗炎白细胞介素-10细胞表达,促进肿瘤细胞凋亡[24-25]。郭君萍等[26]研究显示丁酸通过诱导自噬抑制宫颈癌细胞增殖。Nomura等[27]研究显示短链脂肪酸的浓度与PD-1抑制剂的治疗效果有关。通过气相色谱-质谱联用仪检测,本研究显示WD-3组异丁酸含量较健康组明显升高,推测WD-3合剂可能通过改变肠道菌群改善胃癌患者肠道健康,并提高代谢物短链脂肪酸含量,提高晚期胃癌患者免疫治疗疗效并改善生活质量。
本研究显示胃癌患者肠道菌群的多样性较健康对照组显著下降,异丁酸和异戊酸含量较健康对照组显著升高;相较于观察组,WD-3合剂可以增加放线菌门、双歧杆菌属、粪球菌属细菌丰度,且仅在WD-3组发现了糖多孢菌属。研究结果显示,WD-3合剂可改善晚期胃癌免疫治疗患者口干、味觉改变、吞咽困难等消化道症状,提高客观缓解率及中位PFS、OS。免疫治疗疗效受治疗前瘤负荷、微卫星不稳定/肿瘤错配修复缺陷、EB病毒水平等因素的影响,且治疗前肠道菌群受饮食、地理环境等因素影响。本研究入组Her-2阴性、MSS、PD-L1低表达晚期胃癌患者,入组前避免使用肠道菌群调节剂,但入组前基线菌群仍可能对免疫治疗疗效产生影响。本研究时间较短、样本量较小,结果可能存在偏差,研究结果尚需进一步扩大样本量去验证。
综上,中药WD-3合剂可能通过增加胃癌患者双歧杆菌属、粪球菌属细菌丰度,提高异丁酸和异戊酸含量,改变肠道微生态,提高胃癌免疫治疗的疗效。
参 考 文 献
[1]Sung H,Ferlay J,Siegel RL,et al.Global cancer statistics 2020:globocan estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J].CA Cancer J Clin,2021,71(3):209-249.DOI:10.3322/caac.21660.
[2]郑荣寿,张思维,孙可欣,等.2016年中国恶性肿瘤流行情况分析[J].中华肿瘤杂志,2023,45(3):212-220.DOI:10.3760/cma.j.cn112152-20220922-00647.
[3]Li Y,Feng A,Zheng S,et al.Recent estimates and predictions of 5-year survival in patients with gastric cancer:a model-based period analysis[J].Cancer Control,2022,29(12):10732748221099227.DOI:10.1177/10732748221099227.
[4]Moehler M,Shitara K,Garrido M,et al.Nivolumab(nivo)plus chemotherapy(chemo)versus chemo as first-line(1L)treatment for advanced gastric cancer/gastroesophageal junction cancer(GC/GEJC)/esophageal adenocarcinoma(EAC):first results of the CheckMate 649 study[J].Ann Oncol,2020,31(4):S1191.DOI:10.1016/j.annonc.2020.08.2296.
[5]马祥雪,王凤云,符竣杰,等.基于肠道菌群的中医健脾方剂作用机制的研究现状与思考[J].中国实验方剂学杂志,2017,23(5):210-215.DOI:10.13422/j.cnki.syfjx.2017050210.
[6] 周留勇,单珍珠.赵景芳“微调平衡治癌法”理论及临床运用探讨[J].中国中医基础医学杂志,2016,22(1):90-92.DOI:10.19945/j.cnki.issn.1006-3250.2016.01.034.
[7] 黄箫娜,尤建良.微调三号方联合紫杉醇化疗方案治疗中晚期胃癌的临床研究[J].辽宁中医药大学学报,2008,55(11):113-114.DOI:10.13194/j.jlunivtcm.2008.11.115.huangxn.130.
[8]中华人民共和国卫生部医政司.胃癌诊疗规范(2011年版)[J].中国医学前沿杂志(电子版),2012,4(5):62-71.DOI:10.3969/j.issn.1674-7372.2012.05.015.
[9]中國临床肿瘤学会指南工作委员会.中国临床肿瘤学会(CSCO)胃癌诊疗指南2020[M].北京:人民卫生出版社,2020.
[10]刘伟琳,杨舸,芮煜华,等.EORTC QLQ-STO22量表对我国胃癌患者有效性的验证[J].肿瘤研究与临床,2016,28(9):595-599.DOI:10.3760/cma.j.issn.1006-9801.2016.09.005.
[11]Eisenhauer EA,Therasse P,Bogaerts J,et al.New response evaluation criteria in solid tumours:revised RECIST guideline(version 1.1)[J].Eur J Cancer,2009,45(2):228-247.DOI:10.1016/j.ejca.2008.10.026.
[12]Seymour L,Bogaerts J,Perrone A,et al.iRECIST:guidelines for response criteria for use in trials testing immunotherapeutics[J].Lancet Oncol,2017,18(3):E143-E152.DOI:10.1016/s1470-2045(17)30074-8.
[13]彭颖,李晓波.脾虚证与肠道微生态[J].世界华人消化杂志,2012,20(34):3287-3291.
[14]Sarhadi V,Mathew B,Kokkola A,et al.Gut microbiota of patients with different subtypes of gastric cancer and gastrointestinal stromal tumors[J].Gut Pathog,2021,13(1):11.DOI:10.1186/s13099-021-00403-x.
[15]Reddy BS,Rivenson A.Inhibitory effect of bifidobacterium longum on colon,mammary,and liver carcinogenesis induced by 2-amino-3-methylimidazo[4,5-f]quinoline,a food mutagen[J].Cancer Res,1993,53(17):3914-3918.
[16]Sivan A,Corrales L,Hubert N,et al.Commensal bifidobacterium promotes antitumor immunity and facilitates anti-PD-L1 efficacy[J].Science,2015,350(6264):1084-1089.DOI:10.1126/science.aac4255.
[17]Cheng Y,Ling Z,Li L.The intestinal microbiota and colorectal cancer[J].Front Immunol,2020,11(30):3100.DOI:10.3389/fimmu.2020.615056.
[18]Sayed AM,Abdel-Wahab NM,Hassan HM,et al.Saccharopolyspora:an underexplored source for bioactive natural products[J].J Appl Microbiol,2020,128(2):314-329.DOI:10.1111/jam.14360.
[19]Riquelme E,Zhang Y,Zhang L,et al.Tumor microbiome diversity and composition influence pancreatic cancer outcomes[J].Cell,2019,178(4):795-806.e12.DOI:10.1016/j.cell.2019.07.008.
[20]Ma J,Piao X,Mahfuz S,et al.The interaction among gut microbes,the intestinal barrier and short chain fatty acids[J].Anim Nutr,2022,11(9):159-174.DOI:10.1016/j.aninu.2021.09.012.
[21]Laudes M,Geisler C,Rohmann N,et al.Microbiota in health and disease-potential clinical applications[J].Nutrients,2021,13(11):3866.DOI:10.3390/nu13113866.
[22]Martin-Gallausiaux C,Marinelli L,Blottière HM,et al.SCFA:mechanisms and functional importance in the gut[J].Proc Nutr Soc,2021,80(1):37-49.DOI:10.1017/s0029665120006916.
[23]Vernia P,Cittadini M.Short-chain fatty acids and colorectal cancer[J].Eur J Clin Nutr,1995,49(Suppl 3):S18-S21.
[24]Singh N,Gurav A,Sivaprakasam S,et al.Activation of Gpr109a,receptor for niacin and the commensal metabolite butyrate,suppresses colonic inflammation and carcinogenesis[J].Immunity,2014,40(1):128-139.DOI:10.1016/j.immuni.2013.12.007.
[25]Thangaraju M,Cresci GA,Liu K,et al.GPR109A is a G-protein-coupled receptor for the bacterial fermentation product butyrate and functions as a tumor suppressor in colon[J].Cancer Res,2009,69(7):2826-2832.DOI:10.1158/0008-5472.Can-08-4466.
[26]郭君萍,張珂,季夏薇,等.丁酸通过诱导自噬抑制宫颈癌细胞增殖的研究[J].浙江医学,2022,44(18):1934-1940,2023.DOI:10.12056/j.issn.1006-2785.2022.44.18.2022-1789.
[27]Nomura M,Nagatomo R,Doi K,et al.Association of short-chain fatty acids in the gut microbiome with clinical response to treatment with nivolumab or pembrolizumab in patients with solid cancer tumors[J].JAMA Netw Open,2020,3(4):e202895.DOI:10.1001/jamanetworkopen.2020.2895.
(收稿日期:2023-01-11)

