荧光定量聚合酶链反应法与免疫学化学发光法检测乙型肝炎病毒的比较
王文萍
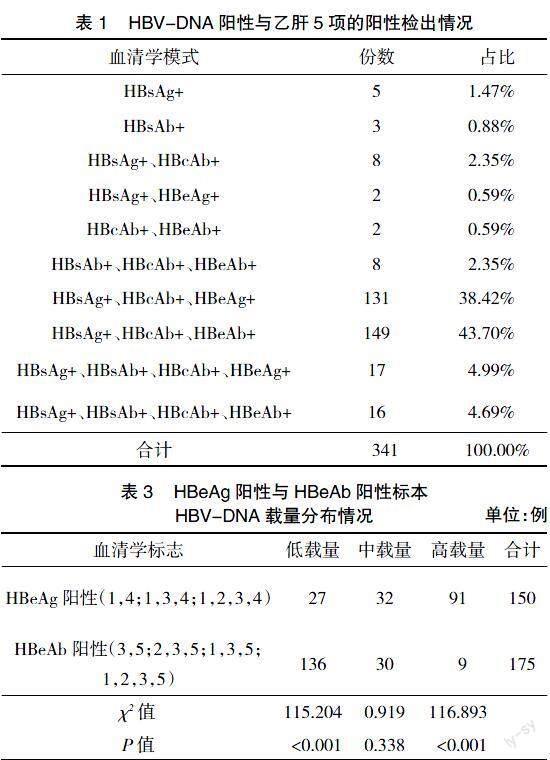
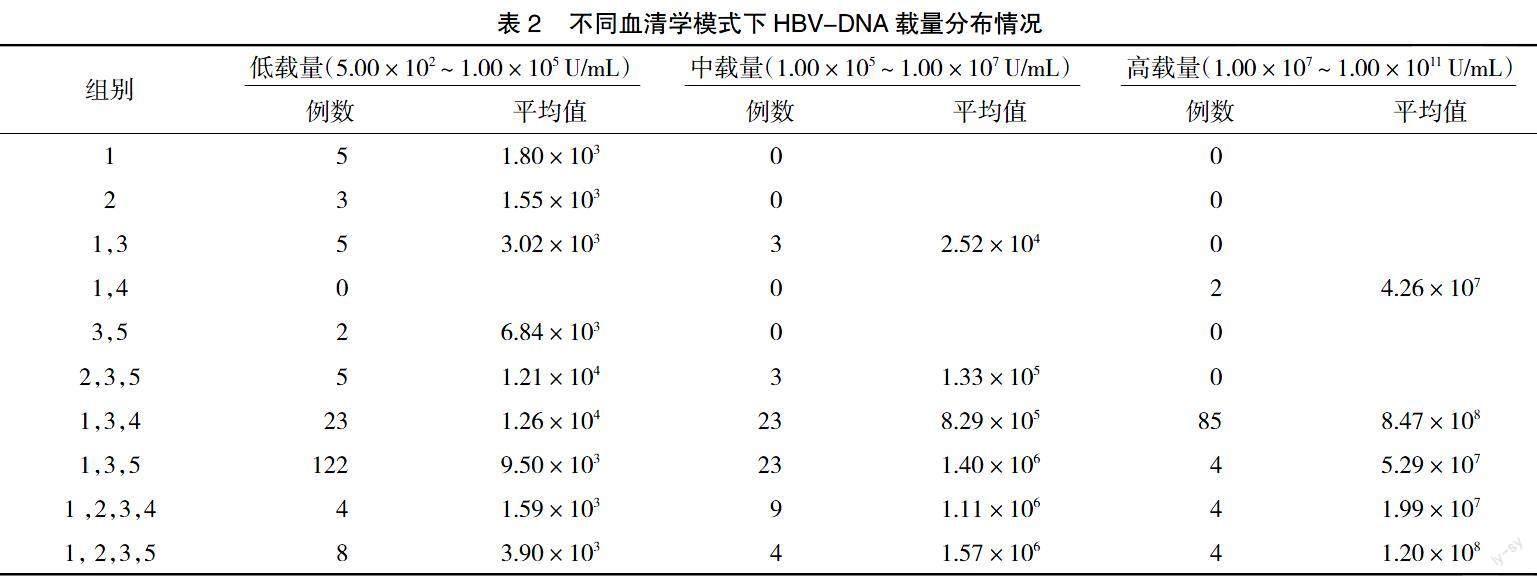
【摘要】 目的 比较荧光定量聚合酶链反应(FQ-PCR)法与免疫学化学发光法(CLEIA)检测乙型肝炎病毒(HBV)的价值。方法 选择2020年8月—2022年6月上饶市人民医院检验科341份应用FQ-PCR法测定HBV-DNA阳性血清标本作为研究对象,所有血清标本均采用FQ-PCR法及CLEIA检测。分析HBV-DNA阳性标本中乙肝5项[乙肝表面抗体(HBsAb)、乙肝表面抗原(HBsAg)、乙肝核心抗体(HBcAb)、乙肝e抗体(HBeAb)、乙肝e抗原(HBeAg)]阳性检出率在不同血清模式下HBV-DNA载量分布情况,对比HBV-DNA载量于HBeAg阳性与HBeAb阳性中的分布情况。结果 HBsAg+、HBcAb+、HBeAg+及HBsAg+、HBcAb+、HBeAb+阳性检出率最高,分别为38.42%、43.70%;HBsAg+、HBsAb+、HBcAb+、HBeAg+阳性检出率为4.99%,HBsAg+、HBsAb+、HBcAb+、HBeAb+阳性检出率为4.69%。另外,HBcAb阳性标本共331份,约占所有HBV-DNA阳性标本数的97.07%。大三阳组(131例)患者HBV-DNA平均载量为 5.65×108 U/mL,其中低载量占全组比例为17.56%(23/131)、中載量占全组比例为17.56%(23/131)、高载量占全组比例为64.89%(85/131);小三阳组(149例)患者HBV-DNA平均载量为 1.82×106 U/mL,其中低载量占全组比例为81.88%(122/149)、中载量占全组比例为15.44%(23/149)、高载量占全组比例为2.68%(4/149)。HBeAg阳性患者于高载量HBV-DNA中占比为60.67%,HBeAb阳性患者于低载量HBV-DNA中占比为77.71%,差异均有统计学意义(P<0.05)。结论 2种方法联合检测在判断HBV感染中具有较高的应用价值,可为诊断及治疗方案制定等提供可靠的参考依据。
【关键词】 乙型肝炎病毒; 荧光定量聚合酶链反应; 免疫学化学发光法; 乙肝5项
中图分类号:R512.6+2 文献标识码:A
文章编号:1672-1721(2023)22-0118-03
DOI:10.19435/j.1672-1721.2023.22.039
乙型肝炎(乙肝)现已成为危害公共卫生安全的严重疾病之一,与艾滋病及肺结核共同为临床常见的传染性疾病。乙肝为乙型肝炎病毒(hepatitis B virus,HBV)感染所致,尽早明确HBV感染对改善患者预后具有重要作用[1-2]。现阶段,临床在HBV检测中主要采用免疫学化学发光法(CLEIA)及荧光定量聚合酶链反应(FQ-PCR)法,其中CLEIA具有较高的特异度及灵敏度,且线性范围较宽,检测时自动化程度较高,现已广泛被应用于HBV感染的检测,其检测内容包括HBV及HBV-DNA载量、乙肝病毒所致的抗原及抗体,如乙肝5项分别为乙肝表面抗体(HBsAb)、乙肝表面抗原(HBsAg)、乙肝核心抗体(HBcAb)、乙肝e抗体(HBeAb)、乙肝e抗原(HBeAg)[3-4]。FQ-PCR法因具有较高的准确度、灵敏度及特异度等,在HBV鉴别诊断中受到广大检验人员及患者的青睐,多被用于HBV-DNA检测[5]。2种方法检测均具有操作便捷、经济、灵敏度及特异度均较高等特点。本研究对比了FQ-PCR法与CLEIA检测HBV的结果,旨在探究其临床应用价值,报告如下。
1 资料与方法
1.1 一般资料 选择2020年8月—2022年6月上饶市人民医院检验科341份应用FQ-PCR法测定HBV-DNA阳性血清标本作为研究对象,血清标本对应患者中,男性189例,女性152例;年龄15~83岁,平均年龄(49.83±3.90)岁;住院患者254例,门诊患者87例。纳入标准:所有血清样本均经FQ-PCR法检测明确HBV-DNA载量≥5.00×102U/mL,并判定为HBV-DNA阳性;血清样本均得到有效保存,质量均合格;血清样本来源明确;均应用CLEIA检测乙肝5项指标。
1.2 方法 采集患者5 mL清晨空腹肘静脉血,将血液标本放置于离心机内,以3 500 r/min速度离心10 min,离心半径10 cm获得上层血清,随后将血清置于-20 ℃环境中保存待检,所有血清标本均采用FQ-PCR法及CLEIA检测。
FQ-PCR法检测:血清样本中HBV-DNA水平的测定应用安普利公司生产的型号为Anadas 9850的全自动核酸提纯荧光定量PCR分析仪,相关试剂盒由厦门安普利生物工程有限公司提供。
CLEIA检测:检测血清中HBsAb、HBsAg、HBcAb、HBeAb、HBeAg水平应用强生公司生产的型号为Maccura i3000全自动免疫分析仪及配套试剂测定,所有操作均严格遵循试剂盒要求;同时要求质量控制需每日执行,且每个监测批次中均包括HBV阳性定量参考品与阴性质控品,HBsAb、HBsAg、HBcAb、HBeAb、HBeAg载量为5.00×103 U/mL、5.00×104 U/mL、5.00×105 U/mL、5.00×106 U/mL、5.00×107U/mL,对其行重复检测,以获得最佳结果。
1.3 观察指标 (1)分析HBV-DNA阳性标本中乙肝5项阳性检出率,依据乙肝5项检测后HBsAb阳性、HBsAg阳性、HBcAb阳性、HBeAb阳性、HBeAg阳性对患者进行分组,计算阳性检出率。(2)分析不同血清学模式下标本的HBV-DNA载量分布情况,依据HBV-DNA载量不同对所有患者进行分级,包括低载量、中载量及高载量3个等级。(3)对比HBeAg阳性与HBeAb阳性标本HBV-DNA载量分布。
1.4 统计学方法 使用SPSS 22.0统计学软件进行数据处理,计数资料以百分比表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 乙肝5项阳性检出情况分析 HBsAg+、HBcAb+、HBeAg+及HBsAg+、HBcAb+、HBeAb+阳性检出率最高,分别为38.42%、43.70%;HBsAg+、HBsAb+、HBcAb+、HBeAg+与HBsAg+、HBsAb+、HBcAb+、HBeAb+阳性检出率分别为4.99%、4.69%。另外,HBcAb阳性标本共331份,约占所有HBV-DNA阳性标本数的97.07%(331/341),见表1。
2.2 HBV-DNA载量分布情况 大三阳组患者(131例)HBV-DNA平均载量为5.65×108 U/mL,其中低载量占全组比例为17.56%(23/131),中载量占全组比例为17.56%(23/131),高载量占全组比例为64.89%(85/131);小三阳组患者(149例)HBV-DNA平均载量为1.82×106 U/mL,其中低载量占全组比例为81.88%(122/149),中载量占全组比例为15.44%(23/149),高载量占全组比例为2.68%(4/149),见表2。
2.3 HBeAg阳性与HBeAb阳性患者HBV-DNA载量分布情况 高载量HBV-DNA占所有HBeAg阳性患者的60.67%(91/150),而低載量HBV-DNA占所有HBeAb阳性患者的77.71%(136/175),差异均有统计学意义(P<0.05),见表3。
3 讨论
乙型肝炎现已成为我国常见慢性传染性疾病之一,随着病情发展,可引发肝硬化、肝癌等,对患者生活质量及生命健康均可造成严重影响。因此,尽早明确诊断对改善患者病情尤为重要。实验室检测现已成为辅助诊断乙肝的有效方法,目前临床多采用定量检测的方式诊断乙型肝炎,该方法是通过免疫技术及分子技术进行检测,包括HBV-DNA载量及HBV相关抗原及抗体水平[6-7]。对检测结果进行判读有助于及时了解HBV感染情况及免疫情况,为临床进一步诊疗提供可靠的参考依据[8]。
FQ-PCR法与CLEIA均为临床常用的定量检测方法,因为2种检测方法原理存在差异,所获得的检测结果无法直接进行比较。其中FQ-PCR检测方法是利用分子水平直接对HBV-DNA的复制情况进行测定,能够充分反映患者的治疗及恢复情况[9]。而CLEIA检测可有效避免HBV检测窗口期效应的影响。将2种检测方法联合使用,可更好地动态监测HBV感染患者病情转归情况,并对患者预后恢复有更加全面的了解[10]。本研究结果显示,乙肝5项阳性检出情况以HBsAg+、HBcAb+、HBeAg+及HBsAg+、HBcAb+、HBeAb+阳性检出率最高,其次为HBsAg+、HBsAb+、HBcAb+、HBeAg+与HBsAg+、HBsAb+、HBcAb+、HBeAb+,大三阳组患者(131例)HBV-DNA平均载量为5.65×108 U/m,其中低载量占全组比例为17.56%、中载量为17.56%、高载量为64.89%;小三阳组患者(149例)HBV-DNA平均载量为1.82×106 U/mL,其中低载量占全组比例为81.88%、中载量为15.44%、高载量为2.68%,表明血清中HBeAg、HBeAb与HBV-DNA水平存在明显相关性。分析原因为患者HBV感染情况与其病情转归属于动态过程,FQ-PCR检测HBV-DNA载量与CLEIA检测的乙肝5项指标水平在判断HBV感染严重程度中均具有重要作用,因患者间机体免疫功能存在较大差异,造成HBV反应度存在不同[11]。FQ-PCR技术已在乙肝早期诊断及疗效判断中得到应用,但需注意药物对HBV-DNA检测结果造成的干扰;而CLEIA检测乙肝5项具有较高的灵敏度,可有效减少HBV检测窗口期效应的影响[12]。
综上所述,FQ-PCR法与CLEIA联合在HBV检测中具有较高的应用价值,可更加全面地反映患者病情转归情况及预后状况,为临床诊疗提供可靠参考。
参考文献
[1] 张毓,田丰,孙国栋,等.化学发光法应用于无偿献血者HBsAg阴性/HBV DNA阳性标本检测及其与核酸检测的关联分析[J].中国输血杂志,2020,33(7):651-654.
[2] 史露宾,毛逸琪,李世宝,等.全自动核酸提取及荧光定量多聚酶链式反应分析系统对HBV-DNA试剂盒检测性能的验证及评价[J].临床与病理杂志,2022,42(2):263-273.
[3] 谢宇端,韩艳,高原小雪.荧光定量聚合酶链反应检测慢性乙肝患者HBV DNA的意义[J].标记免疫分析与临床,2020,27(3):513-517,527.
[4] 武佳欣,杨志清,张睿君,等.HBsAg阳性母亲HBV核心启动子突变与宫内传播的关系[J].中华流行病学杂志,2020,41(6):902-907.
[5] 黄晨璐,许伟,胡乾坤,等.实时荧光核酸恒温扩增试验和定量反转录-聚合酶链反应对血清乙型肝炎病毒RNA定量检测的一致性评价[J].微生物与感染,2020,15(3):158-165.
[6] MENG C,LIU T,LIU Y W,et al.Hepatitis B virus cccDNA in hepatocellular carcinoma tissue increases the risk of recurrence after liver transplantation[J].Transpl P,2019,51(10):3364-3368.
[7] 巫智勇,叶英.两种HBV DNA荧光定量PCR检测试剂的检测能力精度比较[J].中西医结合肝病杂志,2021,31(4):366-368.
[8] 李育敏,徐怡,阚丽娟,等.荧光定量PCR测定HBV DNA测量不确定度的评定与应用探讨[J].现代检验医学杂志,2019,34(3):151-155.
[9] LIU C,LIN J P,XUN Z,et al.Establishment of coamplification at lower denaturation temperature PCR/fluorescence melting curve analysis for quantitative detection of hepatitis B virus DNA,genotype,and reverse transcriptase mutation and its application in diagnosis of chronic hepatitis B[J].J Mol Diagn,2019,21(6):1106-1116.
[10] 朱锦宏,吴红,王春苗,等.乙肝患者血清HBsAg与HBsAb双阳性的临床分析[J].实用医学杂志,2019,35(4):638-640,644.
[11] 王扬,廖昊,邓中平,等.2种实时荧光定量聚合酶链式反应法检测HBeAg阳性慢性乙型肝炎患者血清HBV RNA的一致性分析[J].临床肝胆病杂志,2022,38(5):1035-1040.
[12] 陈贤坤,吴翠云.HBsAg及HBV DNA定量检测在慢性乙型肝炎患者不同病程阶段中的应用价值[J].检验医学与临床,2019,16(13):1829-1831,1836.
(收稿日期:2023-05-16)

