连夏保肝颗粒对肝纤维化大鼠TGF-β1/Smads通路的影响
王珑 刘小军 苗倩倩 肖雨晨 李雨容 赵静
(西安新润药业有限公司药物研发中心,陕西 西安 710003)
肝纤维化(hepatic fibrosis,HF)是慢性肝炎向肝硬化、肝癌发展的中间过程,有效阻止其发生发展对肝硬化及肝癌的控制起到至关重要的作用[1-2]。目前认为,TGF-β1/Smads 信号通路在肝纤维化的发生及发展中具有重要作用,转化生长因子-β1(Transforming growth factor-β1,TGF-β1) 是促肝纤维化的关键因子,α-平滑肌肌动蛋白(α-Smooth muscle actin,α-SMA)是肝纤维化活化的标志物[3-6]。连夏保肝颗粒(Lianxia Baogan Granule,LBG)由连翘、夏枯草、白芍、黄芪、金钱草、五味子、山萸肉、丹参、生地和甘草十味药材组成,具有滋阴疏肝、化瘀通络、散结之功效,临床用于瘀阻肝络证,为治疗肝纤维化的中药制剂,在临床使用多年,其作用机制尚不明确。本试验旨在探讨LBG对TGF-β1/Smads信号通路的影响,为LBG临床治疗肝纤维化提供依据。
1 材料与方法
1.1试剂 ALT测定试剂盒(批号20180841)、AST测定试剂盒(批号20180791)、γ-GT测定试剂盒(批号20180606)均购自中生北控生物科技股份有限公司;大鼠ColⅠ ELISA试剂盒(EXP 15Feb20)、大鼠ColⅢ ELISA试剂盒(EXP 21JAN20)、Rat hyaluronic acid ELISA试剂盒(EXP 20Feb20)均购自美国Amresco公司;大鼠CTGF ELISA试剂盒(批号191201)、大鼠TGFβ1 ELISA试剂盒(批号191106)均购自上海西唐生物科技有限公司);一抗小鼠a-SMA(批号201808)、大鼠Smad2/3(批号201803)、Smad7(批号201708)、β-actin(批号201812)、TGFβ-RⅠ(批号201710)、TGFβ-RⅡ(批号201801)、TGFβ1(批号201701)、大鼠p-smad2(批号201905)均购自武汉博士德生物工程有限公司;山羊抗兔IgG/辣根酶标记(批号73540)、山羊抗鼠IgG/辣根酶标记(批号73750)均购自北京中杉金桥生物技术有限公司;ECL Plas超敏发光液(批号19190503,北京普利莱基因技术有限公司);BCA检测试剂盒(P0012)、RAPI组织细胞裂解液(P0013B)均购自上海碧云天生物技术有限公司;四氯化碳CCl4(批号GB688-92,天津市化学试剂六厂三分厂);连夏保肝颗粒(批号20190901,西安新润药业有限公司自制,制剂标示量:每克颗粒相当于0.91 g生药)。
1.2仪器 MD100全自动生化分析仪(美国Bio-Rad公司);170-3940半干转膜仪(美国Bio-Rad公司);Model 680酶标仪(美国Bio-Rad model公司);AlPha FCQ数字凝胶成像系统(美国HP公司);RM2016转轮式切片机(日本Leica公司);5418R高速冷冻离心机(德国Centrifuge公司);DM2000光学显微镜(日本Leica公司);BP190S1/1000天平(Sarlorius公司);MiasPro图像分析软件(四川大学计算机图像图形研究所);UV-2501PC紫外分光光度计(日本岛津公司)。
1.3动物 SPF级雄性SD大鼠,体重(230±10)g,西安市交通大学实验动物中心提供,医动证字SCXK(陕)2018-001。
1.4造模、分组与给药 72只大鼠,随机取60只大鼠皮下注射40%CCl4香油溶液1 mL·kg-1,每隔3 d注射一次,10%白酒自由饮用,连续造模42天[7-10]。剩余12只大鼠作为空白对照组皮下注射生理盐水1 mL·kg-1,常规饲养。造模42天开始给药治疗,60只造模大鼠随机分为模型组、安洛化纤丸组(3 g·kg-1)、LBG各剂量组(3 g,1.5 g,0.75 g生药·kg-1),每组12只,分别灌胃给予相应的受试药物;空白对照组灌胃给予10 mL·kg-1蒸馏水,2次/d,连续给药治疗35天;给药治疗期间空白对照组常规饲养,其余5组大鼠仍每天饮用5%白酒,每隔7 d皮下注射40% CCl4香油溶液1 mL·kg-1[11]。
1.5指标检测 实验结束后大鼠禁食给水过夜,腹主动脉取血并分离血清,测定大鼠血清AST、ALT和γ-GT的含量[12],及肝纤维化指标HA、PⅢP、LN[13-14],CTGF[15]和TGF-β1[15]。肝大叶取材3份,第1份4%多聚甲醛固定,用于HE和天狼星红染色,光镜下观察肝细胞变性、胶原纤维增生程度[16-17];第2份冰冻切片,免疫荧光法检测肝组织α-SMA[18]、TGF-β1[18]水平;第3份肝组织用于Western blot法测定Smad2/3、p-Smad2、Smad7、TβRⅠ、TβRⅡ[2,19]基因表达水平。

2 结果
2.1肝纤维化大鼠肝脏病理组织变化 HE染色结果显示,空白对照组大鼠肝组织结构正常,肝细胞以中央静脉为中心放射状排列。模型组大鼠肝组织不同程度损伤,肝细胞脂肪性病变并伴有纤维纵膈成大小不同的假小叶。LBG各剂量组及安络化纤丸组大鼠肝组织损伤不同程度减轻,LBG各剂量组大鼠肝细胞脂肪性病变程度与剂量呈正相关,纤维纵膈形成程度与剂量呈负相关;安络化纤丸组大鼠肝组织肝细胞脂肪性病变及纤维纵膈形成程度显著减轻。结果见图1。
天狼猩红染色结果显示,空白对照组大鼠肝组织天狼猩红染色阳性仅表达位于血管壁。模型组大鼠肝组织天狼猩红染色阳性表达位于汇管区及纤维化形成的纤维丝,纤维丝相互累积可见明显的纤维纵膈形成,纤维纵膈沿汇管区向肝组织小叶内延伸,相互连接形成假小叶。LBG各剂量组及安络化纤丸组肝组织天狼猩红染色阳性表达主要在汇管区及少量形成的纤维丝,纤维丝相互累积从汇管区延伸向肝组织小叶内,但无纤维纵膈连接成片形成的假小叶。结果见图2。
2.2连夏保肝颗粒对肝纤维化大鼠血清酶(ALT、AST、γ-GT)水平的影响 与空白对照组比较,模型组血清ALT、AST、γ-GT水平升高,差异具有统计学意义(P<0.05);与模型组比较,安洛化纤丸组血清ALT、γ-GT水平降低,差异具有统计学意义(P<0.05);与模型组比较,LBG各剂量组血清ALT、AST、γ-GT水平降低,差异具有统计学意义(P<0.05),结果见表1。

图1 大鼠肝脏组织HE染色(100倍×)
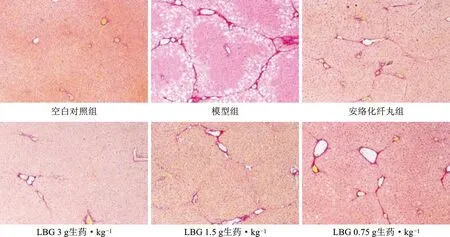
图2 大鼠肝组织天狼猩红染色观察结果(100倍×)
表1 连夏保肝颗粒对肝纤维化大鼠血清酶AST、ALT、γ-GT浓度的影响
2.3连夏保肝颗粒对肝纤维化大鼠血清HA、PⅢP、LN、CTGF、TGF-β1含量的影响 与空白对照组比较,模型组HA、LN、PⅢP、CTGF、TGF-β1水平均升高,差异具有统计学意义(P<0.05);与模型对照组比较,安洛化纤丸组LN、PⅢP、TGF-β1水平均下降,差异具有统计学意义(P<0.05);与模型对照组比较,LBG各剂量组HA、LN、PⅢP、TGF-β1水平均下降,差异具有统计学意义(P<0.05),结果见表2。
表2 LBG对肝纤维化大鼠血清HA、PⅢP、LN、CTGF、TGF-β1含量的影响
2.4连夏保肝颗粒对肝纤维化大鼠肝脏α-SMA和TGF-β1表达的影响 免疫组织化学染色结果显示,α-SMA为红色荧光,阳性表达于肝组织血管壁及纤维纵;TGF-β1为绿色荧光,阳性表达于肝小叶内细胞胞浆,DAPI染色细胞核为蓝色荧光。空白对照组大鼠肝组织α-SMA阳性表达于肝组织血管壁,TGF-β1阳性表达于肝小叶内细胞胞浆。模型组大鼠肝组织α-SMA强阳性表达于肝组织纤维纵膈,TGF-β1阳性表达于肝小叶内细胞胞浆,阳性表达强度高于空白对照组。LBG各剂量组及安络化纤丸大鼠肝组织α-SMA和TGF-β1表达弱于模型组,结果见图3。

图3 α-SMA和TGF-β1在大鼠肝脏组织中的表达(100倍×)
2.5连夏保肝颗粒对肝纤维化大鼠肝脏Smad2/3、p-Smad2、Smad7、TβRⅠ、TβRⅡ蛋白表达的影响 与空白对照组比较,模型组TβRⅠ、TβRⅡ、Smad2/3、p-smad2、Smad7蛋白表达显著上升(P<0.05)。与模型组比较,阳性药对照组和LBG各剂量组TβRⅠ、TβRⅡ、Smad2/3、p-smad2、Smad7蛋白表达显著降低(P<0.05),且呈剂量依赖性,见表3,图4。

表3 LBG对肝纤维化大鼠肝脏smad2/3、p-smad2、smad7、TβRⅠ、TβRⅡ蛋白表达的影响

A.空白对照组;B.模型组;C.LBG3 g生药·kg-1;D.LBG 1.5 g生药·kg-1;E.LBG 0.75 g生药·kg-1;F.安络化纤丸组
3 讨论
肝组织细胞外基质ECM合成增加或降解减少、纤维组织大量沉积并以肝内结缔组织非正常增生为主要特征的病理生理过程[20-21]被称之为肝纤维化。CCl4具有增加TGF-β1的表达而诱导HSC激活的能力,其促进HSC增殖并转化为肌成纤维细胞(Myofibroblast,MFB),最终发展为肝纤维化[1]。乙醇在肝脏代谢产生乙醛[22],乙醛可直接刺激胶原蛋白的合成;且乙醇可使肝脏的氧消耗增加[23-24],减少小叶中心肝细胞供氧,引起小叶中心肝细胞的炎症和坏死,促进肝纤维化的发生发展。故本次试验采用CCl4、乙醇来复制肝纤维化大鼠模型[25]。
ALT、AST及γ-GT是评价肝功能的重要指标,ALT主要在肝细胞浆中,肝细胞坏死可导致血清ALT水平升高;AST主要在肝细胞线粒体内,肝细胞坏死可导致血清AST水平明显升高[5];γ-GT是微粒体中的一种跨膜蛋白质,肝损伤可导致血清γ-GT水平升高[26]。本研究试验结果显示在乙醇与CCl4的影响下,大鼠血清ALT、AST、γ-GT水平指标均显著升高,表明大鼠肝纤维化模型制作成功。给予LBG后ALT、AST、γ-GT含量均显著降低,提示LBG对肝纤维化有明显的降酶保肝作用。
HA、LN、CⅣ、PCⅢ、CTGF与肝纤维化程度密切相关,PCⅢ含量与肝纤维化程度一致,可反映肝Ⅲ型胶原的合成[27];CⅣ可反映基底膜胶原更新,是构成基底膜的主要成份;LN与肝纤维化活动呈正相关,是基底膜总特有的非胶原性结构蛋白;HA可反映肝内生成纤维量及肝细胞受损情况。CTGF是致纤维化因子,能直接刺激成纤维细胞转化为MFB并异常表达ECM,参与纤维化过程[28]。本试验研究结果显示在LBG的作用下大鼠血清HA、LN、CⅣ、PⅢP、CTGF、TGF-β1水平均显著降低,提示LBG对肝纤维化有明显的抑制作用。LBG高、中、低剂量及安络化纤丸大鼠肝组织ɑ-SMA和TGF-β1表达显著弱于模型组,提示在LBG的干预下TGF-β1的表达出现不同程度减轻。
TGF-β1/Smads信号通路是最经典的参与肝纤维化的信号通路,由细胞膜外TGF-β1、膜上TβR受体以及膜内Smads蛋白三部分组成。TGF-β1是激活HSC强有力的细胞因子,TβR为信号传递受体,Smad是TGF-β1的下游信号分子,其中Smad2、Smad3起促进肝纤维化作用,Smad7起抑制肝纤维化的作用[29-30]。Western blot结果表明LBG可显著下调Smad2/3、p-Smad2、Smad7、TβRⅠ和TβRⅡ表达,提示LBG可抑制TGF-β1激活HSC内TGF-β1/Smads信号通路,主要作用位点与下调TGF-β1与TβRⅠ、TβRⅡ结合和降低Smad2磷酸化有关。本试验观察模型组Smad7对TGF-β1/Smads信号转导无负性调节作用,可能是HSC转化为MFB后失去了TGF-β1诱导Smad7表达上调的敏感性,导致Smad2/3持续磷酸化且不被Smad7所抑制,TGF-β1/Smad信号下转,又直接介导HSC向MFB的转化并分泌TGF-β1,提示LBG抑制TGF-β1激活TGF-β/Smad信号通路作用与Smad7无关。

