基于数据挖掘与网络药理学探讨新型冠状病毒肺炎恢复期中医药用药规律及机制
闫志鹏 吴杰 闫曙光 李京涛 魏海梁 常占杰 纪泛扑
(1.陕西中医药大学第一临床医学院,陕西 咸阳 712000;2.陕西中医药大学附属医院,陕西 咸阳 712000;3.西安交通大学第二附属医院,陕西 西安 710004)
新型冠状病毒(Severe acute respiratory syndrome corona virus 2,SARS-CoV-2)引起的新冠肺炎(Corona virus disease 2019,COVID-19)在全世界范围内广泛传播,是一项全球性挑战,严重威胁全世界人民的生命安全[1]。在我国精准而强力的疫情防控之下,国内新冠疫情得到有效控制,疫情态势及防控进入常态化阶段。随着疫情防控工作的深入,救治经验的快速积累,对疾病的认识和临证经验都在提升和丰富,临床治愈患者数量日渐增多,这些患者在住院期间经积极而有效的治疗后,病毒核酸检测虽已转阴,病情进展得以控制,但出现呼吸、消化、躯体及心理功能等方面障碍,严重影响日常生活质量,因此新冠肺炎恢复期患者的康复与预后问题将成为关注热点。众所周知,中医药在阻断新冠肺炎病情进展、缩短病程、提高临床疗效方面发挥了重要作用[2],在新冠肺炎患者恢复期阶段,中医药更能起到”愈后防瘥”效用。本研究采用数据挖掘及网络药理学方法,研究中医药治疗新冠肺炎恢复期的组方规律和相关机制,为新冠肺炎恢复期中医药治疗提供新思路及为临床组方用药提供用药策略,为后续进一步研究提供基础。
1 资料与方法
1.1数据来源 本研究通过以中文检索词“新型冠状病毒肺炎恢复期、COVID-19恢复期、新冠肺炎恢复期”等关键字为检索词,高级检索2019年10月—2022年4月中国知网、万方数据库等文献检索平台,中医药治疗新冠肺炎恢复期患者临床研究及中医经验文献并收集显效用药处方,结合国家卫生健康委员会以及各省、市、自治区针对2019-nCoV所致的新型冠状病毒肺炎公布的各版《新型冠状病毒感染的肺炎诊疗方案》中包含的恢复期中医方药,选取口服剂型,筛去注射剂,鼻滴、熏香剂等其他剂型,共收集处方86套。
1.2数据整理 运用Excel(2019)将整理好的方剂录入数据库,对录入数据进行反复核对,保障数据的准确性。根据《中华人民共和国药典》[3]2020版规范药名,如将“胡桃肉”统一为“核桃仁”,“花粉”统一为“天花粉”。对采用不同炮制方法的同一药物,均不计炮制方法,如“生黄芪”“炙黄芪”统一命名为“黄芪”,“生甘草”“炙甘草”统一命名为“甘草”,将“生、淡附片,熟附子,炮附子”统称为“附子”。
1.3数据提取 提取数据库中的处方并对所用药物进行罗列,制作数据表进行中药频数分析。将每一味中药按名称作为变量列,对每一个方剂进行二分类处理,即若方剂中含有某一味中药,就在与那味中药所在的变量列的对应的位置记为“Y”,否则记为“N”,整理成处方与其所含中药的二分类变量形式的表格格式数据,以便后续处理分析。
1.4数据挖掘方法 采用EXCEL 2019版进行数据整理及频次分析,采用SPSS Modeler 18.0统计软件,进行统计处理、复杂网络分析及关联规则分析,采用IBM SPSS Statistics 21统计软件聚类分析,利用Cytoscape 3.8.0软件进行可视化处理。
1.5网络药理学分析 通过中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php)筛选核心药组的有效成分及相应靶点,并与Genecards数据库(https://www.genecards.org/)筛选出COVID-19的靶点取交集,作为其治疗COVID-19恢复期的潜在靶点。将上述靶点导入STRING 11.5(https://cn.string-db.org/)数据库中,构建PPI网络,根据数据degree值进行筛选出关键靶点,应用DAVID数据库(https://david.ncifcrf.gov/)进行GO分析与KEGG通路富集分析,将收集的富集结果导入微生信网站(http://www.bioinformatics.com.cn/)进行气泡图绘制。
2 结果
2.1基于数据挖掘分析新型冠状病毒肺炎恢复期高频中药与用药规律
2.1.1用药分析 统计新冠肺炎恢复期处方86个,其中药物共149味,药物共出现963次,依据《中华人民共和国药典》[3]2020版,将所有药物的性味、归经进行统计(图1~3),其中性味以甘、辛、苦,温为主,肺、脾、胃三经为新冠肺炎恢复期药物主要归经。使用频次大于20的药物一共13味,共出现420次,占总用药次数的48.2%,将这13味中药作为高频药物。表1展示了该13味中药的频数、频率,性、味,归经等基本信息。除白术、砂仁和五味子外,其余药物归经中均包含肺经,其次是归脾、胃经。
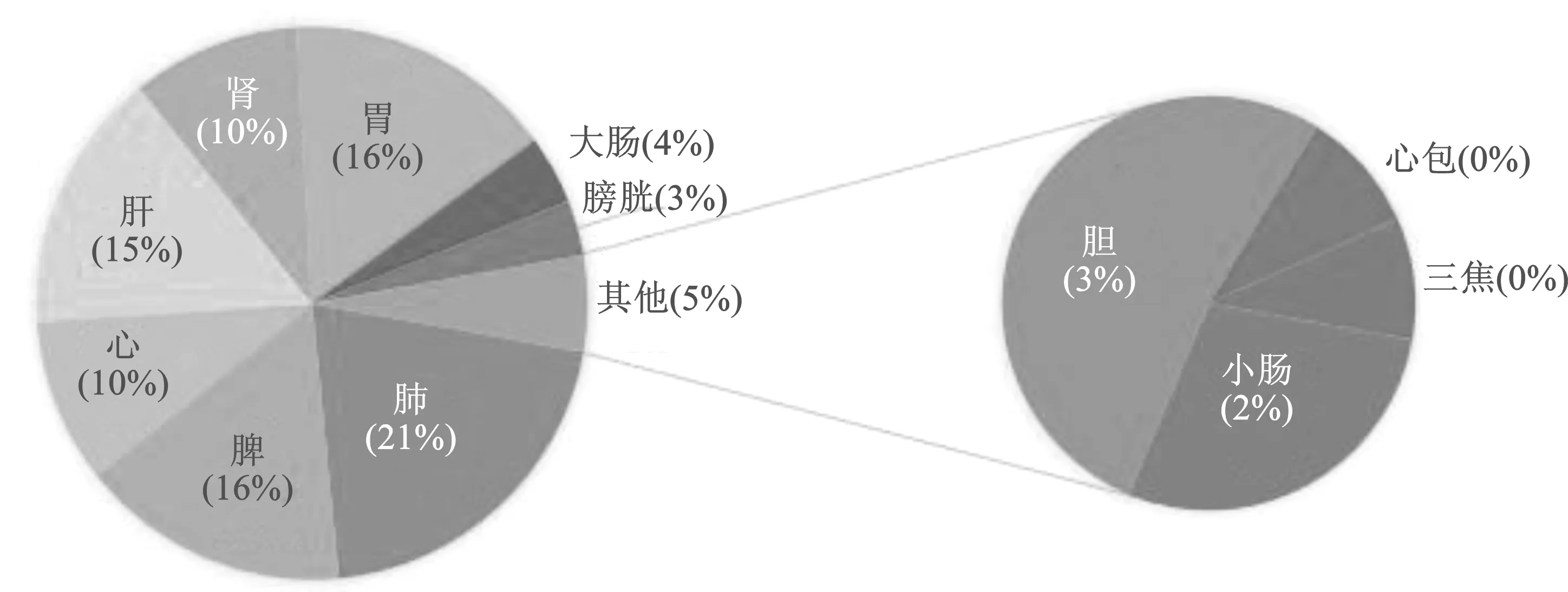
图1 药物归经分布图
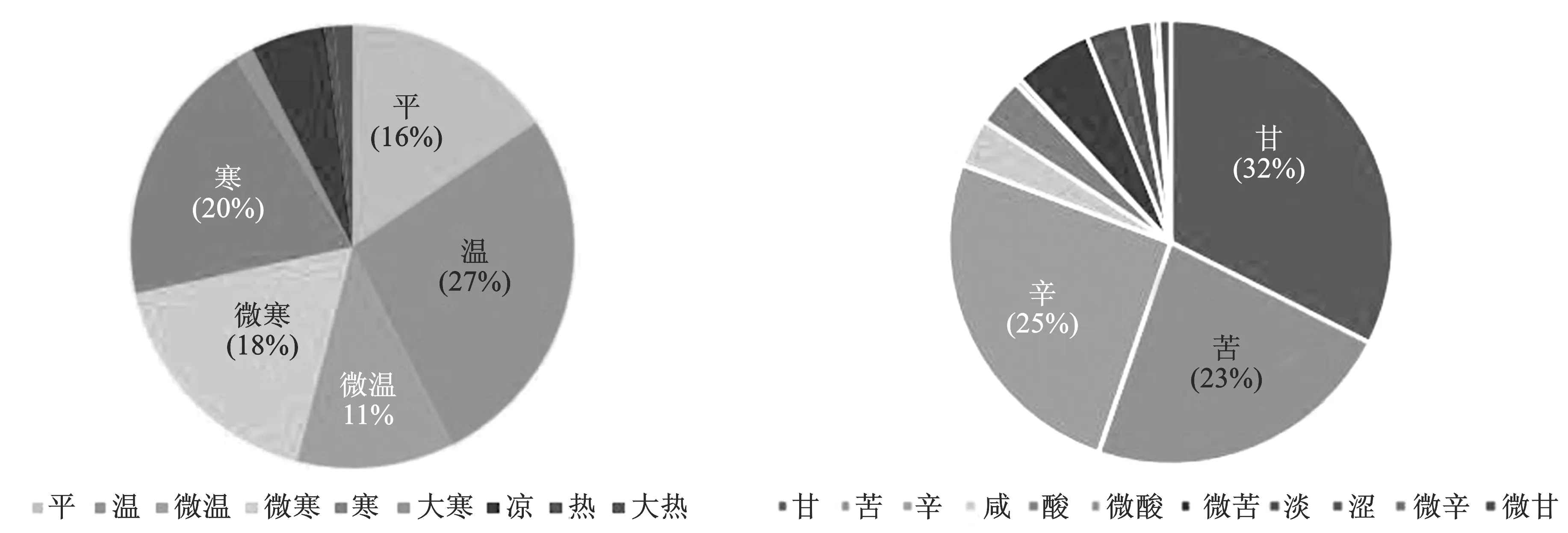
图2 药物性味分布图
2.1.2新冠肺炎恢复期组方规律分析 使用SPSS Modeler18.0统计软件Apriori模块对高频药物(使用频数≥20)进行关联规则分析,设置最低支持度30%,最小规则置信度90%,最大前项数5,共计得到核心药物组合14种。根据置信度百分比进行排序,得出常用药物组合位居前5位者,分别为“茯苓-半夏-陈皮”“茯苓-半夏-党参-陈皮”“茯苓-党参-陈皮”“茯苓-半夏-党参”“陈皮-黄芪-茯苓”。

表1 新冠肺炎恢复期高频药物用药分析

表2 新冠肺炎恢复期处方高频药物关联规则分析
2.1.3新冠肺炎恢复期药物复杂网络分析及高频药物可视化处理 采用SPSS modeler 18.0统计软件对新冠肺炎恢复期组方中所使用药物进行复杂网络分析,设置弱链接上限10,强链接下限25,链接粗细程度显示药物关联程度,即线条越粗,关联程度越高。图3结果显示,与药物频数统计一致,排名靠前的13味中药在新冠肺炎恢复期处方用药中关联程度均在前列,且新冠肺炎恢复期核心处方主要由黄芪六君子汤加减化裁组成。使用Cytoscape 3.8.0软件对高频药物复杂网络分析进行可视化处理(图4),发现除甘草、黄芪外,茯苓、半夏、党参、陈皮、白术在新冠肺炎恢复期处方关联程度最强。
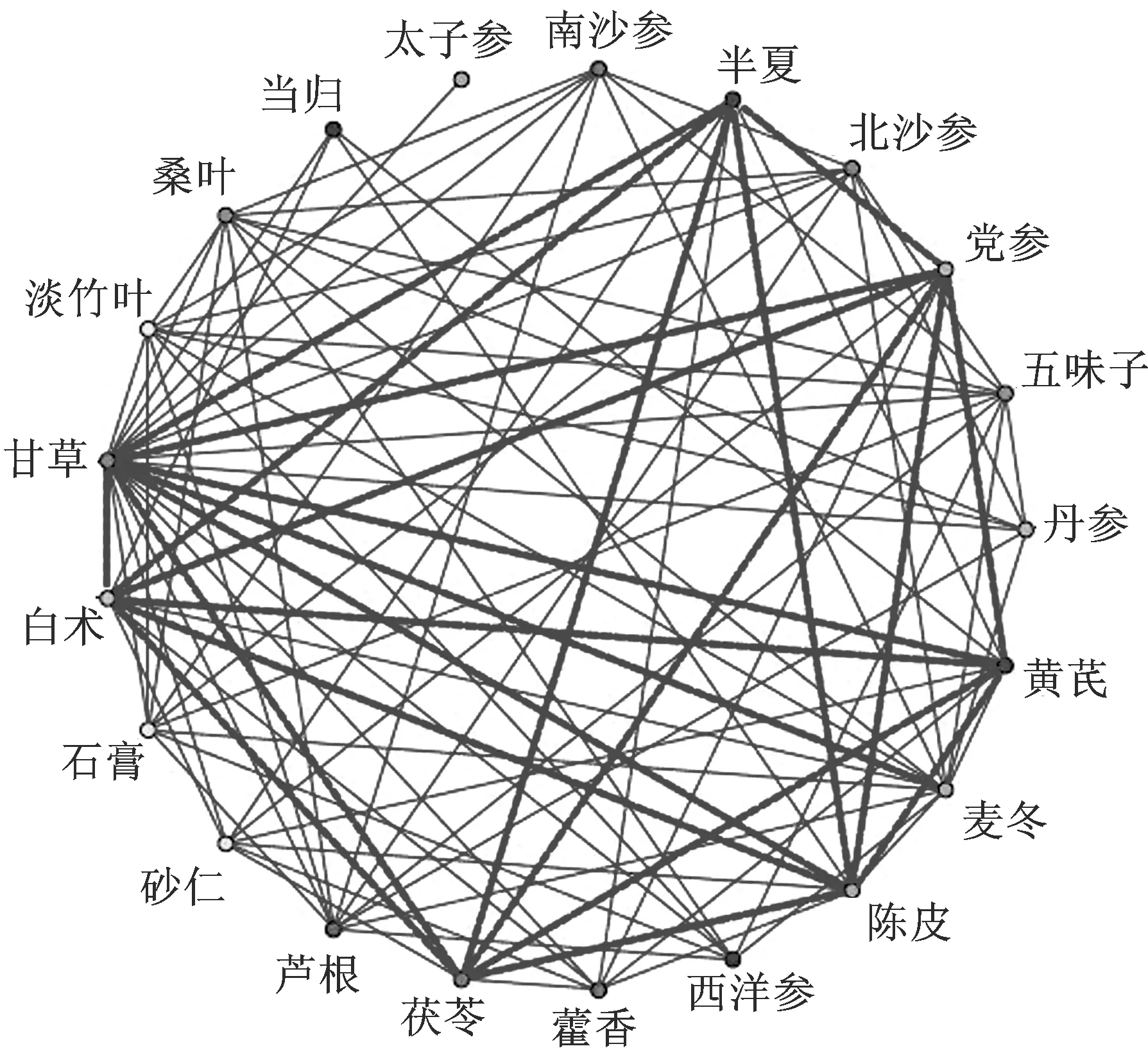
图3 整体药物复杂网络分析
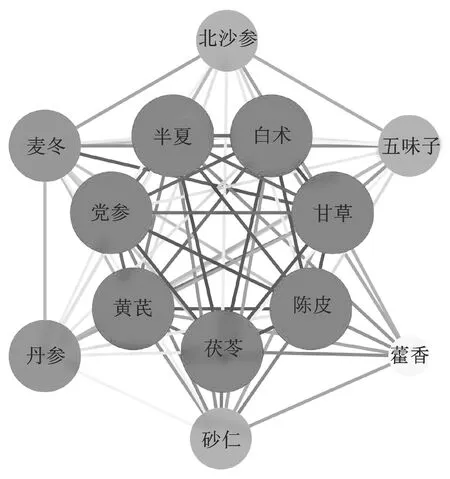
图4 高频药物复杂网络分析
2.1.4聚类组合分析 使用IBM SPSS Statistics 21统计软件对高频药物(使用频数≥10)进行系统聚类分析,设置最小聚类数为5,最大聚类数为10,运用Pearson相关性分析组间变量进行聚类分析。将药物分为2类(图5)。第一类为补脾益肺,利湿化痰药物,包含药物有砂仁、藿香、茯苓、半夏、党参、陈皮、白术、黄芪。第二类由养阴润肺、理气活血药物组成,包含药物有麦冬、五味子、北沙参、丹参、甘草。综合用药频次、组方规律、关联规则置信度及增益程度、聚类分析等方面结果可知新冠肺炎恢复期核心药组为“茯苓-半夏-党参-陈皮”,进一步对“核心药组-疾病”进行网络药理学分析阐明作用机制。
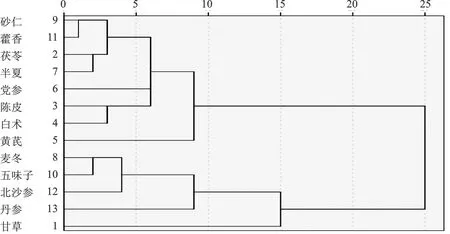
图5 高频药物聚类组合分析
2.2基于网络药理学分析核心药物对新冠肺炎恢复期作用机制研究
2.2.1核心药组靶点收集 通过TCMSP数据库(http://tcmspw.com/tcmsp.php)检索新冠肺炎恢复期核心药组“茯苓-半夏-党参-陈皮”中药化学成分,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为筛选条件,获得其有效成分及蛋白质作用靶点,并下载相关化合物的靶点信息。搜索到四味药物化合物成分共54个,对应靶点511个。筛选结束后,利用Uniprot蛋白质数据库(https://www.uniprot.org)将蛋白质靶点的名称进行标准化统一规范。去重后共合计得出183个靶点。
2.2.2新冠肺炎相关靶点的获取及筛选 基于GeneCards数据库检索治疗COVID-19疾病相关靶点(https://www.genecards.org/)4600个,将数据按Relevance score进行顺序排序,设置筛选条件为Relevance score大于1.11836206,得到COVID-19病相关靶点1397个。筛选结束后,利用Uniprot数据库(https://www.uniprot.org)将蛋白质靶点名称进行标准化统一规范。
2.2.3PPI网络构建及核心靶点筛选 利用Venny在线平台(https://bioinfogp.cnb.csic.es/tools/venny/)对新冠肺炎恢复期核心药组“茯苓-半夏-党参-陈皮”靶点与COVID-19疾病靶点取交集获得共同靶点,绘制“药物-疾病”韦恩图(图6),获得药物-疾病共同靶点34个。将所得交集靶点数据导入STRING平台(https://cn.string-db.org/),得到药物-疾病PPI网络图(图7),下载PPI的TSV数据文件,应用Cytoscape 3.8.0软件进行拓扑分析,按Degree进行排序,得到核心靶点蛋白互作度值前10位关键靶点分别为IL6、TNF、AKT1、VEGFA、HIF1A、IFNG、ICAM1、IL10、IL2、IL4(表3)。
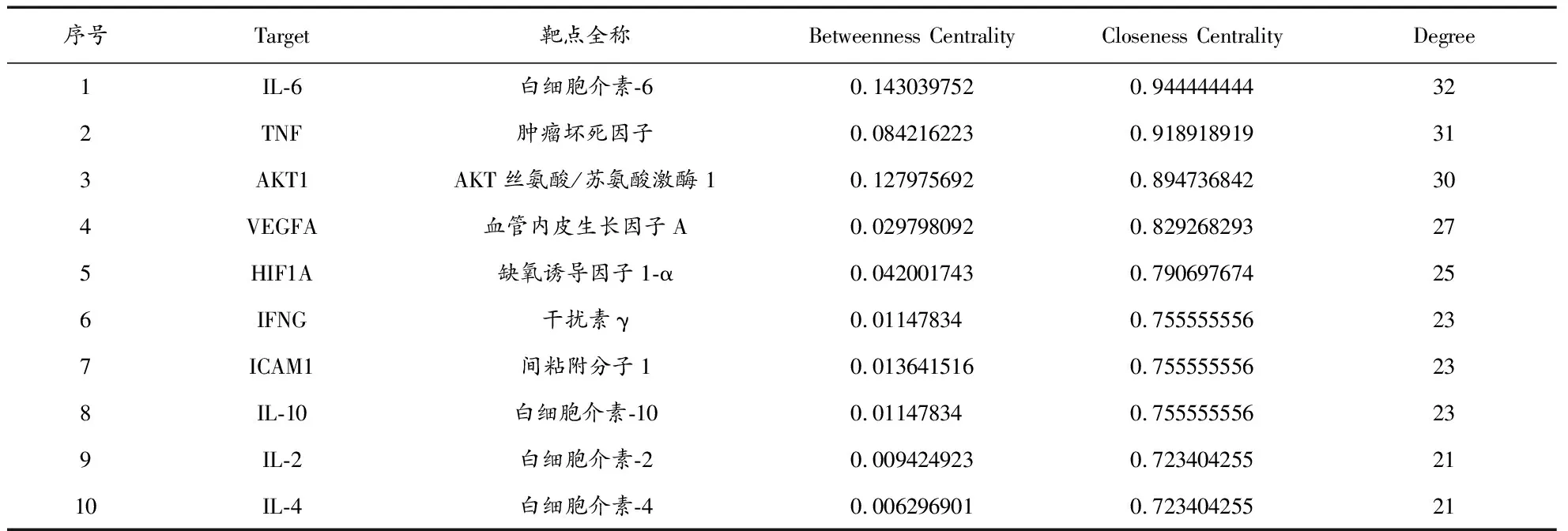
表3 核心靶点蛋白互作度值前10位
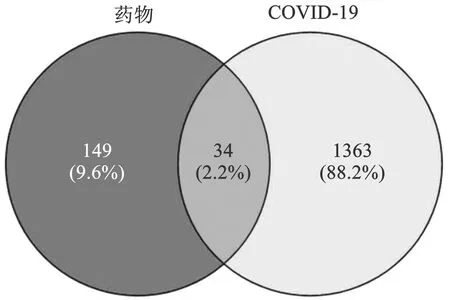
图6 药物-疾病维恩图
2.2.4核心化合物成分-靶点网络图 运用EXCEL将核心药组“半夏-陈皮-党参-茯苓”各药物活性化合物成分及核心靶点建立相互对应关系,部分结果如表4所示(所列主要为Degree值排名靠前的靶点及成分)。运用Cytoscape 3.8.0软件构建“核心药物-成分-靶点”网络图(图8),共构建5个节点,67条边。用“Network Analyzer”功能对该网络进行拓扑分析。按Degree值排序结果显示前三位的化合物依次为luteoli(木犀草素)、baicalein(黄芩素)、naringenin(柚皮素)。其中木犀草素为首要成分,说明木犀草素在新冠肺炎恢复期的治疗中起主要作用。
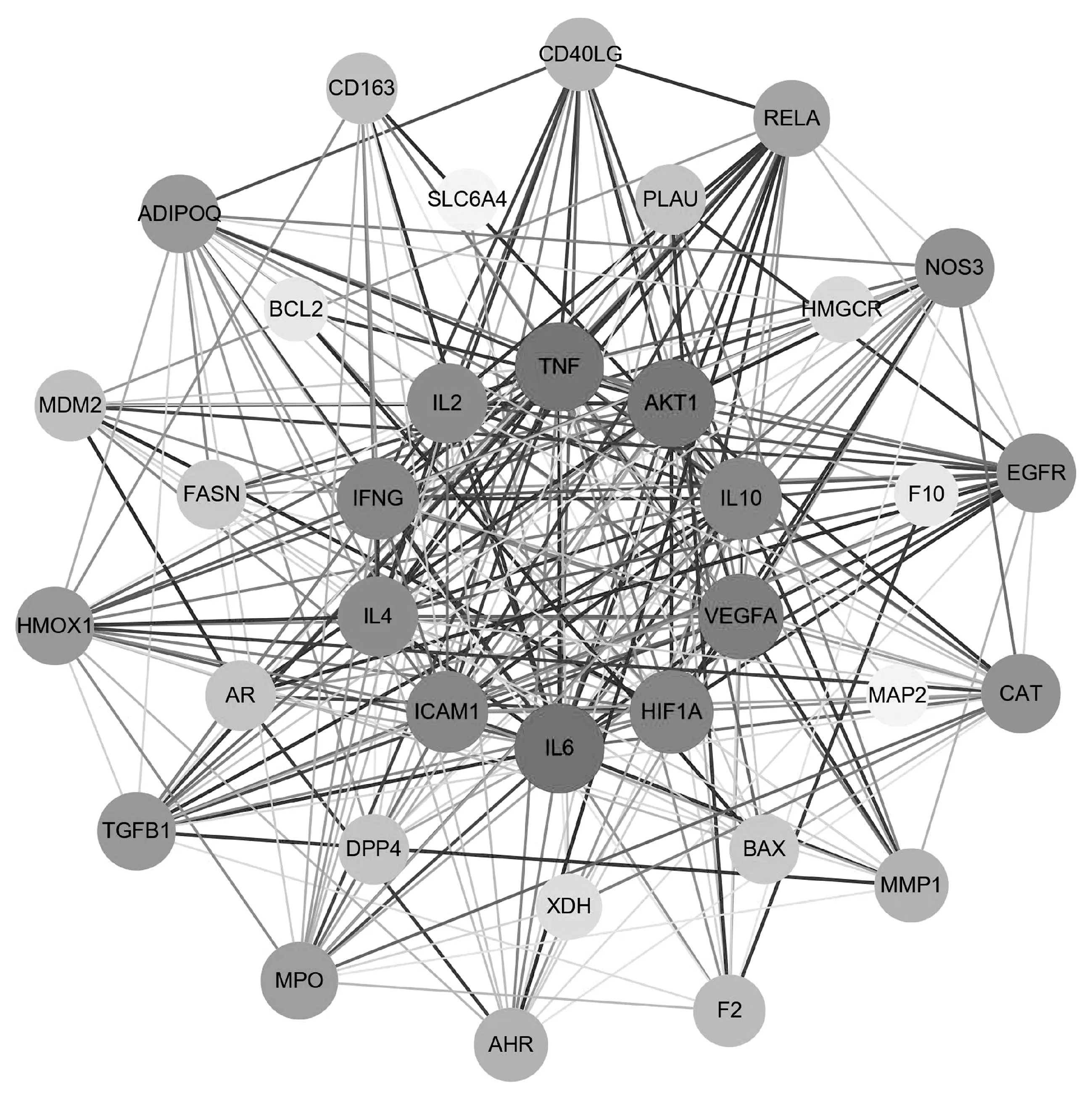
图7 药物-疾病PPI蛋白互作网络图

注:图中菱形代表药物与疾病的共同靶点名称,V形代表与靶点相映射的化合物,三角形代表疾病。靶点大小表示节点度值的不同:度值越大,图形及字母越大,连线越多,代表关联程度越高。

表4 核心化合物-靶点部分展示
2.2.5基因本体(GO)功能富集和京都基因与基因组百科全书(KEGG)通路富集分析 将34个核心交集靶点导入到DAVID数据库,以P<0.01为筛选条件,得到GO分析367条,其中生物学过程(Biological process,BP)307条,细胞组分(Cellular component,CC)23条,分子功能(Molecular function,MF)37条。预测靶点主要参与平滑肌细胞增殖的正向调控、应对缺氧反应、对细胞增殖的正向调控、凋亡过程的调控等生物学过程,分子功能方面与细胞因子活性、生长因子活性、酶结合等关系最为密切,并在细胞表面、高分子配合物、细胞外空隙等处发挥作用较为显著(图9)。
KEGG富集条目共分析通路108条,选取P值最小的20个条目进行绘图,核心靶点主要在于松弛素信号通路、恰加斯病、糖尿病并发症AGE-RAGE信号通路、HIF-1信号通路、PI3K-Akt信号通路、JAK-STAT信号通路、脂质和动脉粥样硬化、T细胞受体信号通路、癌症和疟疾等通路(图10)。
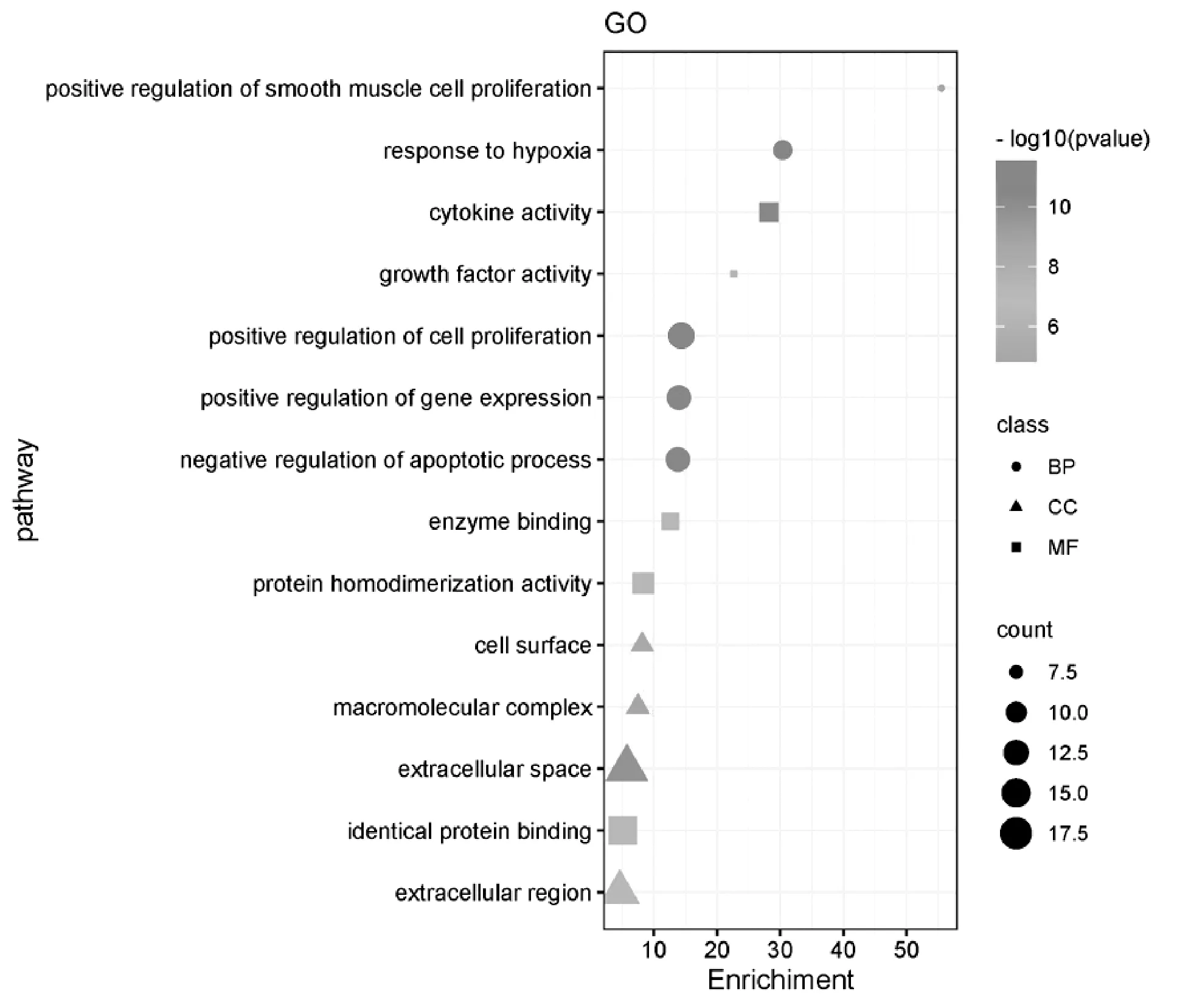
图9 GO富集分析气泡图

图10 KEGG富集分析气泡图
3 讨论
3.1新冠肺炎恢复期患者的临床问题 冠状病毒具有高传染性和高隐蔽性两个特点,SARS-CoV-2作为一种新型冠状病毒,通常引起呼吸道、胃肠道和神经系统症状[4]。据中国新冠肺炎医疗专家组统计,住院期间的患者主要症状包括发热(88.7%)、干咳(67.8%)、气短(53%~80%)、疲劳(38%)、恶心/呕吐(5.0%)或腹泻(3.8%)等[5]。这些患者经住院期间积极而有效的治疗,达到解除隔离和出院的标准,进入恢复期,而由新冠肺炎病毒所带来的并发症包括心、脑、肺、肝、肾和神经系统等功能受损所伴随的症状逐渐暴露。Chaolin Huang等[6]在《柳叶刀》发表的对COVID-19患者出院后6个月的队列研究表明疲劳或肌肉无力(63%)和睡眠困难(26%)是最常见的症状,23%的恢复期患者存在焦虑或抑郁等神经症状。一项单中心纵向研究表明[7]在新冠肺炎恢复期患者中临床后遗症状较为常见,包括一般症状(49.6%),呼吸道症状(39%),心血管相关症状(13%),心理社会症状(22.7%),甚至出现“复阳”的可能,这些可能与住院期间的性别、年龄和临床特征有关。研究表明COVID-19可导致肺纤维化,且肺纤维化可能会成为本次疫情过后最为严重的并发症[8]。自新冠肺炎疫情发生以来,COVID-19的特点、治疗和预后的问题成为研究的热点,然而随着疾病的发展与病程的推进,处于COVID-19恢复期的患者所面临的多方面、长期、慢性的后遗症及这些症状的发生率、特点、持续时间、发病及进展因素、预防及治疗等方面的研究未来应该得到更多的重视。
3.2基于中医药用药规律分析新冠肺炎恢复期核心病机与中医治法 聚类分析将新冠肺炎恢复期用药分为补益肺脾、益气养阴两大类,说明恢复期中药处方以补脾益肺、益气养阴为基础方向,结合恢复期用药及组方规律发现,半夏、丹参、藿香等祛湿利痰、解毒化瘀类药物属于高频用药,针对新冠肺炎恢复期病机特点,可起到“邪去正自安”的效用。新冠肺炎归属中医“疫病”范畴,属中医温病学中感受疫气、毒邪的一类传染疾病,其起病迅速,易于传变,病因以“湿毒疫邪”为主,湿毒贯穿疾病始终,可兼挟六淫外感、从化,可归属于“湿毒疫”范畴[9]。湿毒有重浊黏滞,缠绵难愈的致病特征,湿毒伤于气,则易导致气机不畅,水湿停滞,痰湿黏着,气滞血瘀,故而至恢复期病机特点演变为正虚邪恋,属虚实夹杂,正虚为肺、脾两脏气虚、阴虚,邪恋为“湿、毒、痰、瘀”。故新冠肺炎恢复期治疗原则当以补为主,以攻为辅。综合分析新冠肺炎恢复期处方所含药物特点,统计分析其性味主要以“辛、苦、甘,温”为主,这遵循了《素问·至真要大论》“阳明之复,治以辛温,佐以苦甘,以苦泄之,以苦下之”的治疗理念。故新冠肺炎恢复期以调理脾胃为主,兼以补肺益气,以甘味药升正气,辛开苦降以调畅人体气机。药物归经中主要在于肺经,其次是归脾、胃经。辛入肺,甘入脾。诸气者,皆属于肺,肺为主气之枢,脾为生气之源,疾病日久,正邪交争,五脏虚损,耗气伤津,气血乏源,故脾失健运,升输无力,则致水谷精微不能上输,心肺头目失养,血不上荣,则见心悸气短,头晕目眩等症,《内经》有云:“清气在下,则生飧泄。”脾气不运,清气不升反降则见食少,便溏等消化道症状。
药物频数统计“茯苓、半夏、党参、陈皮”四药均在前列,关联规则分析中四药四者组合置信度及增益程度综合位于第二位,高频药物复杂网络分析四者更是处于核心位置且关联节点众多,故选取“茯苓-半夏-党参-陈皮”为新冠肺炎恢复期核心药物。纵观四药中,半夏辛温而沉降,归脾、胃、肺经,辛者开散宣通;温者燥化寒湿;沉降者,下逆气;茯苓味甘淡,甘可补脾,淡而利湿,二者合用可健脾利水,燥化痰湿,改善纳差、乏力、便溏等症状。党参益气健脾,陈皮理气醒脾,一补一疏,调气机而补气血。半夏与陈皮配伍是“二陈汤”中的经典配伍,半夏燥湿化痰,降逆和胃,陈皮燥湿理气化痰,二者可祛痰逐湿,调理中焦以补脾气。四者合用可起到驱邪扶正、顾护脾胃的治疗作用。研究表明,在肺系疾病的治疗中,辛温药,宣通肺气,消痰理气;辛开苦降甘补调和法可在癌症晚期改善证候、提高体力状态、延长生存期,改善人体机能[10]。故而新冠肺炎恢复期用药应着重强调补脾益肺、益气养阴。《温病条辨·中焦篇·寒湿》曰:“湿邪者藏垢纳污,无所不受,其间错综变化……兼证甚多。”疫毒侵犯,缠绵难愈,在恢复期阶段若需合理运用药物达到祛湿利痰、解毒化瘀的作用进而体现中医药个性化的诊疗特点。
3.3基于网络药理学靶点通路分析核心药组对新冠肺炎恢复期治疗作用 通过网络药理学分析核心药组“茯苓-半夏-党参-陈皮”化合物成分可知,luteoli(木犀草素)、baicalein(黄芩素)、naringenin(柚皮素)为新冠肺炎恢复期用药排名前三的化学成分。其中化合物木犀草素为首要成分,所涉及靶点与表3所得到的核心靶点大部分相映射。木犀草素属于类黄酮类化合物,研究认为,木犀草素具有抗氧化、抗炎、抗菌、心脏保护、抗糖尿病、神经保护和抗过敏等特性[11-14],且在抗病毒方面具有显著作用[15]。黄芩素也属于黄酮类化合物,具有显著的抗炎作用,可以抑制流感病毒感染后炎症相关因子的表达[16]。柚皮素属于二氢黄酮类化合物的一种,可以通过抑制氧化应激、减少肺部炎症对百草枯诱导的急性肺损伤和肺纤维化起到治疗作用[17]。由此可见黄酮类化合物是新冠肺炎恢复期治疗中抗炎、抗纤维化等方面重要的化学成分。王高举等[18]对木犀草素等三种黄酮类化合物与COVID-19核心靶点进行分子对接,结果显示三种化合物与SARS-CoV-23CL水解酶、新冠病毒的受体——血管紧张素转换酶2(ACE2)的结合能均小于筛选标准,结合体构象稳定,同时木犀草素等三种黄酮类化合物还可直接作用于SARS-CoV-23CL水解酶,阻止病毒繁殖,还可与ACE2结合。因此,恢复期核心药组中所具有的黄酮类化合物是新冠肺炎病毒感染后恢复期阶段提高机体免疫力,防止“复阳”的关键所在。
通过PPI蛋白互作分析,恢复期核心药组“茯苓-半夏-党参-陈皮”与新冠肺炎的交集作用蛋白主要参与体内炎症、变态反应、感染、纤维化等多方面的调节。SARS-CoV-2作为一种包膜病毒,其主要通过与ACE2在细胞膜表面结合而进入细胞[19],GO富集分析显示“茯苓-半夏-党参-陈皮”在细胞因子活性、生长因子活性、酶结合等分子功能方面关系密切,在细胞表面、高分子配合物、细胞外空隙等处发挥作用,生物学过程主要富集于对细胞增殖的正向调控、应对缺氧反应、凋亡过程的调控等,这些作用可能对SARS-CoV-2的感染起到一定的抵御作用,在减少感染后的炎症水平、减轻后遗症方面发挥作用。KEGG分析富集的通路主要在于松弛素信号通路、恰加斯病、糖尿病并发症AGE-RAGE信号通路、HIF-1信号通路,此外PI3K-Akt信号通路、JAK-STAT信号通路、脂质和动脉粥样硬化、T细胞受体信号通路等通路在其中也发挥重要作用。炎症和纤维化作为新冠肺炎过程中的病理表现,松弛素信号通路与其相关。松弛素不仅影响炎症细胞向损伤部位募集和迁移,还可以改善缓解疾病后期的炎症水平,促进组织修复[20-21]。PI3K-Akt信号通路在SARS-CoV-2和MERS-CoV的感染过程中起到重要作用,通过靶向AKT激酶,可以对MERS-CoV起预防和抑制作用[22-23]。另外,有证据表明SARS-CoV-2感染与AGE-RAGE信号通路、疟疾等信号通路均有密切关系[24]。
综上所述,新冠肺炎恢复期核心药组“茯苓-半夏-党参-陈皮”可作用于多靶点减少感染后体内的炎症水平,通过多途径减轻疾病后期炎症损伤,且在抗病毒、调控细胞凋亡、改善氧化应激水平、缓解肺纤维化等多方面发挥作用。
COVID-19是21世纪第三次上升并迅速演变为全球大流行的疫情,成为全球重大的卫生事件[25],国家卫生健康委发布《新冠肺炎出院患者主要功能障碍康复治疗方案》[26]中提出针对不同病情、不同功能障碍的患者采取个体化康复治疗措施,“整体观念、辨证论治”是中医理论的核心观点,“未病先防、既病防变、瘥后防复”是中医“治未病”的三大主题,在恢复期针对不同的个体的证候进行治疗可以促进疾病恢复、提高生活质量。个体化诊治是中医药特色,也将是指导治疗新冠肺炎恢复期的优势所在。本文详细讲解了新冠肺炎恢复期方剂组方规律和核心高频药组,并阐释了其作用机制,为新冠肺炎恢复期临床治疗思路提供参考。

