黄芩苷诱导人肝癌HepG-2细胞凋亡及对Bcl-2和Bax蛋白表达的影响
谢燕华 康超 缑娇 王松海 许鹏
(陕西省中医医院,陕西 西安 710003)
肝癌是临床最为常见的恶性肿瘤之一,具有较高的发病率和死亡率,会对人们的健康乃至生命安全构成威胁[1]。近年来,随着人口老龄化的加剧,以及人们生活、饮食等习惯的改变,肝癌的发病率逐年上升,并且呈现出一定的年轻化趋势,其防治形势不容乐观[2]。然而至今,肝癌的发病机制并未真正明确[3]。近来有研究指出,在恶性肿瘤的发生、发展过程中,细胞凋亡抑制比细胞过度增殖起到的作用更重要,它是许多凋亡相关基因协同作用的结果,因此认为加强对细胞凋亡的干预,可能为恶性肿瘤的治疗提供新的方向[4]。黄芩苷是一种黄酮类化合物,从黄芩根部分离提取,在抑菌、抗炎、利尿、解痉等方面有着重要的作用[5-6]。但是从目前临床对黄芩苷在肝癌治疗中的应用来看,并未见太多报道,其对肿瘤细胞增殖的抑制和凋亡的促进作用如何,仍有待深入探究[7-8]。为此,本研究针对黄芩苷诱导人肝癌HepG-2细胞凋亡及对Bcl-2和Bax表达的影响展开分析,旨在探讨黄芩苷诱导HepG-2细胞凋亡的机制,从而为临床提供一定的科学依据。现报道如下:
1 仪器与材料
1.1仪器 NJL07-3型微波炉(南京杰全微波设备有限公司);3110型CO2培养箱(美国Thermo Fisher公司);CKX53倒置荧光显微镜(日本Olympus公司);FACSCalibur型流式细胞仪(美国Becton Dicknson公司);HH-420电热恒温水浴箱(新康医疗器械有限公司)。
1.2试药 黄芩苷(南京青泽医药有限公司);细胞株:人肝癌细胞株HepG-2购自中国科学院细胞所细胞库。小牛血清(北京华美生物工程公司);兔抗Bcl-2、Bax单克隆抗体均购自碧云天生物科技有限公司;免疫细胞化学试剂盒(福建迈新生物有限公司)。
2 方法
2.1HepG-2细胞培养 采用体外细胞培养的形式,培养于含10%胎牛血清的RPMI-1640培养液中,置37 ℃、95%湿度、体积分数5%的CO2培养箱中培养。按给药不同分为4组:对照组(细胞未给予黄芩苷处理),低剂量组(25 μg·mL-1),中剂量组(50 μg·mL-1),高剂量组(100 μg·mL-1)。
2.2MTT检测 取对数生长期的人肝癌HepG-2细胞,加入适量0.25%胰酶消化,吹打制成单个细胞悬液,调整细胞密度为4×104个·mL-1,以每孔100 μL,加入96孔培养板内,再加入培养基80 μL。倒置显微镜观察细胞贴壁后,加入不同浓度的莽草酸20 μL,使其终浓度为25、50、100 μg·mL-1,再置于 37 ℃、5% CO2饱和湿度的培养箱中分别培养24,48,72 h。每个浓度设4个复孔。终止培养后每孔加入20μL MTT溶液,继续培养4 h后吸取上清液,用PBS溶液冲洗3次后,加入150 μL DMSO,振荡,充分溶解结晶,用酶联免疫检测仪测定490 nm处各孔的吸光度(A值)。细胞增殖抑制率的计算同文献[9]。
2.3流式细胞术 取对数生长期的人肝癌HepG-2细胞,用含10%胎牛血清的培养基制备成浓度为3×105个·mL-1的细胞悬液,于6孔板中每孔接种1 mL。将平板置于37 ℃、5%CO2培养箱培养24 h后加入黄芩苷(终浓度为25、50、100 μg·mL-1),48 h后收集细胞,按Annexin V-FITC细胞凋亡检测试剂说明书处理样品。实验重复3次。
2.4免疫细胞化学法检测 爬片准备同文献[10]。检测操作:取出药物处理后的HepG-2细胞爬片,95%乙醇室温固定30 min;3 %H2O2-甲醇,室温孵育20 min,消除内源性过氧化物酶活性;0.1% Tritonx-100室温孵育30 min,利于抗体进入细胞;10%正常山羊血清室温孵育20 min,封闭非特异性抗原;倾去血清,加入50 μL一抗,使其完全覆盖细胞,置于湿盒内,4 ℃过夜;加入50 μL二抗,37 ℃,40 min;加入50 μL三抗,37 ℃,20 min;DAB显色,显微镜下观察,至阳性显色明显时用自来水冲洗,逐级脱色、透明、中性树胶封片。
光镜下观察图片,实验结果采用Image Pro Plus软件进行灰度值分析。光镜下连续观察5个视野,得出灰度值,取均值,计算其阳性率。
2.5Western Blot 收集细胞,1500 r/min离心5 min,PBS再洗2次。加入100 μL细胞裂解液,涡旋后放入冰中裂解90 min。4 ℃ 12000 r/min离心10 min,收集上清液。用Bradford法测定蛋白含量,各组取等量蛋白进行10%SDS-聚丙烯酰胺凝胶,常规电泳,转膜,膜用含5%脱脂奶粉TBST 4 ℃封闭非特异结合位点2 h,将膜与稀释的一抗4 ℃冰箱中孵育过夜,TBST液充分洗膜3次,每次振摇10 min。再与二抗室温孵育2 h。冲洗未结合二抗,TBST摇洗3次,每次8 min。取出NC膜加入显色剂闭光显色,显色后凝胶成像系统照相并用密度分析软件对蛋白含量进行定量。实验重复3次。

3 结果
3.1黄芩苷对HepG-2细胞抑制作用比较 不同组别对HepG-2细胞具有抑制作用,随着浓度的增加和时间的延长,抑制作用明显增强(P<0.05)。如表1所示。
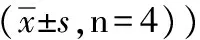
表1 不同浓度黄芩苷对不同时间点HepG-2细胞的抑制作用比较
3.2黄芩苷对HepG-2细胞抑制率比较分析 随着浓度的不断增加,以及作用时间的延长,黄芩苷对HepG-2细胞的抑制率逐渐上升(P<0.05)。如表2所示。
3.3流式细胞术观察细胞凋亡结果 实验结果显示,对照组、黄芩苷25 μg·mL-1、50 μg·mL-1、100 μg·mL-1早期凋亡率分别为1.01%、6.91%、8.06%、9.71%。如图1所示。可见,黄芩苷可诱导HepG-2细胞发生凋亡,且随着浓度的增加凋亡率更高。

表2 不同浓度黄芩苷对HepG-2细胞抑制率比较分析(n=4,%)
3.4不同浓度黄芩苷对凋亡相关基因Bcl-2、Bax的影响比较 不同浓度黄芩苷作用于HepG-2细胞,可抑制Bcl-2的表达,降低其浓度,并且显著低于对照组(P<0.05);不同浓度的黄芩苷作用于HepG-2细胞,可使Bax表达上升,明显高于对照组(P<0.05)。黄芩苷对HepG-2细胞凋亡相关基因Bcl-2、Bax的影响呈现出剂量依赖关系。如下表3、图2、图3所示。

表3 不同浓度黄芩苷对凋亡相关基因Bcl-2、Bax的影响比较

注:A.对照组;B.低剂量组;C.中剂量组;D.高剂量组
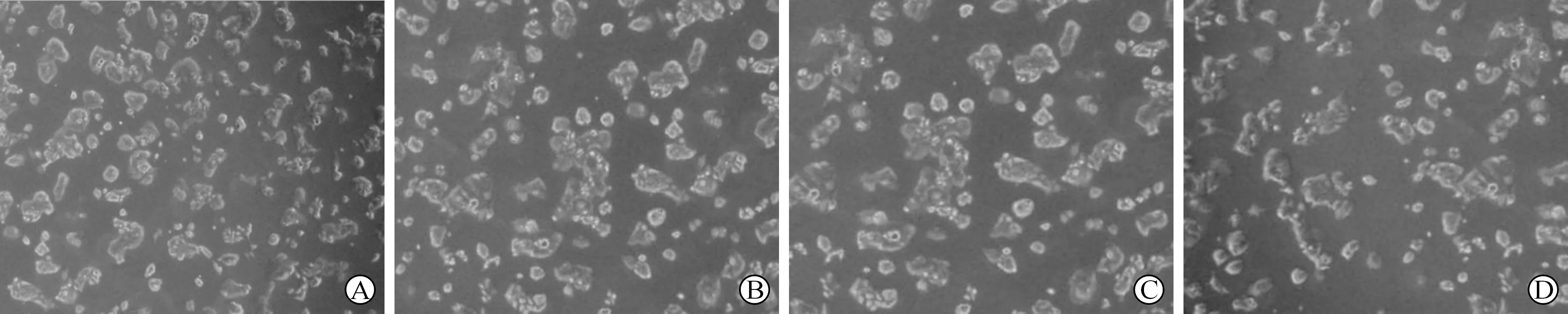
注:A.对照组;B.低剂量组;C.中剂量组;D.高剂量组

注:A.对照组;B.低剂量组;C.中剂量组;D.高剂量组
3.5Western Blot 如图4所示,对照组均表达一定量的Bax、Bcl-2蛋白,药物作用后,可明显上调HepG-2细胞中Bax表达,降低抑制凋亡蛋白Bcl-2的表达,且Bax、Bcl-2在浓度100 μg·mL-1时的变化比在其它两个浓度时作用更明显。

注:A.对照组;B.低剂量组;C.中剂量组;D.高剂量组
4 讨论
目前,临床对肝癌的发病机制并未明确,但仍旧在不断深入研究[11-12]。细胞凋亡是机体保持稳态的一种方式。肿瘤细胞在扩散转移、生长的过程中,细胞死亡有着十分重要的影响[13-14]。现阶段,临床对于抑制剂抑制能力强弱的评定中,一般将抑制率50%作为对比指标,所谓抑制率50%,指的是抑制剂使用后,细胞数量减少1/2所需的抑制剂浓度[15-16]。本研究中,黄芩苷对HepG-2细胞抑制作用和抑制率实验显示,50 μg·mL-1浓度,作用48 h抑制率为50.32%,接近临床采用的50%标准。由此可以看出,该浓度、该作用时间点时,对HepG-2细胞凋亡的抑制作用最强。细胞凋亡首先表现为形态学的改变,尤其是细胞核形态学改变为突出特征,因此在判定时对细胞形态学进行观察。本研究中,使用流式细胞术对细胞凋亡率进行观察,结果显示黄芩苷诱导了HepG-2细胞凋亡的发生[17-18]。
研究指出,细胞凋亡的触发,是一个级联式过程,多种基因参与其中,并对药物诱导细胞凋亡产生影响[19-20]。在细胞凋亡过程中,Bcl-2发挥着十分重要的作用,也被认为是最具代表性的抑制和促凋亡基因[21-22]。Bax是Bcl-2活性的主要调控因子,自身形成同源二聚体,若细胞内的Bcl-2浓度较高,Bax的异源二聚体增加,凋亡的趋势会减弱;若Bax较多时,则Bax本身形成的同源二聚体占主导,更容易发生细胞凋亡[23-24]。免疫细胞化学法检测是Bcl-2、Bax测定的常见方法,在临床上已被广泛使用,具有较高的测定价值[25-26]。本研究结果中,与对照组相比,人肝癌HepG-2细胞中Bcl-2、Bax蛋白的表达具有显著性差异(P<0.05),不同浓度黄芩苷作用后显示,随着浓度的增加,Bcl-2的表达水平下降,Bax表达水平上升,这一结果印证了黄芩苷具有协同增敏作用,促进人肝癌HepG-2细胞凋亡,这可能是其抑制癌症作用的重要分子机制之一。
综上所述,人肝癌HepG-2细胞凋亡过程中,黄芩苷发挥着十分重要的作用,通过对细胞形态学和分子水平的变化探究,认为这一凋亡机制可能与下调基因Bcl-2,上调Bax蛋白水平有关。

