采前外源多胺预处理对杏鲍菇内源多胺及乙烯的诱导分析
黎春红,张雷刚,罗淑芬,周宏胜,胡花丽,邵 彬,李鹏霞*
(1.江苏省农业科学院 农业设施与装备研究所,江苏 南京 210095;2.重庆三峡学院 生物与食品工程学院,重庆 404100;3.徐州鑫丰农业科技有限公司,江苏 徐州 221000)
0 引言
早在1964年Lieberman等[1]就提出了乙烯来源于蛋氨酸(Methionine,Met),之后Apelbaum等[2-3]又先后用小麦及大豆为研究材料阐明胁迫诱导下的乙烯合成和基础乙烯合成均遵循Met-SAM-ACCC2H4的途径。几乎与此同时,Yang等[4-5]的研究同样证明,植物体内源多胺的生物合成途径,Met-SAM-Spd-Spm与乙烯存在一定的重合。多胺中的亚精胺和精胺与乙烯具有共同的前体物质S-腺苷蛋氨酸(SAM)[6],两者在各类生命活动中均具有重要的调控作用,其在代谢上的相关性受到极大的关注。
Icekson等[7]研究发现,乙烯释放速率的增加可抑制黄化豌豆幼苗多胺的合成并降低内源多胺含量。Locke等[8]发现在大麦种子萌发过程中使用10 μmol/L乙烯合成抑制剂CoCl2(氯化钴)和AVG(氨基乙基乙烯基甘氨酸)可显著降低大麦叶片乙烯的释放,由此来促进叶片内源多胺的合成。Seo等[9]在前人研究的基础上,利用外源Spm和多胺合成抑制剂MGBG(甲基乙二醛双脒基腙)、ACC(1-氨基环丙烷-1-羧酸)、AVG及乙烯利研究了多胺和乙烯的关系,发现Spm可通过降低ACC合成酶和ACC氧化酶的转录水平及活性,从而抑制MGBG对乙烯的诱导作用。Bin等[10]发现盐胁迫下黄瓜幼苗叶片内源多胺含量显著增加,并伴随ADC(精氨酸脱羧酶)、ODC(鸟氨酸脱羧酶)、SAMDC和Spds(亚精胺合成酶)、PAO(多胺氧化酶)基因表达水平的显著上调;外源Spd通过下调盐胁迫下ADC、ODC基因的表达来抑制内源Put(腐胺)的积累,同时上调SAMDC基因的表达以促进内源Spd和Spm的积累,进而缓解盐胁迫对黄瓜幼苗生长的抑制。Roberts等[11]研究发现多胺合成抑制剂可促进乙烯的释放,而乙烯合成抑制剂则可提高多胺水平,并指出乙烯和多胺在生物合成途径中竞争共同前体物质SAM。这个结论已被Baker等[12-13]证实,他们提出在鳄梨组织中抑制SAM转变为ACC的抑制剂AVG在抑制乙烯合成的同时可刺激放射性标记的Met结合到Spd、Spm中,且多胺与乙烯之间的拮抗关系受SAMDC的表达调控。此外,乙烯和衰老具有一定的关联性,而多胺则有一个相反的效应。因此,多胺和乙烯对植物生长发育的调控作用近年来越来越受到重视。然而,目前在杏鲍菇常温贮藏中,乙烯生成量、多胺含量的变化及两者相关性的研究鲜有报道。同时,考虑到食用菌遇水极易腐烂,结合多次预实验的结果发现采后药剂及清水浸泡处理组杏鲍菇的贮藏品质明显低于未处理组的。因此,本实验通过采前喷施外源多胺(Spd、Spm)的处理方式分析该处理下杏鲍菇内源乙烯、多胺含量的变化情况,并对该处理下子实体的贮藏品质进行了评估,同时初步探讨了乙烯、多胺间的相关性,以期为进一步揭示多胺延缓杏鲍菇采后衰老的机理提供理论参考。
1 材料与方法
1.1 实验材料的培养及最适外源多胺浓度的筛选
杏鲍菇培养菌袋购于江苏省兴化食用菌公司,随即运回实验室,经121 ℃高压蒸汽灭菌30 min,待菌袋冷却至室温后,于超净工作台接种杏鲍菇菌种(编号:GIM 5.280,购于广东省微生物菌种保藏中心),随后置于(26±1)℃培养箱中,待菌丝长满整个菌袋后,去掉袋口的扎绳,并将其转至(16±1)℃、在相对湿度80%~90%的条件下继续培养,每天通风1~2次。待原基初步形成或出现小菇蕾时,随机选取栽培条件一致的9个杏鲍菇菇室,每个菇室放置30个菌袋,面积约1 m2。实验分别设置浓度为0、0.5、1.0、2.0、4.0 mmol/L的Spd及Spm喷施,共9组处理。每天定点用小型喷雾器向各处理组杏鲍菇喷施相应浓度的Spd及Spm溶液,喷施标准以溶液均匀布满子实体但不下滴为宜,每个处理组Spd及Spm用量为500 mL,连续处理4 d后,分别采收成熟度一致、大小均一、菇体洁白、无机械损伤、无病虫害的杏鲍菇,置于带孔的21 L乐扣箱(每组处理采收30 个杏鲍菇,各设置3 组重复),于(20±1)℃,相对湿度为70%~80%的环境中贮藏4 d后,测定菇柄及菇伞的可溶性糖及蛋白含量,以确定Spd及Spm的最适处理浓度。
1.2 外源多胺处理
参考1.1的方法进行杏鲍菇采前多胺处理,以清水喷施为对照(CK),连续处理4 d后,每组处理采收60个杏鲍菇,各设置3 组重复,各处理组菇体分装于21 L贮藏箱,于(20±1)℃、相对湿度70%~80%下贮藏4 d,分别于0、2、4 d取样,保留菇柄及菇伞部位,液氮冷冻后于-80 ℃保存用于各项指标的测定,其中乙烯释放量及细胞膜相对透性的测定采用同期鲜样。
1.3 仪器与设备
实验所用仪器:雷磁PHSJ-3F型pH计由上海雷磁新径仪器有限公司生产,3K15型高速台式冷冻离心机由Sigma公司生产,WH-886涡旋混合器由常州翔天实验仪器厂生产,-80 ℃超低温冰箱由海尔公司生产,Technologies 7280A气相色谱仪由美国Agilent公司生产,Waters Acquity UPLC型液相色谱分析仪由美国Waters公司生产,PD-501型PH/电导率/离子综合测试仪由梅特勒托利多有限公司生产,Epoch酶标仪由美国Biotek公司生产,荧光倒置显微镜由日本Olympus公司生产。
1.4 测定指标及方法
1.4.1 可溶性糖含量的测定 可溶性糖含量采用蒽酮比色法测定。取菇柄与菇伞组织各1 g,分别加入5.0 mL蒸馏水,匀浆后置于沸水浴浸提30 min(提取2次),提取液过滤后置于25.0 mL的容量瓶中,以蒸馏水定容,混匀后吸取1.0 mL,加入0.5 mL蒽酮乙酸乙酯试剂和5.0 mL浓硫酸,充分振荡后,立即将试管置于沸水浴中,保温1 min后取出冷却至室温,以蒸馏水做空白参比,于630 nm处测定吸光值。采用标准蔗糖溶液依上述过程制作标准曲线,对照标准曲线计算样本可溶性糖含量。
1.4.2 可溶性蛋白含量的测定 可溶性蛋白含量采用考马斯亮蓝G-250染色法测定。酶液提取:取菇柄与菇伞组织各3 g加入6.0 mL 50.0 mmol/L磷酸缓冲液(pH值为 7.8,另含0.1 mmol/L EDTA,0.3% Triton X-100和4% PVP),匀浆,4 ℃、10000 r/min离心20 min,上清即为酶提取液。取3支试管,各加入上述酶提取液100.0 μL,加考马斯亮蓝G-250溶液5.0 mL及蒸馏水0.9 mL,混匀,室温下静置5 min,于595 nm处测定吸光值。采用牛血清蛋白作标准曲线,对照标准曲线计算样本蛋白含量。
1.4.3 乙烯释放量测定 乙烯释放量的测定参考黎春红等[14]的气相色谱法,每个样品重复测定3次。
1.4.4 内源多胺含量测定 参考Song等[15]的方法,略有改动。取菇柄与菇伞组织各4 g,分别加入8 mL预冷的5%高氯酸(v/v)冰浴研磨匀浆,浸提1 h后4 ℃、10000 r/min离心30 min。取500.0 μL上清置于10.0 mL带盖塑料离心管中,加入7.0 μL苯甲酰氯,1.0 mL 2 mol/L NaOH,涡漩20 s后于37 ℃水浴25 min。加入2.0 mL饱和NaCl溶液,混匀后用2.0 mL乙醚萃取,10000 r/min离心5 min后,取1.5 mL醚相于真空或水浴干燥,用100.0 μL甲醇涡旋溶解,过0.45 μm有机滤膜后,取10.0 μL于Waters Acquity UPLC型液相色谱分析仪中进行检测。流动相为已过滤的去离子水(A)、甲醇溶液(色谱纯)(B);洗脱程序为A:0~1 min,50%;A:15~25 min,20%;A:26 min,70%;运行时间35 min,流速0.8 mL/min,柱温30 ℃,进样体积1.0 μL。采用XBridge C18柱(250 mm×4.6 mm,5.0 μm填料粒径),紫外检测器,检测波长230 nm。同时将Spd和Spm(Sigma公司)标准品配制为1 mmol/L的储备液,各取40.0 μL按上述方法进行苯甲酰化。分别取苯甲酰化后的多胺标准液0.1、0.2、0.3、0.4、0.5 mmol/L进样,以峰面积及标品浓度制作标准曲线,参照曲线方程计算样本内源Spd和Spm含量。
1.4.5 SAM含量测定 参考Aboul-Enein等[16]的方法测定SAM含量,略有改动。取菇柄与菇伞组织各2 g,分别加入4 mL 10%三氯乙酸重悬,冰浴浸提2 h,4 ℃、10000 r/min离心20 min后,取上清过0.22 μm水相滤膜,取20 μL用Waters Acquity UPLC型液相色谱分析仪检测。流动相:95%的0.01 mol/L甲酸铵溶液(A相),5%甲醇溶液(色谱纯、B相);运行时间20 min,流速0.45 mL/min,柱温30 ℃,进样体积1 μL。采用XBridge C18色谱柱(250 mm×4.6 mm,5.0 μm填料粒径),紫外检测器,检测波长260 nm。同时分别配制浓度为0.01、0.04、0.16、0.64 g/L的SAM标准溶液(Sigma公司),以峰面积及标品浓度制作标准曲线,参照曲线方程计算样本SAM含量。
1.4.6 SAMDC活性测定 采用上海仁捷生物科技有限公司的植物S-腺苷甲硫氨酸脱羧酶(SAMDC)酶联免疫分析(ELISA)试剂盒测定杏鲍菇子实体的SAMDC活性。
1.4.7 MDA含量、细胞膜相对透性及活性氧水平测定 MDA含量及细胞膜相对透性的测定参考刘红艳等[17]的方法;活性氧的测定参考Shi等[18]的方法,对每个样本进行3次生物学重复检测,使用GloMax 96发光计检测发光输出。
1.5 数据处理
实验数据均为3个平行样品的测定结果,表示为平均值±标准误差。采用SPSS 21.0软件进行相关性及单因素方差分析,数据处理间差异显著性检验采用Duncan法,并用Excel和Origin 8.5软件作图。
2 结果与分析
2.1 最适外源多胺浓度筛选
食用菌中可溶性糖含量与其品质、成熟度和耐贮性密切相关[19]。由图1A、图1B可知,贮藏至4 d时,经0~4.0 mmol/L外源Spd及Spm处理的杏鲍菇菇体组织的可溶性糖含量介于114~192 mg/g,其中,经1.0 mmol/L Spd及Spm处理菇伞和菇柄的可溶性糖含量水平最高,其中Spm处理菇伞和菇柄的可溶性糖含量与其他处理组间的差异达极显著水平。
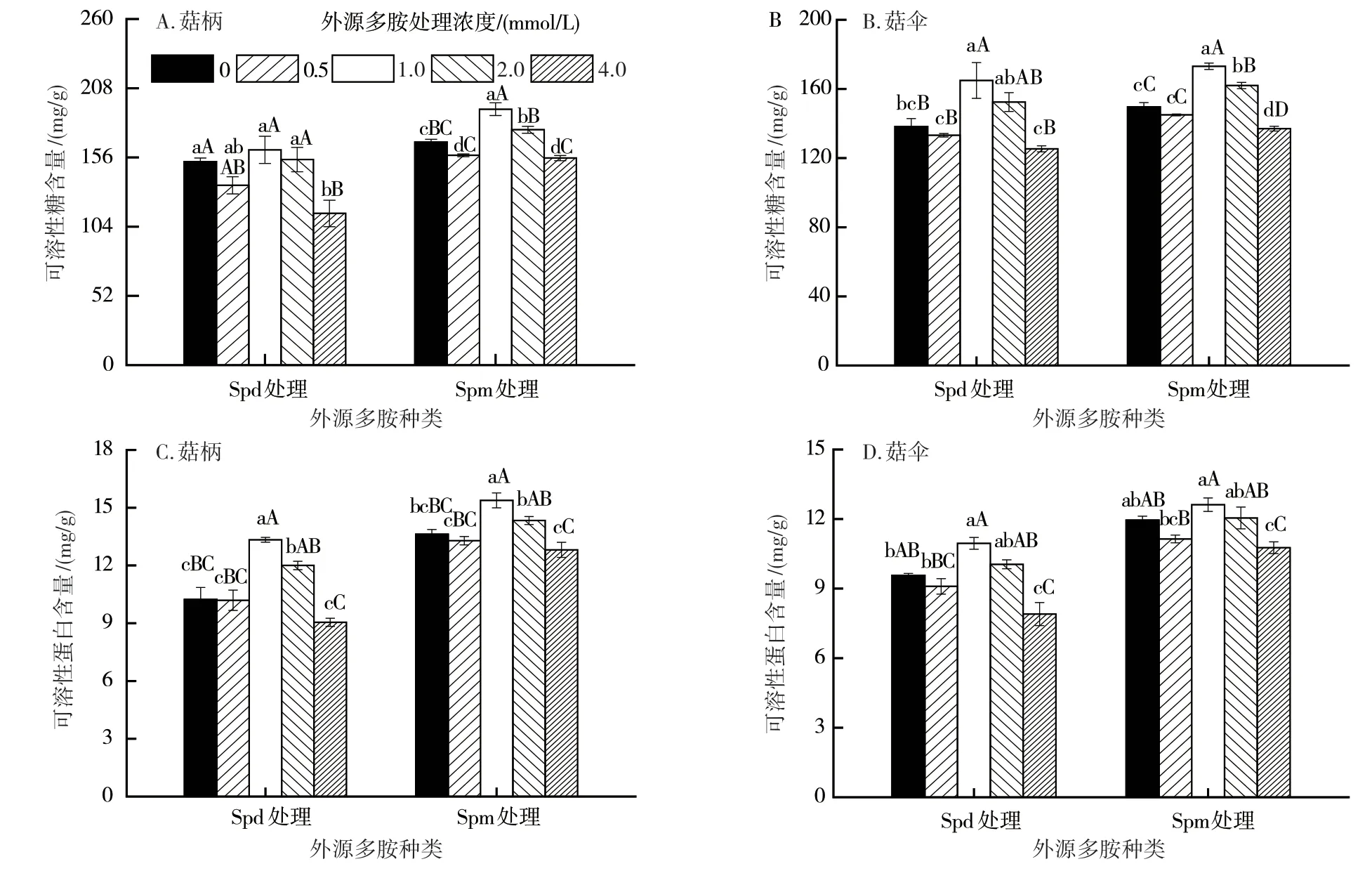
图1 不同浓度外源多胺处理对杏鲍菇子实体可溶性糖和可溶性蛋白含量的影响
可溶性蛋白是杏鲍菇采后期间主要的营养物质来源,其含量的降低是组织衰老的重要特征之一。由图1C、图1D可知,经0~4.0 mmol/L外源Spd及Spm处理杏鲍菇菇体的可溶性蛋白含量介于8~15 mg/g,经1.0 mmol/L Spd及Spm处理菇伞和菇柄的可溶性蛋白含量最高,其中,菇柄的可溶性蛋白含量显著高于其他处理组间的。
可溶性糖和可溶性蛋白是杏鲍菇采后代谢底物之一,它们的降解是杏鲍菇采后变质和腐败的主要原因。只有较适宜浓度的多胺(1.0 mmol/L Spd及1.0 mmol/L Spm)处理才能保持杏鲍菇采后贮藏期间获得较高水平的可溶性糖及可溶性蛋白。同时,从菇体表型可以看出,杏鲍菇贮藏期间易出现菇柄褐变、菇伞扩张、菌丝体生长及菇体自溶等品质衰败现象(图2)。相较于清水处理,1.0 mmol/L Spd及Spm处理可明显维持杏鲍菇的采后贮藏品质,降低菌丝体生长与菇体自溶现象的发生。综上,采前喷施1.0 mmol/L Spd及1.0 mmol/L Spm可显著维持采后子实体的可溶性糖和可溶性蛋白含量及其贮藏品质,后续选择1.0 mmol/L Spd及1.0 mmol/L Spm进行多胺保鲜效果研究。
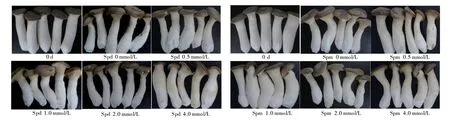
图2 不同浓度外源多胺处理对处理前及处理后4 d杏鲍菇子实体衰老表型的影响
2.2 外源多胺处理对杏鲍菇子实体内源乙烯的诱导
采后贮藏期间,随着子实体的继续分化发育及衰老,乙烯释放量整体呈现先增后降的模式(图3)。经外源Spd及Spm处理的子实体,其乙烯释放量均受到了不同程度的抑制,整体释放水平仅为对照组的0.42~0.83倍,其中Spm处理组菇体的乙烯释放量极显著低于对照菇体的。同期,Spd、Spm及对照处理组乙烯释放的峰值水平分别为0.23、0.20、0.29 μL/(kg·h),其中Spd及Spm处理组的乙烯释放峰值仅为对照菇体贮藏至4 d时的0.94~1.08倍。可见,多胺处理能显著降低杏鲍菇内源乙烯释放的峰值水平,同时降低乙烯整体释放量。
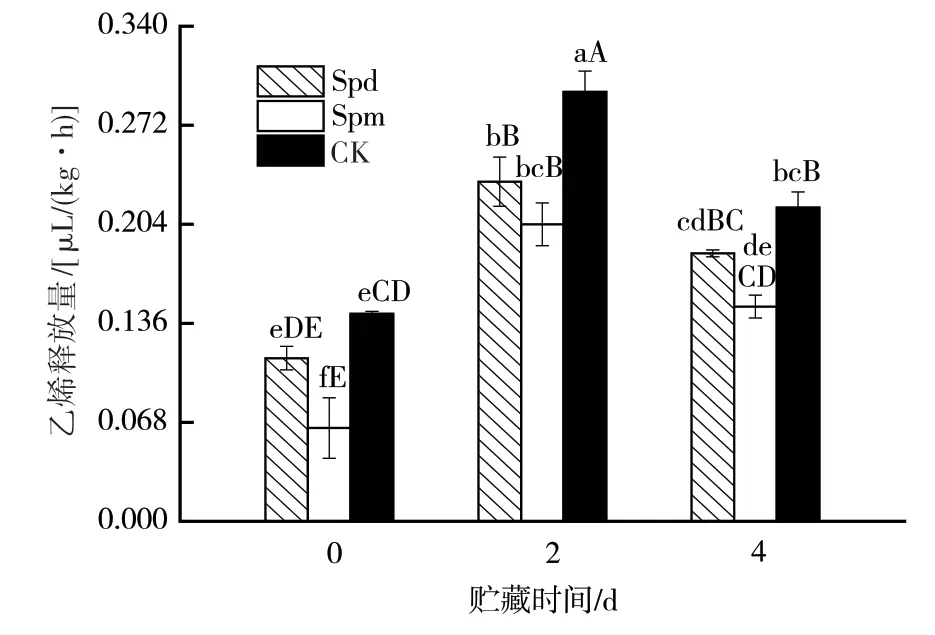
图3 外源多胺处理对杏鲍菇子实体贮藏期间乙烯释放量的影响
2.3 外源多胺处理对杏鲍菇子实体内源多胺含量的影响
采后贮藏期间,杏鲍菇内源Spd及Spm含量呈先增后降趋势,表现出极显著正相关效应(r=0.86**,图4),这与Flores等[20]发现逆境胁迫下多胺含量在大幅度上升后下降的趋势保持一致。经外源Spd及Spm处理后,菇体内源Spd及Spm含量明显高于对照组的,且Spm处理组菇柄及菇伞的内源多胺含量水平与对照组的差异达极显著水平。实验期间,对照组子实体内源Spd及Spm含量的峰值水平为外源Spd及Spm处理组贮藏初期(0 d)与末期(4 d)的0.80~2.07倍;同时仅为贮藏中期(2 d)的57.74%~87.57%,差异显著。可见,采前喷施Spd及Spm可促进内源Spd及Spm的迅速合成。
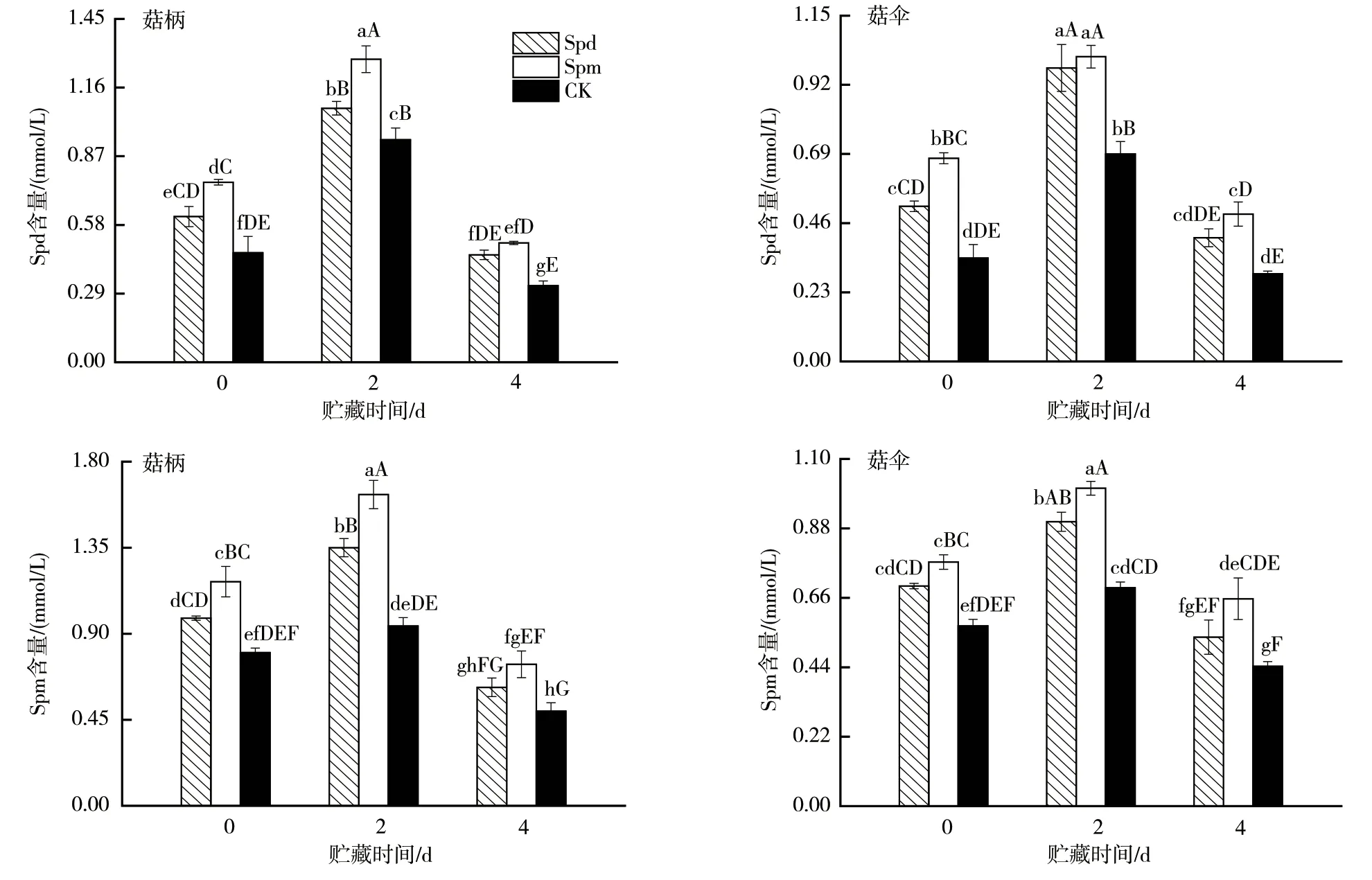
图4 外源多胺处理对杏鲍菇子实体贮藏期间内源多胺含量的影响
2.4 外源多胺处理对杏鲍菇子实体SAM含量和SAMDC活性的影响
采后贮藏期间,各处理组杏鲍菇子实体的SAM浓度水平整体呈先降后增的“V”形趋势(图5 A、图5B)。期间,外源Spd及Spm处理可明显延缓菇体组织SAM的分解,其浓度水平极显著高于对照。就整个贮藏期而言,各处理组SAM整体变化趋势不大,表明该贮藏环境下子实体SAM库容量相对充足。此外,由于SAMDC是植物体内多胺生物合成代谢过程中的关键酶[21],对外源多胺处理子实体的SAMDC活性进行了测定,发现各处理组子实体SAMDC活性水平整体呈先增后降趋势,均于贮藏的第2天达峰值水平(图5 C、图5D)。其中,对照组的变化幅度仅为11.82%~27.58%,活性水平保持相对稳定,而外源Spd及Spm处理组变幅为30.56%~47.70%,两者活性水平极显著高于CK的。可见,外源Spd及Spm处理可极大增强子实体SAMDC的活性水平。
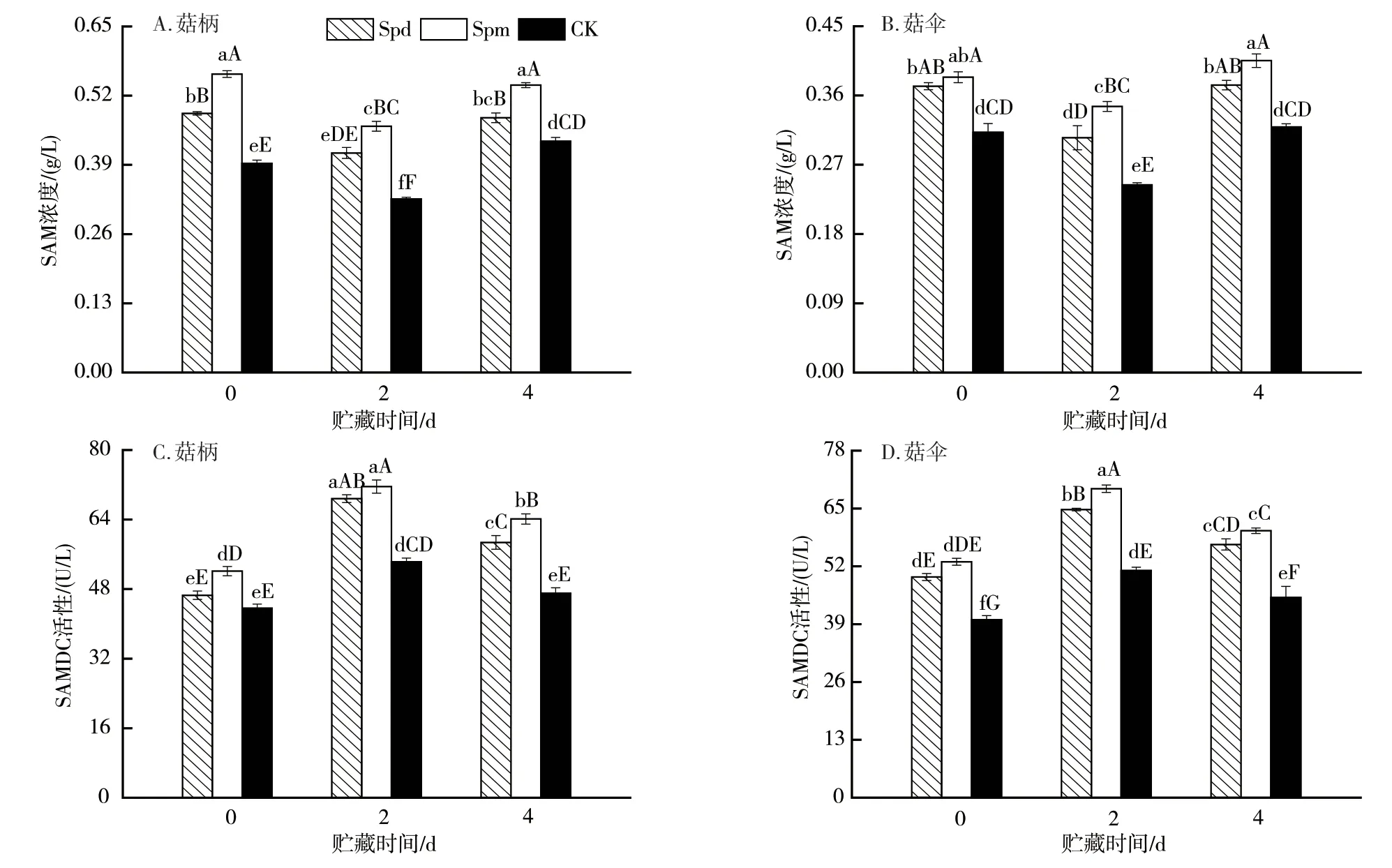
图5 外源多胺处理对杏鲍菇子实体贮藏期间SAM浓度和SAMDC活性的影响
2.5 外源多胺处理对杏鲍菇子实体乙烯释放量和内源多胺含量消长关系的影响
在多胺生物合成途径中,Spd、Spm与乙烯共同竞争底物SAM,杏鲍菇子实体乙烯释放量和内源多胺含量的比值(E/Spd和E/Spm)可反映底物SAM的主要去向[22]。随贮藏时间的延长,杏鲍菇子实体的衰老程度加剧,E/Spd和E/Spm值大体呈现逐渐增加的趋势(图6),说明底物SAM生成乙烯的途径有所加强。而外源多胺处理可极大降低E/Spd和E/Spm值,其中相较于CK,外源Spm处理可极显著降低该比值,结合SAMDC活性水平,说明外源多胺处理组SAM较多地转向Spd及Spm合成途径。同时结合采后贮藏期间子实体乙烯释放及内源多胺的变化趋势可知,杏鲍菇多胺与乙烯在代谢过程中竞争SAM库,但其相互牵制性并不明显,外源多胺处理可促使SAM较多地合成Spd及Spm。
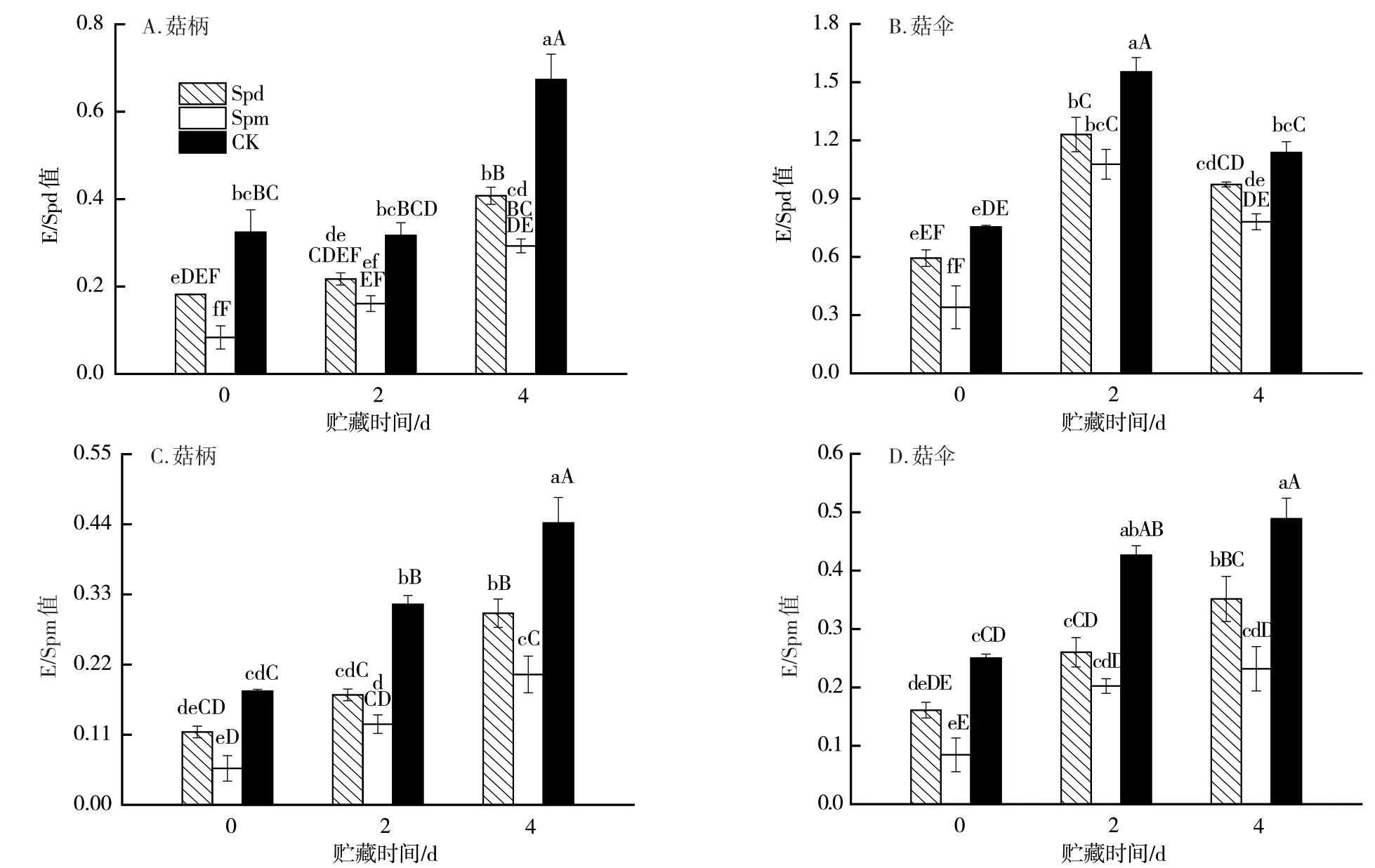
图6 外源多胺处理对杏鲍菇子实体贮藏期间乙烯释放量和内源多胺含量比值的影响
2.6 外源多胺处理对杏鲍菇子实体MDA含量、细胞膜相对透性及活性氧水平的影响
脂质过氧化是衰老的固有特征,而MDA是膜脂过氧化的主要产物之一,其含量的高低可以反映膜脂质过氧化程度[23]。在贮藏期间,杏鲍菇子实体的MDA逐渐积累,其含量整体呈上升趋势(图7A、图7B)。细胞膜相对透性的高低则可以反映细胞膜损伤程度。子实体采后贮藏期间膜透性也呈现出逐渐递增的变化趋势(图7 C、图7D),且贮藏前期(0~2 d)MDA含量及膜透性增幅较后期(2~4 d)明显。可见杏鲍菇采后贮藏过程中细胞膜受到损伤,膜的完整性受到破坏。但经外源多胺尤其是外源Spm处理后,MDA含量及膜透性上升幅度显著减缓。由此可知,外源多胺处理可对杏鲍菇子实体细胞膜系统起到一定的保护作用。此外,我们通过检测辣根过氧化物酶HRP催化菇体样本氧化反应的荧光强度来监测样本的活性氧水平,发现所检测的荧光强度与样本活性氧水平正相关[24]。如图7E所示,经1.0 mmol/L Spd及Spm处理后的杏鲍菇菇体中的活性氧水平明显低于CK的。其可能原因是多胺作为质子来源可能具有一定清除活性氧自由基的能力,可在一定程度上降低由自由基引发的膜脂过氧化作用,保护膜的完整性。Drolet等[25]的研究也指出,Spd和Spm可有效地充当活性氧自由基清除剂。
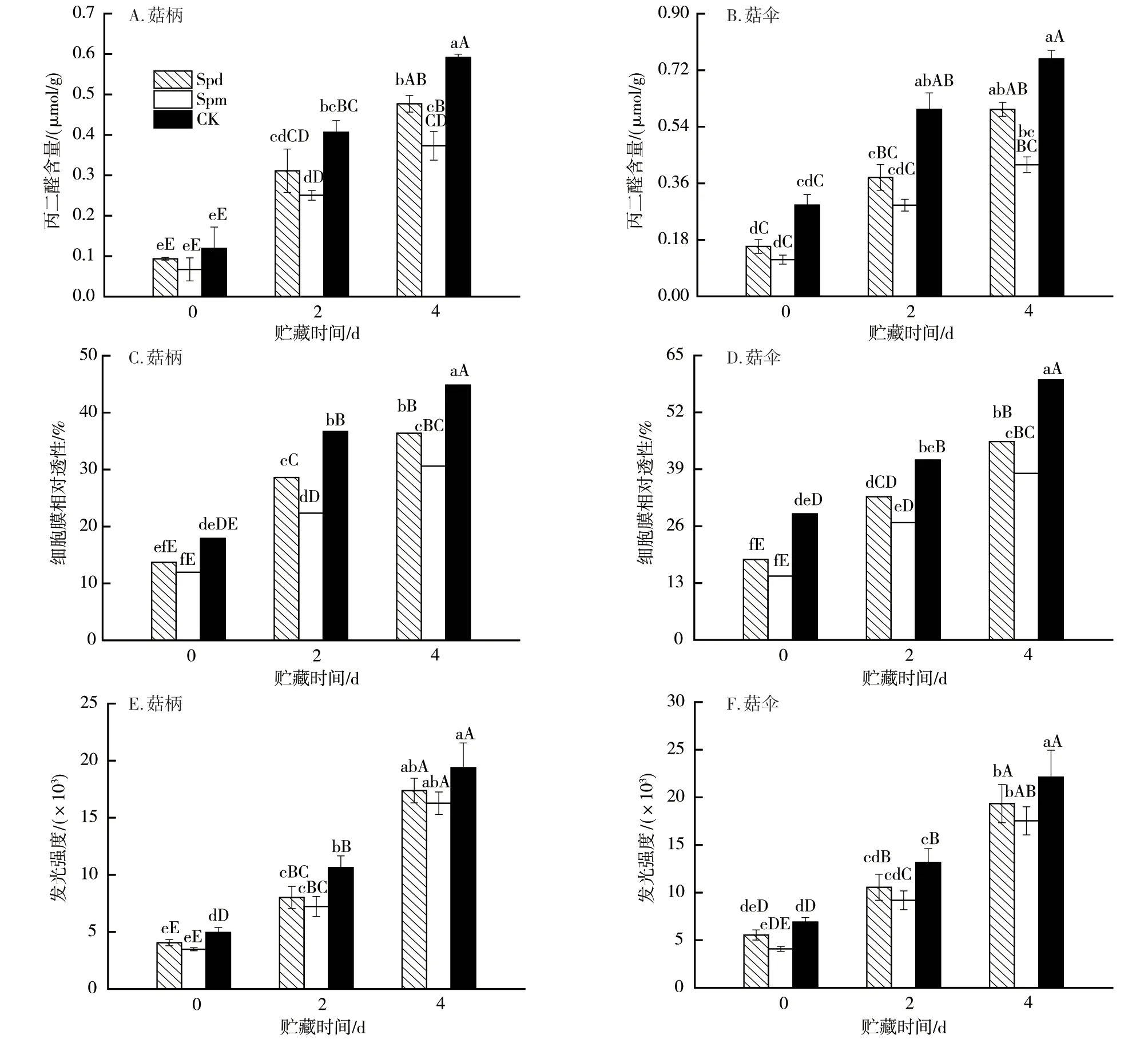
图7 外源多胺处理对杏鲍菇子实体贮藏期间MDA含量、细胞膜相对透性及活性氧水平的影响
3 讨论
在逆境胁迫下,植物体内多胺含量与乙烯释放量均会发生显著的变化并相互牵制。本研究中,杏鲍菇子实体采后贮藏期间,内源Spd、Spm含量和乙烯释放量在贮藏前期大量积累,之后又出现迅速下降,这与Mo等[26]对草莓果实成熟期间多胺的代谢趋势的测定结果相似。贮藏前期内源多胺和乙烯的大量积累,一方面可能是由于采后环境胁迫造成了细胞膜的损伤和生理代谢的紊乱,从而激活了细胞内胁迫抗性机制,通过Spd及Spm的大量合成以降低膜脂过氧化程度,保护膜的完整性,增强子实体抵御逆境的能力;另一方面,子实体在采收过程中不可避免地会遭受机械伤害,引起呼吸迅速增加、消耗大量的营养成分,而多胺可能是逆境胁迫下的一种应激产物,因而会大量合成。但多胺增加的同时可能也刺激了多胺分解代谢途径相关酶活性的提高,使多胺分解加速,产生较多的H2O2等活性氧自由基,而过多的活性氧自由基可加速ACC氧化酶催化ACC转化为乙烯,同时也导致了乙烯释放量的增加。贮藏后期内源多胺和乙烯释放量快速降低可能是由于贮藏后期杏鲍菇已衰老至一定程度,胞内代谢速率降低所致。
由于乙烯与多胺共同竞争前体物质SAM,两者均在各种生命活动中具有重要调节作用,其在代谢上的相关性受到了普遍重视。本研究发现,采后贮藏期间,外源多胺处理组杏鲍菇子实体乙烯释放量与内源多胺含量的变化趋势相同,呈显著正相关(r=0.41*)。这与近年来在番茄[27]、水稻[28]、小麦[29]等的研究中发现多胺,尤其是精胺、亚精胺与乙烯之间存在一定拮抗关系的研究结果不一致,究其原因:一方面是两者之间的关系可能与供试材料内的多胺种类相关,前期实验发现子实体菇柄及菇伞组织基本检测不到内源腐胺及尸胺,其浓度水平极低,而番茄、水稻、小麦等试材所含的多胺种类更为齐全,组织内不同多胺间的正相互作用可在一定程度上增强对乙烯合成的抑制作用[30];另一方面,上述作用与试材的种类、组织及胁迫的程度、方式等也有一定关联[31]。而在采后常温贮藏这种轻度环境胁迫下,杏鲍菇菇柄及菇伞组织的SAM库容量供应相对充足,即使乙烯与多胺在代谢合成过程中也会竞争SAM库,但两者并不表现出明显的牵制效应。乙烯与多胺间的拮抗效应仅在SAM库容量受限时才发生,上述结论在Wang等[32]的研究中已得到相应证实。
类似的研究表明,多胺与组织衰老密切相关,而适宜浓度的外源多胺处理可延缓植物体衰老症状的出现。本研究还发现,采前外源喷施1.0 mmol/L Spd及Spm可在一定程度上加速内源Spd及Spm含量的积累,增强子实体对活性氧自由基的清除能力,MDA含量整体呈上升趋势,可在一定程度上降低由活性氧自由基引发的膜脂过氧化程度及膜透性的上升,保护细胞膜的完整性,同时降低E/Spd和E/Spm值,增强SAMDC活性水平,延缓茹体组织SAM的分解,促使底物SAM更多地转向多胺合成方向,抑制底物转变为乙烯,从而维持子实体较高的贮藏品质。
4 结论
综上所述,采后常温贮藏期间,内源Spd、Spm含量和乙烯释放量均呈现出先增后降的变化趋势,并维持较高的SAM含量水平。可见在该轻度环境胁迫下,SAM库容量充足,多胺与乙烯之间并不存在明显的拮抗关系。而采前外源喷施Spd、Spm可在一定程度加速内源Spd及Spm含量的积累,增强子实体对活性氧的清除能力,并显著延缓贮藏期间杏鲍菇组织膜脂过氧化程度及细胞膜相对透性的上升,同时降低E/Spd和E/Spm值,增强SAMDC活性水平,促使SAM更多地转向多胺合成方向,抑制子实体乙烯释放,从而维持杏鲍菇较高的贮藏品质。综合分析内源多胺与乙烯的关系,认为外源多胺处理可对乙烯生成产生抑制作用,但相关抑制机理及多胺与乙烯合成的调控机制仍有待进一步探讨。

