双酶协同对烟梗提取物中淀粉降解效应的研究
刘恩芬,赵晓晨,周国福,王 军,何声宝
(1.云南中烟再造烟叶有限责任公司,云南 昆明 650001;2.中国农业大学 食品科学与营养工程学院,北京 100083;3.云南中烟工业有限责任公司 技术中心,云南 昆明 650032;4.国家烟草质量监督检验中心,河南 郑州 450001)
0 引言
目前,造纸法再造烟叶在卷烟原料配方中应用较广泛[1],其除了具有填充值较高、机械加工力度好、成丝率高、燃烧速度较快、产生的焦油量较低等优点外,还可根据烟草原料配方实际需要调整造纸法再造烟叶的物理性能以及化学指标,使其起到功能性原料等多种作用[2]。但不足之处在于再造在烟叶加工过程中需要加入一定量烟梗提取物——梗膏,其中含有较高质量百分数的淀粉、蛋白质和果胶等大分子物质[3],会给产品抽吸品质带来较大的负向作用,如淀粉质量百分数高易导致烟草燃烧不充分,其烟气会带来刺激、呛咳感,同时会增加焦油释放量[4],淀粉在高于600 ℃燃烧时还会生成部分稠环芳烃,如萘、萘酚、蒽和芴酮等[5]。这不仅制约了烟梗提取物在生产实际中的应用,也是目前造成再造烟叶生产企业烟梗物料过剩的重要原因。骆莉等[6]对废次烟叶进行了加酶萃取,相比于传统水溶液萃取,其水溶物萃取效率提高了21.2%;通过对酶提取液中还原糖和挥发性成分分析发现,因酶解导致的葡萄糖等还原糖总量增加了15.4%,石油醚浸提致香成分总量增加了46.9%。通过酶提取废次烟叶提取物对卷烟加香评析表明,酶法萃取烟叶碎片提取物能增加烟香、降低刺激性、掩盖杂气。林登铨[7]以淀粉、果胶及木聚糖复合酶为发酵载体,采用三级逆流提取方式对碎片原料进行酶解萃取,萃取率比原有工艺提高了10.4%。通过比较该方法处理前、后所得萃取液涂布制作的再造烟叶评吸效果显示,经复合酶处理过的萃取液品质较原有工艺有一定提高,说明适当的酶解技术对提升烟草品质具有积极的贡献。姚光明等[8]发现,向烟叶中施加α-淀粉酶和糖化酶可使烟叶中的淀粉降解为水溶性糖,能有效改善烟叶质量。胡耀辉等[9]以普通玉米淀粉为原料,分别用α-淀粉酶和普鲁兰酶降解淀粉,研究结果表明此2种酶在降解淀粉方面均具有较好的实用效果。但目前对于梗膏这种复杂基质中酶解淀粉状况的研究仍然比较缺乏。因此,结合实际应用需求,为提高烟梗提取液在生产实际中的使用量,降低产品生产成本,提升再造烟叶在烟草配方中使用的配伍性,利用不同体系生物酶降解烟梗提取液中的淀粉,分析再造烟叶烟梗提取液中淀粉降解情况以及还原糖的增加量,旨在为提高再造烟叶吸味品质提供参考,在一定程度上解决生产企业烟叶和烟梗原料应用失衡问题,为缓解企业排污压力提供技术支持。
1 材料与方法
1.1 材料与仪器
试验材料:烟梗提取物(云南中烟再造烟叶有限责任公司);α-淀粉酶(酶活力为23000 U/g,武汉新华扬生物股份有限公司);糖化酶(酶活力为290000 U/g,山东隆科特酶制剂有限公司);普鲁兰酶(酶活力为20000 U/g,山东隆科特酶制剂有限公司);超纯水(18.2 MΩ,自制);其他试剂均为市售分析纯。
试验仪器:ICS 5000+赛默飞离子色谱仪、CarboPacTMPA10糖柱(美国Thermo科技有限公司);ASE-12固相萃取仪(天津奥特赛恩斯仪器有限公司);ASE-12固相萃取仪(配Cleanert-S型C18小柱,500 mg/6 mL,美国Agela科技有限公司);水系IC针式过滤器(0.22 μm,天津博纳艾杰尔科技有限公司);FA1104B电子天平(感量0.0001 g,上海越平科学仪器有限公司);SHZ-88水浴恒温振荡器(江苏太仓市实验设备厂);SHB-Ⅲ真空抽滤机(郑州长城科工贸有限公司);MILLI-Q超纯水仪(美国Millipore公司)。
1.2 试验方法
1.2.1 标准工作溶液配制 准确称取0.1 g(精确至0.0001 g)葡萄糖标准品,用超纯水溶解并定容至100 mL,得到1 mg/mL的标准储备液。吸取1 mL上述标准储备液,用超纯水定容至25 mL,准确移取该溶液0.050、0.125、0.250、0.500、1.000 mL 至试管,分别用超纯水稀释并定容至5 mL,得到系列标准工作溶液,溶液浓度分别为0.4、1.0、2.0、4.0、8.0 mg/L。用离子色谱法测定标准溶液中的葡萄糖浓度,并对峰面积与其浓度进行线性回归分析,得到工作曲线方程。
1.2.2 不同酶体系效果比较 为便于研究α-淀粉酶与糖化酶、普鲁兰酶协同作用的效果,将2种组合酶体系分别与α-淀粉酶单酶体系酶解效果进行对比。分别选择生产工艺应用要求的淀粉降解率为25%和50%时所需的α-淀粉酶酶量、糖化酶量、普鲁兰酶量,以及对该条件下生成的葡萄糖质量百分数进行比较。
1.2.2.1 α-淀粉酶单酶体系 取25 g烟梗提取物,分别添加0、30、50、100、200、300、400、500、600 U/g的α-淀粉酶,在70 ℃下减压浓缩2.5 h(与工生产工艺中浓缩烟梗提取液的时间保持一致)。然后用超纯水定容至25 mL容量瓶中,分别对淀粉和葡萄糖浓度进行测定。
1.2.2.2 α-淀粉酶+糖化酶双酶体系 取25 g烟梗提取物,添加365 U/g α-淀粉酶,再分别添加500、600、700、800、900、1000 U/g糖化酶,在70 ℃下减压浓缩2.5 h,再用超纯水定容至25 mL容量瓶中。分别测定淀粉和葡萄糖的浓度,并拟合出淀粉降解率与加酶量变化的回归分析方程。
1.2.2.3 α-淀粉酶+普鲁兰酶双酶体系 取25 g烟梗提取物,添加365 U/g的α-淀粉酶,再分别添加500、600、700、800、900、1000 U/g普鲁兰酶,在70 ℃下减压浓缩2.5 h,再用超纯水定容至25 mL。分别测定淀粉和葡萄糖的浓度,并拟合出淀粉降解率与加酶量变化的回归分析方程。
1.2.3 烟梗提取物中淀粉及葡萄糖的质量百分数
1.2.3.1 淀粉 (1)乙醇超声提取去除水溶性糖、色素及酚类物质。取1.5 g制备好的烟梗提取物,加入25 mL 85%乙醇超声30 min,以5000 r/min的转速离心5 min,除去上清液,重复2次。沉淀用冷水反复洗涤,并向上清液中加入3,5-二硝基水杨酸溶液,沸水浴共热5 min后,如果溶液不显色,表明滤渣中可溶性糖已去除干净。
(2)酶解烟梗提取物样品。向沉淀中加入50 mL pH值约为5.5的磷酸二氢钠-磷酸氢二钠缓冲液及适量2000 U/g的α-淀粉酶,60 ℃恒温水浴水解2.5 h;之后加入50 mL pH值约为4.5的柠檬酸-柠檬酸钠缓冲溶液及10000 U/g的糖化酶,60 ℃恒温水浴水解1.5 h,待冷却后抽滤,洗涤残余物,合并滤液,用超纯水定容至200 mL。吸取0.1 mL该溶液,用超纯水定容至25 mL,将酶解液经过ASE-12固相萃取仪Cleanert-S型C18小柱除去杂质,再经过水系IC针式过滤器过滤后,进行离子色谱分析。
脉冲安培-离子色谱检测条件:检测方式为脉冲安培-糖波形;色谱柱为PA-10糖柱;柱温30 ℃;流速为1.0 mL/min;进样量25 μL;流动相为超纯水(A)+250 mmol/L的NaOH溶液(B);淋洗液梯度洗脱程序为0~13 min,80% A+20% B(v:v)。
去除烟草浸提物中的水溶性糖,加入淀粉酶后将其中的淀粉分解成葡萄糖,通过测定葡萄糖的质量百分数,折算淀粉的质量百分数:
式(1)中:W淀粉为淀粉的质量百分数(%);W葡萄糖为酶解后葡萄糖的质量百分数(%);0.9为葡萄糖质量百分数换算为淀粉质量百分数的换算系数。淀粉由葡萄糖分子间脱水链接形成,葡萄糖的分子量为180,水的分子量为18(为葡萄糖的0.1倍),所以公式(1)中的换算系数为0.9。
1.2.3.2 葡萄糖 准确称取1.000 g的烟梗提取物,用超纯水定容至100 mL。准确移取1 mL该溶液,用超纯水定容至100 mL,通过C18小柱净化后,再经过水系滤膜过滤,用离子色谱法[10]分析,分析条件同1.2.3.1节中离子色谱检测。
1.2.3.3 拟合回归分析方程 根据工作曲线方程,计算并拟合出淀粉降解率随加酶量变化的回归分析方程:
式(2)中:P为淀粉降解率(%);W酶解前为烟梗提取物中淀粉的质量百分数(%);W酶解后为酶解后梗膏中淀粉的质量百分数(%)。
2 结果与分析
2.1 标准曲线及检出限、定量限
用离子色谱法测定标准溶液中的葡萄糖浓度曲线如图1所示。在一定浓度范围内,葡萄糖的质量浓度(x)与色谱峰相对峰面积(y)具有良好的线性关系,线性回归方程:y=1.6432x-0.0431,R2=0.9991,线性范围为0.4~8.0 mg/L,回收率为98.2%~103.9%,说明该检测方法的准确性良好。分别按照3和10倍信噪比(S/N=3,S/N=10)计算的葡萄糖检出限(LOD)和定量限(LOQ)分别为1.0和3.0 mg/g。
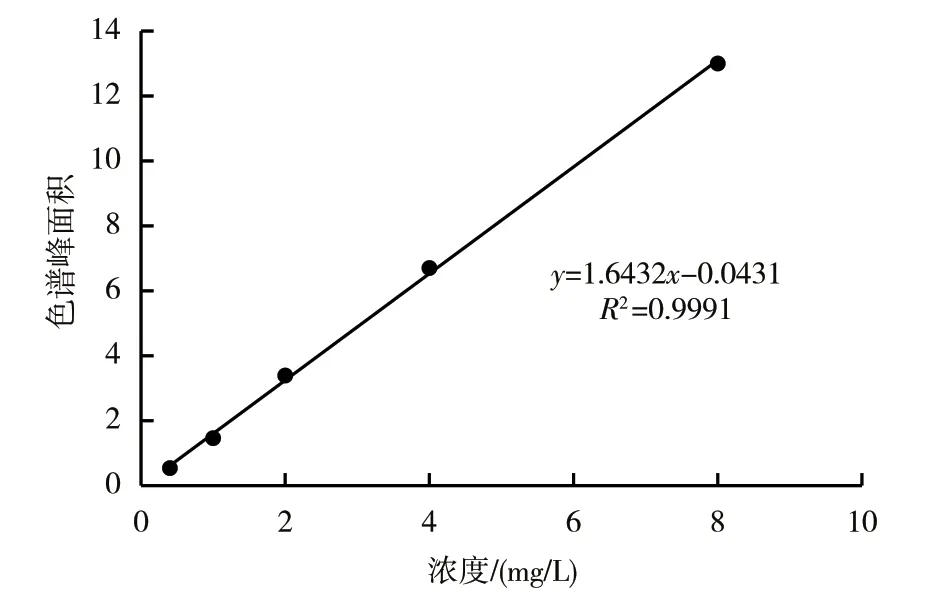
图1 葡萄糖标准品的标准曲线
2.2 单双酶体系淀粉酶解效果及葡萄糖生成量
2.2.1 单双酶体系的酶用量
2.2.1.1 α-淀粉酶单酶体系的酶用量 以提取液淀粉质量百分数为基准,计算不同酶用量条件下的淀粉降解率(图2),并拟合出淀粉降解率随加酶量变化的回归分析方程:y=8.4369lnx-24.7360,R2=0.9812。由回归分析方程可预测,当淀粉降解率为25%时,约需365 U/g的α-淀粉酶;当淀粉降解率为50%时,约需7397 U/g的α-淀粉酶,酶用量明显增加。将酶用量添加至样品中验证发现,当α-淀粉酶添加量为365 U/g时,淀粉降解率的测定值为24.47%,与预测值(25%)无显著性差异,降解效果较好;当α-淀粉酶添加量为7397 U/g时,测得淀粉的降解率为45.48%,与预测值(50%)存在显著性差异。
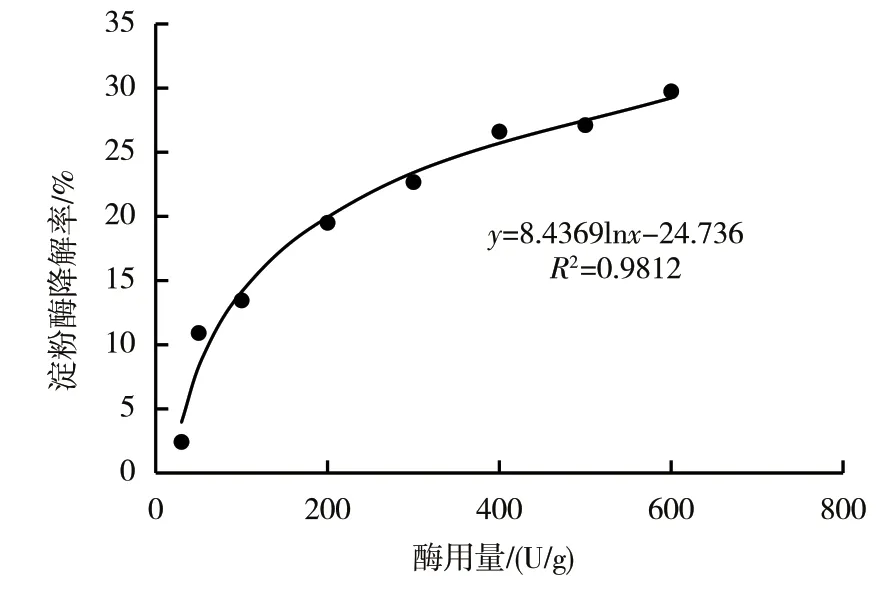
图2 淀粉降解率与α-淀粉酶用量的关系
2.2.1.2 α-淀粉酶+糖化酶双酶体系的酶用量 以烟梗提取物淀粉质量百分数为基础,当α-淀粉酶的使用量为365 U/g时,拟合出淀粉降解率随加糖化酶量变化的回归分析方程:y=-5.0×10-6x2+0.0472x+12.490,R2=0.9799,见图3。由上述回归分析方程可知,当淀粉降解率需要达到50%时,约需使用901 U/g的糖化酶。将以上用量的酶添加至样品中进行验证实验,测得淀粉降解率为51.74%,与预测值无显著性差异。
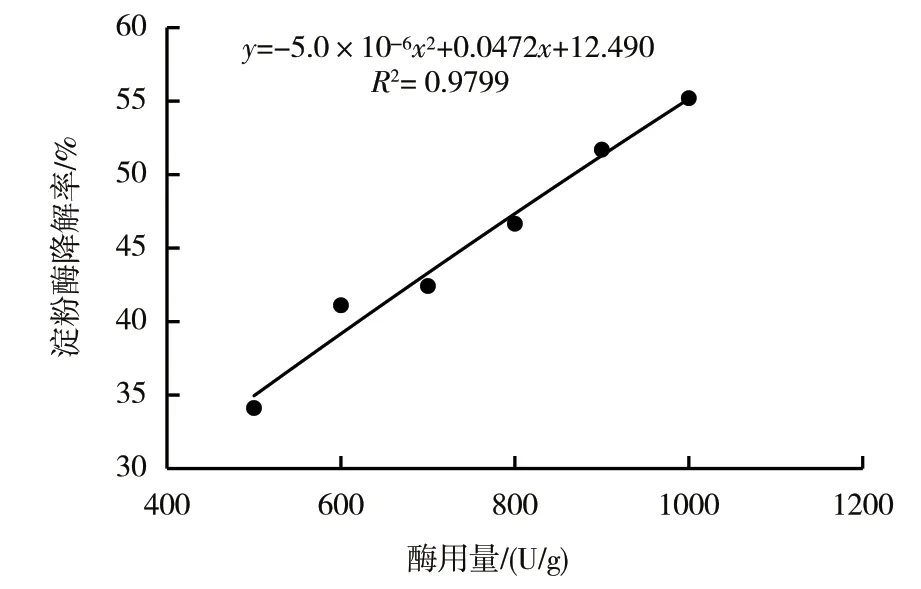
图3 淀粉降解率与α-淀粉酶+糖化酶用量的关系
2.2.1.3 α-淀粉酶+普鲁兰酶双酶体系的酶用量 由图4可知,以烟梗提取物淀粉质量分数为基础,当α-淀粉酶的使用量为365 U/g时,通过实验拟合出淀粉降解率随普鲁兰酶用量变化的回归分析方程:y= -9.0×10-5x2+0.183x-39.969,R2=0.9824。由上述回归分析方程可得,当α-淀粉酶添加量为365 U/g时,淀粉降解率为50%时,约需815 U/g普鲁兰酶。将以上用量的酶添加至样品中进行验证实验,测得淀粉降解率为48.93%,与预测值无显著性差异。
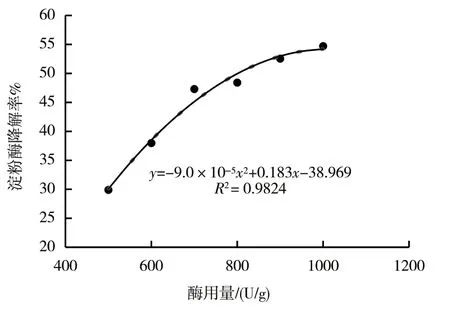
图4 淀粉降解率与α-淀粉酶+普鲁兰酶用量的关系
2.2.1.4 单酶体系与双酶体系酶解淀粉效果的比较 (1)淀粉酶解率。α-淀粉酶、糖化酶和普鲁兰酶是水解淀粉非常重要的酶,通常使用α-淀粉酶复合糖化酶或普鲁兰酶酶解淀粉的效率优于单酶体系的[11]。通过对不同双酶体系或仅使用α-淀粉酶对烟梗提取液中淀粉的降解效果比较(表1)可知,在相同的淀粉降解率(50%)下,α-淀粉酶+糖化酶、α-淀粉酶+普鲁兰酶的酶活单位使用总量远低于仅使用α-淀粉酶的用量,α-淀粉酶与糖化酶、普鲁兰酶均具有协同酶解淀粉的作用[12]。α-淀粉酶在添加量高达7032 U/g时,淀粉降解率仅为45.48%,这是因为单酶体系中α-淀粉酶虽能水解淀粉内部的α-1,4-糖苷键,但不能有效地水解α-1,6-糖苷键[13],同时该酶无法对其产生的糊精、低聚糖等进行充分水解,因此酶解反应易受到产物浓度抑制,淀粉酶解效率不高。
由图5可知,在α-淀粉酶的使用量为365 U/g条件下,当糖化酶、普鲁兰酶用量高于600 U/g后,α-淀粉酶+普鲁兰酶双酶体系对应的梗膏中淀粉的质量百分数低于α-淀粉酶+糖化酶双酶体系的。这是因为普鲁兰酶可以水解梗膏中支链淀粉分支点中的α-1,6-糖苷键[14-15],同时将最小单位的支链分解,并使α-淀粉酶得以快速降解成直链淀粉,产生更多的低聚糖。综上,双酶体系酶解淀粉的协同酶解效果高于单酶体系的,且当α-淀粉酶+普鲁兰酶双酶体系在使用量高于600 U/g后,对淀粉的酶解效率更高。
(2)葡萄糖生成量。由表2可知,在相同的淀粉降解率(50%)下,双酶体系葡萄糖的生成量高于单酶体系葡萄糖的生成量(P<0.05),这与α-淀粉酶无法彻底水解低聚糖有关[16],酶解后有一部分淀粉未完全水解为葡萄糖,而是以低聚糖或糊精的形式存在,因此生成葡萄糖的效率低。由图6可知,在α-淀粉酶的使用量为365 U/g条件下,协同使用糖化酶、普鲁兰酶时,α-淀粉酶+糖化酶双酶体系条件下葡萄糖生成的质量百分数均高于α-淀粉酶+普鲁兰酶双酶体系的。这可能是因为糖化酶能从淀粉、糊精、低聚糖的非还原性末端水解α-1,4-糖苷键产生葡萄糖,α-淀粉酶为糖化酶不断提供新的非还原末端,提高了糖化酶的底物浓度,使得糖化酶可以催化生成葡萄糖,因此糖化酶与α-淀粉酶协同作用可以大幅度提高葡萄糖的生成量;而普鲁兰酶水解淀粉的部分产物为麦芽三糖等低聚糖,α-淀粉酶水解低聚糖缓慢,所以该体系的酶解产物可能仍有一部分以低聚糖的形式存在于梗膏中。因此,由α-淀粉酶与糖化酶组成的双酶酶解体系生成葡萄糖的效果更好。
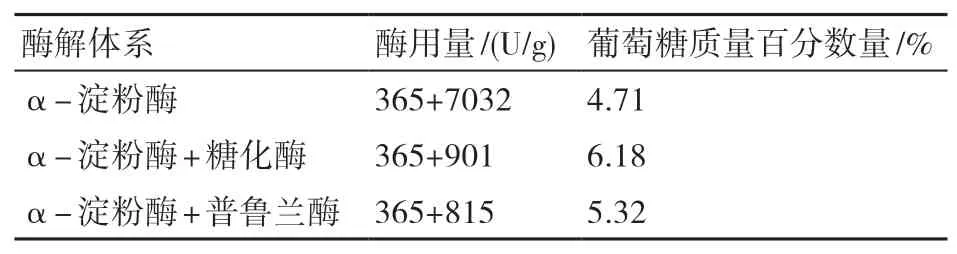
表2 单酶体系与双酶体系酶解淀粉生成葡萄糖质量百分数的比较
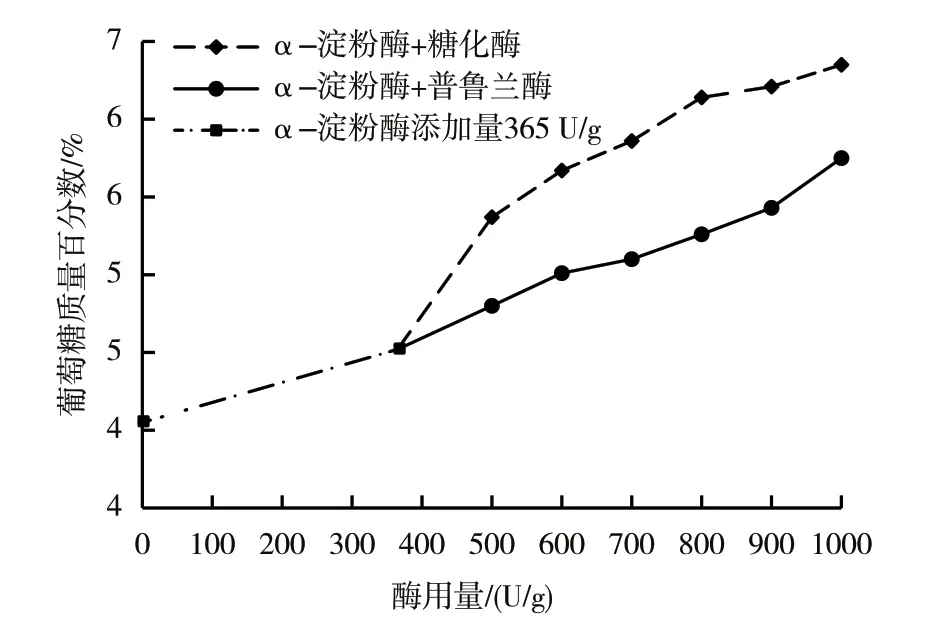
图6 梗膏中葡萄糖质量百分数与双酶体系酶用量的关系
2.3 单双酶体系酶解效果分析
通过研究表明,α-淀粉酶+糖化酶和α-淀粉酶+普鲁兰酶双酶体系降解淀粉的效果明显强于α-淀粉酶单酶体系的(表2)。在烟梗提取液中淀粉降解率为50%的情况下,单酶体系酶总用量为7397 U/g α-淀粉酶,α-淀粉酶+糖化酶体系共需要1266 U/g酶,α-淀粉酶+普鲁兰酶体系共需1180 U/g酶。α-淀粉酶+普鲁兰酶双酶体系酶用量最少,说明普鲁兰酶的应用对降解大分子淀粉有明显的协同作用,双酶体系降解效果优于单酶体系。酶为一种蛋白质活性物质,在满足需求的情况下,应尽可能少加入酶品种和酶活量,以免给再造烟叶产品的感官品质带来不利影响。在降解率基本相同的情况下,单酶体系α-淀粉酶的用量明显高出其他2个双酶体系的。实际生产应用中,在满足生产需求的条件下,降解烟梗提取物中的淀粉可优先选择双酶体系。
3 讨论与结论
与α-淀粉酶不同,普鲁兰酶是专一性的淀粉脱支酶,能够专一性切开支链淀粉分支中的α-1,6-糖苷键,其能切下整个支链淀粉分支包括最小单位的分支,形成直链淀粉,最大限度地利用淀粉原料[17]。淀粉经过普鲁兰酶脱支处理后,淀粉颗粒的微观结构会发生变化,形成较多的短链淀粉分子。本研究中,当鲁兰酶用量高于600 U/g时,α-淀粉酶+普鲁兰酶双酶体系对应的淀粉降解率高于α-淀粉酶+糖化酶双酶体系的,所以在酶用量较高时,α-淀粉酶+普鲁兰酶双酶体系酶解梗膏中淀粉的效果更好。
糖化酶能把淀粉从非还原糖端水解α-1,4-葡萄糖苷键并逐个释放出单个β-D-葡萄糖,此外还能水解α-1,6-葡萄糖苷键和α-1,3-糖苷键,将梗膏中的支链淀粉彻底水解为葡萄糖[18],这也解释了本研究中α-淀粉酶+糖化酶体系在降解淀粉的同时能增加更高的葡萄糖质量百分数的现象。综上,本研究中α-淀粉酶+糖化酶体系在降解淀粉的同时增加葡萄糖生成量的效果较优。
烟梗提取物在淀粉降解率相同的情况下,α-淀粉酶+普鲁兰酶和α-淀粉酶+糖化酶双酶体系的酶用量远低于α-淀粉酶单酶体系。在α-淀粉酶酶用量相同的情况下,α-淀粉酶+普鲁兰酶双酶体系中普鲁兰酶用量高于600 U/g时,降解淀粉的效果优于α-淀粉酶+糖化酶双酶体系的;α-淀粉酶+糖化酶双酶体系通过降解烟梗提取物中的淀粉并增加葡萄糖质量百分数的效果更突出。

