肝硬化门静脉血栓形成的危险因素分析
胡宜涛,张 帆
云南省第三人民医院消化内科,云南 昆明 650000
门静脉血栓(PVT)形成是一般人群中一种相对少见的疾病,但在肝硬化患者中PVT 是一种常见的并发症,发病率为0.6%到26%[1],PVT也发生于其他疾病,如遗传性血小板减少症、腹部感染或肠道疾病。急性PVT 可导致肠系膜缺血,甚至是严重的不良后果,如肠坏死等。慢性PVT 可导致门静脉阻塞,从而导致继发性门静脉高压[2]。有研究[3]表明,肝硬化PVT 的发病机制可能是多因素共同作用的结果,主要包括门静脉血流量改变、血管壁的高凝性及血管壁损坏。同时也有研究[4]指出,门静脉内径、脾脏厚度、糖尿病、肥胖、凝血酶原时间(PT)、纤维蛋白原、D-二聚体、抗凝血酶Ⅲ(AT-Ⅲ)、血红蛋白、脾切除史、硬化剂注射史、静脉曲张程度、MELD 评分、Child-Pugh 评分等均可能与肝硬化患者PVT 的发生有关。本研究通过分析肝硬化合并PVT 的危险因素,并对肝硬化合并这些危险因素的患者进行跟踪随访,从而明确肝硬化PVT 发生的危险因素,可更好地指导临床,预防肝硬化PVT的发生。
1 资料与方法
1.1 一般资料
回顾性分析2017 年1 月—2018 年12 月在云南省第三人民医院消化内科就诊并诊断为肝硬化患者的临床资料。入组患者共206 例,以是否发生PVT 分为PVT 组和对照组,其中PVT 组90例,对照组116例。收集患者的一般资料,包括性别、年龄、侧支循环、硬化剂治疗、脾切除、饮酒、高血压、腹腔积液、Child-Pugh 评分。收集患者的实验室检查,包括红细胞(RBC)、白细胞(WBC)、血红蛋白(Hb)、血小板(PLT)、谷丙转氨酶(ALT)、谷草转氨酶(AST)、PT、活化部分凝血酶原时间(APTT)、D-二聚体。收集患者的影像学检查结果,包括门静脉主干直径、脾脏厚度。
1.2 选取标准
纳入标准:(1)年龄为18~85岁。(2)患者病史、临床表现、实验室及影像学检查(腹部超声、门静脉超声、腹部CT、MRI等)符合肝硬化的诊断标准。(3)入院后完善门静脉超声或腹部增强CT 或CTA 提示有或无PVT。(4)患者资料完整。(5)患者均知情同意本研究。排除标准:(1)年龄<18岁或>85岁。(2)合并恶性肿瘤。(3)肝移植患者。(4)近期有服用抗凝药物史。(5)其他原因导致PVT。本次研究共随访患者86 人,随访过程中至少每3个月复查1 次门静脉超声或腹部增强CT 或CTA,以发现PVT为随访终点。
1.3 统计学方法
采用SPSS 20.0 软件进行统计分析。正态分布的计量资料以均数±标准差(±s)表示,组间参数比较采用独立样本t检验,组内参数比较重复测量方差分析。计数资料以例数和百分比(%)表示,比较采用χ2检验或Fisher 确切概率法,非正态分布计量资料以中位数(M)和四分位数间距(IQR)表示,组间比较采用秩和检验,等级资料比较采取秩和检验。采用多因素logistic 回归分析危险因素分析。用ROC曲线进行预测价值分析,患者的随访结果采用生存分析进行比较。以P<0.05为差异有统计学意义。
2 结果
2.1 两组患者的一般资料情况
单因素分析显示,肝硬化PVT 的发生与患者的性别、年龄、侧支循环、是否行硬化剂治疗、是否行脾切除治疗、饮酒、高血压、是否有腹腔积液比较,差异无统计学意义(P>0.05),见表1。
2.2 两组患者的检查情况
单因素分析显示,肝硬化PVT 的发生与患者的PT、D-二聚体、门静脉主干直径有关,差异有统计学意义(P<0.05)。与RBC、WBC、Hb、PLT、Child-Pugh 评分、ALT、AST、APTT、脾脏厚度无关,差异无统计学意义(P>0.05),见表2。

表2 两组患者的检查情况
2.3 肝硬化PVT形成的多因素logistic回归分析结果
以是否发生PVT 为因变量,将上述单因素分析P<0.2的变量(Hb、ALT、PT、APTT、D-二聚体、门静脉主干直径)纳入模型,进行多因素logistic 回归分析,结果发现D-二聚体、门静脉主干直径、PT 是肝硬化PVT 形成的危险因素,其OR及95%CI分别为(OR=3.115,95%CI:
1.713~5.663,P<0.001)、(OR=2.643, 95%CI: 1.238~5.646,P=0.012)、(OR=1.044,95%CI:1.005~1.058,P=0.026),见表3。

表3 肝硬化PVT形成的多因素logistic回归分析结果
2.4 PT、D-二聚体、门静脉主干直径单项检测及3 项指标联合检测对肝硬化PVT的诊断效能情况
PT、D-二聚体、门静脉主干直径单项检测诊断肝硬化PVT 诊断的ROC 曲线AUC 分别为:0.66、0.68、0.73,三项指标联合检测ROC曲线AUC为0.82,以约登指数最大值为诊断阈值,其敏感度为0.61,特异度为0.92,见图1。
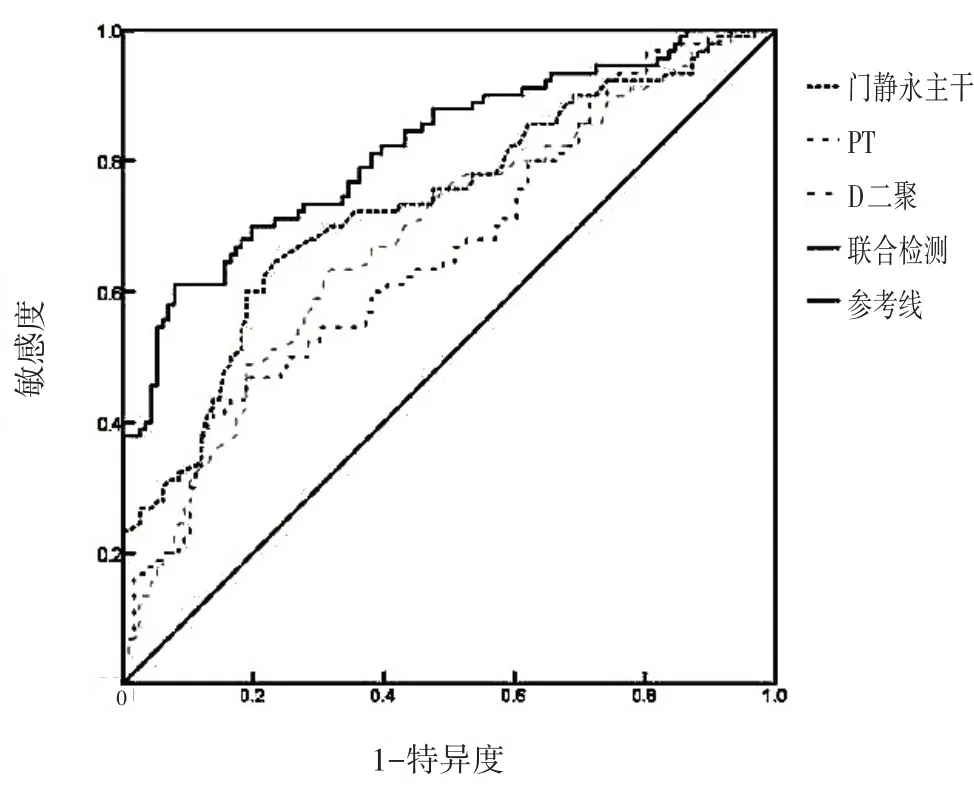
图1 PT、D-二聚体、门静脉主干直径指标单独检测与联合检测诊断肝硬化PVT的ROC曲线
2.5 PT、D-二聚体、门静脉主干直径与肝硬化发生PVT关系情况
为了更进一步明确三项指标与肝硬化PVT 形成的关系,对在样本医院诊断为肝硬化的患者进行了随访,随访患者共86 人,诊断肝硬化时一项指标为阳性者共36 人,随访过程中发生PVT 共17人;两项指标为阳性者共28人,随访过程中发生PVT 共19 人;3 项指标为阳性者共15 人,随访过程中形成PVT 共11 人;3 项指标均阴者共7 人,随访过程中形成PVT 共1 人;诊断肝硬化时各个指标不同表达状态与后期PVT 的发生,差异有统计学意义(P<0.05)。诊断肝硬化时3 项指标均阳性的患者后期发生PVT的概率明显高于3项指标均阴性的患者,见图2。

图2 PT、D-二聚体、门静脉主干直径与肝硬化发生PVT关系情况
3 讨论
肝硬化,特别是在肝硬化失代偿阶段,机体的凝血功能发生了复杂的改变,促凝物质的抗凝物质的改变,最终导致了出血或血栓形成[5]。有研究[6]表明,肝硬化患者发生PVT 的风险是非肝硬化患者的两倍,PVT 在肝硬化患者中的发生机制目前尚未明确,PVT 的发生是一个涉及先天遗传的和后天获得的多因素共同作用的结果[7]。肝硬化和门静脉高血压引起的肝脏结构紊乱,门静脉血流减缓,血管壁损伤,从而诱导高凝,在PVT 的发生过程中起着至关重要的作用[8]。因此,肝硬化不再被认为是一种血栓发生概率很小的疾病。
对肝硬化患者,腹部手术是导致局部血管损伤的最常见原因。在我国,脾切除术是一种处理门脉高压并发症常用的手术方法,有研究[9]表明,脾切除使PVT 发生的概率增加了10倍。但在本研究中,我们并没有发现脾切除与PVT 的发生有明显关系,这可能是因为入组的患者中行脾切除的患者过少。D-二聚体是一种纤维蛋白降解产物,通过增加纤维蛋白的形成和纤维蛋白的溶解而升高[10]。D-二聚体检测已被广泛应用于静脉血栓栓塞的诊断,预测静脉血栓栓塞的发生和复发,指导患者使用抗凝血药物的持续时间。有研究[11]表明,D-二聚体作为内源性纤维蛋白解的标记物可以在PVT 患者中被检测到,并可以预测疾病进展和预后。本研究证实了这一点,PVT组患者中D-二聚体明显高于对照组。有研究[12]表明,在肝硬化的进程中,门静脉的扩张是持续发展的,门静脉的不断扩张会引起血管内皮细胞的损伤,内皮细胞的损伤是血栓形成的关键因素之一。DONG[13]的研究表明,随证门脉直径的增加,PVT 发生的风险也在增加,门静脉直径>12.5 mm 对预测PVT 的发生有很高的敏感性。本研究同样证实了随着门静脉直径的增加,肝硬化PVT 发生的概率明显增加,这可能是因为血管壁的损伤和门静脉直径增加导致门静脉内血液流速降低所致。肖春桃等[4]的研究指出门静脉内径、脾脏厚度、糖尿病、肥胖、PT、纤维蛋白原、D-二聚体、AT-Ⅲ、血红蛋白、脾切除史、硬化剂注射史、静脉曲张程度、MELD 评分、Child-Pugh 评分等均可能与肝硬化患者PVT 的发生有关。本研究同样把凝血酶原时间纳入研究,通过多因素logistic 分析显示,PT 是肝硬化PVT 发生的危险因素。
为了更好地评价PT、D-二聚体、门静脉主干直径对肝硬化PVT 形成的预测作用,本研究有对3 个指标进行了ROC 曲线分析,结果显示三者联合检测对肝硬化PVT的发生具有一定的预测价值,其敏感度为0.61,特异度为0.92。为了更进一步地明确3 项指标与肝硬化PVT 形成的关系,本研究对诊断肝硬化时患者3 项指标不同表达状态进行了生存分析,结果显示诊断肝硬化时各个指标不同表达状态与后期PVT 的发生有统计学意义,诊断肝硬化时3 项指标均阳性的患者后期发生PVT 的概率明显高于3 项指标均阴性的患者。
本研究初步对肝硬化PVT 发生的危险因素进行了分析,发现PT、D-二聚体、门静脉主干直径是PVT 发生的危险因素,三者联合检测对PVT 的发生有一定的预测价值。本研究为单中心研究,入组样本量有限,在后续的研究中我们会纳入更多的患者,更全面的对PVT 发生的临床因素进行分析,更好的服务临床。

