circCEP128靶向miR-4458对胃癌AGS细胞增殖、凋亡、迁移及侵袭的影响
杨卫振 侯伟 张磊 李小龙 翟建
(保定市第一中心医院 1普外科,河北 保定 071000;2放疗科;3中国人民解放军陆军第八十二集团军医院消化内科)
胃癌是常见的消化道恶性肿瘤之一,由于肿瘤细胞具有高度侵袭性导致术后患者复发率高,且患者远期生存率较低,目前胃癌的发病机制尚未阐明,已有报道证实环状RNA(circRNA)在胃癌中表达异常,并可能作为胃癌分子、靶向治疗的潜在靶点,circNRIP1、circ-HuR、circNHSL1、circRNA_001569在胃癌中表达上调/下调,并可吸附微小RNA(miRNA)充当其海绵分子,进而调控靶mRNA表达,参与胃癌等肿瘤发生及发展过程〔1~4〕。circCEP128在胶质瘤细胞中表达水平升高,敲低circCEP128可通过调节miR-145-5p抑制胶质瘤的发展〔5〕。靶基因预测显示circCEP128与miR-4458存在结合位点,研究表明miR-4458可靶向抑制非小细胞肺癌细胞迁移〔6〕。因此,本研究主要探讨circCEP128与miR-4458在胃癌中的表达及其在胃癌AGS细胞恶性生长中的作用。
1 材料与方法
1.1一般资料 在保定市第一中心医院伦理委员会批准下,2018年6月至2019年12月纳入医院病理确诊为胃癌的33例患者。所有患者知情且签署同意书,其中男20例,女13例,年龄53~67岁,平均年龄(58.69±9.16)岁,患者术前均无放化疗等治疗史,未合并其他恶性肿瘤,且临床资料完整。将手术获得的癌组织及相匹配的癌旁组织标本置于-80 ℃保存。
1.2细胞、试剂与仪器 胃癌细胞AGS(美国ATCC);DMEM培养液、Opti-MEM减血清培养基(美国Gibco公司);胎牛血清、Lipofectamine2000、膜联蛋白Ⅴ异硫氰酸荧光素(Annexin V-FITC)/碘化丙啶(PI)双染法细胞凋亡检测试剂盒、Matrigel基质胶(北京索莱宝科技有限公司);Transwell小室(美国Corning公司);si-NC、si-circCEP128、miR-NC、miR-4458 mimics、anti-miR-NC、anti-miR-4458(上海吉玛制药技术有限公司);pcDNA、Trizol试剂(美国Invitrogen公司);逆转录与SYBR荧光定量聚合酶链反应(PCR)试剂(北京天根生化科技公司);细胞对数试剂盒(CCK)-8试剂(上海奥默生物技术有限公司);兔抗人Ki-67、B细胞淋巴瘤(Bcl)-2、基质金属蛋白酶(MMP)-2、MMP-9、Bcl-2相关X蛋白(Bax)抗体(美国CST公司)。
1.3实验分组 采用Opti-MEM减血清培养基分别与si-NC、si-circCEP128、miR-NC、miR-4458 mimics、pcDNA、pcDNA-circCEP128、si-circCEP128+anti-miR-NC、si-circCEP128+anti-miR-4458混合后室温孵育5 min(A液),Opti-MEM减血清培养基与Lipofectamine2000转染试剂充分混合(B液),A液与B液充分混匀后室温孵育20 min,将其加入AGS细胞后6 h,将转染液替换为DMEM新鲜培养液,继续培养48 h,分别记为si-NC组、si-circCEP128组、miR-NC组、miR-4458组、si-circCEP128+anti-miR-NC组、si-circCEP128+anti-miR-4458组。
1.4实时荧光定量(qRT)-PCR检测circCEP128、miR-4458表达水平 胃癌组织、癌旁组织与各组AGS细胞总RNA采用Trizol法提取,将RNA应用紫外分光光度计进行浓度测定后将其置于-80 ℃超低温冰箱内保存。配制反转录体系(20 μl):5×gDNA缓冲液2 μl,10×King RT缓冲液2 μl,FastKing RT Enzyme Mix 1 μl,FQ-RT Primer Mix 2 μl,RNA(2 μg),最后RNase-Free ddH2O补足。qRT-PCR在StepOnePlus实时荧光定量PCR仪进行,并设置循环条件为:1次循环,95 ℃预变性5 min;40次循环,95 ℃变性15 s,60 ℃退火60 s,72 ℃延伸30 s。采用2-ΔΔCt法计算circCEP128〔相对于磷酸甘油醛脱氢酶(GAPDH)〕、miR-4458(相对于U6)的相对表达量。
1.5CCK-8实验检测细胞增殖 在96孔板每孔接种1×103个各组AGS细胞,96孔板中加入10 μl CCK-8溶液,继续培养2 h后应用酶标仪Multiskan Sky检测各孔吸光度(OD)值(450 nm)。
1.6流式细胞术检测细胞凋亡率 Annexin Ⅴ-FITC/PI双染法细胞凋亡检测试剂盒用于检测各组AGS细胞凋亡。各组AGS细胞在黑暗环境中用5 μl Annexin V-FITC、5 μl PI充分混合10 min,在FACS Canto流式细胞仪分析细胞凋亡率。
1.7Transwell实验检测细胞迁移与侵袭 收集各组AGS细胞(1×105个/ml)加入小室的上室(200 μl/孔),下室加入600 μl含10%胎牛血清的培养液,培养24 h,穿模细胞固定、染色10 min,于显微镜下观察并统计迁移细胞数(个)。小室的上室加入稀释后的基质胶(40 μl/孔),后续操作同迁移检测。
1.8双荧光素酶报告基因检测circCEP128与miR-4458的靶向关系 将含有结合位点片段克隆至pmirGLO载体得到野生型(WT)载体WT-circCEP128,将miR-4458结合序列进行突变,并克隆至pmirGLO载体获得突变型(MUT)载体MUT-circCEP128,在AGS细胞中分别共转染上述载体与miR-NC或miR-4458 mimics,在荧光素酶检测系统中测量转染24 h的荧光素酶活性。
1.9Western印迹检测Ki-67、Bcl-2、MMP-2、MMP-9、Bax蛋白表达 各组AGS细胞通过RIPA裂解液抽提总蛋白,将蛋白用二喹啉甲酸(BCA)试剂盒进行定量。通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)将50 μg蛋白电泳、转膜,随后封闭膜。向膜中加入一抗稀释液(1∶1 000)后4 ℃孵育12 h,加入辣根过氧化物酶(HRP)标记山羊抗兔IgG二抗稀释液(1∶50 000)后室温培养1 h,ImageJ软件用于分析各条带光度,计算目标蛋白值与内参与GAPDH的比值。
1.10统计学处理 采用SPSS21.0软件进行独立样本t检验、单因素方差分析。
2 结 果
2.1胃癌组织中circCEP128和miR-4458表达比较 癌旁组织circCEP128表达水平显著低于胃癌组织,miR-4458表达水平显著高于胃癌组织(P<0.001),见表1。

表1 circCEP128和miR-4458在胃癌组织中表达比较
2.2抑制circCEP128表达对胃癌AGS细胞增殖的影响 与si-NC组比较,si-circ-CEP128组细胞活力及Ki-67蛋白水平显著降低(P<0.001),见图1、表2。

图1 Western印迹检测两组Ki-67蛋白表达

表2 抑制circCEP128表达对胃癌AGS细胞增殖、凋亡的影响
2.3抑制circCEP128表达对胃癌AGS细胞凋亡的影响 与si-NC组比较,si-circCEP128组细胞凋亡率、Bax蛋白显著升高,Bcl-2蛋白水平显著降低(P<0.001),见表2、图2、图3。

图2 抑制circCEP128表达对胃癌AGS细胞凋亡、迁移及侵袭相关蛋白的影响

图3 抑制circCEP128表达的胃癌AGS细胞凋亡
2.4抑制circCEP128表达对胃癌AGS细胞迁移和侵袭的影响 与si-NC组比较,si-circCEP128组迁移及侵袭细胞数显著减少,MMP-2、MMP-9蛋白水平也显著降低(P<0.001),见表3、图4。

图4 抑制circCEP128表达影响胃癌AGS细胞迁移和侵袭(结晶紫染色,×200)

表3 抑制circCEP128表达的胃癌AGS细胞迁移和侵袭
2.5circCEP128靶向调控miR-4458表达 StarBase预测见图5,结果显示circCEP128与miR-4458存在互补序列。胃癌AGS细胞转染WT-circCEP128的荧光素酶活性在miR-4458过表达时显著低于对照miR-NC组(P<0.001),见表4。表明circCEP128可靶向结合miR-4458。qRT-PCR实验结果显示,pcDNA组miR-4458表达水平(1.00±0.06)显著高于pcDNA-circCEP128(0.45±0.04,P<0.05);si-NC组miR-4458表达水平(0.99±0.05)显著低于si-circCEP128组(3.15±0.21,P<0.05)。circCEP128可负向调控miR-4458表达。
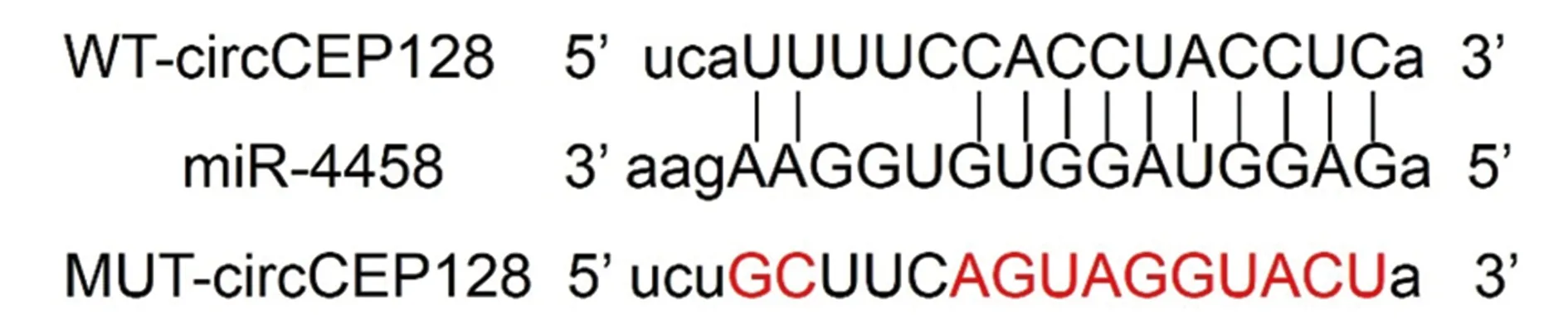
图5 circCEP128与miR-4458互补的核苷酸序列

表4 circCEP128与miR-4458的双荧光素酶报告实验
2.6miR-4458过表达的胃癌AGS细胞的增殖、凋亡、迁移和侵袭 与miR-NC组比较,miR-4458组细胞活力、Ki-67、Bcl-2、MMP-2、MMP-9蛋白水平显著降低,细胞凋亡率显著升高,迁移及侵袭细胞数显著减少,Bax蛋白水平显著升高(均P<0.001),见图6、图7、图8、表5。

图6 miR-4458过表达的胃癌细胞凋亡

图7 miR-4458过表达影响胃癌AGS细胞凋亡、迁移和侵袭(结晶紫染色,×200)

图8 Western印迹检测各组增殖、凋亡、迁移侵袭相关蛋白表达

表5 miR-4458过表达对胃癌AGS细胞增殖、凋亡、迁移和侵袭及相关蛋白的影响
2.7circCEP128通过miR-4458调节胃癌AGS细胞增殖、凋亡、迁移和侵袭 与si-circCEP128+anti-miR-NC组比较,si-circCEP128+anti-miR-4458组细胞活力显著升高,细胞凋亡率显著降低,迁移及侵袭细胞数、Ki-67、Bcl-2、MMP-2、MMP-9蛋白水平明显升高,Bax蛋白水平显著降低(均P<0.001),见表6、图8、图9、图10。

图9 干扰miR-4458表达逆转了抑制circCEP128表达对胃癌AGS细胞凋亡

图10 干扰miR-4458表达逆转了抑制circCEP128表达对胃癌AGS细胞迁移和侵袭(结晶紫染色,×200)

表6 干扰miR-4458表达及抑制circCEP128表达的胃癌AGS细胞增殖、凋亡、迁移和侵袭及相关蛋白表达的影响
3 讨 论
circRNA具有组织特异性与结构稳定性,其基因序列是由3'端与5'端以共价键结合形成的闭合环状分子,其基因序列上含有多个miRNA结合位点,并可发挥海绵分子的作用而参与肿瘤发生及发展过程,既往研究证实circRNA在胃癌中可发挥癌基因或抑癌基因作用,circ-SFMBT2通过充当miR-182-5p的海绵分子以促进环腺苷酸反应元件结合蛋白(CREB)1表达而促进胃癌细胞的增殖〔7〕。circRNA蛋白激酶B(AKT)3通过miR-198抑制上调磷酸肌醇-3-激酶调节亚基(PI3K)R1而增强胃癌的顺铂耐药性〔8〕。胃癌中circ_006100的表达水平升高,并可通过miR-195/GPRC5A信号传导促进细胞生长和转移〔9〕。circPDSS1通过充当miR-186-5p的海绵分子并调节永离有丝分裂基因A相关激酶(NEK)2而促进胃癌的进展〔10〕。circRNA_LARP4通过充当miR-424-5p的海绵分子并调节肿瘤抑制激酶(LATS)1表达而抑制胃癌细胞的增殖和侵袭〔11〕。
circCEP128在膀胱癌中表达水平升高,并可调节miR-145-5p/髓样分化因子(MyD)88及丝裂原活化蛋白激酶(MAPK)信号通路而促进膀胱癌的进展〔12〕。研究表明Ki-67表达水平高低可反映细胞增殖能力的强弱〔13〕。本研究结果提示,胃癌细胞中circCEP128可增加细胞增殖。本研究结果还显示,抑制circCEP128表达可明显提高胃癌细胞凋亡率,并上调Bax而下调Bcl-2表达,其中Bcl-2和Bax分别起抗凋亡和促凋亡作用〔14〕,这些提示抑制circCEP128表达可促进胃癌细胞凋亡。肿瘤细胞转移能力与细胞外基质沉积有关,MMPs家族成员MMP-2和MMP-9能够促进细胞转移〔15〕。另外,本研究表明,circCEP128可增强胃癌细胞的迁移及侵袭能力。
本研究证实circCEP128靶向负调控miR-4458的表达。研究表明miR-4458可抑制乳腺癌细胞的生长、迁移〔16〕。miR-4458通过直接靶向己糖激酶2而抑制糖酵解和乳酸的产生从而抑制结肠癌的发展〔17〕。LncRNA HEIH通过miR-4458/细胞因子信号转导抑制蛋白(SOCS)1轴调节三阴性乳腺癌细胞增殖和凋亡〔18〕。miR-4458通过直接靶向Lin28B抑制肺癌细胞的增殖〔19〕。circRNA PRMT5通过miR-4458/REV3编码DNA聚合酶催化亚基(REV3L)轴增强非小细胞肺癌顺铂耐药性〔20〕。本研究结果显示,miR-4458过表达抑制胃癌细胞增殖、迁移及侵袭,并使细胞凋亡增加,而抑制circCEP128表达对胃癌细胞增殖、凋亡、迁移及侵袭的不利影响被干扰miR-4458表达所明显逆转。
综上,抑制circCEP128表达通过靶向miR-4458抑制胃癌细胞增殖、迁移及侵袭,并诱导胃癌细胞凋亡,circCEP128可能作为胃癌治疗的潜在靶标。下一步将进行体内实验验证circCEP128/miR-4458分子轴在胃癌发生过程中的作用机制。

