生地中活性成分梓醇对秀丽隐杆线虫衰老的影响
赵丹丹 焦盼盼 吴宿慧,2 李寒冰,2 李根林,2
(1河南中医药大学,河南 郑州 450046;2河南省仲景方药健康衰老产业工程研究中心)
衰老是指随着时间推移,生物对环境及心理上适应能力降低,逐渐走向衰亡的过程〔1〕,是自然界的一种普遍现象,任何生物都无法抗拒的生理过程。有研究发现,人类衰老自胚胎发育时期已经开始〔2〕,而全球老龄化人口正在以越来越快的速度扩大,到2050年,世界四分之一人口将由老年人组成。由于衰老研究成本高、耗时长、衰老过程复杂,因此衰老研究被认为是最困难的生物学领域之一〔3〕。秀丽隐杆线虫是一种在土壤中生活的真核生物,全身透明易观察,生命周期短,基因组序列已知,可操控性强,价格低廉〔4〕,并且具有与人类基因组序列高度的同源性〔5〕、高度保守的信号通路等优势,被广泛应用于抗衰老领域的研究。地黄是玄参科地黄属植物,以块根入药,是著名的“四大怀药”之一,首载于《神农本草经》,被列为上品,生地黄具有滋阴清热、凉血止血的功效〔6〕。生地黄作为一种传统中草药,在我国被广泛用于治疗衰老相关疾病,但其延缓衰老成分并未完全阐明,梓醇作为生地黄中含量最高的活性单体成分之一,研究发现其具有抗炎和抗氧化、心血管保护、神经保护、抗糖尿病、抗癌、保肝等多种药理作用〔7~12〕,然而,梓醇的抗衰老特性及其作用机制报道尚少。因此,本研究以秀丽隐杆线虫为模式生物,研究梓醇抗衰老特性及其作用机制。
1 材料与方法
1.1材料和仪器 梓醇(从生地黄中提取,≥98%,分子式C15H22O10,分子量362.45)购自成都瑞芬思生物科技有限公司。尿嘧啶缺陷型大肠杆菌OP50、野生型N2秀丽隐杆线虫、突变体线虫Daf-2(CF1041)、Daf-16(CF1038)购自美国秀丽隐杆线虫遗传中心(CGC)。蛋白胨、琼脂粉、胆固醇(北京奥博星生物技术有限责任公司);胡桃醌(上海阿拉丁试剂公司);TB GreenTMPremix Ex TaqTMⅡ、Prime ScriptTMRT reagent Kit with gDNA Eraser (宝日医生物技术有限公司);氯化钠、次氯酸钠、磷酸氢二钠、磷酸二氢钾、硫酸镁、氢氧化钠、乙醇、异丙醇、氯仿等均为分析纯。生化培养箱(LRH-250,上海一恒科学仪器有限公司);超声波清洗器(KQ5200B,昆山市超声仪器有限公司);体式显微镜(SMZ-161,麦克奥迪实业集团有限公司);分析天平(BSA224S-CW,德国赛多利斯公司);自动凝胶成像系统(美国Bio-Rad公司);实时荧光定量聚合酶链反应(PCR仪,美国Applied Biosystems公司);低温离心机(FRESO21)、超微量紫外分光光度计(Nano Drop One C 2000)购自美国Thermo Fisher公司;超纯水纯化系统(ESW-I-30,上海茸研生化仪器厂);高压灭菌锅(HVE-50,日本HIRAYAMA公司);制冰机(SIM-F140AY65,宁波格兰特制冷设备制造有限公司)。
1.2溶液配制 (1)LB固体培养基:准确称量氯化钠2.0 g,胰蛋白胨2.0 g,酵母提取物1.0 g,琼脂粉3 g,加入200 ml超纯水,超声混匀后,121 ℃,20 min高压灭菌。(2)LB液体培养基:准确称量氯化钠2.0 g,胰蛋白胨2.0 g,酵母提取物1.0 g,加入200 ml超纯水,超声混匀后,121 ℃,20 min高压灭菌。(3)M9缓冲溶液:准确称量磷酸二氢钾0.602 g,磷酸氢二钠2.922 g,氯化钠0.104 g,硫酸镁0.206 g,加入纯水200 ml,超声混匀后,121 ℃,20 min高压灭菌,超净工作台冷却至室温,放4 ℃冰箱备用。(4)同期化漂白液配制:0.33 mol/L的氢氧化钠3 ml、7 %的次氯酸钠1.4 ml和0.6 ml的超纯水混匀,避光(现配现用)。(5)1 mol/L磷酸钾缓冲溶液:准确称量磷酸二氢钾27.2 g,磷酸氢二钾11.401 g,纯水定容至250 ml,用磁力搅拌器混匀,1 mol/L氢氧化钾调pH为6.0,121 ℃,20 min高压灭菌,超净工作台放凉后放入4 ℃冰箱中备用。(6)1 mol/L氯化钙溶液:准确称量22.2 g的无水氯化钙加入纯水200 ml,超声混匀后,121 ℃,20 min高压灭菌,超净工作台待放凉后放入4 ℃冰箱备用。(7)1 mmol/L硫酸镁溶液:准确称量49.2 g的硫酸镁加入纯水200 ml,超声混匀后,121 ℃,20 min高压灭菌,超净工作台待放凉后放入4 ℃冰箱备用。(8)5 mg/ml胆固醇溶液:准确称量1.0 g胆固醇加入200 ml无水乙醇,超声混匀后,放入4 ℃冰箱备用。(9)75%无水乙醇:取9 ml的无水乙醇加入3 ml的无水RNase后混匀放置。
1.3药液配制 取15 ml离心管,准确称量20.0 mg梓醇置于离心管中,加入10 ml纯水,得到原液2 mg/ml。浓度依次稀释成0.100、0.050、0.025 mg/ml。
1.4线虫固体培养基 NGM培养基:精密称取0.6 g氯化钠、0.5 g蛋白胨、3.4 g琼脂粉、200 μl胆固醇(5 mg/ml胆固醇),加入纯水200 ml,超声混匀,121 ℃高压灭菌锅12 min后,放入超净工作台中,加入200 μl氯化钙(1 mol/L氯化钙),200 μl硫酸镁(1 mol/L硫酸镁)和5 ml(1 mol/L磷酸钾缓冲溶液)慢慢摇匀,倒入培养皿中。
1.5线虫同期化 取M9缓冲液冲洗含有孕虫的培养皿,反复冲洗几次至离心管中,3 000 r/min,3 min,弃去上清。迅速加入5 ml次氯酸钠漂白液,室温下剧烈震荡2.5 min,然后4 000 r/min,1 min,弃去上清,用5 ml M9缓冲液重悬底部沉淀,混匀后3 000 r/min,3 min,弃上清,M9重悬底部沉淀过程重复3次,吸取沉淀加入含有大肠杆菌的培养基中,N2线虫和Daf-16线虫置于20 ℃培养箱中,Daf-2线虫在15 ℃培养箱中,孵育大约52 h后,由卵可得到L4期线虫,用于后续实验。
1.6寿命实验 将L4期N2、Daf-2及Daf-16线虫随机挑取至空白对照组、梓醇高、中、低剂量给药组(0.100、0.050、0.025 mg/ml),每组平行3盘,每盘30条。每天计数线虫死亡数、上壁数、钻培养基数,饲养至每组线虫全部死亡为止。判断线虫死亡标准:用热铂丝针轻触线虫,观察线虫是否有反应。
1.7生殖实验 挑取L4期N2野生型线虫至空白对照组、梓醇高、中、低剂量组,每组10盘,每盘1条,开始产卵时记录为生殖实验第一天,每隔一天将线虫转移至新的培养基中,直到线虫进入生殖后期不再产卵。将含有卵的培养基养至虫卵长大,在子代产卵前计算虫数,计算得到的总虫数即该线虫的产卵数。
1.8抗应激实验
1.8.1急性热应激实验 挑取L4期N2野生型线虫至空白对照组、梓醇高、中、低剂量给药组,连续给药7 d后,将不含大肠杆菌的培养基置35 ℃培养箱预热1 h,然后每组挑取线虫20条置于该培养基中,35 ℃培养进行实验,每隔1 h计数线虫死亡、存活数目至全部死亡。
1.8.2胡桃醌应激实验 挑取L4期N2野生型线虫至空白对照组、梓醇高、中、低剂量给药组,连续给药7 d后,挑取20条至胡桃醌终浓度500 μmol/L不含大肠杆菌的培养基中。每隔1 h计数线虫死亡、存活数目至全部死亡。
1.8.3紫外应激实验 挑取L4期N2野生型线虫至空白对照组、梓醇高、中、低剂量给药组,连续给药7 d后,每组挑取20条至不含大肠杆菌的培养基中,采用75 μW/cm2紫外灯平放照射(未关箱门)照射15 min,每隔30 min计数线虫死亡、存活数目直至全部死亡。
1.8.4过氧化氢应激实验 挑取L4期N2野生型线虫至空白对照组、梓醇高、中、低剂量给药组,连续给药7 d后,每组挑取8条,置于含30 mmol/L双氧水溶液的24孔板中。记录线虫死亡时间。
1.9摆动频率的测定 挑取L4期N2野生型线虫至空白对照组、梓醇高、中、低剂量给药组,连续给药7 d后,测试线虫摆动频率,取96孔板,每孔板中加入200 μl的M9,然后挑取1条线虫,观察线虫1 min内身体摆动次数,并记录数据。
1.10实时荧光定量聚合酶链反应(RT-PCR) 将N2野生型线虫同期化培养至L4期,分为空白对照组、梓醇高、中、低剂量给药组。每组各挑取约600条L4期线虫,连续给药7 d。采用低温Trizol法提取线虫体内总RNA,实验按照Takara(PrimeScriptTMRT reagent Kit)试剂盒进行反应得cDNA,最后按照Takara(TB GreenTMPremix Ex TaqTMⅡ)试剂盒进行荧光定量反应。具体步骤:预变性95 ℃ 30 s;95 ℃ 15 s、60 ℃ 30 s,40个循环。引物设计为目的基因Daf-2、Daf-16、Sod-3、Ctl-1,以Act-1为内参。引物序列委托上海华大基因生物有限公司合成。见表1。
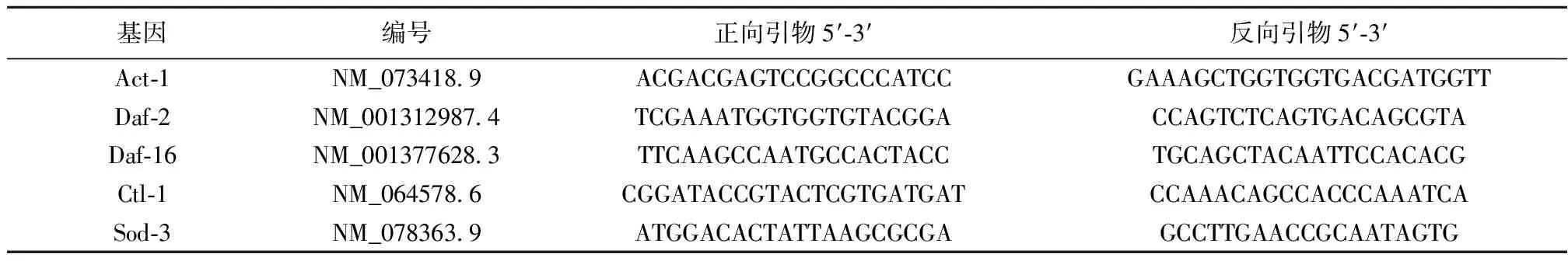
表1 引物基因碱基序列
1.11统计学处理 采用 GraphPad Prism5.0软件作图,SPSS25.0 软件进行数据处理。单因素方差分析对实验数据进行统计学检验,多重比较方差齐时选用Turkey HSD和LSD法,方差不齐时选用TamhaneT2 检验和DunnettT3法。两组样本比较采用独立样本T检验。所有实验独立重复3次。
2 结 果
2.1梓醇影响秀丽隐杆线虫寿命 梓醇高、中剂量组N2线虫平均寿命显著高于空白对照组(P<0.01,P<0.05)。而梓醇对于突变体Daf-2和Daf-16线虫平均寿命差异无统计学意义(P>0.05)。见表2、图1。
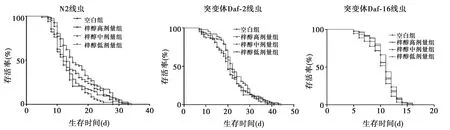
图1 3组不同线虫生存率
表2 各组线虫生存时长
2.2梓醇对线虫生殖能力和运动能力的影响 不同浓度梓醇处理后N2线虫生殖能力无统计学差异(P>0.05),表明梓醇对N2 线虫生殖能力没有明显作用。与空白组比较,梓醇高、中剂量组N2线虫运动能力明显提高(P<0.01)。见表3。

表3 各组线虫生殖、运动能力比较
2.3梓醇对线虫抗应激能力的影响 在过氧化氢(H2O2)应激、高温热应激(35 ℃)、紫外线辐射应激和胡桃醌应激等应激条件下,与空白组比较,梓醇高、中剂量组平均生存时间显著延长(P<0.05,P<0.01)。与空白组相比,不同浓度梓醇均能使N2线虫应激生存曲线右移,生存曲线右移揭示梓醇延缓了秀丽线虫的衰老。见表4、图2。
表4 各组线虫急性应激存活平均生存时长比较
2.4梓醇对线虫衰老相关基因表达的影响 与空白组相比,梓醇高剂量组N2线虫体内Daf-2 mRNA表达水平显著下调,而Daf-16、Sod-3和Ctl-1 mRNA表达水平显著上调(P<0.01,P<0.05);梓醇中剂量组Sod-3、Ctl-1 mRNA表达水平显著上调(P<0.05)。见表5。
表5 各组野生型线虫mRNA表达水平比较
3 讨 论
生物体寿命不可避免伴随着衰老过程,包括功能衰退、大量慢性疾病逐渐增加,并最终导致死亡〔13〕。尽管衰老无法避免,但是人们还是致力于找到一些干预的措施延缓衰老。橙提取物可以通过胰岛素/胰岛素样生长因子(IGF)信号传导途径磷脂酰肌醇3-激酶同源物Age-1和Daf-16基因、丝裂原活化蛋白激酶(MAPK)信号通路及抗氧化基因增强线虫抗氧化性能,减轻细胞损伤,延长秀丽隐杆线虫的寿命〔14〕。迷迭香酸通过胰岛素信号途径和 MAPK信号途径改善秀丽隐杆线虫的抗氧化特性,延长了线虫寿命〔15〕。玉竹叶提取物通过Daf-16/叉头转录因子(Fox)O和SKN-1/核因子E2相关因子(Nrf)-2 信号通路延长寿命,提高了秀丽隐杆线虫抗氧化应激的特性〔16〕。梓醇是地黄环烯醚萜苷类含量最高的活性单体成分,研究发现梓醇具有抗炎和抗氧化等药理作用〔17〕,研究发现,线虫繁殖力降低可以延长秀丽隐杆线虫的寿命〔18〕,本实验结果表明,梓醇对野生型秀丽隐杆线虫繁殖力没有明显影响,表明梓醇具有抗衰老作用但并不降低线虫繁殖力,通过对运动能力实验发现,梓醇可以改善因衰老引起的运动能力下降。研究表明,压力应激状态下应激能力的增强也是线虫延长寿命的原因之一〔19,20〕。本实验结果进一步证明了梓醇延缓衰老的作用。胰岛素信号通路是调控衰老的途径之一,在多种模式生物中都具有高度的保守性,在线虫体内也发挥着重要作用。Daf-2和Daf-16这两个基因是胰岛素信号通路上与寿命相关的调控因子,Daf-2是胰岛素受体样基因〔21〕,Daf-16是FoxO转录因子的同源物,是调节寿命的关键分子开关,其下游靶基因有Sod-3、Ctl-1等〔22,23〕。在胰岛素信号通路中,线虫体内的Daf-2受体与胰岛素配体结合之后,激活了磷脂酰肌醇-3激酶(PI3K)/Age-1,产生了一系列磷酸化级联反应,Age-1又通过蛋白激酶B(AKT)-1、AKT-2、血清和糖皮质激素诱导的蛋白激酶(SGK)-1通路引起Daf-16磷酸化,阻止其进入细胞核对下游靶基因进行调控,进而影响寿命〔24〕。本研究结果表明,胰岛素信号通路中Daf-2 mRNA表达降低,Daf-16 mRNA表达升高,促进了下游靶基因Sod-3、Ctl-1表达,延缓了线虫的衰老。为了进一步确定其作用机制,本研究对胰岛素信号通路上Daf-2(CF1041)、Daf-16(CF1038)突变体进行研究,结果表明,梓醇并未延长突变体Daf-2、Daf-16的寿命,以上结果表明,梓醇可能是通过胰岛素信号通路来延长线虫的寿命。
综上,梓醇延缓秀丽隐杆线虫正常状态和氧化应激状态下的寿命,并不影响其生殖能力,同时改善了应激状态下线虫运动能力,其作用机制可能是通过胰岛素/IGF-1信号通路,促进Daf-16下游相关抗氧化基因表达,提高线虫抗氧化应激能力,从而延长线虫寿命。本研究为梓醇的研究提供了新思路,但是寿命调控机制众多,还需要进一步探索。

