1株大鲵源多重耐药维氏气单胞菌全基因组解析及其致病性
郝成森,刘 佳,王 艳,骆泽礼,宋振辉,张立武,杨晓伟,,赵光伟,*
(1.西南大学 动物医学院,重庆 荣昌 402460;2.上海海关,上海 200135;3.重庆三杰众鑫生物工程有限公司,重庆 荣昌 402460)
维氏气单胞菌(Aeromonasveronii)是气单胞菌科(Aeromondaceae)气单胞菌属(Aeromonas)的成员,该菌革兰阴性、兼性厌氧并具有运动能力[1],呈世界性分布,并具有广泛的宿主范围,对畜禽、水产动物和免疫力低下的人具有较强的致病性,是一种典型的人-畜-水生动物共患病病原菌[2]。繁殖过程中可产生气溶素、肠毒素、黏附因子等毒力因子,可引起人的胃肠炎、蜂窝织炎、脑膜炎以及败血症等[3];致病性维氏气单胞菌感染狐狸造成肠道积气,心脏、肺脏、肾脏等主要脏器出血等病变,引起死亡[4];在水生动物中该菌引起的疾病更为常见,大口黑鲈、锦鲤、草鱼、中华鳖、中华绒鳌蟹、中国大鲵等均有维氏气单胞菌感染的报道[5-9],患病动物表现皮肤溃烂、内脏出血、腹水等多种临床症状,对养殖业危害较大。
中国大鲵(Chinese giant salamander)属于国家二级保护动物,已被列入《濒危野生动植物种国际贸易公约》附录Ⅰ[10-11],因其极高的科研、观赏、保健、药用及食用价值,其人工繁育产业在我国发展迅猛,生产区主要集中在我国陕西、四川、重庆、贵州、湖南、湖北等地。人工养殖过程中大鲵细菌性疾病时有发生,其中维氏气单胞菌也是常见的细菌病之一,感染后大鲵皮肤及四肢溃烂、腹腔大量积液,病死率高。而在治疗及预防这类疾病的过程中,又由于抗生素使用的不规范以及饵料、水环境污染等众多因素,导致耐药性菌株不断出现,增加了防控的难度。本试验针对前期分离的1株大鲵源多重耐药菌株进行全基因组测序以及致病性和耐药基因的检测,以期为该病原的防控提供理论依据。
1 材料与方法
1.1 菌株维氏气单胞菌CQ-AV1株分离自重庆市开州某大鲵人工繁育场,患病大鲵皮肤及肢体溃烂、腹水。分离菌经16S rDNA和gyrB测序鉴定确定为维氏气单胞菌,药敏试验显示CQ-AV1株对多种β内酰胺类、氨基糖苷类和四环素类药物有耐药性,为多重耐药菌株。分离菌加甘油保护剂于-80℃ 保存。
1.2 主要试剂细菌基因组DNA提取试剂盒(DP302)购自天根生化科技有限公司;2×Rapid Taq Master Mix和DL2000 DNA Marker购自南京诺唯赞生物科技有限公司;引物合成及PCR产物测序在北京六合华大基因重庆分公司完成。
1.3 实验动物健康大鲵30尾,购自陕西汉中红星大鲵养殖场,6月龄,体长(20±5)cm,体质量为(100±10)g,饲养于本实验室安静的暗环境中,室温18~25℃,每天换水1次,饲喂养殖场配送饵料;SPF昆明鼠10只(20~25 g,雌性),购自重庆国家生物产业基地实验动物中心。
1.4 主要分析软件和数据库Trimmomatic(http://www.usadellab.org/cms/index.php),HGA(https://github.com/aalokaily/Hierarchical-Genome-Assembly-HGA),SSPACE(https:// www.Base clear.com/ services/bioinformatics/basetools/),QUAST(http://bioinf.spbau.ru/quast),Barrnap 0.8(https:// github.com/tseemann/barrnap),VFDB数据库(Virulence Factors of Pathogenic Bacteria,http://www.mgcacc n/VFs/download),CGE数据库(Center for Genomic Epidemiology,http://www.genomicep idemiology.org/)。
1.5 维氏气单胞菌纯培养及扩增取-80℃保存的维氏气单胞菌CQ-AV1株划线接种于LB平板,于30℃恒温生化培养箱培养24 h。挑取单个菌落至LB液体培养基,30℃振荡培养至D600值为1.0,3 000×g离心20 min,收集菌体。
1.6 细菌DNA的提取利用细菌基因组DNA提取试剂盒提取细菌DNA,微量分光光度计测定DNA纯度和含量,确保D260/280在1.8~2.0之间,D260/230值在2.0以上,低温送至成都罗宁生物科技有限公司进行全基因测序。
1.7 文库构建及测序采用全基因组鸟枪法(whole genome shotgun,WGS)策略,构建约350 bp 大小的文库,基于Illumina HiSeq测序平台的双端测序PE150测序方法进行测序。首先使用Covaris M220对鉴定合格的基因组DNA进行超声破碎随机片段化,形成一系列在350 bp左右的DNA小片段,在片段的两个末端加上接头,使用Illumina公司TruSeqTMDNA PCR-Free Sample Prep Kit构建大小为350 bp的单链DNA文库。使用测序试剂盒HiSeq 3000/4000 SBS Kit(300 cycles)FC-410-1003进行测序,将构建好的文库种到已连接引物的测序芯片上(Flowcell),产生互补杂交,再加入dNTP和聚合酶,以此连续重复进行桥式PCR扩增,DNA链的数量以指数增长,最后形成单克隆DNA簇。利用边合成边测序的原理:加入特定DNA聚合酶及带有4种荧光标记的dNTP进行延伸,一个循环只延伸一个正确互补的碱基,后用激光扫描根据4种不同的荧光信号读取碱基种类。以此重复,直到每条模板序列都完全被聚合为双链。最后统计每个循环所读取到的荧光信号结果,获得完整序列信息。
1.8 测序数据的组装、注册及注释利用Trimmomatic软件对测序数据中产生的低质量和污染序列进行修剪和过滤,去除接头污染,切除两端碱基质量小于3的碱基。使用HGA V1.0进行序列组装,并通过软件SSPACE、QUAST软件对组装后的结果进一步的校正和评价。将全基因组序列信息注册至GenBank数据库中,并通过NCBI上的原核基因组注释通道PGAP(prokaryotic genome annotation pipeline)对组装后的基因组序列进行注释。全基因组序列与已注册的其他菌株进行比较,构建系统进化树,进而将全基因组序列在上传至VFDB数据库,对其毒力基因进行分析,获得该菌株相关毒力因子信息;将全基因组序列在上传至 CGE数据库,利用其ResFinder数据库分析比对该菌株所携带的耐药基因,获得该菌株的耐药信息。
1.9 致病性试验参考其他动物源维氏气单胞菌致病性试验的感染剂量[4-9],首先将CQ-AV1株菌液浓度调整为9.5×108CFU/mL,腹腔注射小鼠(n=5)0.5 mL,另有5只小鼠仅腹腔注射等量生理盐水作为对照;感染后每天观察小鼠的精神状态和发病情况,及时剖检死亡小鼠,观察其病变。随后,调整CQ-AV1株菌液浓度为6.0×108CFU/mL进行大鲵的致病性试验,共分为6组(n=5),其中1~5组为感染组,第6组为阴性对照注射生理盐水,5个感染组分别腹腔注射浓度为6.0×108,6.0×107,6.0×106,6.0×105和6.0×104CFU/mL的菌液0.5 mL,观察并记录大鲵的发病及死亡情况,观察时间为30 d。对发病死亡的大鲵进行剖检、观察其病变情况,并取其肝脏、脾脏、肺脏、肾脏等组织进行病理切片,HE染色后观察其病变特征,同时进行细菌的分离以验证科赫法则。
2 结果
2.1 全基因组测序结果测序结果经过滤后得到的高质量DNA序列,通过软件HGA V1.0对序列进行组装,共获得41个重叠群(contigs),组成36个scaffolds数据,总长度4 782 590 bp,其中最大的scaffold有425 514 bp。将组装好的全基因组序列注册到GenBank数据库中,登录号为:RZII00-000000.1(https://www.ncbi.nlm.nih.gov/nuccore/RZII00000000)。通过GenBank中原核基因组注释通道PGAP对CQ-AV1进行基因结构的注释,发现该菌基因组GC含量为58.48%,有5个rRNA和75个tRNA基因,其中rRNA包括:3个5S rRNA,16S rRNA和23S rRNA各1个;tRNA基因预测到22个同种型,其中Leu类最多,有8个,其次是Gly、Thr、Ser类各7个;基因组编码基因共4 323个,假基因62个;通过对蛋白编码基因中存在的信号肽序列进行分析,蛋白中共有4 378个信号肽位点。
2.2 系统进化树的绘制将大鲵源菌株CQ-AV1与GenBank中其他动物源维氏气单胞菌菌株序列进行比对,构建系统进化树。结果发现CQ-AV1与猪源菌株(A5、A136、A86、A34和A31株)位于同一分支,具有最近的亲缘关系;与鲈鱼源菌株(BAQ-071013-135株)和罗非鱼源菌株(UDRT09和NK01株)相邻,亲缘关系次之;与人源菌株亲缘关系最远,如AK247、CN17AOO29、553-SP、CN17A0154和71506株等。
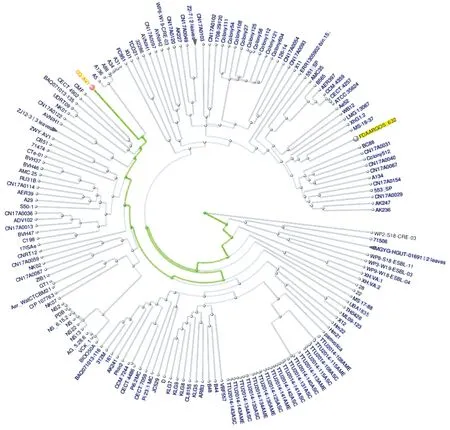
图1 CQ-AV1菌株与GenBank中其他动物源维氏气单胞菌菌株构建的系统进化树
2.3 毒力基因注释VFDB数据库注释CQ-AV1菌株的毒力因子有7大类(表1),分别是气溶素(aerolysin)、溶血素(hemolysin)、直接血红素摄取蛋白系统(direct heme uptake system)、菌毛相关蛋白(Pili-related protein)、鞭毛相关蛋白(Flagella related protein)、Ⅱ型分泌途径蛋白(type Ⅱ secretion system protein,T2SS)和Ⅲ型分泌途径蛋白(type Ⅲ secretion system protein,T3SS)。注释的毒力基因总共有159种,共320个。其中鞭毛蛋白类最多(163个),其次是菌毛蛋白(56个),最少的是气溶素和直接血红素摄取蛋白,均只有2个。
2.4 抗生素耐药基因注释ResFinder数据库比对发现表明发现CQ-AV1菌株中存在5个耐药基因(表2),分别为氨基糖苷类aac(3)-IId、β-内酰胺类AmpS、blaCEPH-A3、blaTEM-1B和四环素类Tet(E)。
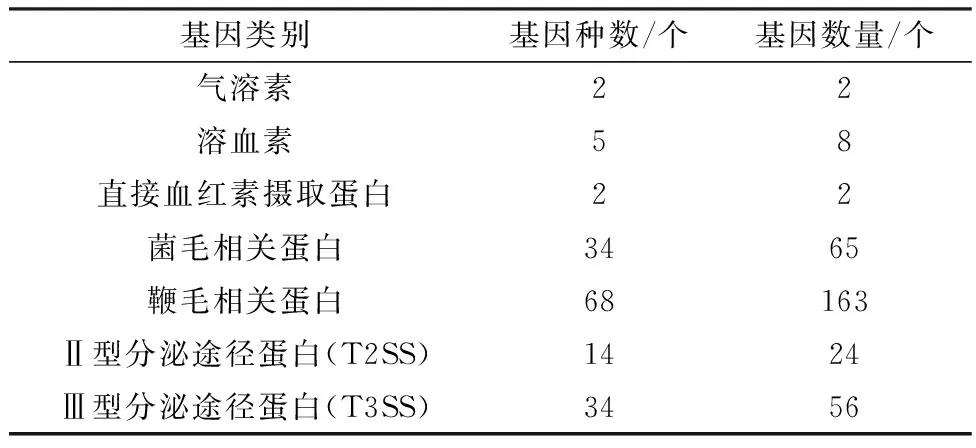
表1 VFDB数据库注释CQ-AV1菌中毒力相关基因

表2 ResFinde数据库注释CQ-AV1耐药基因结果
2.5 致病性试验结果感染组小鼠腹腔注射CQ-AV1株菌液后10 h内全部死亡,死亡小鼠可见腹部膨大,剖检发现肠腔内充满气体,内脏充血;阴性对照组小鼠均无异常。
CQ-AV1株菌腹腔接种大鲵后24 h,5个感染组均出现行动减缓,表皮黏液脱落现象;72 h时6×108感染组1条大鲵死亡,腹部注射处皮肤红肿、溃烂(图2A),同组另1条大鲵出现腹部膨胀症状(图2B);6×107感染组也出现1条腹部膨胀的大鲵,其余感染组均未出现异常;观察期结束后,6×108感染组死亡率20%,其余4个感染组均无死亡;对感染死亡大鲵剖检,发现肝脏、肾脏、肺脏充血肿大,腹腔积液,胃肠充血(图2C),与自然感染结果相似;阴性对照组中国大鲵均无任何异常。

图2 CQ-AV1菌株6×108感染组死亡大鲵临床及剖检结果
病理组织学观察发现感染组发病大鲵主要脏器中存在充血、出血和炎性细胞浸润等病变。患病大鲵肝细胞出现肿胀,严重的表现为空泡变性、坏死,狄氏间隙内枯否氏细胞增多(图3A);脾脏组织结构破坏,脾索排列紊乱,脾窦、脾小结内红细胞增多,淋巴细胞核肿大、溶解(图3B)。肺脏组织中炎性细胞增多,间质内出现大量丝网状纤维蛋白,黏膜下出现大量红细胞(图3C)。肾脏结构被破坏,毛细血管内皮细胞变性坏死,整个囊腔充满纤维蛋白,肾小管中可见蛋白管型(图3D)。而阴性对照组大鲵各脏器均正常。
3 讨论
维氏气单胞菌在自然界中分布广泛,在水环境、土壤和水生动物中报道较多,是一种对人、畜、鱼均具有感染性的致病菌,具有一定的公共卫生意义[1],特别是在水生和两栖动物中,近年来维氏气单胞菌感染引起鲤、鲫、鳗和鲟等鱼类以及虾、蟹和鳖等动物发病的报道很多[5-9],本试验菌株分离自患病大鲵,进一步说明该菌感染谱广泛。结合致病性试验结果,CQ-AV1对小鼠具有较强的致死性,人工感染后小鼠均在12 h内急性死亡,然而将菌株按不同剂量接种大鲵,尽管所有大鲵都表现出一定的运动迟缓、表皮黏液脱落等现象,但仅在最高剂量组(6×108CFU/mL)出现2尾死亡,而较低剂量的(6.0×106,6.0×105和6.0×104CFU/mL)3个组大鲵在出现一过性临床表现后均无死亡,说明该菌对大鲵的致病性较弱,同时也反映出该菌对不同宿主的致病性存在一定的差别。
二代测序技术(next-generation sequencing,NGS)和生物信息学手段的发展对深入了解细菌的生物特征提供了帮助。本试验通过全基因组测序及组装成功获得了CQ-AV1株的完整序列信息,系统进化树分析显示该菌与猪源维氏气单胞菌的亲缘关系最为接近,而与鱼源和人源菌株相对较远,经调查大鲵繁育场周边有猪散养户,存在猪-大鲵传播的可能性。全基因组信息对进一步深入了解该菌的致病机制奠定了基础,借助VFDB数据库[12]发现CQ-AV1株的毒力因子主要包括鞭毛蛋白、T3SS、T2SS、气溶素、溶血素、直接血红素摄取蛋白和菌毛相关蛋白共320个。其中鞭毛蛋白和菌毛相关蛋白分别介导细菌的运动和黏附作用[13],T3SS通过运载毒力相关的效应分子以抵抗宿主自身的防御[14],而气溶素和溶血素被认为是细菌产生致病性的效应毒力因子[15-16],尤其是气溶素已经被证实是维氏气单胞菌的主要毒力因子,可以破坏肠道组织使得菌体穿透肠道壁屏障而进入周身系统,本试验中小鼠和大鲵感染后表现出的病理特征及临床表现(如肠道鼓气、肝脏等出血)与CQ-AV1菌株中气溶素、溶血素等毒力因子的生物学效应一致。
维氏气单胞菌的耐药性也是困扰临床养殖的一个重要问题,不同时空和宿主的菌株所表现出的耐药性有很大差别,这对临床药物的使用提出了更高的要求,前期的试验结果显示CQ-AV1株对氨基糖苷类和β-内酰胺类药物具有较强的耐药性,本试验通过ResFinder耐药基因数据库的注释共发现了5个耐药基因,其中β-内酰胺类最多,共有3种,包括AmpS、blaCEPH-A3和blaTEM-1B,此外还有氨基糖苷类aac(3)-IId和四环素类Tet(E)。在同一菌株中检测到5种不同的耐药基因,一方面能够解释菌株药敏试验所表现出对氨基糖苷类和β-内酰胺类药物的耐药现象,与其表型一致,且与临床中经常使用卡那霉素、头孢曲松、头孢喹肟等药物具有一定的相关性;另一方面也充分体现出维氏气单胞菌耐药的复杂性,这与以往报道[6-7]的气单胞菌耐药现象日趋严重是一致的。
β-内酰胺类抗生素产生耐药性的重要机制为质粒介导的AmpC β-内酰胺酶和超广谱β-内酰胺酶的产生,进而水解药物的β-内酰胺环,使酰胺键断裂而失去抗菌活性[17],按照Ambler分类法将β-内酰胺酶分成了4类:即A类超广谱β-内酰胺酶(ESBLs)、B类金属酶(metallo-β-lactamases,MBL)、C类头孢菌素酶(AmpC酶)和D类苯唑西林酶(OXA酶),值得注意的是本试验CQ-AV1中blaTEM-1B属于A类ESBLs,blaCEPH-A3属于B类MBL,AmpS则属于D类OXA酶耐药基因,在同一个菌株中同时出现3种类型的耐药基因在临床分离菌株中是比较少见的,这进一步说明了耐药情况的严重性和复杂性。此外,在一份我国台湾地区调查[18]中发现,某些人源的气单胞菌株(豚鼠气单胞菌、嗜水气单胞菌)中,blaMOX和blaCEPH阳性菌株分别占调查菌株的29.4%(45/153)和7.8%(12/153),说明这些耐药菌株已经对人类的健康构成了潜在威胁,因此规范养殖行业抗生素的使用以及对替抗产品(如中草药)的研发是非常必要的。
CQ-AV1菌株中还检测到含有氨基糖苷类耐药基因aac(3)-IId和四环素类Tet(E),其中aac(3)-IId是产氨基糖苷类修饰酶中氨基糖苷乙酰转移酶的成员之一,通过催化氨基糖苷药物氨基或羟基的共价修饰,使得氨基糖苷类药物与核糖体的结合减少而介导耐药;Tet(E)是一种外排蛋白,可将四环素排出胞外从而降低胞内的药物浓度,核糖体因此受到保护,从而产生了耐药性,这是维氏气单胞菌中研究较早的一种耐药机制[19],后被证实Tet(E) 基因是介导气单胞菌分离株对四环素类药物耐药的优势基因[20],本试验在CQ-AV1菌株中仅发现这一种四环素类耐药基因,与其是优势基因的结论一致。
综上,本试验首次对1株大鲵源多重耐药维氏气单胞菌进行了全基因组测序,通过生物信息学手段对其基因组结构、毒力和耐药基因进行了分析注释,为研究维氏气单胞菌的分子流行病学、致病性及耐药特征等方面提供了参考。

