不同动物源性维氏气单胞菌气溶素基因的克隆及比较分析
曾范利,赵 丹,康元环,陈 龙,王 惠,单晓枫∗,钱爱东∗
(1.吉林农业大学中药材学院,长春130118;2.吉林农业大学农业质量标准与检测技术研究中心,长春130118;3.吉林农业大学动物科学技术学院,长春130118)
维氏气单胞菌(Aeromonas veronii,A.veronii)隶属于气单胞菌科气单胞菌属,广泛分布于各种水环境以及土壤中。该菌的毒力有强弱之分,强毒菌株不仅可以感染人,还可以感染包括狐、熊猫等哺乳动物以及鱼、虾、蟹、鳖等多种水生生物,因此,维氏气单胞菌被认为是一种人-兽-鱼共患病原菌[1-5]。该菌可以产生气溶素、溶血素、胞外蛋白酶等多种毒力因子,其中,气溶素作为一种溶血性毒素,可以导致多种脏器出血,进而引发感染动物死亡,因此,产生气溶素被认为是气单胞菌具有致病性的重要标志之一[6]。
目前,有关维氏气单胞菌气溶素的研究较少,且主要是针对单一动物源性维氏气单胞菌[7]。因此,本研究对不同动物源性维氏气单胞菌气溶素基因(aerA)进行了克隆及序列分析,以期为维氏气单胞菌共同保护性抗原的筛选、疫苗的制备以及致病机理的研究奠定基础。
1 材料与方法
1.1 菌种 A.veronii ATCC35624(人源)、A.veronii CY0806(框镜鲤源)、A.veronii NC4122-3(草鱼源)、A.veronii NN725(鲇鱼源)、A.veronii NJ4112-4(鲫鱼源),由吉林农业大学预防兽医学研究室保存;A.veronii QXF0711B(青虾源)由浙江省淡水水产研究所潘晓艺副研究员惠赠;大肠杆菌DH5α购自北京全式金生物技术有限公司。
1.2 主要试剂 细菌基因组提取试剂盒、DNA凝胶回收试剂盒、质粒小量提取试剂盒购自北京索莱宝科技有限公司;pMD-18T载体、DL2000 DNA Marker、Hind Ⅲ DNA Marker、ExTaq DNA 聚合酶、EcoRⅠ、HindⅢ购自宝生物工程(大连)有限公司;RS鉴别培养基购自北京陆桥技术有限责任公司。

1.4 aerA基因的克隆 活化不同动物源性维氏气单胞菌,并提取其基因组DNA,以其为模板,用引物P1、P2对aerA基因进行扩增。PCR反应条件为:94 ℃ 5 min;94 ℃ 1 min,60 ℃ 40 s,72 ℃ 1.5min,34个循环;72℃ 10 min。PCR产物经琼脂糖凝胶电泳检测,DNA凝胶回收试剂盒纯化回收,纯化回收的产物与pMD-18T载体连接,转化至DH5α感受态细菌中,平铺于含氨苄青霉素LB固体培养基,37℃培养12 h,挑取单个菌落,接种于含氨苄青霉素的液体LB培养基中,37℃培养过夜。
1.5 重组质粒的鉴定与测序 重组质粒DNA以质粒小量提取试剂盒提取,并经EcoRⅠ、HindⅢ双酶切鉴定,阳性克隆质粒送至上海生工科技公司测序。
1.6 aerA基因的序列分析 应用DNAStar Lasergene 7.1、MEGA 5.1、NCBI中的 ORF Finder与 CDD等相关生物学软件对上述6株不同动物源性的维氏气单胞菌aerA基因序列以及GenBank上的二株维氏气单胞菌aerA基因序列(登录号分别为CP002607.1、EF034117.1)进行分析并比对。
2 结果
2.1 维氏气单胞菌aerA基因的PCR扩增结果以不同动物源性维氏气单胞菌基因组DNA为模板,进行PCR反应,在1500 bp处出现与目的片段大小相符的目的条带(图1)。
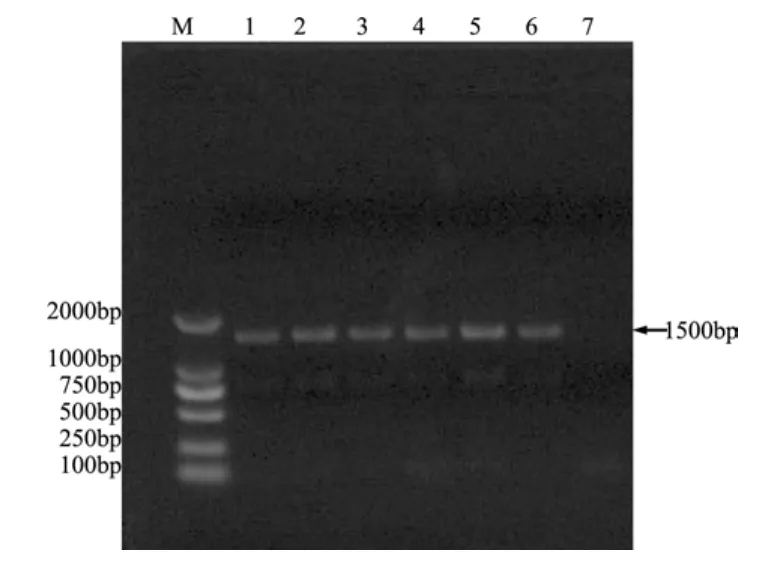
图1 维氏气单胞菌aerA基因的PCR扩增
2.2 克隆质粒的鉴定 提取阳性pMD18-T-aerA重组质粒,并用EcoRⅠ与HindⅢ双酶切鉴定,酶切产物经琼脂糖凝胶电泳检测,在约1500 bp处可见目的条带(图2)。
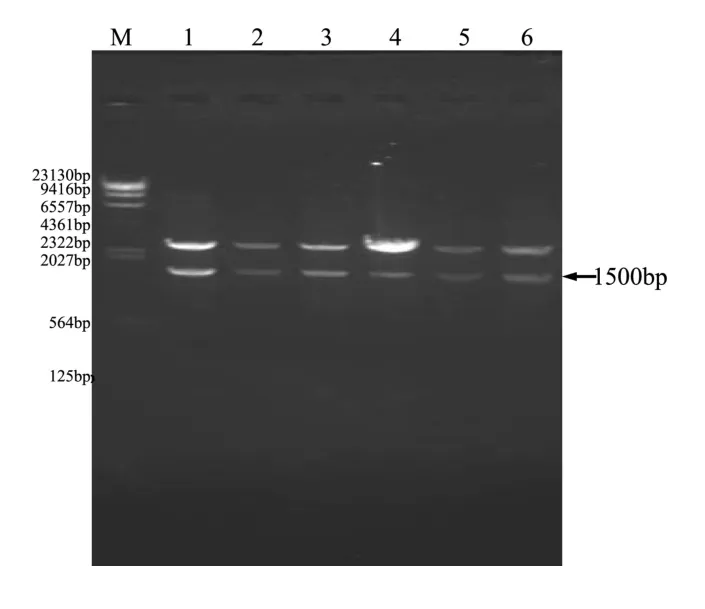
图2 pMD18-T-aerA重组质粒酶切鉴定结果
2.3 维氏气单胞菌aerA基因结构域分析 利用NCBI中的CDD数据库搜索功能发现,不同动物源性维氏气单胞菌以及GenBank上的CP002607.1、EF034117.1 aerA基因的核苷酸序列均具有APT Superfamily与Aerolysin Superfamily保守结构域(图3)。
2.4 维氏气单胞菌aerA基因序列的同源性分析通过DNAStar Lasergene 7.1软件比对分析不同动物源性核苷酸序列及编码的氨基酸序列,结果显示:不同动物源性维氏气单胞菌的aerA基因核苷酸序列同源性均在95.8%以上,其中以ATCC35624与CP002607.1核苷酸序列同源性最高(99.9%),而QXF0711B与CP002607.1、CY0806与EF034117.1核苷酸序列的同源性相对较低(95.8%),其余核苷酸序列均介于95.8%~99.9%之间(图4);各aerA基因编码的氨基酸序列的同源性均在89.8%以上,其中菌株CY0806的氨基酸序列与其他菌株的同源性均相对较低(89.8%~91.4%),其余菌株的氨基酸序列的同源性则介于98.0%~99.4%之间(图5)。

图3 不同动物源性的维氏气单胞菌aerA基因核苷酸序列的保守结构域

图4 不同动物源性维氏气单胞菌aerA基因核苷酸序列的同源性比较
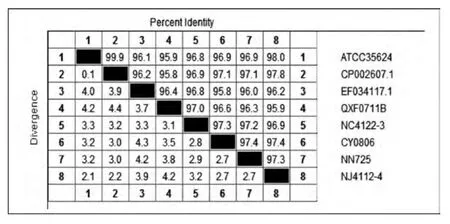
图5 不同动物源性维氏气单胞菌aerA基因编码的氨基酸序列的同源性比较
2.5 维氏气单胞菌aerA基因的遗传演化分析 利用MEGA5.1软件对不同动物源性的维氏气单胞菌aerA基因遗传演化进行分析,结果显示:QXF0711B与 EF034117.1处于同一大分支;ATCC35624与CP002607.1亲缘关系较近,处同一小分支,同时与 NJ4112-4、NN725、CY0806聚为一支,又与NC4122-4共同处于一大分支(图6)。
3 讨论
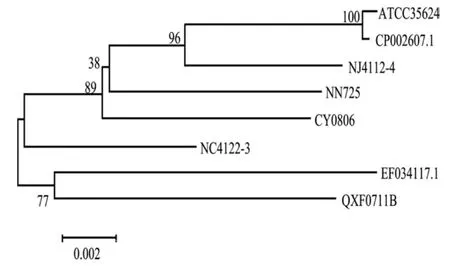
图6 不同动物源性维氏气单胞菌aerA基因的进化分析
作为一种较为新型的人-兽-鱼共患病原菌,维氏气单胞菌引发人与动物患病的报道逐年增多,但有关该菌的深入研究却少有报道,尤其缺少毒力因子与致病机制的研究。目前已知的维氏气单胞菌是与其他气单胞菌成员一样,可以产生多种毒力因子,其对其致病性具有重要作用。其中,气溶素作为气单胞菌属中最重要的致病性标志之一,可导致感染动物全身的广泛性出血、并致使动物死亡[8]。而且,aerA基因在维氏气单胞菌检出率也显著增加:Nawaz等[9]用PCR技术对分离的81株维氏气单胞菌进行气溶素的检测,结果发现有78株携带aerA基因;本实验室也证实,环境中维氏气单胞菌分离株 aerA基因的携带率高达 89.8%(44/49)。因此,较为系统的研究气溶素对维氏气单胞菌的检测及防治尤为重要。
本研究首次对不同动物源性维氏气单胞菌的aerA基因进行了比较分析。结构域分析结果显示,所有序列均具有APT Superfamily与Aerolysin Superfamily保守结构域,它们作为维氏气单胞菌aerA基因的重要标志,在不同维氏气单胞菌菌株中存在,说明aerA基因相对比较保守,这与其他气单胞菌对aerA基因的研究结果相似[10]。同源性分析结果证实,不同维氏气单胞菌菌株aerA基因的核苷酸序列及其所编码的氨基酸序列同源性均较高,但也存在一定差异,尤其是CY0806株,其aerA基因编码的氨基酸序列在289位、301位、333位分别多出了L、G、A,这种差异是否会影响气溶素的功能以及菌株的毒力仍有待于深入研究。而就本实验的遗传演化分析表明,源性不同、地区差异与aerA基因亲缘关系的远近没有太大相关性,至于什么是影响其亲缘关系的重要因素,仍需要大量菌株进一步验证分析。
综合分析可以看出:不同源性的维氏气单胞菌气溶素之间虽然存在一定差异,但其核苷酸序列、氨基酸序列的同源性均较高,且所有基因的核苷酸序列均有APT Superfamily与 Aerolysin Superfamily保守结构域,说明维氏气单胞菌的气溶素具有一定的保守性。本实验的研究结果可为维氏气单胞菌的检测及疫苗的研究提供一定的理论依据。
[1]龚 倩,高淑琴,单晓枫,等.框镜鲤致病性维氏气单胞菌的分离鉴定[J].中国预防兽医学学报, 2010, 32(12):981-983.
[2]潘晓艺,沈锦玉,李建应,等.青虾“软壳综合症”病原及其特性[J].微生物学通报,2009,36(10):1571-1576.
[3]Rahman M, Colque-Navarro P, Kuhn I, et al.Identification and characterization of pathogenic Aeromonas veronii biovar sobria associated with epizootic ulcerative syndrome in fish in Bangladesh[J].Appl Environ Microbiol, 2002, 68 (2): 650-655.
[4]王意银,李刚山,朱姝媛,等.维罗纳气单胞菌温和生物变种分离鉴定及致病性研究[J].中国热带医学,2011,11(8):918-919.
[5]李伟杰,赵耘,刘 燕,等.狐狸源致病性维氏气单胞菌的分离鉴定及耐药性分析[J].中国预防兽医学报,2012,32(4):289-292.
[6]吴同垒,单晓枫,孟庆峰,等.维氏气单胞菌研究进展[J].中国兽药杂志,2011,45(7):41-44.
[7]吴同垒,单晓枫,孟庆峰,等.框镜鲤维氏气单胞菌 CY0806株气溶素基因的生物信息学分析及原核表达[J].中国预防兽医学报, 2011, 33(11):866-869.
[8]Sung Hung-hung, Hwang Shu-fen, Tasi Fu-ming.Responses of giant freshwater prawn (Macrobrachium rosenbergii) to challenge by two strains of Aeromonas spp.[ J].J Invertebrate Pathol,2000,76: 278-284.
[9]Nawaz M,Khan S A,Khan A A,et al.Detection and characterization of virulence genes and integrons in Aeromonas veronii isolated from catfish [J].Food Microbiol, 2007, 27: 327-331.
[10]Singh V, Somvanshi P, Rathore G, et al.Gene cloning,expression,and characterization of recombinant aerolysin from Aeromonas hydrophila[J].Applied Biochemistry and Biotechnology,2010, 160(7): 1985-1991.

