黄芪多糖APS10-100组分免疫调节活性及其机制
李 巍,陈贵才,胡伟莲,戴德慧*
(1.浙江大学 实验动物中心,浙江 杭州 310058;2.浙江科技学院 生物与化学工程学院,浙江 杭州 310012)
免疫抑制是一种暂时或永久性免疫功能障碍的状态,是养殖业常见的临床病理现象。滥用药物、不良环境、病原微生物感染等多种因素均会引发养殖动物发生免疫抑制[1-2]。免疫抑制大多数呈亚临床症状,往往被养殖人员所忽视,治疗不当很容易引起大批死亡,与畜牧生产的经济效益直接相关[3-4]。由于免疫系统受损,使生物体对病原体更加敏感。因此抗生素在集约化养殖中被大量滥用,但随之而来的是微生物耐药性、食品安全等问题。我国与欧美等国相继禁用了饲用抗生素,开发健康安全有效的饲用抗生素替代物成为研究的重要方向之一[5]。中药及其植物提取物属于天然的活性物质,兼具营养和药物的双重作用,且有无抗药性、功能多样性、经济实用等特点。在饲料中添加中药类免疫增强剂能够提高动物机体免疫功能,是一种稳定、安全和环保的调节手段。近年来越来越多的研究表明,黄芪多糖(Astragaluspolysaccharide,APS)作为绿色饲料添加剂使用有极高的保健价值,应用后有无残留、无污染、无副作用的特点,可以增强机体免疫力、抗病力、抗应激能力[6-7]。
以往对APS应用及生物活性研究已有大量报道,但主要集中在对总多糖(粗多糖)或者某一特定相对分子质量均一多糖组分的研究[8-10],粗多糖成分复杂,相对分子质量分布广,除活性多糖外,还含有大量生理活性不明显的多糖组分。即便采用同一提取方法但因也会因具体的生产原料或批次间的参数差异而导致所得的粗多糖成分和药理活性差异[11]。特定相对分子质量均一多糖组分需要离子交换、分子筛等柱层析方法获得,柱层析填料价格高昂,且均一多糖得率极低,无法应用于畜牧生产中。因此,基于产品开发的角度,选择特定相对分子质量范围内的多糖组分制备成替抗产品可以克服两者的缺点,但对其结构、免疫调节活性及机制研究报道较少。本研究以中药企业副产物黄芪水提醇沉药渣为原料,通过膜分离对其进行分级,制备相对分子质量为10~100 kDa(APS10-100)特定范围的多糖组分,并与粗多糖进行了对比,阐明其免疫调节活性及可能的机理,为中药企业副产物黄芪水提醇沉药渣资源化利用及APS的质量控制、提质增效、新产品开发提供依据。
1 材料与方法
1.1 实验动物SPF 级ICR小鼠96只(生产许可证号:SCXK(浙)2019-0002),体质量18~22 g,雌雄各1/2。所有小鼠均饲养于屏障环境(使用许可证号:SYXK(浙)2017-0010)(温度20~26℃,日温差≤4℃,相对湿度40%~70%,换气次数15~20次/h),饲喂60Co-γ射线灭菌的营养配合饲料,饮用超滤水,笼器具、垫料等均经121℃高压灭菌20 min。
1.2 主要试剂与设备黄芪水提醇沉药渣购自正大青春宝药业有限公司;葡萄糖(Glc)、半乳糖(Gal)、阿拉伯糖(Ara)、甘露糖(Man)、鼠李糖(Rha)、岩藻糖(Fuc)和半乳糖醛酸(GalA)均购自美国Sigma-Aldrich公司;1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone, PMP)、HPLC级乙腈购自阿拉丁试剂有限公司;注射用环磷酰胺(CTX)购自通化茂祥制药有限公司;超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、丙二醛(MDA)、谷胱甘肽过氧化物酶(GSH-Px)测定试剂盒均购自南京建成生物科技有限公司;CD3-PE-Cy5、CD4-FITC、CD8-PE单克隆抗体(MAb)、BD Pharmingen、γ-干扰素(IFN-γ)、免疫球蛋白G(IgG)检测试剂盒均购自杭州联科生物技术有限公司。电子分析天平(BSA224S),赛多利斯科学仪器(北京)有限公司;高速离心机(Allegra X-30R)美国贝克曼库尔特公司;多功能酶标仪(Multiskan FC)美国赛默飞世尔公司;755型紫外可见分光光度计,上海元析仪器有限公司; 流式细胞仪(FACSCantoTMⅡ)美国 BD公司;高效液相色谱仪(water e2695),沃特世科技(上海)有限公司。
1.3 黄芪水提醇沉药渣分步醇沉将黄芪水提醇沉药渣加去离子水溶解,5 000 r/min离心收集上清液,Sevag法脱蛋白至D250~D280无明显吸收峰,上清液逐渐加入无水乙醇,使乙醇浓度达到 10%,4℃条件下静置过夜,抽滤,无水乙醇和丙酮洗涤滤饼后真空冷冻干燥得到10%的醇沉物。上清液再逐渐加入无水乙醇,使乙醇体积分数达到20%,按上述操作得到20%的醇沉物。再依此方法得到30%,40%,50%,60%,70%,80%,90%的醇沉物。
1.4 黄芪粗多糖及APS10-100粉制备黄芪水提醇沉药渣加入去离子水溶解至最终乙醇浓度为10%,充分搅拌后,5 000 r/min离心10 min,取上清液加入等质量去离子水,先后通过孔径为100,10 kDa中空纤维膜,收集10~100 kDa多糖组分,真空浓缩后,冷冻干燥得到APS10-100粉。另取黄芪水提醇沉药渣加入去离子水充分溶解,5 000 r/min离心10 min,取上清液真空浓缩后,冷冻干燥得到黄芪粗多糖粉。
1.5 ASP分子中单糖组成分析样品进行三氟乙酸水解并PMP衍生化后,采用HPLC法测定单糖组成。称取 5 mg 待测样品置于水解管中,加入 2 mol/L三氟乙酸 3 mL 溶解,密封, 120℃水解 2 h。氮气吹干,加入少量甲醇,吹干,重复操作3次后,加去离子水定容至0.5 mL。吸取0.2 mL置于离心管中,依次加入0.5 mol/L的PMP甲醇溶液0.5 mL和0.2 mol/L的NaOH溶液0.2 mL,涡旋混合1 min,在70℃条件下反应110 min。冷却至室温,加入0.2 mol/L的HCl 0.2 mL进行中和并再加入1 mL氯仿萃取,离心,弃去有机层,重复萃取操作3次,即得多糖样品水解衍生物。另取Glc、Gal、Ara、Man、Rha、Fuc及GalA对照品按上述方法进行衍生化并制备标准曲线。
液相色谱条件:色谱柱,C18柱(250 mm×4.6 mm,5 μm);流动相,0.01 mol/L磷酸盐缓冲溶液(pH6.7)∶乙腈(83∶17);流速:1.0 mL/min;进样量:20 μL;柱温,30℃;检测波长,245 nm[12]。
1.6 多糖含量的测定利用苯酚-硫酸法测定总糖质量分数[13],根据葡萄糖标准曲线计算总糖的质量分数。
1.7 APS10-100及黄芪粗多糖对CTX所致小鼠免疫抑制功能的影响
1.7.1试验设计 动物适应1周后,分性别按体质量将其随机分为空白对照组、模型组、黄芪粗多糖低、中、高剂量组(50,100,200 mg/kg)及APS10-100低、中、高剂量组(50,100,200 mg/kg)等8组。每组12只,雌雄各1/2。除对照组外,其余各组腹腔注射CTX,剂量80 mg/kg,连续注射3 d后,对照组及模型组用生理盐水灌胃,给药组分别灌胃各剂量黄芪粗多糖及APS10-100,连续给药30 d。在试验过程中除对照组外,其余各组分别于9~11,19~21 d再次每天腹腔注射剂量为80 mg/kg CTX进行强化。给药结束后小鼠禁食12 h左右,测体质量后麻醉采血。部分血至抗凝管用于T淋巴细胞亚群的分析,其余血液自然凝固后离心取血清按试剂盒操作说明进行IFN-γ、IgG检测。脱颈剖杀各组小鼠取肝脏、脾脏以及胸腺测质量并计算脏器指数(小鼠脏器质量与其体质量的比值)。
1.7.2小鼠外周血T淋巴细胞亚群的测定 吸取各组小鼠抗凝血100 μL加入到流式管中,分别加入稀释后的CD3-PE-Cy5、CD4-FITC、CD8-PE单抗各5 μL混匀,避光室温孵育30 min。再加入稀释后的溶血素2 mL混匀,避光孵育10 min。1 200 r/min离心5 min,弃上清,用2 mL PBS缓冲液洗涤1次,再加入含1%多聚甲醛的PBS溶液0.5 mL混匀。采用流式细胞术检测小鼠外周血中的 CD3+CD4+和 CD3+CD8+T 细胞的数量,并计算 CD4+/CD8+T 细胞的比例。
1.7.3小鼠肝组织抗氧化指标的测定 准确称取肝组织0.5 g,加入4.5 mL生理盐水捣碎匀浆,再用生理盐水稀释10倍,制成1%肝组织匀浆,按试剂盒说明书测定MDA含量及 SOD、CAT、GSH-Px活性。
1.8 数据统计应用SPSS Statistics 19.0统计学软件进行单因素方差分析(One-way ANOVA),利用LSD 法进行多重比较,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 分步醇沉对黄芪多糖分布的影响不同相对分子质量的多糖在不同浓度的乙醇中溶解度有所差异,大分子多糖易在较低浓度的乙醇溶液中沉淀下来,而小分子多糖则易溶解于更高浓度的乙醇中。由图1可知,醇浓度30%的多糖所占比例最大,其次是20%和10%,而50%和40%醇沉物较少,表明APS不同组分多糖分布不均匀。与文献报道[14]醇浓度 10% 的多糖所占比例最大,其次是 20% 和 30%有所差异,这可能与黄芪产地和提取方法的不同有关。
2.2 APS10-100及粗多糖的单糖组成APS10-100和粗多糖经水解及PMP衍生后,进行 HPLC 分析,结果见图2。通过与单糖标准物HPLC相对保留时间比较可知,粗多糖主要由Rha、GalA、Glc、Gal及Ara组成,物质的量的比率为0.05∶0.48∶1.0∶0.11∶0.36,而APS10-100主要由GalA、Glc、Gal及Ara组成,物质的量的比率为0.43∶1.0∶0.16∶0.39。粗多糖与APS10-100的单糖组成分析表明最丰富的是Glc,其次是GalA,Ara及Gal,但两者的单糖组成的物质的量的比有所差异,此外,粗多糖中还含有少量的Rha,而ASP10-100则未检测到。

图1 分步醇沉对APS的分布影响
2.3 APS10-100及粗多糖对小鼠体质量的影响试验期间各组小鼠进食饮水正常,大、小便无异常改变,在给定的造模剂量内无动物死亡。但模型组出现了精神状态较差、毛色不光亮等体征,各组小鼠体质量测定结果见图3。
体质量是衡量机体机能的一个重要指标,反映了机体代谢的综合情况。由图3可知,与对照组相比,模型组体质量显著降低(P<0.05),表明小鼠逐次注射CTX后机体受到一定的损伤。APS10-100及粗多糖高剂量组体质量虽有所下降,但无显著性差异(P>0.05)。表明摄入适量的粗多糖与APS10-100均能有效抵抗CTX所致的体质量增量减少,两者在改善体质量指标上无显著性差异(P>0.05)。

a、b、c等不同小写字母表示差异显著(P<0.05),A、B、C等不同大写字母表示差异极显著(P<0.01);无字母标注表示差异不显著(P>0.05)。下同
2.4 APS10-100及粗多糖对小鼠脏器系数的影响由图4可知,与对照组相比, 模型组小鼠的肝脏、免疫器官(胸腺、脾脏)的脏器指数均发生了显著变化(P<0.05),其中,肝脏及脾脏指数极显著升高(P<0.01),胸腺指数显著降低(P<0.05),表明CTX对小鼠胸腺发育具有较强抑制作用,同时引起脾脏及肝脏代偿性增生而肿大。有文献报道CTX可引起脾脏萎缩[15],但本研究中出现脾脏肿大,可能与CTX造模的方法、剂量及造模后小鼠脾脏采样时间等因素有关,这与文献报道的一致[16-17]。与模型组相比,高剂量APS10-100可极显著降低肝脏及脾脏指数(P<0.01),升高胸腺指数,与对照组无显著性差异(P>0.05),异常症状得到显著改善,恢复到正常小鼠水平。高剂量粗多糖组能显著降低肝脏指数(P<0.05),降低脾脏指数和升高胸腺指数,但差异不显著(P>0.05)。表明摄入适量的APS10-100及粗多糖均有修复肝脏及免疫器官损伤的作用,但APS10-100活性更强。
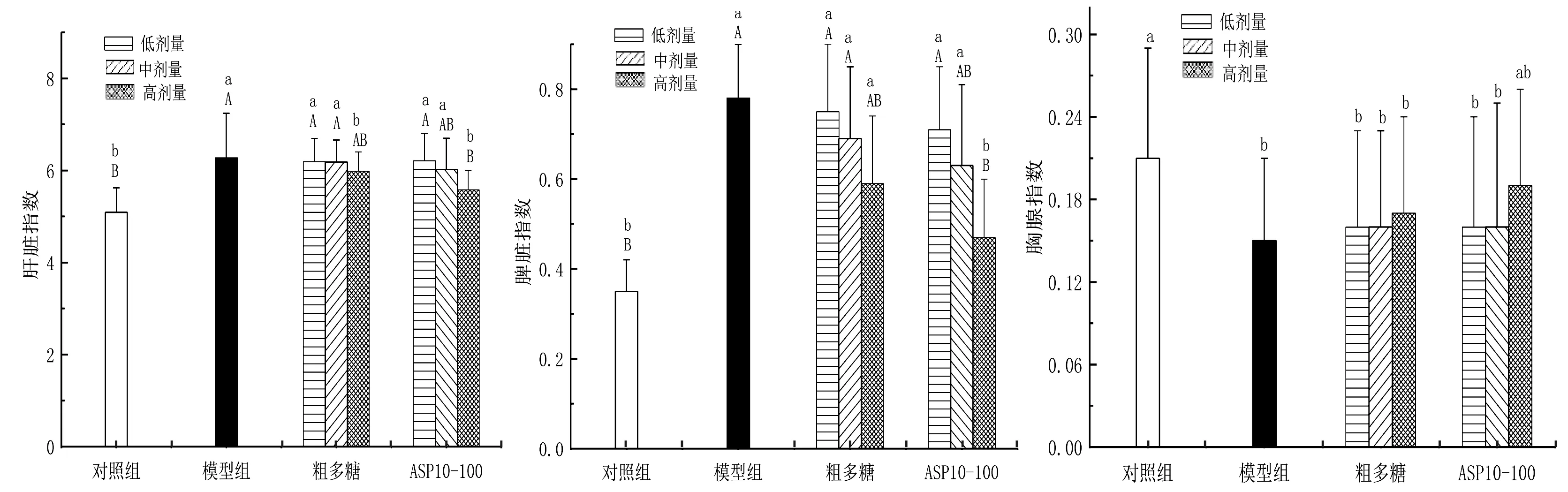
图4 APS10-100及粗多糖对小鼠脏器指数的影响
2.5 APS10-100及粗多糖对外周血IFN-γ和IgG含量的影响IFN-γ是宿主防御病原体的重要细胞因子,可刺激巨噬细胞清除细菌和肿瘤细胞,激活中性粒细胞和自然杀伤 (NK) 细胞。IgG是机体最丰富的免疫球蛋白,可介导被动免疫,与巨噬细胞、中性粒细胞和自然杀伤细胞相互作用而激活这些细胞。由图5可知,与对照组比,模型组小鼠IFN-γ和IgG含量均发生了极显著降低(P<0.01),表明本试验的造模方式下,CTX能有效地降低小鼠IFN-γ和IgG含量。高剂量APS10-100能极显著升高IFN-γ水平(P<0.01),达到对照组的范围(P>0.05)。高剂量粗多糖能显著升高IFN-γ水平(P<0.05),但与对照组仍有一定的差距(P<0.05)。高剂量APS10-100能显著提高IgG含量(P<0.05),但与对照组IgG仍有极显著差异(P<0.01),这可能与本试验造模条件下小鼠IgG过低有关。高剂量粗多糖对IgG含量有提高趋势,但差异不显著(P<0.05)。以上结果表明适量的APS10-100具有提高模型组小鼠IFN-γ和IgG水平的作用,其活性高于粗多糖。
2.6 APS10-100及粗多糖对外周血T淋巴细胞亚群的影响T 淋巴细胞是适应性免疫反应中的主要辅助细胞和效应细胞,CD3分子表达在全部T细胞上,是鉴定T细胞的重要标记。当机体免疫功能低下、细胞免疫功能受到抑制时,出现CD3+、CD3+CD4+和CD4+/CD8+降低[18]。由图6可知,CD3+CD4+和CD3+CD8+双阳性淋巴细胞亚群均可明显分群。由图7可知,模型组CD3+CD4+、CD3+CD8+及CD4+/CD8+降低极显著(P<0.01),表明本试验所采用的免疫抑制剂CTX及造模方法能有效抑制小鼠的细胞免疫功能。
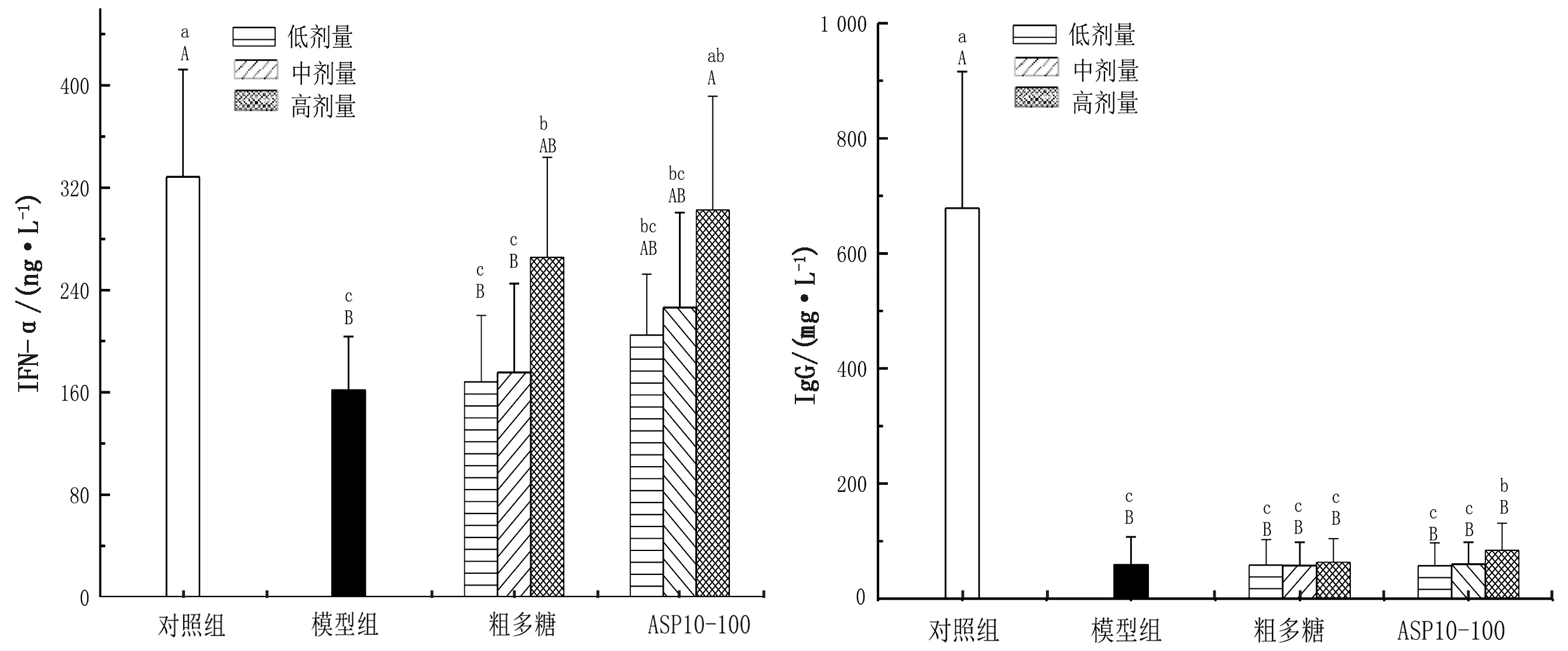
图5 APS10-100及粗多糖对外周血IFN-γ和IgG含量的影响
APS10-100及粗多糖均可显著提高免疫抑制小鼠外周血中CD3+CD4+和CD3+CD8+细胞的数量及改善两者之间的比例(CD4+/CD8+),其中高剂量APS10-100能恢复到正常小鼠水平(P>0.05)。而高剂量粗多糖虽能显著提高CD3+CD4+和改善CD4+/CD8+(P<0.05),但仍与对照组及APS10-100组有显著性差异(P<0.05)。
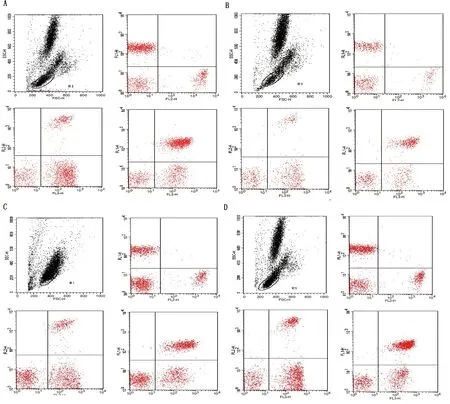
A.对照组;B.模型组;C.黄芪粗多糖;D.APS10-100
2.7 APS10-100及粗多糖对小鼠抗氧化指标的影响由图8可知,与对照组比,模型组肝内SOD、CAT、GSH-Px活性降低,MDA含量增加。其中GSH-Px及CAT下降显著(P<0.05,P<0.01),MDA上升显著(P<0.05),SOD活性有所下降,但差异不显著(P>0.05)。与模型组比,高剂量APS10-100能极显著降低MDA含量(P<0.01),极显著提高GSH-Px活性(P<0.01),尤其在MDA指标上,其含量显著低于对照组(P<0.05)及高剂量粗多糖组(P<0.01)。结果表明,适量的APS10-100能有效改善机体抗氧化能力,其抗氧化活性强于粗多糖。

图7 APS10-100及粗多糖对外周血T淋巴细胞亚群的影响
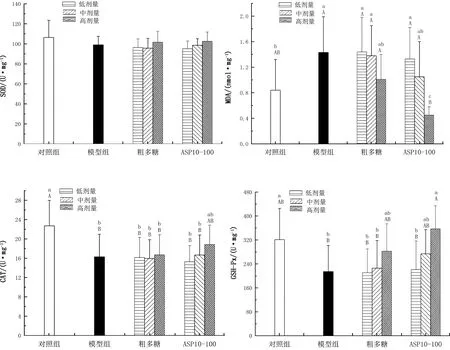
图8 APS10-100及粗多糖对小鼠抗氧化指标的影响
3 讨论
迄今从黄芪中分离鉴定出的化合物有 100 多种,包括多糖类、黄酮类、皂苷类、氨基酸类、微量元素等,其中ASP是黄芪中含量最丰富、免疫调节活性最强的物质[19]。APS的化学结构是其发挥免疫调节作用的物质基础。相对分子质量、单糖组成、糖连接方式及三维结构的改变,其免疫调节活性均有可能发生相应的变化。JIANG等[20]研究表明 APS 的免疫调节作用与其相对分子质量之间有明确的关系,相对分子质量太大,不利于跨越多重细胞膜障碍进入生物体内发挥生物学活性,而相对分子质量太小则难以维系多糖的高级结构,体内活性往往较低。目前,市场绝大多数产品为黄芪粗多糖,由于APS的相对分子质量分布较广(1~104kDa)[13],黄芪粗多糖产品生物活性难以达到理想状态。以往研究报道免疫调节活性较强的均一多糖往往集中在中等相对分子质量(10~100 kDa)区域[21-24]。但缺乏此相对分子质量范围的ASP组分结构、免疫调节活性及其机制等相关研究。本研究通过超滤截留了10~100 kDa特定相对分子质量范围的ASP组分制备了ASP10-100产品。APS10-100与粗多糖的单糖组成种类与比例有所差异,这与黄芪多糖不同相对分子质量组分的自身结构有关。以往的研究报道[25-27]黄芪多糖不同相对分子质量组分的单糖组成及比例虽差异较大,但大多数均含有Glc、GlaA、Gal和Ara等,其中Glc占比最高,与本试验结果相似。CTX是免疫抑制动物模型常用的诱导剂。模型动物常表现出免疫器官异常、体质量减轻以及外周血中免疫细胞失衡等[28-29]。在本研究中,模型组小鼠具有相同现象。APS10-100与粗多糖粉均可以逆转CTX引起的体质量、免疫器官等的异常,提高淋巴细胞的活性和功能,促进细胞生长因子,提高机体的免疫能力。但APS10-100作用活性明显高于黄芪粗多糖。这对黄芪多糖产品的提质增效及质量控制提供了新的思路。
有研究表明氧化应激是导致免疫失调的重要因素[30-31]。先天性免疫和适应性免疫都需要氧化还原调节过程,例如免疫细胞浸润、激活和分化、吞噬细胞呼吸暴发、细胞信号转导和转录程序的控制等。此外,氧化应激还会影响T细胞的分化和极化,导致炎症细胞因子和趋化因子的异常表达[32-33]。因此,机体的免疫功能与体内抗氧化剂/氧化剂的失衡息息相关。活性氧(ROS)是氧的化学活性衍生物,当体内ROS超出了细胞的清除潜力或抗氧化反应体系严重受损时,就会发生氧化应激[34]。CTX在体内经肝脏细胞色素P450酶体系等转化,形成具有高度毒性的磷酰胺氮芥和丙烯醛,丙烯醛能迅速消耗细胞内的还原型谷胱甘肽 (GSH),干扰组织抗氧化防御系统,并导致ROS 的过量生成和大量累积,随后引起氧化应激和脂质过氧化,产生MDA等物质[35]。MDA是细胞损伤和氧化应激的可靠指标,反映组织氧化的程度。它能与磷脂蛋白质、核酸等形成稳定的不溶性代谢终产物,积聚在细胞内而影响正常细胞功能。MDA含量的增减代表着脂质过氧化作用的强弱,反映出机体内过氧化程度。细胞通过复杂的氧化还原调控系统控制ROS的产生和清除,维持氧化还原平衡是其实现正常生理功能的重要条件[36]。体内氧化还原酶类(SOD、CAT、GSH-Px、NOX、NOS等)会产生氧化还原活性分子,如超氧化物、过氧化氢、一氧化氮和硫化氢等。这些酶与靶蛋白反应,在不同的信号级联中诱导半胱氨酸残基的时空修饰。如硫氧还蛋白通过特定的硫醇还原和氧化来调节氧化修饰的形成和去除[37]。所有这些氧化还原酶都会影响炎症过程和适应性免疫反应,这种调节涉及不同生物区室和特殊细胞类型的不同机制[38]。此外,体内氧化还原酶还被证明通过充当细胞因子或趋化因子来调节各种类型免疫细胞的活性和迁移行为[39]。本研究中,CTX组肝脏MDA含量升高,SOD、CAT、GSH-Px活性降低,表明CTX引起了机体明显的氧化应激;与JIANG 等[40]的研究结果相似。黄芪多糖ASP10-100组分处理后,能明显提高SOD、CAT、GSH-Px活性,降低MDA含量。其中高剂量APS10-100能极显著降低MDA含量(P<0.01),显著提高GSH-Px活性(P<0.05),尤其在MDA指标上,其含量显著低于阴性对照组(P<0.05)及高剂量黄芪粗多糖组(P<0.01)。CAT、SOD和GSH-Px是体内抗氧化酶系统的重要组成,能完成细胞内的抗氧化任务。黄芪多糖APS10-100组分可减少脂质过氧化,增强抗氧化酶活性,从而缓解机体因氧化应激造成的免疫损伤,其作用效果优于黄芪粗多糖。以往对黄芪多糖的生物活性研究中,多数试验只单一考虑了对抗氧化系统的影响或对免疫系统的影响,而很少考虑其在免疫调节作用中的抗氧化作用,其作用的分子机制还需要进一步的研究。
综上所述,APS10-100可以逆转体质量、免疫器官等的异常,提高淋巴细胞的活性和功能,促进细胞生长因子,从而提高机体的抗氧化及免疫能力,增强动物对疾病的抵抗力,其作用效果明显高于黄芪粗多糖,具有发展为新型替抗类功能性饲料添加剂的潜力。

