急性脑梗死患者介入取栓术围术期PPAR-γ、FAR、ENA-78水平变化与预后的关系
李菲菲,马冬璞,牛金朵,朱小倩
郑州市中心医院CNICU1、神经重症2,河南 郑州 450000
临床实践表明,尽早开通闭塞血管、恢复脑灌注及挽救缺血半暗带组织是抢救急性脑梗死(acute cerebral infarct,ACI)关键,血管内介入治疗是其主要治疗手段,但无法捕捉远端微小血管新生血栓、取栓过程中脱落微型栓子,增加血管再次堵塞风险[1-2]。若能早期预测ACI患者血管内介入治疗预后情况,对治疗方案调整及改善患者预后尤为关键。过氧化小体增殖剂激活型受体γ(PPAR-γ)可通过调节相关基因表达、转录参与多种病理过程[3]。中性粒细胞激活肽-78(ENA-78)是一种炎症介质。已有研究证实,其活性增加与水肿、炎性细胞侵入、微血管通透具有显著相关性[4]。另有研究指出,纤维蛋白原/白蛋白比值(FAR)不仅能够预测结直肠肿瘤及胃、胆囊预后,同时也与脑血管疾病不良预后存在关联[5]。由此推测PPAR-γ、FAR、ENA-78 水平可能与ACI 患者血管内介入治疗短期预后有关。为此,本研究首次尝试探讨PPAR-γ、FAR、ENA-78 水平与ACI 病情相关性及对预后的影响,旨在为临床准确评估病情变化、预测预后提供可靠指标。
1 资料与方法
1.1 一般资料 经我院医学伦理委员批准,前瞻性选取2020 年1 月至2022 年11 月于郑州市中心医院收治的134 例ACI 患者作为研究对象。纳入标准:符合ACI 相关诊断标准[6],急性起病,局灶神经功能缺损,经核磁共振证实;符合介入取栓术指征;首次发病;发病至溶栓时间<4.5 h;患者及家属签署知情同意书。排除标准:颅内动脉瘤或脑血管畸形者;既往有脑血管病遗留症状,影响本研究评分者;严重肝肾功能不全者;各种原因引起的脑出血;伴有各种急、慢性创伤或感染;合并癫痫;血压持续升高无法有效控制者。根据术后3 个月改良Rankin 量表(mRS)[7]评分分为对照组78 例(mRS 评分≤2 分)和观察组56 例(mRS评分>2 分)。观察组患者中男性31例,女性25例;年龄50~70岁,平均(57.85±1.57)岁;发病至溶栓时间1~4 h,平均(3.12±0.51) h;梗死部位:前循环28例,后循环28例;Killip 分级:Ⅰ级15 例,Ⅱ级27 例,Ⅲ级10 例,Ⅳ级4 例。对照组患者中男性42例,女性36例;年龄47~70岁,平均(57.07±1.51)岁;发病至溶栓时间1~4.5 h,平均(3.23±0.55) h;梗死部位:前循环40 例,后循环38 例;Killip分级:Ⅰ级20例,Ⅱ级33例,Ⅲ级18例,Ⅳ级7例。两组患者的一般资料比较差异均无统计学意义(P>0.05),具有可比性。另根据美国国立卫生研究院卒中量表(NIHSS)[8]评分分为轻度损伤51例(NIHSS<4分)、中度损伤43 例(NIHSS 评分4~20 分)和重度损伤40 例(NIHSS 评分>20 分),根据颅脑电子计算机断层扫描(CT)检查的脑梗死面积分为大面积梗死39例、中面积梗死57例和小面积梗死38例。
1.2 治疗方法 取平卧位,常规消毒、铺巾,局麻,以Seldinger 技术穿刺股动脉,置入6 F 血管鞘,采用脑血管造影确定病变位置、严重程度及侧支循环代偿等,病变位置确定后,责任血管置入6 F 引导管,在微导丝引导下将微导管置入病变部位,缓慢通过栓塞部位远端,撤出微导丝并通过微导管进行造影,明确血管远端畅通情况,顺着微导管将Solitaire AB支架置入病变部位远端,打开支架,等待5 min后收回支架、微导管,同时持续回抽导管内血液防止栓子脱落,取栓后,再行血管造影,确定血管再通后撤出微导管和引导管,局部缝合并加压包扎。术后给予双抗及对症治疗。
1.3 检测方法 术前、术后1周和术后2周,采集所有患者5 mL 静脉血,置于离心管,室温条件下静置30 min,离心处理,离心速率3 000 r/min,离心半径10 cm,离心时间10 min,取上清液,保存于-70℃冰箱内,备用。以酶联免疫吸附试验测定PPAR-γ、ENA-78,全自动特定蛋白仪(型号:IMMAGE800,生产公司:美国贝克曼库尔特公司)测定纤维蛋白原、白蛋白,计算FAR。
1.4 观察指标 (1)比较术前不同神经损伤程度和不同梗死面积患者的血清PPAR-γ、FAR、ENA-78水平;(2)分析术前血清PPAR-γ、FAR、ENA-78水平与梗死面积、NIHSS 评分的相关性;(3)比较不同预后患者术前、术后1 周、术后2 周血清PPAR-γ、FAR、ENA-78水平;(4)分析血清PPAR-γ、FAR、ENA-78水平对预后的预测价值。
1.5 统计学方法 应用SPSS22.0 统计学软件分析数据。计量资料符合正态分布,以均数±标准差(±s)表示,组间两两比较采用t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;计数资料比较采用χ2检验;相关性采用Pearson 线性相关法分析;危险度采用RR表示,U检验;预测价值采用受试者工作特征曲线(ROC)分析。以P<0.05为差异有统计学意义。
2 结果
2.1 术前不同神经损伤程度患者的血清PPAR-γ、FAR、ENA-78 水平比较 患者术前血清PPAR-γ水平随着神经损伤程度加重呈下降趋势,而血清FAR、ENA-78 水平则随着神经损伤程度加重呈上升趋势,差异均有统计学意义(P<0.05),见表1。
表1 术前不同神经损伤程度患者的血清PPAR-γ、FAR、ENA-78 水平比较(±s)Table 1 Comparison of serum PPAR-γ,FAR,and ENA-78 levels in patients with different degrees of preoperative nerve injury(±s)
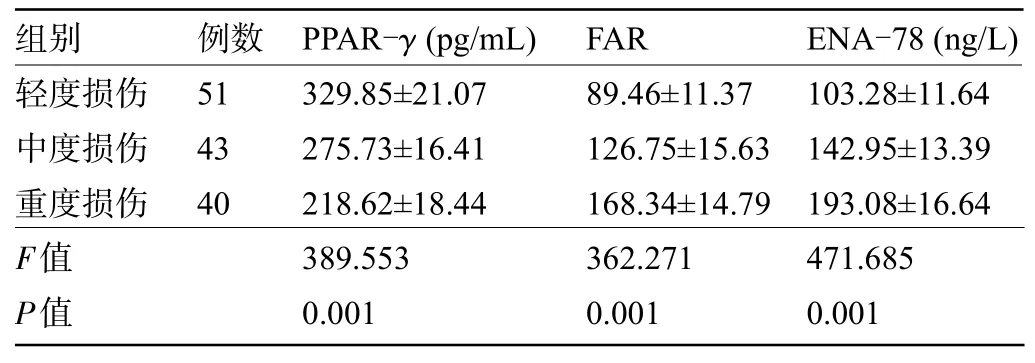
表1 术前不同神经损伤程度患者的血清PPAR-γ、FAR、ENA-78 水平比较(±s)Table 1 Comparison of serum PPAR-γ,FAR,and ENA-78 levels in patients with different degrees of preoperative nerve injury(±s)
?
2.2 术前不同梗死面积患者的血清PPAR-γ、FAR、ENA-78 水平比较 患者术前的血清PPAR-γ水平随着梗死面积增加呈下降趋势,而术前血清FAR、ENA-78 水平则随着梗死面积增加呈上升趋势,差异均有统计学意义(P<0.05),见表2。
表2 术前不同梗死面积患者血清PPAR-γ、FAR、ENA-78水平比较(±s)Table 2 Comparison of serum PPAR-γ,FAR,and ENA-78 levels in patients with different infarct sizes before surgery(±s)
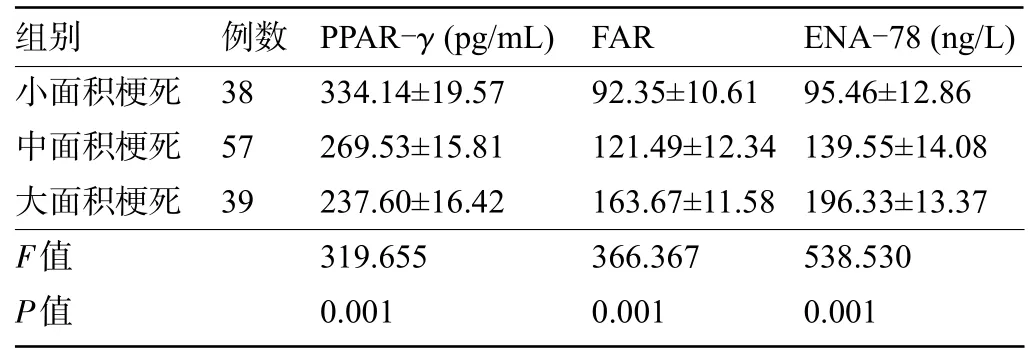
表2 术前不同梗死面积患者血清PPAR-γ、FAR、ENA-78水平比较(±s)Table 2 Comparison of serum PPAR-γ,FAR,and ENA-78 levels in patients with different infarct sizes before surgery(±s)
?
2.3 术前血清PPAR-γ、FAR、ENA-78 水平与梗死面积、NIHSS评分的相关性 经Pearson线性相关法分析结果显示,术前血清PPAR-γ水平与NIHSS评分、梗死面积呈负相关(P<0.05);术前血清FAR 水平与NIHSS 评分、梗死面积呈正相关(P<0.05);术前血清ENA-78 水平与NIHSS 评分、梗死面积呈正相关(P<0.05),见表3。
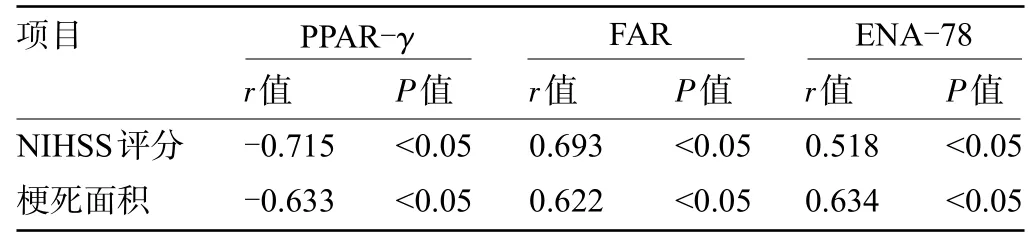
表3 术前血清PPAR-γ、FAR、ENA-78 水平与梗死面积、NIHSS 评分的相关性Table 3 Correlation between preoperative serum levels of PPAR-γ,FAR,ENA-78DE,infarct size,and NIHSS score
2.4 不同预后患者的血清PPAR-γ、FAR、ENA-78水平比较 术前,两组患者的血清PPAR-γ、FAR、ENA-78水平比较差异均无统计学意义(P>0.05);与对照组比较,术后1 周、术后2 周,观察组患者的血清PPAR-γ水平较低,血清FAR、ENA-78水平较高,差异均具有统计学意义(P<0.05),见表4。
表4 不同预后患者的血清PPAR-γ、FAR、ENA-78水平比较(±s)Table 4 Comparison of serum PPAR-γ,FAR,and ENA-78 levels in patients with different prognosis(±s)

表4 不同预后患者的血清PPAR-γ、FAR、ENA-78水平比较(±s)Table 4 Comparison of serum PPAR-γ,FAR,and ENA-78 levels in patients with different prognosis(±s)
?
2.5 血清PPAR-γ、FAR、ENA-78 水平对ACI 患者预后的预测价值 以预后不良ACI 患者为阳性样本,以预后良好ACI 患者为阴性样本绘制ROC 曲线。结果显示,术后1 周血清PPAR-γ、FAR、ENA-78 水平联合预测ACI 患者预后不良的AUC 为0.728,最佳预测敏感度、特异度分别为78.57%、66.67%;术后2 周血清PPAR-γ、FAR、ENA-78 水平联合预测ACI 患者预后不良的AUC为0.816,最佳预测敏感度、特异度分别为91.07%、71.79%,见表5。

表5 血清PPAR-γ、FAR、ENA-78水平对ACI患者预后的预测价值Table 5 Predictive value of serum PPAR-γ,FAR,and ENA-78 levels for the prognosis of ACI patients
2.6 危险度分析 以术后1 周、术后2 周血清PPAR-γ、FAR、ENA-78 水平的Cut-off 值为界,将ACI患者分为高水平、低水平,结果显示,术后1 周血清PPAR-γ、FAR、ENA-78 高水平患者预后不良险度是低水平的0.418、2.153、1.880倍(P<0.05);术后2周血清PPAR-γ、FAR、ENA-78 高水平患者预后不良险度是低水平的0.313、2.852、2.220倍(P<0.05),见表6。
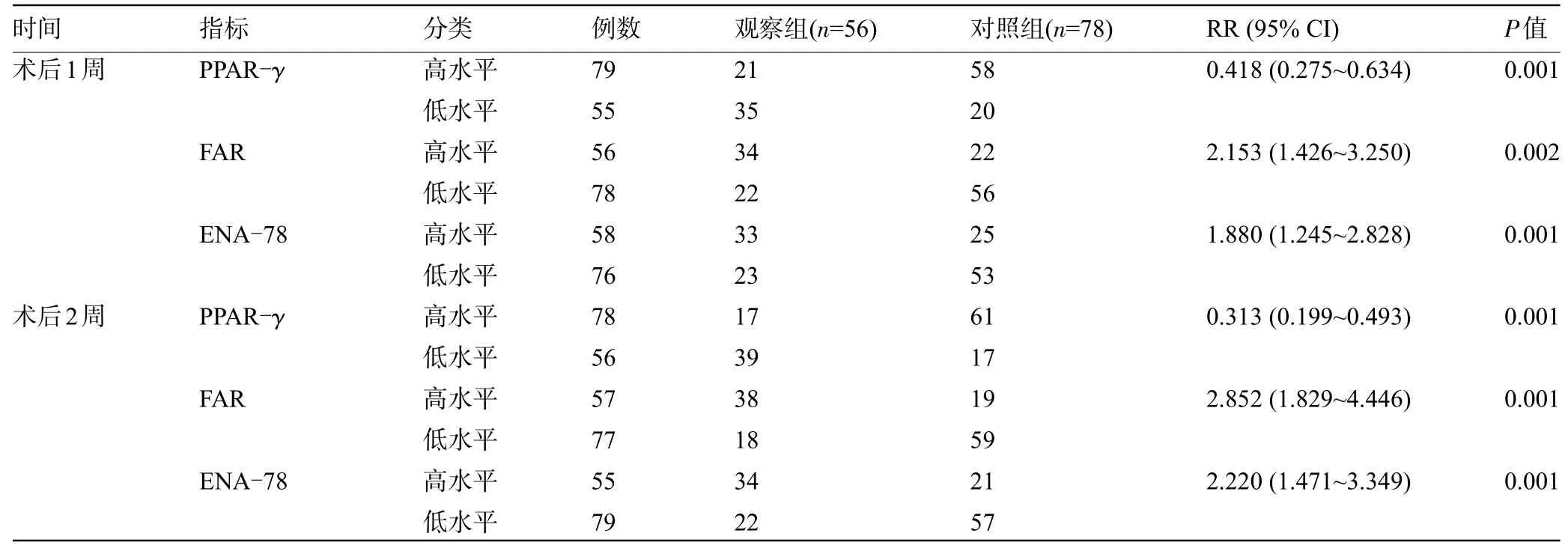
表6 危险度分析(例)Table 6 Hazard analysis(n)
3 讨论
ENA-78由78个氨基酸组成,具有激活、趋化中性粒细胞作用,可通过促进新生血管生成,导致局部出现缺血、缺氧。相关研究表明,ENA-78可增加中性粒细胞与内皮细胞和内皮下基质细胞黏附作用,导致中性粒细胞形态改变,加快超氧化物、溶酶体及炎症因子表达,从而诱发微循环障碍[9-10]。张琳艳等[11]报道指出,ACI 患者血清ENA-78 水平明显高于健康人群。在此基础上,本研究结果显示,随着神经功能损伤程度增加、脑梗死面积增大,ACI患者血清ENA-78水平明显升高,可见ENA-78 水平能作为ACI 病情进展及神经功能缺损程度评判的良好指标。分析其可能机制为,脑梗死后周围脑组织缺血缺氧导致细胞损伤、坏死,大量炎症细胞浸润,ENA-78 合成增加,引起ENA-78 水平明显升高。本研究还发现,观察组术后1 周、术后2周ENA-78水平高于对照组,可明显增加预后不良风险,提示其可作为评估ACI预后不良的重要指标。为此,临床可通过检测血清ENA-78水平变化为评估ACI预后不良风险及早期诊断提供有效信息。
PPAR-γ作为一种有效的转录因子,在氧化应激、能量稳态、线粒体脂肪酸代谢和炎症中均起重要作用[12-13]。相关研究证实,PPAR-γ激动剂可促进细胞周期停滞、细胞分化和细胞凋亡,并可抑制炎症反应、血管生成、氧化应激,在改善神经退行性和神经发育性疾病中脑细胞代谢及认知功能等方面具有正向促进作用[14]。本研究数据表明,ACI患者血清PPAR-γ水平随着病情加重显著降低,与张文青等[15]报道一致。推测原因,脑梗死后,动脉粥样硬化形成引起局部血小板聚集,诱发凝血功能障碍,促进血栓生成,PPAR-γ配体通过调节肝脏内X受体,加快脂肪胆固醇向高密度脂蛋白转化,抑制血小板凝结,降低血管粥样硬化发生风险;PPAR-γ水平降低可引起凝血功能异常,促进血栓生成,其含量下降血栓形成抑制作用减弱,增加ACI发生风险。提示临床可将其作为ACI的血清标志物,为早期确诊、采取合理治疗方案提供可靠依据。
纤维蛋白原是一种具有促炎作用的活性蛋白,可诱发炎症反应,同时其可损伤内皮细胞,引起血小板聚集,从而增加血液黏度,促进血栓形成[16]。白蛋白作为一种负性炎症蛋白,已被证明具有保护性抗炎特性[17]。本研究发现,FAR 升高可增加ACI患者预后不良风险。可能机制如下:(1)纤维蛋白原及其降解产物可增加血管内皮通透性,导致低密度脂蛋白胆固醇沉积;(2)可引起新生血管内膜增生,加快动脉粥样硬化斑块生成;(3)可促进平滑肌及血管内皮细胞迁移,进入斑块内部,加速动脉粥样硬化进展。
此外,本研究结果显示,患者术前血清PPAR-γ水平与NIHSS 评分、梗死面积呈负相关,FAR、ENA-78水平与NIHSS 评分、梗死面积呈正相关,可见PPAR-γ、FAR、ENA-78在ACI发生过程中起着重要作用,能为临床评估病情程度提供相关参考依据。进一步探讨发现,PPAR-γ、FAR、ENA-78 联合诊断ACI 预后不良的AUC大于各指标单一诊断,尤其是术后2周各指标联合预测的AUC 高达0.816,预测效能进一步升高,能为临床提供更为可靠的诊断途径。
综上所述,PPAR-γ、FAR、ENA-78水平升高/降低可明显增加ACI患者介入治疗后预后不良风险,联合检测可作为临床早期诊断的重要辅助途径,还能为临床评估病情进展提供数据支持。但本研究纳入样本量偏少,研究结果可能存在一定偏倚,今后需收集更多病例做进一步探讨与分析。

