外周血SIRT1、GRK2水平对急性ST段抬高型心肌梗死病人PCI术后心力衰竭的预测价值
张 洪,薛 蕾,王喜欢
ST段抬高型心肌梗死(STEMI)是冠心病最严重的类型,因冠状动脉血供减少或中断引起,经皮冠状动脉介入治疗(PCI)为STEMI有效的治疗方法[1]。但STEMI病人PCI术后仍有较高概率出现不良心血管事件,其中心力衰竭(HF)是预后不良的重要原因,与炎症、氧化应激、心肌纤维化、心肌细胞凋亡等引起心室重构密切相关[2-4]。沉默信息调节因子2相关酶1(SIRT1)是一种负责细胞调控的Ⅲ型组蛋白去乙酰化酶,能通过调节多个信号通路参与炎症和氧化应激[5]。实验研究显示,SIRT1能抑制HF小鼠心肌组织炎症[6]。G蛋白偶联受体激酶2(GRK2)是一种可脱敏多种G蛋白偶联受体(GPCR)的激酶,能通过调节G蛋白偶联受体快速脱敏参与炎症和氧化应激[7]。实验报道,GRK2在HF小鼠心肌组织中表达和活性增强[8]。目前,关于SIRT1、GRK2与STEMI病人PCI术后HF的关系报道较少,本研究检测STEMI病人外周血SIRT1、GRK2水平,探讨外周血SIRT1、GRK2水平与STEMI病人PCI术后HF的关系及其预测价值。
1 资料与方法
1.1 一般资料
选取2020年1月—2021年12月我院收治的195例STEMI病人。纳入标准:1)符合《急性ST段抬高型心肌梗死诊断和治疗指南(2019)》[9]诊断标准;2)首次发病,符合PCI手术指征[10];3)年龄≥18岁;4)病人及家属均知情并签署知情同意书。排除标准:1)既往心脏移植术、冠状动脉搭桥术、PCI;2)既往HF、无症状左心室功能不全、左心室射血分数(LVEF)<50%、严重瓣膜病、先天性心脏病;3)严重肝肾功能不全;4)合并慢性炎症性疾病或近2周内有活动性感染;5)合并恶性肿瘤;6)造血或免疫系统损害;7)临床资料或随访资料不全。本研究获得医院伦理委员会批准。
1.2 方法
1.2.1 基线资料收集
收集STEMI病人基线资料,包括性别、年龄、体质指数、基础疾病、吸烟史、发病至就诊时间、病变支数、出院用药和PCI术后即刻LVEF(飞利浦EPIQ5彩色超声诊断仪行超声心动图检查通过双平面Simpson法评估)、血脂[总胆固醇(TC)、三酰甘油(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)]、N末端脑利钠肽前体(NT-proBNP)水平。
1.2.2 外周血SIRT1、GRK2水平检测
收集STEMI病人PCI术后即刻3 mL外周静脉血,3 000 r/min离心10 min(半径10 cm),取上层血清,采用酶联免疫吸附法(深圳海思安生物技术有限公司,编号:HAS-53722、HAS-55983)检测SIRT1、GRK2水平。
1.3 随访和分组
STEMI病人PCI术后通过门诊或电话随访6个月,记录1年内HF发生情况,HF参考《中国心力衰竭诊断和治疗指南2018》[4]进行诊断。根据是否发生HF分为HF组(57例)和非HF组(138例)。
1.4 统计学处理

2 结 果
2.1 HF组与非HF组临床资料比较
HF组年龄大于非HF组,发病至就诊时间≥12 h、多支病变比例和LDL-C、NT-proBNP水平高于非HF组,LVEF低于非HF组,差异均有统计学意义(P<0.05);两组病人性别、体质指数、基础疾病、吸烟史等比较,差异均无统计学意义(P>0.05)。详见表1。
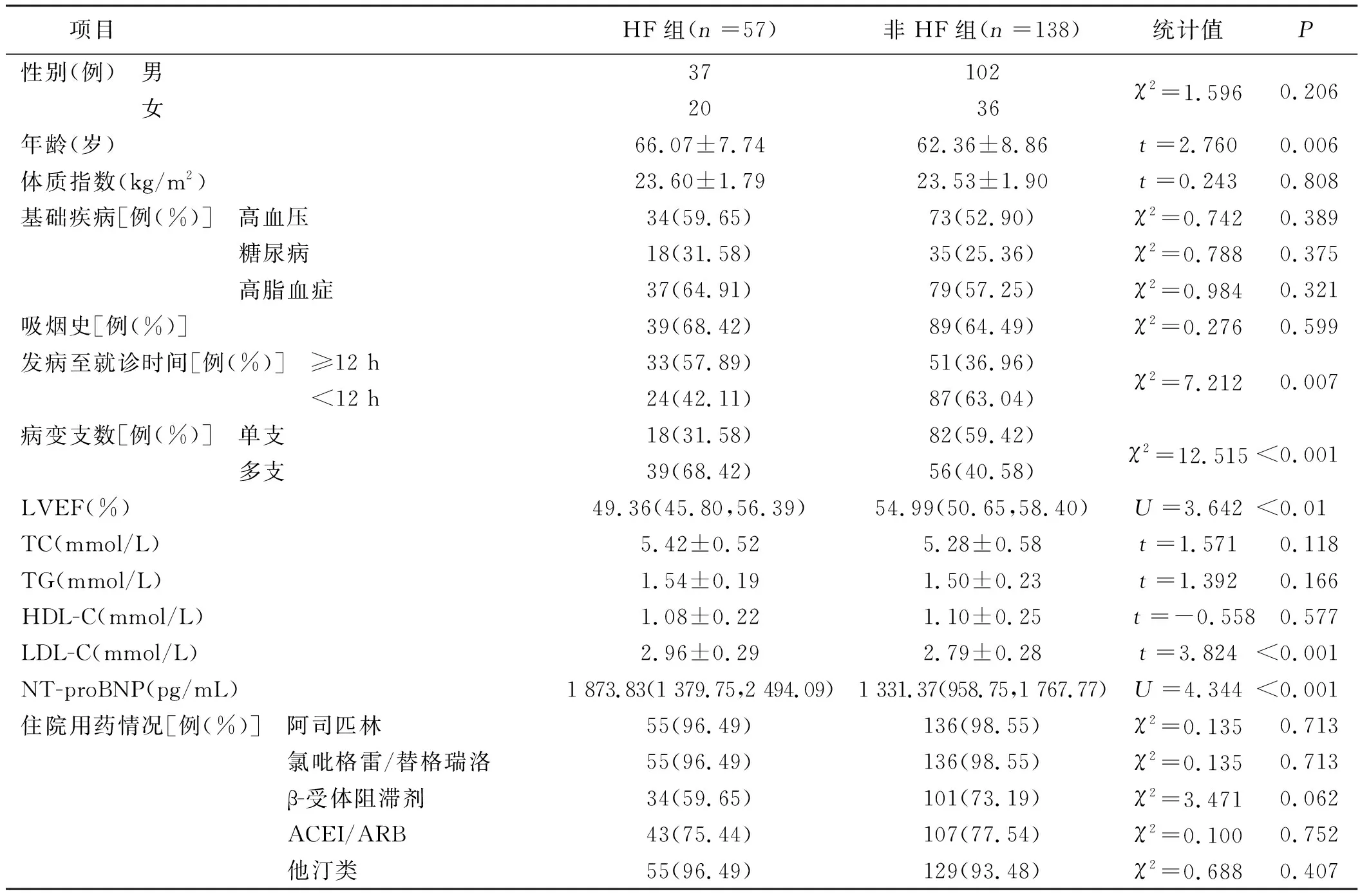
表1 HF组与非HF组临床资料比较
2.2 HF组与非HF组外周血SIRT1、GRK2水平比较
HF组外周血SIRT1水平为2.70(2.48,2.94)ng/mL,低于非HF组的3.15(2.91,3.36)ng/mL,差异有统计学意义(U=6.227,P<0.01);HF组外周血GRK2水平为2.67(2.46,2.92)mg/L,高于非HF组的2.38(2.22,2.49)mg/L,差异有统计学意义(U=6.348,P<0.01)。
2.3 STEMI病人PCI术后HF的多因素Logistic回归分析
以年龄(实际值)、发病至就诊时间(≥12 h=1,<12 h=0)、病变支数(多支=1,单支=0)、LVEF(实际值)、LDL-C(实际值)、NT-proBNP(实际值)、SIRT1(实际值)、GRK2(实际值)为自变量,PCI术后HF(是=1,否=0)为因变量,多因素Logistic回归分析显示,发病至就诊时间≥12 h、多支病变、NT-proBNP升高、GRK2升高为STEMI病人PCI术后HF的独立危险因素(P<0.05),LVEF升高、SIRT1升高为独立保护因素(P<0.05)。详见表2。

表2 STEMI病人PCI术后HF发生的多因素Logistic回归分析
2.4 外周血SIRT1、GRK2水平对STEMI病人PCI术后HF的预测价值
ROC曲线分析显示,外周血SIRT1、GRK2水平单独与联合预测STEMI病人PCI术后HF的AUC分别为0.784,0.789,0.875,两者联合预测STEMI病人PCI术后HF的AUC大于单独预测(Z=2.929,P=0.003;Z=3.037,P=0.003)。详见表3和图1。
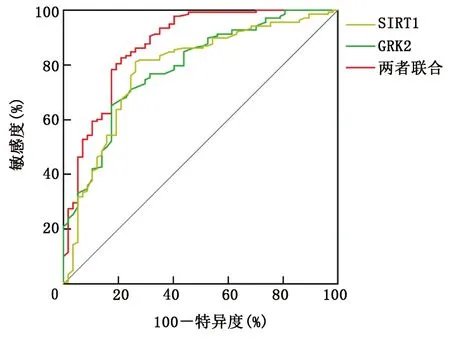
图1 外周血SIRT1、GRK2水平单独与联合预测STEMI病人PCI术后HF的ROC曲线

表3 外周血SIRT1、GRK2水平单独与联合预测STEMI病人PCI术后HF的效能
3 讨 论
STEMI是冠状动脉不稳定斑块破裂、糜烂、侵蚀和内皮损伤基础上继发血栓形成而导致的急性心肌缺血性坏死,相比非STEMI的心肌损伤更严重,PCI虽然能尽快恢复阻塞冠状动脉的血流灌注,缩小梗死面积,但PCI成功开通冠状动脉后仍有部分病人可出现心室重构,最终引起HF,导致病人心功能、生活质量、远期预后显著降低[11]。因此,早期预测PCI术后HF风险有助于尽早制定合理的防治方案,降低病人死亡率并改善远期生活质量。
心室重构是HF发生的根本机制,目前研究认为,心肌梗死后大量细胞向心肌内迁移,导致心肌梗死区(变薄)和非梗死区(代偿性肥厚)的结构和生化改变是心室重构的发生主要原因[2],其病理生理机制涉及炎症反应、氧化应激、神经内分泌系统激活、细胞内Ca2+稳态、心肌纤维化、心肌细胞凋亡等[3-4]。蛋白质翻译后修饰几乎参与细胞所有的生命活动过程,蛋白的乙酰化修饰对蛋白质翻译后修饰功能转变具有重要调控作用[12]。SIRT1是辅酶1(NAD)+依赖的蛋白去乙酰化酶沉默信息调节因子2家族中同源性最高的成员,能通过去乙酰化作用调节靶蛋白活性、染色体稳定性、基因转录,抑制炎症反应、氧化应激和细胞凋亡[13]。郑婉等[14]通过肿瘤坏死因子-α诱导大鼠心肌细胞炎症损伤发现,上调SIRT1表达能抑制大鼠心肌细胞炎症,提升心肌细胞增殖活性,保护心功能。在异丙肾上腺素诱导的小鼠心肌缺血模型中,上调SIRT1表达能抑制小鼠心肌细胞炎症、氧化应激和凋亡[15]。这些研究表明,SIRT1能通过抑制炎症反应、氧化应激和细胞凋亡对心肌发挥保护作用。同时近年研究指出,新型HF治疗药物钠-葡萄糖协同转运蛋白2抑制剂主要通过上调SIRT1发挥心脏保护作用[16]。在临床研究中,入院时血清SIRT1水平降低与STEMI病人预后不良有关[17]。然而,关于血清SIRT1与STEMI病人HF的关系尚缺乏研究报道。本研究结果显示,HF组外周血SIRT1水平明显降低,外周血SIRT1水平升高为STEMI病人PCI术后HF的独立保护因素,这说明外周血SIRT1水平降低参与STEMI病人PCI术后HF。分析与SIRT1能通过抑制核因子-κB p65乙酰化,抑制核因子-κB p65介导的心肌细胞炎症、凋亡和心室重构有关[18]。同时SIRT1能通过抑制线粒体氧化损伤,抑制心肌细胞氧化应激,逆转心室重构,改善心脏功能[19]。
G蛋白偶联受体是真核生物中最大的膜蛋白家族,能通过结合细胞周围的化学物质激活细胞内一系列信号通路,参与多种病理生理过程[20]。GRK是一簇与G蛋白偶联受体快速失敏相关的激酶,GRK2是第一个被证实与心血管系统相关的GRK,广泛表达于各种组织中,其NT端结构域能接触G蛋白偶联受体细胞质尾部,使G蛋白偶联受体快速活化后从细胞质转移到细胞膜,进而介导炎症、氧化应激、细胞纤维化等多种病理生理过程[7]。Penela等[21]研究报道,GRK2能通过激活心肌细胞炎症,促进心肌细胞纤维化。Sato等[22]研究报道,敲除GRK2能抑制小鼠心肌细胞线粒体氧化损伤,抑制心肌细胞凋亡和改善心功能。临床研究显示,淋巴细胞GRK2表达水平降低与老年男性非STEMI病人疗效有关[23]。本研究结果显示,HF组外周血GRK2水平明显升高,是STEMI病人PCI术后HF的独立危险因素,这说明外周血GRK2水平升高参与STEMI病人PCI术后HF。分析与GRK2能通过诱导核因子-κB释放和β2-肾上腺素受体脱敏,促进心肌纤维化,进而诱导心室重构有关[21,24]。同时GRK2能通过诱导心肌细胞内Ca2+过载促进心肌细胞凋亡,增加HF风险[25]。本研究结果还显示,发病至就诊时间≥12 h、多支病变、NT-proBNP升高也是PCI术后HF的危险因素,分析是发病至就诊时间越长和多支病变STEMI病人心肌缺血受损更严重,导致心功能进一步恶化,增加PCI术后HF风险。NT-proBNP由心肌细胞受损后释放,LVEF则是反映心功能状态的有效指标,NT-proBNP水平越高和LVEF越低说明心功能受损越严重,PCI术后HF风险更高。ROC曲线分析显示,外周血SIRT1、GRK2水平单独与联合预测STEMI病人PCI术后HF的AUC分别为0.784,0.789,0.875,两者联合预测AUC显著增加,说明SIRT1、GRK2可能成为STEMI病人PCI术后HF的预测标志物,同时联合检测外周血SIRT1、GRK2水平能提升STEMI病人PCI术后HF的预测价值。但本研究结果还需前瞻性多中心研究进一步证实,并探究SIRT1、GRK2参与STEMI病人PCI术后HF的机制。
综上所述,PCI术后HF的STEMI病人外周血SIRT1水平降低,GRK2水平升高,可作为STEMI病人PCI术后HF的辅助预测指标,且两者联合的预测价值较高。

